A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חוט השדרה Electrophysiology
In This Article
Summary
הפגנה של בידוד של חוט השדרה בילוד עכבר ללימודי אלקטרו.
Abstract
חוט השדרה בילוד עכבר הוא מודל לחקר התפתחות circuitries עצבי התנועה של תנועה. אנו מדגימים את לנתיחה חוט השדרה והכנת אמבט נוזל המוח והשדרה הקלטה מלאכותי המשמש במחקרים של תנועה. גזור פעם, חוט השדרה הגחון שורשי העצבים יכולה להיות מחוברת אלקטרודה הקלטה כדי להקליט את אותות אלקטרו של המעגלים דפוס מרכזי ביצירת בתוך חוט השדרה.
Protocol
1. הכן מלאכותי הנוזל השדרתי (aCSF) 1. אנחנו הראשונים 2L להכין מלאי של 10X aCSF ללא מגנזיום או סידן. ריאגנטים המפורטים millimolar. המספרים מתייחסים קטלוג Sigma / אולדריץ'.
| 2 ליטר aCSF 10X (ללא מ"ג או Ca) | |||
| מגיב | mM | g/2L | קטלוג |
| KCl | 40 | 5.96 | P-9333 |
| NaCl | 1280 | 149.61 | S-7653 |
| NaHCO 3 | 210 | 35.28 | S-6297 |
| לאא 2 PO 4 | 5 | 1.38 | S-9638 |
| גלוקוז | 300 | 108.12 | D-9434 |
| הוסף מים מזוקקים עד 2L | |||
אנו גם להכין פתרונות 1M של MgSO 4 ו CaCl 2 ב 50 מ"ל מים, כדי לאפשר התאמות molarity מניסוי לניסוי ולהבטיח סידן נשאר פתרון.
| סידן מגנזיום 1M ו מניות | |||
| מגיב | M | g/50mL | קטלוג |
| CaCl 2 | 1 | 7.35 | C-5080 |
| MgSO 4 | 1 | 12.33 | M-5921 |
הפתרון חייב להיות aCSF בגז עם carbogen (95% O2 / CO2 5%) להוריד את ה-pH לפני הוספת סידן או סידן יהיה להאיץ.
| 1 ליטר aCSF | |
| מגיב | נפח |
| 10X aCSF | 100 מ"ל |
| 1M CaCl 2 | 1 מ"ל (לנתח) 2ml (הקלטה) |
| 1M MgSO 4 | 1 מ"ל |
| הוסף את ~ 800 מ"ל מים מזוקקים, גז עם carbogen 2 דקות לפני הוספת סידן | |
| הוסף מים מזוקקים עד 1 ליטר. | |
משאבות וצינורות ומנות לנתח יש לשטוף לפני ואחרי השימוש.
בתור
בעוד לנתח, 1mm סידן aCSF צריך להיות בגז ברציפות עם carbogen. ACSF יכול להיות שאב מבקבוק אל צלחת הניתוח, הנשאבים המנה לנתח את הבקבוק או נשלחו פסולת. אנו משתמשים אלסטומר (Sylgard, Dow Corning) צלחת מצופה לבצע את הנתיחה.
עכבר בילוד הוא ערופה במהירות במספריים חדים חתך עשה עם מספריים דרך בית החזה והבטן הגחון ו. בעל חיים הוא נדחק אז. העכבר נדחק היא שטפה עם aCSF. בעל חיים הוא ניצח אז המנה לנתח עם סיכות חרקים מוכנס דרך forelimbs ועל בבסיס הזנב.
עמוד השדרה הוסר על ידי ביצוע laminectomy הגחון. עמוד השדרה מוחזק במלקחיים קטנים ואחד להב מספריים קטנים מוכנס הגב מיד עמוד השדרה הגרמית. Lamina היא לחתוך בצד אחד ולאחר מכן השני בעדינות תוך כדי הרמת עמוד השדרה הגרמית. זו מתבצעת לכל אורך עמוד השדרה.
חוט השדרה מוסר על ידי חיתוך לאורך צדי עמוד השדרה לנתק את שורשי העצבים בעמוד השדרה וחתך את קרומי המוח המקיף את חוט השדרה. אנחנו חותכים בצדדים ימין ועל שמאל, אז חתכנו את קרומי המוח מחובר לצד הגבי של חוט השדרה כדי לשחרר אותו. כבל מבודד הוא ניצח אז המנה ליד כניסת aCSF להבטיח חמצון טוב אם בעלי חיים נוספים גזור.
חוט השדרה מבודד הוא הועבר לאחר מכן מנה הקלטה בעזרת כף או מרית קטנה. כאן אנו perfuse ההכנה עם מחומצן 2mm סידן aCSF. חוט השדרה הוא ניצח על המנה אלסטומר מצופה micromanipulators השתמשו כדי להעביר תאיים, כל יניקה אלקטרודות ליד שורש השורשים. כאשר קצה האלקטרודה הוא לקראת סוף שורש בחינם, שאיבה עדינה מוחל לצייר את השורש לתוך האלקטרודה יניקה. תהליך זה ניתן לחזור להקליט השורשים בו זמנית.
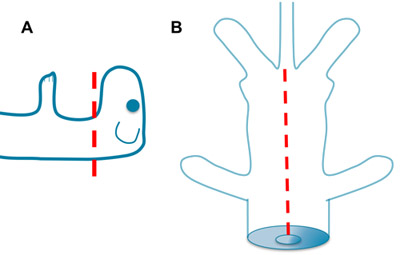
באיור 1. עריפת ראש ועל הוצאת הקרביים א. במהירות לערוף את העכבר במספריים חדים. תרומות פחות או יותר מן גזע המוח יכולה להיות מושגת בהתאם לרמת של לחתוך. מקום ב להב אחד של המספריים לתוך הפתח של חלל החזה נוצר על ידי עריפת ראש. פתח את בית החזה והבטן הגחון ועל בסיס הזנב. הסר את הקרביים ולשטוף עם aCSF.

איור 2. הסרת עמוד השדרה א. הכנס את הלהב השמאלי של המספריים אל תוך החלל שבין עמוד השדרה וחוט השדרה ימינה של חוט השדרה לחתוך דרך עצמות הגחון על הנחת הכבל. ואז להכניס את הלהב הימני של המספריים אל תוך החלל שבין עמוד השדרה וחוט השדרה מצד שמאל של חוט השדרה לחתוך. ב חזור על תהליך זה, תוך יישום המתיחה עדין עמוד השדרה. יש להיזהר שלא לנקב את עמוד השדרה על ידי החזקת המספריים בזווית נמוכה.

איור 3. הסרה של חוט השדרה. A. הכנס את הלהב השמאלי של המספריים אל תוך החלל שבין עמוד השדרה ועל עצמות ימינה של חוט השדרה דרך לחתוך את השורשים ואת קרומי המוח הנחת לרוחב השדרה אל חוט. ואז להכניס את הלהב הימני של המספריים אל תוך החלל שבין עמוד השדרה ועל עצמות בצד שמאל של השדרה לחתוך את השורשים קרומי המוח הנחת לרוחב השדרה אל חוט. ב לבסוף, בעדינות להרים את כבל מקורי וחתך את קרומי המוח חיבור כבל הגב אל רבדים. שוב להיזהר שלא לנקב את עמוד השדרה על ידי החזקת המספריים בזווית נמוכה. אין לחתוך את השורשים קרוב מדי לחוט השדרה.
Discussion
חוט השדרה בילוד מבודד מספק שיטה ממושמע ללמוד development1 מערכת העצבים, 2. בתוך עמוד השדרה המותני של מכרסמים בילוד, המעגלים מרכזי ליצירת דפוס יכול לייצר תנועה פיקטיבי בנוכחות של נוירוטרנסמיטורים. זו תנועה מורכבת פיקטיבי של עליות בפעילות קצבית, התפרצויות, אשר מיוצרים הרץ 0.2-...
Disclosures
ניסויים בבעלי חיים בוצעו בהתאם להנחיות והתקנות שנקבעו על ידי מכון סאלק למחקרים ביולוגיים AIACUC.
Acknowledgements
סמואל ל Pfaff הוא פרופסור במעבדות ביטוי גנים במכון סאלק למחקרים ביולוגיים החוקר את הווארד יוז רפואי במכון. עבודה זו נתמכה על ידי כריסטופר ודנה ריב קרן. ג'ו Belcovson, קנט Schnoeker ומייק סאליבן ב משאבי מולטימדיה במכון סאלק סיוע בצילום ועריכה.
Materials
| Name | Company | Catalog Number | Comments |
| KCl | P-9333 | ||
| NaCl | S-7653 | ||
| NaHCO3 | S-6297 | ||
| NaH2PO4 | S-9638 | ||
| Glucose | D-9434 | ||
| CaCl2 | C-5080 | ||
| MgSO4 | M-5921 | ||
| Large Scissors | Fine Science Tools | 14070-12 | |
| Forceps | Fine Science Tools | 11050-10 | |
| Fine Scissors | Fine Science Tools | 15000-10 | |
| Insect pins | Fine Science Tools | 26002-10 | |
| Sylgard 184 (Dow-Corning) | |||
| 1L volumetric flask | |||
| 100mL volumetric flask |
References
- Myers, C. P. Cholinergic input is required during embryonic development to mediate proper assembly of spinal locomotor circuits. Neuron. 46, 37-49 (2005).
- Goulding, M., Pfaff, S. L. Development of circuits that generate simple rhythmic behaviors in vertebrates. Curr Opin Neurobiol. 15 (1), 14-20 (2005).
- Gallarda, B. Segregation of axial motor and sensory pathways via heterotypic trans-axonal signaling. Science. 320, (2008).
- Gosgnach, S. V1 spinal neurons regulate the speed of vertebrate locomotor outputs. Nature. 440 (7081), 215-219 (2006).
- Lanuza, G. M., Gosgnach, S., Pierani, A., Jessell, T. M., Goulding, M. Genetic identification of spinal interneurons that coordinate left-right locomotor activity necessary for walking movements. Neuron. 42 (3), 375-386 (2004).
- Jiang, Z., Carlin, K. P., Brownstone, R. M. An in vitro functionally mature mouse spinal cord preparation for the study of spinal motor networks. Brain Res. 816 (2), 493-499 (1999).
- Ziskind-Conhaim, L., Gao, B. X., Hinckley, C. Ethanol dual modulatory actions on spontaneous postsynaptic currents in spinal motoneurons. J Neurophysiol. 89 (2), 806-813 (2003).
- Tabak, J., Rinzel, J., O'Donovan, M. J. The role of activity-dependent network depression in the expression and self-regulation of spontaneous activity in the developing spinal cord. J Neurosci. 21 (22), 8966-8978 (2001).
- Chub, N., Mentis, G. Z., O'Donovan, M. J. Chloride-sensitive MEQ fluorescence in chick embryo motoneurons following manipulations of chloride and during spontaneous network activity. J Neurophysiol. 95 (1), 323-330 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved