A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה חיה של תסיסנית melanogaster Hemocyte נדידות עובריים
In This Article
Summary
Hemocytes תסיסנית לפזר מעל מכלול של העובר המתפתח. פרוטוקול זה מדגים כיצד הר התמונה באמצעות העברות אלה עוברים עם hemocytes שכותרתו fluorescently.
Abstract
תא מחקרים רבים כתובת הגירה באמצעות
Protocol
הכנה
- השג המתאים קווי תסיסנית המכיל hemocyte ספציפי Gal4 הנהג (למשל SRP-Gal4 2) ו כתב ניאון מקודדים גנטית כטב"מ תחת שליטה (למשל כטב"מ-GFP). זבובים הומוזיגוטים SRP-Gal4, כטב"מ-GMA 3 או crq-Gal4, כטב"מ-GFP 4, 5 הם שימושיים במיוחד לצורך הדמיה (nb GMA היא GFP התמזגו תחום אקטין מחייב של moesin); ראו בהמשך לדיון על את טווח Gal4 נהגים כטב"מ בונה זמין (המניות Bloomington המרכז מכיל מגוון רחב).
- חוצה גנטית בדרך כלל מבוצעים כזה אללים מוטנטים מאוזנים באמצעות פלורסנט balancers CTG או TTG 6, עם Gal4 נהגים כטב"מ בונה נישא על כרומוזומים הומולוגיים חלופיים. זה מאפשר לבחור מוטציות הומוזיגוטים על בסיס של העדר CTG / TTG הקשורים GFP פלואורסצנטי (זה נעשה בשלב 2.11).
- Amplify מניות וזבובים מקום בכלוב הנחת עם צלחת אגר מיץ תפוחים 7. הזבובים צריך לפחות יומיים להתאקלם לכלוב לפני הנחת עוברים מספיק להתחיל להיות מונח. באופן כללי עשרים זבובים המין כל צריך להיות מספיק כדי לייצר עוברים מספיק הדמיה אך יש לציין כי קווים שונים יש שונות של פוריות. אנו משתמשים 55mm צלחות פטרי להשתלב בתחתית כוס פלסטיק, ניקב בבסיסו על מנת לאפשר זרימת אוויר. האמצעי המדויק של אוסף העובר לא חשוב, אבל תזמונים הם קריטיים על מנת לאסוף מבוים כהלכה עוברים.
- איסוף עוברים מתוך צלחת לילה מיץ תפוחים אגר שמרו על 25 מעלות צלזיוס או צלחת מתוזמן. עבור אלה האחרונים אנחנו בדרך כלל מאפשרים הזבובים להניח בצלחת מראש התחמם במשך 4 שעות, לפני הסרת צלחת והניח אותו על 18 מעלות צלזיוס במשך 15-16 שעות לפני הרכבה של עוברים, זה מספק עוברים משלב מאוחר 12 דרך שלב 15 של פיתוח. צלחת לילה מכיל מגוון גדול יותר של שלבים אבל מציע את היתרון של רמות גבוהות יותר של ביטוי עיתונאי ניאון hemocytes עקב תקופת זמן ארוכה יותר של 25 ° C כמערכת Gal4-כטב"מ הוא רגיש לטמפרטורה.
נוהל
- לעקור מן העוברים את צלחת אגר מיץ תפוחים באמצעות כמות קטנה של מים במכחול רך שקצהו. עוברים וחילצה ניתן לראות בקלות בעין בלתי מזוינת.
- העברת העוברים על מסננת תא (פישר) או תוצרת בית 7 סל על ידי שפיכת מים מן צלחת אגר מיץ תפוחים לתוך הסל שנערך על מבחנה כדי לאסוף מים לבזבז.
- חזור על שלב 2.2 עד שאתה מרוצה יש לך מספיק עוברי העבירה מן צלחת אגר מיץ תפוחים.
- לשטוף עוברים מסננת תא / סל באמצעות מים.
- מניחים מסננת תא / סל במכסה צלחת פטרי של צלחת אגר מיץ תפוחים ולהוסיף מספיק אקונומיקה מסודר להשעות עוברים מסננת התא / סל.
- עקבו dechorionation של העוברים על מיקרוסקופ לנתיחה תחת brightfield: dechorionation תושלם כאשר הנספחים הגב יש מומס, שאמור להתרחש תוך שתי דקות.
- הסר מסננת / סל תא עוברי המכיל מ אקונומיקה לשטוף באקונומיקה שיורית באמצעות מים. עקבות של אקונומיקה כל יש להסיר לפני שתמשיך לשלב 2.8. טריק להעריך האם כל אקונומיקה הוסר הוא למחוק את המים שיורית על הכחול בצבע רקמות במעבדה - אם יש שאריות אקונומיקה הצבע הכחול יהיה מולבן לבן / ורוד.
- כתם את המים הנותרים באמצעות רקמות במעבדה / mediwipes להחיל התחתון של התא מסננת / סל.
- המקום טיפה של מים מכסה צלחת פטרי. בעזרת מכחול דק, לאסוף את כל העוברים dechorionated מסל את העובר ואת resuspend אותם אגל. לאחר מכן לייבש את העוברים על ידי aspirating מים באמצעות micropipette או סופג אותו בזהירות עם רקמות במעבדה / mediwipes.
- לאחר עוברים כבר יבשים, להוסיף טיפה של שמן voltalef לכסות את כל העוברים. שים טיפה קטנה השנייה של שמן הסמוך אגל המכילה את העוברים. נ.ב. לא הצלחנו למצוא ספק בריטניה מבוססי נפט voltalef; שמן halocarbon 700 (Sigma) עשוי לשמש במקום.
- תחת מיקרוסקופ פלואורסצנטי לנתיחה לבחור כראוי מבוים בעוברים של הגנוטיפ הרצוי בעזרת זוג מלקחיים שענים (מספר 5) מן אגל הנפט. מלקחיים אלו צריכות להיות כפופות פנימה (איור 1) על מנת לאסוף את העוברים ללא ניקוב קרום vitelline שלהם. העברת עוברים שנבחרו אגל הנפט השנייה. חשוב כי אתה יכול לראות hemocytes ניאון על המיקרוסקופ לנתח על מנת להיות מסוגל לאסוף תמונות טובות על המיקרוסקופ confocal (איור 2). אנחנו בדרך כלל הר עוברים שלב 13/14 הגירה תמונה לרוחב קו האמצע של hemocytes על הבמה הגחון או 15 עובריםהתמונה תנועתיות של hemocytes הבאים פיזור על העובר.
- סטיק two coverslips (18x18mm, עובי 1) לחלק התחתון של צלחת Petriperm / Lumox (Sarstedt), באמצעות 2 טיפות קטנות של שמן voltalef, ומשאיר כ 1cm ביניהם (איור 3); אלה ישמשו כדי לתמוך coverslip הניח על העוברים, כדי לא לרסק אותם. מנות Petriperm (בקוטר 50mm) מכילים הידרופובי, גז קרום חדיר. אנו מוצאים כי הכלים הופכים קלים יותר לשימוש פעם הם היו בשימוש מספר פעמים (צלחות יכולים להימחק עם אתנול 70% ולעשות בהם שימוש חוזר).
- תחת brightfield על המיקרוסקופ לנתיחה, להרים עוברים שנבחרו אחד אחד עם מלקחיים כפוף קו אותם בצד הגחון מעלה במקביל לקצה coverslips (איור 3). אפשר ליישר עד 15 העוברים בדרך זו, תלוי במיומנות שלך ואת הסבלנות. חשוב לתפעל את העוברים בעדינות כמו גם עוברים צלחת קרום Petriperm שבירים וניתן מקרע בקלות.
- לאחר העוברים מיושרים להוסיף טיפה קטנה של שמן ולתת לו להתפשט כדי ליצור שכבה אחידה בין שתי coverslips. אחרי הנפט התפשט (זה עשוי לקחת כמה דקות) לבדוק כי העוברים עדיין בצד הגחון למעלה. אם עוברים יש התגלגל קצת, למקם אותם שוב עם מלקחיים.
- לבסוף, בעזרת פינצטה (מספר 3) במקום coverslip (18x18mm, עובי 1) על העוברים, הנשענת על שני coverslips דבק בעבר. דבק זה coverslip כדי coverslip תומך באמצעות לק (איור 3).
- קח את המנה Petriperm עם עוברי רכוב על המיקרוסקופ confocal או רחב שדה הר צלחת Petriperm על הבמה באמצעות מתאם מתאים. או מיקרוסקופ זקוף או הפוך יכול לשמש, עם עדשה אובייקטיבי באמצעות התמקדות coverslip (בניגוד דרך הממברנה).
נציג התוצאה:
פרוטוקול זה מתאר כיצד הר עוברים תסיסנית הדמיה חיה של hemocytes בצד הגחוני של העובר. אם נעשה בצורה נכונה יהיה קל לייצר או תמונות סטילס או סרטים של hemocytes. הקובע העיקרי הוא מיקרוסקופ המשמש התמונה hemocytes (בעדשה מסוימת אובייקטיבית), אך טבעו של התמונות רכשה גם תלוי בשלב של פיתוח, הטמפרטורה העוברים גדלו ב וקווי Gal4 ו כטב"מ בשימוש.
רמות גבוהות יותר של ביטוי חלבון פלואורסצנטי יאפשר hemocytes להיות צילמו ביתר קלות, ולכן חשוב להיות מסוגל לראות hemocytes כאשר העוברים נמצאים בשלב של 2.11 פרוטוקול (איור 2 מכיל דוגמאות hemocytes ברור בתוך עוברי, נלקח עם מצלמה מצויד מיקרוסקופ דיסקציה). מספר גדל של Gal4 לכן ובונה כטב"מ לאפשר יותר אות לרעש יחס. יתר על כן זה מפחית את הצורך בעוצמות לייזר גבוהה או שעות חשיפה מוגברת כאשר הדמיה, אשר בתורו מאפשר התנהגות hemocyte להיות במעקב במשך תקופות זמן ארוכות יותר.
רמות גבוהות מאוד של ביטוי ה-GFP יופיעו הפרטים הקטנים של מורפולוגיה hemocyte, במיוחד lamellae סדין דק דמוי המקיפים את גוף תא עגול (איור 4A-B). אזורים חוזר למעט ה-GFP מייצגים phagosomes (איור 4A-C). Finger כמו filopodia ניתן גם לראות העולה מתוך lamellae (איור 4 ב). שני הנהגים Gal4 להישאר מספיק כדי לראות את התהליכים האלה (איור 4C), במיוחד אם אחד או יותר הוא SRP-Gal4 (ראה דיון), אולם מהירויות סריקה איטית יותר או כוח רב יותר על לייזר מיקרוסקופ confocal ייתכן שתידרש. כמו ירידה ברמות הביטוי הוא הופך להיות קשה יותר לדימוי של בליטות hemocytes, בכל זאת עדיין אפשר לעקוב אחר נדידת hemocytes בתנאים אלה כמו גוף התא נשאר ברור גם כאשר בליטות ברורים פחות (איור 4D).
ב בשלבים המוקדמים של הפיתוח (עד שלב 13) hemocytes להעביר במגע קרוב אחד לשני וזה לעתים קרובות קשה להבחין בין תאים בודדים. בסוף שלב 13 hemocytes יצרו שורה אחת למטה קו האמצע הגחון (איור 5A), ואז, נהיה יותר ניעתי, נודדים רוחבית את הקצוות של חוט העצב הגחון (איור 5 ב). Cytoskeleton אקטין בתוך בליטות הדינמי של hemocytes ניתן לצפות ישירות דרך הביטוי של GMA (איור 5c) או דובדבן moesin.
הרכבה את העוברים בדרך זו מאפשרת חילוף הגזים ומונע התייבשות עוברים להישאר הדמיה הבאים קיימא. אם העובר ניזוק במהלך הרכבה הוא בדרך כלל כמובן מאליו את התוכן העובר ידלפו דרך הממברנה שלה vitelline. אם העובר מתחיל להתייבש ואז זה יכול לעיתים קרובות נצפו על ידי דפורמציות בקרום vitelline. מדי פעם עובר תגלגל במהלך סרט timelapse, אולם זה רק נוטה להיות בעייתית עבור סרטים זמנים ארוכים יותר. Lastly, הרכבה עוברים בבת אחת בניסויים נותן את הסיכוי הטוב ביותר להשגת עובר בכיוון המושלם עבור הניסוי שלהם.

באיור 1. מלקחיים מניפולציה של עוברים dechorionated.
טיפים של שענים מלקחיים (מספר גודל 5) צריך להיות כפוף פנימה על מנת אופנה כלי לגרוף את העוברים כפי שמוצג כאן. המשטח החיצוני של האזור כפוף שימושית גם כדי לתפעל עוברים כאשר מיצוב על הממברנה Petriperm כמו ברשותם שום קצוות חדים שיכול לנקב את העובר.
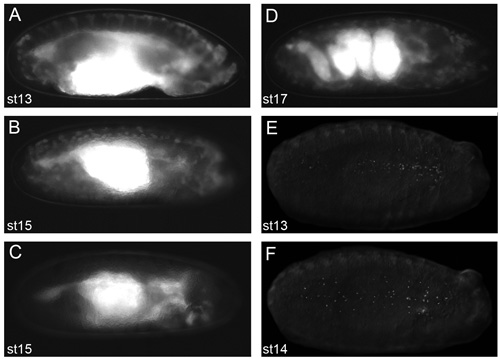
איור 2. נציג תמונות של עוברים שיניבו תוצאות טובות הדמיה לחיות.
תמונות של עוברים dechorionated בשמן voltalef (בשלב 2.11 לפרוטוקול) לקחה על מיקרוסקופ פלואורסצנטי לנתח. צפיות הרוחב של שלב 13 (א) ו שלב 15 (ב) SRP-Gal4, כטב"מ-GFP, crq-Gal4, כטב"מ-GFP עוברים. תצוגה רוחבית של שלב 15-SRP Gal4, כטב"מ-GFP / +; crq-Gal4, העובר uas-GFP/uas-N17Rac (C) שבו hemocytes לא הצליחו להעביר את הראש, מה הוכחת העוברים נראים כאשר hemocytes לא ברור לאורך נתיבי הנדידה שלהם. תצוגה רוחבית של שלב 17-SRP Gal4, כטב"מ-GFP, העובר כטב"מ-GFP crq-Gal4, מראה את מבנה מפותל של המעי בשלב זה של התפתחות (ד); את התחלתה של התכווצות שרירים מונע הדמיה של עוברים לחיות מעבר לכך השלב של הפיתוח. צפיות הגחון של שלב 13 (E) שלב 14 (F) SRP-Gal4, כטב"מ אדום עוברים העוקץ מראה פיזור hemocytes עם גרעינים שכותרתו fluorescently. תצפית של hemocytes ידי הקרינה בשלב 2.11 של הפרוטוקול היא תנאי הכרחי כדי להשיג תמונות מעולה; הקדמי נמצאת מימין עבור כל התמונות.

איור 3. הרכבה של עוברים על צלחת Petriperm / Lumox.
שני coverslips 18x18mm (עובי 1) תקועים מול התחתון של המנה Petriperm באמצעות טיפה קטנה של שמן, המופרדים על 1cm כמוצג. עוברים מסודרים ואז למעלה בצד הגחון עם מקבילים ארוך (קדמית, אחורית) שלהם ציר את הקצוות של coverslips מכוסה טיפה קטנה של שמן. ברגע הנפט התפשט כדי למלא את הפער בין שתי coverslips coverslip השלישי (עובי 18x18mm 1) ממוקם בעדינות על גבי שמן מכוסה עוברים באמצעות שני coverslips דבק בעבר כגשר למנוע עוברים מלהיות מעוכה. Coverslip זה מודבק אז אל שני גשרים coverslip באמצעות שתי טיפות קטנות של לק. לאחר ההגדרה, העוברים ניתן הדמיה על מיקרוסקופ זקוף או הפוך עם עדשה המטרה התמקדות למטה דרך coverslip (בניגוד דרך הממברנה Petriperm).
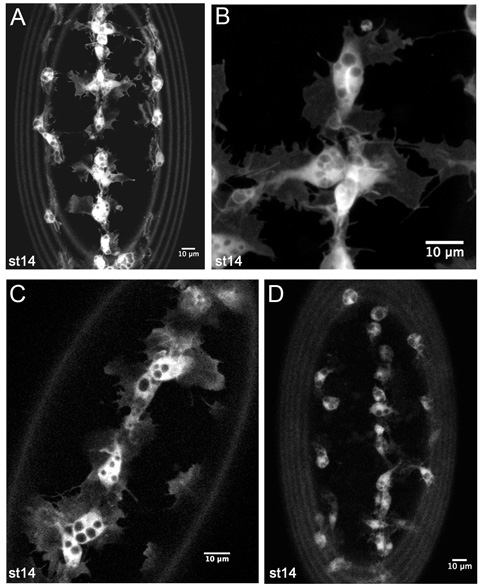
איור 4. תוצאות נציגת הדמיה חיה של ה-GFP hemocytes שכותרתו.
Z-תחזיות hemocytes בצד הגחוני של שלב 14-SRP Gal4, כטב"מ-GFP, crq-Gal4, כטב"מ-GFP העובר (AB). (A) היא התמונה בהגדלה נמוכה כגון להשתמש כדי לפקח על העברות התפתחותי hemocyte בסרטים timelapse. (ב) הוא עדיין גבוה הגדלה של קו האמצע hemocytes על הגחון, מראה הפרטים הקטנים של המורפולוגיה שלהם. (ג) היא פרוסה אחת של 1 מ 'hemocytes על קו האמצע הגחון בשלב 14-SRP Gal4, כטב"מ-GFP / +; crq-Gal4, כטב"מ-GFP / + העובר, חושף כי עותק מספרי נמוך יותר של נהגים Gal4 כטב"מ בונה הם גם מספיק כדי להפיק תמונות טובות. (ד) מציג הקרנה-z של hemocytes ב עובר שלב 14 crq-Gal4 כטב"מ-GFP,. כאן בליטות hemocyte ברורים פחות בשל הביטוי התחתון של ה-GFP, אבל זה עדיין אפשרי לעשות סרטים מסלול הגירה hemocyte עם השילוב הזה של הנהג Gal4 ו כטב"מ לבנות. תמונות צולמו על מיקרוסקופ הלייקה LSM510 confocal; הקדמי הוא מעלה את כל התמונות, את טבעות בשולי תמונות נגרמות על ידי autofluorescence קרום vitelline.

איור 5. תוצאות נציגת הדמיה חיה של hemocytes GMA להביע.
Z-תחזיות hemocytes על קו האמצע הגחון של שלב 13 (א) ו שלב 14 (ב) SRP-Gal4, כטב"מ-GMA עוברים, שנלקחו סרטים timelapse להראות הגירות ההתפתחותי של hemocytes. מידע מפורט על אקטין הדינמיקה ניתן להשיג על ידי הדמיה בהגדלה גבוהה יותר של hemocytes GMA להביע (C). GMA מורכב GFP התמזגו תחום אקטין מחייב של סיבי אקטין moesin ותוויות. Anterior היא מעלה את כל התמונות, התמונות צולמו על מיקרוסקופ confocal.
Discussion
האלמנטים החשובים ביותר של הליך זה הם מבחר של עוברים בריאים עם hemocytes שכותרתו ברורה לעלות אותם בזהירות מבלי לפגוע בהם. פעם הם עוברים בשמן halocarbon הם עמידים בפני התייבשות רכוב פעם ניתן הדמיה במשך כמה שעות. בידיים שלנו אנחנו hemocytes תמונה במשך שלוש שעות, עם התייבשות זניח של הע?...
Acknowledgements
פרוטוקול זה פותח דרך העבודה שלנו בתוך בשיתוף עם מעבדות של פול מרטין ואנטוניו חסינטו. אנו מודים מרכז במלאי Bloomington עבור שירות מעולה שלה ושל הקהילה תסיסנית להמשך לשתף קווי לעוף. BS ממומנת כרגע על ידי מענק לפרויקט BBSRC. WW ממומנת על ידי מלגה האמון Wellcome פיתוח קריירה.
Materials
| Name | Company | Catalog Number | Comments |
| Cell strainer | BD Biosciences | 352350 | 70μm pores |
| Halcarbon oil 700 | Sigma-Aldrich | H8898 | |
| Lumox/Petriperm dish | Sarstedt Ltd | 96077305 |
References
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bruckner, K. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7, 73-84 (2004).
- Dutta, D., Bloor, J. W., Ruiz-Gomez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34, 146-151 (2002).
- Stramer, B. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Halfon, M. S. New fluorescent protein reporters for use with the Drosophila Gal4 expression system and for vital detection of balancer chromosomes. Genesis. 34, 135-138 (2002).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Tepass, U., Fessler, L. I., Aziz, A., Hartenstein, V. Embryonic origin of hemocytes and their relationship to cell death in Drosophila. Development. 120, 1829-1837 (1994).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135, 621-626 (2008).
- Doerflinger, H., Benton, R., Shulman, J. M., St Johnston, D. The role of PAR-1 in regulating the polarised microtubule cytoskeleton in the Drosophila follicular epithelium. Development. 130, 3965-3975 (2003).
- Olofsson, B., Page, D. T. Condensation of the central nervous system in embryonic Drosophila is inhibited by blocking hemocyte migration or neural activity. Dev Biol. 279, 233-243 (2005).
- Paladi, M., Tepass, U. Function of Rho GTPases in embryonic blood cell migration in Drosophila. J Cell Sci. 117, 6313-6326 (2004).
- Vlisidou, I. Drosophila embryos as model systems for monitoring bacterial infection in real time. PLoS Pathog. 5, e1000518-e1000518 (2009).
- Jacinto, A. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol. 10, 1420-1426 (2000).
- Wood, W., Jacinto, A. Imaging cell movement during dorsal closure in Drosophila embryos. Methods Mol Biol. 294, 203-210 (2005).
- Kunwar, P. S. Tre1 GPCR initiates germ cell transepithelial migration by regulating Drosophila melanogaster E-cadherin. J Cell Biol. 183, 157-168 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved