A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפיך, לא פולשני שיטת ההתנגדות מדידות דרכי הנשימה ואת נוזל שטיפה ברונכואלוואולרית דגימה של עכברים
In This Article
Summary
מדידות חוזרות של הפיזיולוגיה מכרסם הנשימה דגימה של תאים דלקתיים בדרכי האוויר רצויות, אבל בדרך כלל לא ריאלי. כאן אנו מתארים את שיטת הדיר עבור בעל פה intubating עכברים המאפשר מדידות חוזרות של דרכי הנשימה ואת hyperreactivity דגימה של תאים דלקתיים בדרכי האוויר.
Abstract
Airway (AHR) hyperreactivity מדידות שטיפה ברונכואלוואולרית (BAL) דגימת נוזל חיוניים מודלים ניסיוניים אסטמה, אך הליכים חוזרים ונשנים להשיג מדידות כאלה החיה אותו הם בדרך כלל לא ריאלי. הנה, אנחנו מדגימים פרוטוקולים לקבלת מעכברים מדידות חוזרות של AHR ו ברונכואלוואולרית דגימות נוזל שטיפה. עכברים היו תיגר intranasally שבע פעמים מעל 14 ימים עם אלרגן חזק או טיפול דמה. לפני האתגר הראשוני, ותוך 24 שעות לאחר כל אתגר intranasal, החיות באותו היו מורדמים, מחובר לצינורות בעל פה מאוורר מכאני. AHR, שהוערכו על ידי השוואת עקומות מינון תגובה של התנגדות מערכת הנשימה (RRS) הנגרמת על ידי הגדלת מינון תוך ורידי של כלוריד אצטילכולין (אח) בין זיוף ו-אלרגן תיגר בעלי חיים, היו נחושים. לאחר מכן, ובאמצעות אינטובציה זאת, הריאה השמאלית lavaged כך ההפרש ספירה של תאים בדרכי הנשימה יכול להתבצע. מחקרים אלה מראים כי מדידות חוזרות של AHR ואיסוף נוזל BAL אפשריים מן החיות באותה הנשימה כי hyperresponsiveness מירבית דרכי הנשימה eosinophilia מושגות תוך 7-10 ימים של ייזום אתגר אלרגן. טכניקה חדשנית זו מפחיתה באופן משמעותי את מספר העכברים הנדרש לניסויים האורך הוא ישים מינים מכרסמים שונים, מודלים מחלות דרכי הנשימה מכשירים הפיזיולוגיה.
Protocol
אלרגן אתגר:
- C57BL / 6 עכברים, 4-8 שבועות של גיל, מורדמים בתא פרספקס אטום מטוהר עם 3.2% isoflurane בתערובת אדי חמצן במשך 10 דקות כדי להשיג הרדמה כללית עמוקה.
- אתגרים אלרגן Intranasal (45μL OVA (22.5 מיקרוגרם) ו 7μL א Oryzae (7 מיקרוגרם), ב-PBS) מנוהלים, כל יום שלישי, חמישי וראשון, עבור סכום כולל של שבעה יישומים רצופים.
הרדמה:
- לפני אתגר כל אלרגן, ובעקבות האתגר 7, עכברים מנוהלים זריקה intraperitoneal etomidate של 48 מ"ג / ק"ג (2 מ"ג / מ"ל), לפני מיקום קיבול אור למעט.
- נושא נותר קיבול עד חוסר תגובה נוירולוגית הנצפה הוא זוהה על הפעלת לחץ על כפותיו האחוריות (50-10 דקות).
אינטובציה:
- מנורת החום הקורן, שמרו על מרחק כדי להבטיח תחזוקה של ~ 37 ° C הליבה טמפרטורת הגוף, צריך להיות ממוקד בנושא לאורך ההליך כדי למנוע היפותרמיה. מדחום רקטלי יש להשתמש לפחות בהתחלה כדי לאשר euthermia ללא קשר למקור חום בשימוש.
השלבים הקריטיים כל נוזלים ומכשירי שהתקבלו על ידי חיות הניסוי צריך להיות סטרילי, נהלים צריכה להתבצע בתנאים aseptic קפדנית. היפותרמיה ממושכת ואילו בהרדמה תוביל נתונים סוטה ו / או למותם של בעלי חיים. כשירות בכל הליכים פולשניים צריך להיות פותח באמצעות בעלי חיים cadaveric לפני שתנסה לעבוד על בעלי חיים. חומר סיכה עיניים צריך לשמש כדי למנוע שפשופים בקרנית של בעלי חיים תחת הרדמה כללית. - בעכברים מורדמים יוסרו קיבול והניח במצב שכיבה (עד הצד הגחוני), על השולחן plethysmograph, מותאם זווית של ° 45.
- גומייה המקיפה את הטבלה מוכנס מאחורי בשורה העליונה של החותכות כך לאבטח את הנושא למקומו. עם פינצטה ביד ימין, אחיזה, להרחיב, ולהרים את הלשון מהפה לפני לאבטחת אותו במקום עם מתכת במלחוץ בידו השמאלית, ובכך מאפשר דרכי הנשימה ללא הפרעה עבור אינטובציה.
- 0.8 מ"מ בקוטר fiberoptic חוט, מחובר למקור אור, מוחדר דרך angiocatheter והאריך 10 מ"מ מעבר לקצה. ככל במלחוץ היא התייצבה עם יד שמאל, בסוף מואר החוט fiberoptic מונחה דרך חלל הפה והלוע ביד ימינה עד מיתרי הקול הם דמיינו. החוט לאחר מכן עבר דרך מיתרי הקול נעים לתוך קנה הנשימה תחת להדמיה ישירה, בעיתוי להתרחש כאשר מיתרי פתוחים מרבית.
- Angiocatheter לאחר מכן עבר על חוט סיב אופטי לתוך קנה הנשימה עד קצה הצנתר נמצא בתוך החלק באמצע של קנה הנשימה. עבור 17-22 גרם עכברים, זה מתאים לפלח קטטר 10 מ"מ שנותרו גלויים בין המחבר לבין קיצוניים גולגולתי של הלסת התחתונה של הנושא. הסכום בפועל שבו את הקטטר מועבר צריך להיקבע על ידי בדיקה ישירה של קנה הנשימה של 2-3 עכברים צינתור בגודל רלוונטי רקע גנטי.
- החוט fiberoptic יוסר אינטובציה מוצלחת היא מאושרת על ידי התבוננות נשימות עמוקות רגיל (טיולים קצבית של בית החזה והבטן), אשר מיד לאחר סיום חסימה של המחבר עם האגודל. בתגובה חנק, ללא חסימה אצבע, נשימות סדירות, או סימנים אחרים של קשיי נשימה מצביעים על angiocatheter malpositioning ובדרך כלל מצביעים על אינטובציה הוושט.
כישלון שלב קריטי במהירות לאחור אינטובציה הושט יכול להיות קטלני. אם אינטובציה הושט חשוד, הקטטר יש להסיר במהירות לרחם פעם החיה חידשה דפוס נשימה רגיל. Etomidate הוא הרדמה של בחירה כמו, כל הרדמה מכרסם זמין, סוכן זה מעורר את הרעילות לב וכלי דם לפחות (תת לחץ דם, הפרעות קצב, דום לב). - שולחן plethysmograph התחתון עד במקביל הספסל לעבוד ולהפוך את הנושא עד 180 מעלות מול יציאת האוויר ההנשמה. הפעל את החיה על צדה לפני ההתחברות ההנשמה.
- אינטובציה מוצלחת היא אישור נוסף כאשר, לאחר הבטחת חיבור אוויר חזק הפעלת המאוורר (מתפקד 150 נשימות / דקה, 9 מ"ל / g נפח גאות, 100% חמצן), טיול thoracoabdominal נתפסת קצב ההנשמה.
תוך ורידי קו:
- 10 מ"מ, מחט 27ga יוסר מחבר המזרק שלה בדרך של היתוך זה בחינם, כיפוף 90 מעלות מחט על האמצע באמצעות מלקחיים סטרילית hemostat כך שפוע הפנים לתוך זווית. הסוף לא משופעים מחוברת בצינור PE10 המובילים לנמל הזרקה IV.
- כדי למנוע פוטנציאלאמבוליזציה אוויר קטלני, את צינור ומחט הם מטוהר עם 37 ° C, 0.9% NaCl באמצעות מזרק 1 מ"ל. נמל הזרקת מורכב מחט 27ga, דחף דרך חור קדח לתוך כובע של צינור צנטריפוגה 15 מ"ל. כובע מלא כאלה מלוחים כי בסופו של מחט הוא שקוע כל העת, ובכך להקטין את הסבירות כי האוויר יהיה נגרר את המחט ואת מוזרק לווריד.
- עם העכבר שנותרו תחת מנורת החום, המחט מיושר בקצה הזנב של מקבילים הזנב אל על הווריד לרוחב. מחט מנוהלת על מעט מתחת לעור, בעוד ביים cranially לאורכו של וריד ודחף לכופף את תת עורי. מיקום מוצלח IV הוא אושר על ידי התבוננות backflow דם לתוך צינורות העירוי עם מעט משיכת הבוכנה במזרק. יתר על כן, לא אמורה להיות הפרעה בזרימת דרך קו IV על הזרקה של תמיסת מלח 5-10 μl לווריד הזנב. ורידים זנב מזדמנים שלא ניתן cannulated ביציבות. במקרים אלה, העכבר ניתן לסובב 180 מעלות לצד השני ואת הזנב אחרים IV לגשת בדרך כלל ללא קושי.
- לאחר הסרת מנורת חום ההתקנה, הנושא הוא מוקף plethysmograph, לאחר מכן מאובטח כמו אוויר הדוק עם היישום של 4 מלחציים.
שלב קריטי לאפשר את המנורה חום להישאר יהיה חום האוויר בחדר plethysmograph ואפשרות לשנות את המידות הבאות של עקרות RS-R של מחטים iv ופתרונות חייבת להישמר. עיקור של מחטים מושגת על ידי טבילה שטיפה עם אתנול 70% ואחריו שטיפה שטיפה עם תמיסת מלח סטרילית לפני iv הכניסה. יתר על כן, הזנב יש לנקות עם 70% אתנול או אלכוהול איזופרופילי לפני הכניסה iv.
Airway מדידות של התנגדות:
- שיא ההתנגדות נקבעת על ידי quantitation רציפה של המנה DPT / V (DPT שבו הוא השינוי בלחץ קנה הנשימה ו-V היא זרימת אוויר) בנקודות של נפח ריאות שווים (70% בנפח גאות). DPT נקבעת באמצעות מתמר הלחץ מחובר angiocatheter קנה הנשימה. כדי לקבוע V, לחץ וריאציות plethysmograph מכוילים לשינויים נפח על טווחי פיזיולוגי למד. ההפרש נפח plethysmograph לאורך זמן, כפי שחושב על ידי מודול preamp, הוא V. לאחר הקמת הבסיס יציב R RS (<וריאציה 5% מעל 3 דקות), חמש מנות עוקבות (נפח = 2 μl / g משקל הגוף) של הגדלת ריכוזי כלוריד אצטילכולין (0.058, 0.18, 0.59, 1.58 ו -5.8 מ"ג / ק"ג משקל גוף, מלח ב 0.9% ב-pH 7.4, שמרו על הקרח ביד התחמם לפני כל הזרקה) מוזרקים על שנייה אחת דרך iv, עם מינון כל הבאים מנוהל עם שובו של R-RS לקו הבסיס, עד tripling של התנגדות בסיסית (כ 12 ס"מ H 2 O x מ"ל -1 x שניות, כלומר גידול של 200% התנגדות האוויר מעל הבסיס טיפוסי של כ 4 ס"מ H 2 O x מ"ל -1 x שניות) מושגת. ריכוז פרובוקטיבי של אח, של מ"ג / גרם של משקל הגוף, הגורמת גידול של 200% R מ RS ערכי הבסיס (שמכונה PC 200), מחושב על ידי אינטרפולציה מתמטית של אח RS-R מנה תגובה עקומות.
- ברגע PC 200 ערכים כבר הגיע, מחברים שחרור, ולפרק את plethysmograph. מקסימום של 5 מנות הגוברת של אח הוא נתון. טווח הריכוז אח לעיל מתאים להשגת 200 ערכים PC עבור זנים עכבר נאיבי ביותר.
שלב קריטי כאשר הבסיס של כ 4 ס"מ H 2 O x מ"ל -1 x שניות הוא הוקם על צג התנגדות למשך 30 שניות, 60 μL של תמיסת מלח רגיל ניתן להזריק iv כדי לאשר את המטוס המתאים הרדמה הושגה. עם הרדמה מלאה, לא יהיה שינוי משמעותי בהתנגדות; עלייה התנגדות או התנועה של הגפיים או הזנב מהווה סימן של מצוקה פיזית מצביע על הצורך בהרדמה נוספת. - הסר IV מווריד הזנב ולאחר מכן לנתק את החיה מן המכונה, שמירה על דרכי הנשימה פטנט על ידי שמירה על צינורית לקנה הנשימה במקום. בעלי חיים מזדמנים אינם מצליחים לחדש נשימה ספונטנית מיד. במקרים אלה, הנשימה יכול להיות מעודד בעדינות לעסות את בית החזה.
נשימה שלב קריטי ספונטנית יש להקים לפני ההעברה לחדר התאוששות, אחרת למותם תתרחש. - עם חידוש הנשימה הספונטנית, עכברים מועברים עם cannulae קנה הנשימה במקום, לחדר מטוהר עם 100% O 2 ושמירה על 37 מעלות צלזיוס באמצעות מנורת חום. בתוך 15-20 דקות, עכברים נושמים חזק ומתחיל להזיז הגפיים שלהם, ובנקודה את הקטטר קנה הנשימה ניתן להסיר וחיות יםהועבר afely אל הכלובים הרגילים שלהם.
שלב קריטי דרכי הנשימה חסום בקלות העכבר מודע עקב ריור-hyper-Induced אצטילכולין והוא הסיבה העיקרית למוות מחנק הקשורות בעכברים מורדמים הבאים מדידות פיזיולוגיות דרכי הנשימה. מסיבה זו, צינורית לקנה הנשימה חייבת להישאר במקום, אפילו בעכברים לא עוברת שטיפה ברונכואלוואולרית, עד שהם arousable ולא צריך להסיר עד Hyper-salivaton חדלה.
ברונכואלוואולרית שטיפה:
- אוסף של נוזל שטיפה ברונכואלוואולרית בטוח כאשר העכברים להתאושש מספיק רפלקס ההקאה שלהם (~ 20 דקות אחרי מיקום בחדר ההתאוששות). רפלקס ההקאה נבחנת על ידי הזזה angiocatheter בעדינות פנימה והחוצה, שיעול ברור או נאבקים עולה כי רפלקס ההקאה שב.
שלב קריטי מתן ממושך מדי זמן ההחלמה יהיה מאוד מפחיתים את יעילות לחזור BAL מעכברים הפרט, ולכן רפלקס ההקאה חייב להיות במעקב כל כמה דקות, לאחר תקופת הציע 20 דקות מנוחה. אם העכברים לא מסוגלים לסבול את ההליך שטיפה עקב התעוררות חלקית, 3.2% isoflurane הרדמה אדי יכול לשמש. - אינטובציה מדריך חוט מתכתי (0.5mm OD), עם עיקול מתמשך של ~ 30 ° מכוונת באונה השמאלית של הריאה, מוכנס לתוך angiocatheter. החוט מדריך angiocatheter מתקדמים יחד לתוך האונה השמאלית של הריאות, כך הקטטר (רכזת נשלל) חורג השיניים הקדמיות על ידי 1mm בלבד.
כישלון שלב קריטי לבודד הריאה השמאלית יהיה לצמצם במידה ניכרת תשואה, תוך שיפור הסיכויים למוות של בעלי חיים. יש להקפיד על מנת להבטיח את קצה החוט המדריך אינו עובר סוף פתוח angiocatheter. קידום angiocathether עם קצה מתכתי בולט יכול להוביל קריעה קנה הנשימה ומוות עקב קרע קנה הנשימה. - שמירה על angiocatheter במקום, guidewire יוסר 300 μL של PBS (pH 7.4, סטרילי) הוא הסמיק לתוך הריאה השמאלית באמצעות מזרק 1 מ"ל. מיד לאחר מכן, תוך כדי ציור את הבוכנה במזרק כדי ליצור לחץ שלילי, angiocatheter הוא לאט (3 ים) הסיר תוך בעוצמה עיסוי ריאות. לחזור BAL של μL 100-200 צפויה.
- מיד לחזור עכברים lavaged על 37 ° C, 100% O 2 קאמרית ברציפות תוך עיסוי בית החזה. עכברים מניחים על צד שמאל שלהם עד התאושש לחלוטין (~ 20 דקות). בעלי חיים ממוקמות מכן בחזרה לתוך הכלובים.
תזמון:
לפי עכבר, ההליך כולו צריך לקחת לא יותר משעה 1 להשיג: שלב 3-4 דק ', 5-10; שלבים 5-21, 10 דקות, שלב 22, 20-30 דקות; שלבים 23-24,... 10 דקות. עם מיומנות מוגברת לפי נושאים מדהים בפרוטוקול, עד 3 עכברים / שעה עשוי להיות מעובד.
נציג תוצאות:
Hyperreactivity Airway בעכברים, כפי שנקבע על ידי מודד של 200 ערכים PC, הוא תוצאה של הפעלת וגיוס אל הריאות של תאים T ו הפרשת ציטוקינים IL-135-7. לפיכך, hyperreactivity דרכי הנשימה אינה תוצאה בלתי נמנעת של אתגר דרכי הנשימה עם האלרגן, אלא תלויה תא תא שלם T החיסונית ואת הזמן הנדרש התגובות תא T לפתח בקביעת החשיפה לאלרגן חוזרות ונשנות. כפי שמוצג באיור. 2a, hyperreactivity דרכי הנשימה, כהגדרתו PC 200 ערכים נמוכים משמעותית לעומת ערכי הבסיס, שפותחה לאחר 5 אתגרים אלרגנים ללא עלייה משמעותית נוספת לאחר האתגר השישי. מסיבות שאינן מובנות לגמרי, תגובתיות דרכי הנשימה ירד (200 ערכים PC גדל) לאחר האתגר אלרגן הראשון (איור 2 א). מגמות דומות ניכרות על ידי השוואת התגובה אח עקומות מנה של עכברים אותו (איור 2b). עם זאת, ברור כי כאן hyperreactivity דרכי הנשימה מלא מתפתח בפתאומיות לאחר האתגר אלרגן החמישי, כגון עכברים להיות יותר מאשר פי 30 יותר רגיש אח בין האתגרים הרביעי השישי. יחדיו, ממצאים אלה מצביעים על מדידות אמין ביותר AHR מתקבלים לאחר שישה אתגרים האלרגן (12 ימים); מדידות timepoints מוקדם צפויים להניב נתונים משתנה מאוד. עכברים תיגר שוב ושוב עם הרכב intranasally (מלוחים) אינם מפתחים hyperreactivity דרכי הנשימה, וכן, בכל המינונים של אח נתון, R מדידות RS לא משמעותי להשתנות ערכי הבסיס (איור 3 ו מידע לא מוצג).
לפני הופעתה של AHR חזקים, סוג התא הדומיננטי של דרכי הנשימה הנגרמת על ידי אלרגן היה נויטרופילים (איור 4). בדומה למגמה עבור AHR, לעומת זאת, התחזק בהדרגה eosinophilia עם האתגר אלרגן חוזרות אאזנופילים הפך את סוג התא דומיננטי מבחינה מספרית בנוזל af BALter האתגר השישי, ביחד עם ירידה ניכרת במספר neutrophis (איור 4). המקרופאגים בתחילה גדל מספר עם האתגרים הראשונים אלרגן כמה נע בשפע לאחר מכן. שפע הלימפוציטים לא השתנה משמעותית ללא קשר למספר אתגרים אלרגן, בהתחשב באופן פרדוקסלי חשיבות העיקרי שלהם למודל, הם בדרך כלל התא לפחות רבים בנוזל BAL.
מדידות Airway עמידות בעכברים שקיבלו לא אתגר אלרגן ולא הדגימה BAL לא להשתנות במשך 17 ימים של ניסויים. חוזרים הדגימה נוזל BAL בהעדר מדידות דרכי הנשימה פיזיולוגיה או אתגר אלרגן בוצעו גם, והראה רק נויטרופילים משופרת גיוס macrophage אל דרכי הנשימה שלא להתמיד מעבר 5 ימים (מידע לא מוצג). ממצאים אלה מעידים כי neutrophilia בולט נצפתה בעכברים אלרגן תיגר הוא במידה רבה תוצאה של התהליך ולא את האנטיגן.
בשליטה, PBS-תיגר עכברים, מדידות התנגדות האוויר גם לא משתנה באופן משמעותי לאורך זמן. Enhanced macrophage ו נויטרופילים, אך לא גיוס אאזנופילים, כדי נוזל BAL נתפסה גם אלה עכברים, הדומים לאלו השינויים שנצפו בעכברים שקיבלו רק חזר הדגימה נוזל BAL (איור 4 ב, ד). יחד, נתונים אלה מדגישים את החשיבות של האלרגן, ולא מניפולציות שונות של דרכי הנשימה, כדי אינדוקציה של דלקת שניהם (eosinophilic) אלרגיות בדרכי הנשימה ואת AHR.
תוצאות דומות ניתן לצפות באמצעות אלרגנים intranasal מקביל proteinase כי השתמשנו כאן. עם זאת, חוקרים רבים משתמשים ovalbumin לגרום מחלת ריאות אלרגית. לאחר תקופה המתאים תחול intradermal או intraperitoneal (1-2 שבועות) עם ovalbumin זירז מלח אלומיניום, פנוטיפ אסטמה חזקים, כולל hyperreactivity דרכי הנשימה, ניתן לצפות תוך 24 שעות לאחר אתגר intranasal יחיד עם ovalbumin מסיסים.
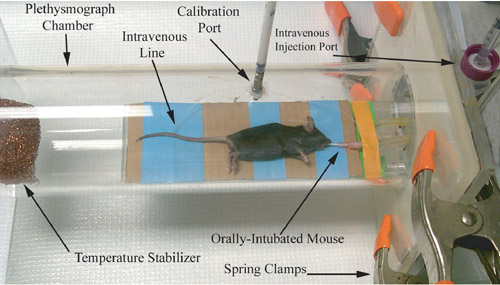
באיור 1. ייצוג צילום של plethysmograph מכרסם, מיד לפני ההקלטה מדידה הפיזיולוגיה דרכי הנשימה.

2. איור התנגדות Airway מדידות. א) למטרות סטטיסטיות, antilog PC 200 ערכים מדווחים. הערה העלייה הגדולה המחשב antilog 200 אחרי האתגר הראשון וירידה הבאים הבאים אתגרים נוספים. ב) התנגדות מערכת הנשימה (RRS): שים לב תלילות של אח-RRS מנה תגובה עקומות אחרי אתגרים השישית והשביעית. ברים שגיאה מייצגים SEM.
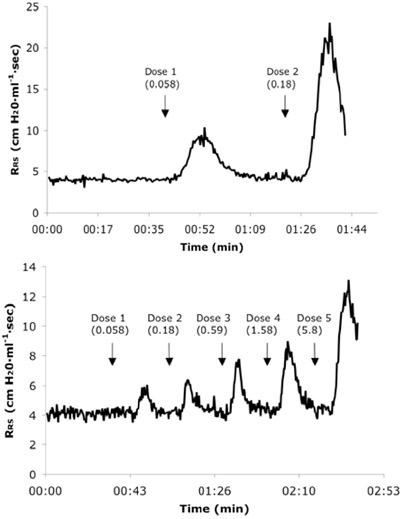
איור 3. התנגדות הנציג בזמן אמת מערכת הנשימה (R RS) העתקים מן אלרגן נאיבי (א) ו 6X תיגר עכבר (ב) קבלת מנות הרביעי ברציפות של אח. ערכים מנה מוצגים מ"ג / ק"ג יחידות.

איור 4. דיפרנציאלי ספירת תאים חיסוניים דגימות שטיפה ברונכואלוואולרית נגזר לריאות השמאלי של העכברים שטופלו 7 אתגרים intranasal רצופים. (%) אחוז שפע של תאים חיסוניים בעכברים שטופלו עם האלרגן (א) או PBS (B). מספר כולל של תאים חיסוניים מן העכברים שטופלו האלרגן (ג) או PBS (ד '). ערכים המיוצגים אומר + / - SEM.
Discussion
המחקר של אסטמה, מחלות שונות אחרות חסימתית בדרכי הנשימה, מהווה שדה פעיל והרחבת של מחקר ביו. מרכיב חשוב של מחקר אסטמה הקשורות ניסיוני הוא היכולת למדוד שינויים בגודל דרכי הנשימה בתנאים משתנים. היצרות דרכי הנשימה מוגזמת בתגובה אתגר פרובוקטיבי, תכונה הקנוני של אסטמה, מחלו...
Acknowledgements
אנו מודים לד"ר וו מינצר על ההצעה לבצע אינטובציה orotracheal סיב אופטי. U19AI070973 נתמך על ידי מענקים, R01AI057696, K02HL75243 ו R01HL082487 מן המכונים הלאומיים לבריאות.
Materials
Airway הפיזיולוגיה מדידה תוכנה (Rescomp) היה מוכן אישית (Millennium פרמייר קבוצה: 415-519-4371).
הנתונים נותחו באמצעות תחנת PC מערכת הפעלה Windows XP מצויד עם מעבד Pentium III (Intel, Inc בסנטה קלרה, קליפורניה) ו אנלוגי 17 פינים ל אות ממיר דיגיטלי (National Instruments, # PC-LPM16).
חיה קטנה בדרכי האוויר תחנת הפיזיולוגיה הורכב אישית (Millennium פרמייר קבוצה) באמצעות מתמרים ללחץ זמינים מסחרית (חלק # TRD5700 TRD4510 ו), מודולים preamp (חלק # MAX2270), מארז (חלק # MAX1320, כל מן Buxco, Inc בווילמינגטון, צפון קרוליינה ) ו plethysmograph אישית חיה קטנה.
0.5mm קוטר חיצוני סיבים אופטיים חוט, מחובר למקור האור (הפנס קול פאלמר, 41722 סדרה)
מאוורר (הרווארד Apparatus עכבר מאוורר, # 687)
10 מ"מ, מחט 27ga (BD Biosciences, חתול. לא. 309602)
מחממים מנורה
1 מ"ל במזרק (BD Biosciences, חתול. לא. 305109)
מהדק 4 (פוני 3200 מהדק קפיץ)
חוט 0.5 מ"מ חיצוני עבור מדריך אינטובציה
Hemacytometer
Superfrost / פלוס מיקרוסקופ שקופיות (חתול פישר. לא. 12-550-15)
Shandon סינון כרטיסים (Thermo חתול. לא. 5991022)
תא שקופיות דיפרנציאלי כתם (חתול פישר. לא. 122911)
מיקרוסקופ אור (לייקה)
Cytospin 3 (Shandon)
20 ga, 1.25 אינטש ProtectIV קטטר תוך ורידי (סמית רפואי)
0.5 מ"מ פולימר סיב אופטי (אדמונד אופטיקה # NT02-532).
References
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved