A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פיזור מיקרוסקופיה אופטית על בסיס דו מימדי מסננים גאבור
In This Article
Summary
אנו להדגים שיטה כהה שדה מיקרוסקופית המבוססת על גאבור כמו סינון למדוד הדינמיקה subcellular בתוך תאים חיים בודד. הטכניקה היא רגישה לשינויים במבנה של האברונים, כגון פיצול המיטוכונדריה.
Abstract
אנו מדגימים מכשיר מיקרוסקופי שניתן למדוד מרקם subcellular הנובעים מורפולוגיה אברון וארגון בתוך תאים חיים בלא כתם. המכשיר המוצע מרחיב את הרגישות של מיקרוסקופיה אופטית, תווית חינם לשינויים בגודל ננומטרי אברון וצורה והוא יכול לשמש כדי להאיץ את המחקר של הקשר מבנה פונקציה הנוגעים אברון הדינמיקה הבסיסית תהליכים ביולוגיים בסיסיים כגון מוות תאים מתוכנת או הסלולר בידול. המיקרוסקופ יכול להיות מיושם בקלות על פלטפורמות מיקרוסקופיה הקיים, ולכן יכול להיות מופץ למעבדות הפרט, שבו מדענים יכולים ליישם להשתמש בשיטות המוצע עם גישה מוגבלת.
הטכניקה המוצעת תוכל לאפיין את מבנה subcellular על ידי התבוננות דרך תא דו מימדי מסננים אופטיים גאבור. מסננים אלה יכול להיות מכוון לחוש ברגישות (10 של של ננומטר) הננומטרי, תכונות מורפולוגיות ספציפיים הנוגעים לגודל והכיוון של אי - כדורית האברונים subcellular. אמנם מבוסס על הניגוד שנוצר על ידי פיזור אלסטי, הטכניקה אינה מסתמכת על מודל פיזור מפורט הפוך או על התיאוריה מ.י. לחלץ מדידות morphometric. טכניקה זו היא אפוא החלים הלא כדורית האברונים עבורו תיאור מדויק פיזור תיאורטית לא ניתן בקלות, והוא מספק פרמטרים morphometric הייחודי שניתן להשיג בתוך תאים חיים בלא כתם על מנת להעריך את תפקידם. הטכניקה היא יתרון לעומת עיבוד תמונה דיגיטלית, כי היא פועלת ישירות על השדה של האובייקט ולא לשנות את העוצמה של האובייקט discretized. אין להסתמך על שיעורי דגימה גבוה התמונה ולכן יכול לשמש במהירות מסך פעילות מורפולוגיים בתוך מאות תאים בכל פעם, ולכן מאוד להקל על לימוד מבנה אברון מעבר פילוח אברון שחזור הפרט על ידי מיקרוסקופיה confocal פלואורסצנציה של תמונות דיגיטליות מוגדל מאוד תחומים מצומצם של הנוף.
בהפגנה זו אנו מראים נתונים diatom ימיים כדי להמחיש את המתודולוגיה. כמו כן, אנו מראים נתונים ראשוניים שנאספו תאים חיים כדי לתת מושג על איך השיטה ניתן להחיל בהקשר הביולוגי הרלוונטיים.
Protocol
1. התחלת התאים מוכן
- התאים היו מצופה יום לפני צריך להיות מתויג עם ירוק Mitotracker עבור דימות פלואורסצנטי של המיטוכונדריה.
- הסר את 100 המניות מיקרומטר פתרון ירוק Mitotracker ב DMSO עשה בעבר מן המקפיא 4 מעלות צלזיוס, חם לטמפרטורת החדר עם היד. כמו כן, להוציא שור לתאי אנדותל העורקים (BAEC) תרבית תאים בינוניים גם הכין בעבר חמים 37 ° C ב waterbath benchtop.
- לאחר Mitotracker ובינוניים תרבות הם חיממו, במקום אלה לתוך השכונה דואגים לחטא את הידיים בכפפות שלך כל המשטחים החיצוניים של מכולות עם פתרון אתנול 70%. אין להדליק את האור מכסה המנוע, כמו התווית פלורסנט אור רגיש במהרה photobleach באור החדר הסביבה.
- ביצוע הריכוז הנכון עבור תיוג המיטוכונדריה היא מאוד חשובה. מעט מדי לא התווית ביעילות המיטוכונדריה, בעוד Mitotracker רבה מדי יכולה להיות השפעה רעילה. ריכוז של 100 ננומטר של Mitotracker מודגרות במשך 45 דקות עם התאים עובד היטב. הכן זה ריכוז ידי הוספת 100 μL של המניה Mitotracker עד בינוני 10 מ"ל תרבות בצינור 15 מ"ל. זה יגרום הרבה לניסוי אחד לפחות.
- החלף את המדיום הקיים בינוני שכותרתו ידי ומוצץ את המדיום הישן עם פיפטה פסטר מחובר לקו הואקום. מיד לאחר מכן להוסיף 2 מ"ל של המדיום שכותרתו כל תרבות כבוש היטב צלחת 6 היטב.
- בגלל התווית ניאון הוא רגיש לאור, להחליף את התאים בחממה במהירות בלי לחשוף את האור בחדר ישיר. כיסוי צלחת 6 היטב עם הידיים עובד היטב עבור זה. התאים יישארו בחממה במשך 45 דקות.
2. התחלת ההתקנה אופטי מוכן
- בעוד התאים לחכות בחממה, אנחנו צריכים להפעיל את ההתקנה האופטי. בחדר אופטיקה, קודם להדליק את מנורת קשת כספית, ואחריו המחשב, מיקרוסקופ, מצלמות, ואת לייזר. ואז לחבר את המכשיר micromirror הדיגיטלי (DMD) לבין מפזר ספינינג.
- ודא כי ההשקה אופטי מיושר על ידי הסתכלות דרך העינית מיקרוסקופ כדי להבטיח את שדה הראיה הוא מואר באור לייזר.
- נקו את המטרה על ידי קיפול פיסת נייר העדשה לריבוע חזק לתפוס בחוזקה עם hemostat. טובלים את הנייר לתוך העדשה אמוניה ללא פתרון זכוכית ניקיון לספוג כמות קטנה לתוך הנייר. ראפ hemostat על יד חופשית שלך כמה פעמים כדי להסיר את כל העודפים. נגבו את המטרה על ידי בתוקף יישום אחת לסחוב נקי, מתמשך על פני המטרה מקצה אחד לקצה השני, הולך על העדשה באמצע. אתה לא מחדש לגנוב או שיחים. בטל הנייר בו נעשה שימוש.
- כדי לטעון את המדגם, במקום graticule מעל המטרה שמן 63x טבילה ידי הטלת 1-2 טיפות קטנות של שמן טבילה מעל המטרה בעוד המטרה היא כל הדרך למטה. אז במקום graticule בשלב. ואז להעלות את המטרה, כך שמן "תופס" את המדגם. פוקוס מדגם העינית.
- כדי ליישר את הקבל, להתאים את גובה הקבל, כך שהוא מיושר בתאורה קולר המרכזית על ידי התמקדות קצה של משושה לעצור את השדה הקבל. מרכז השדה הקבל לעצור מעל שדה הראייה במידת הצורך על ידי סיבוב הכפתורים הקבל מרכוז. לעצור את הצמצם הקבל צריך להיות סגור.
- הפעל את תוכנית קלט IPlab ואת ההגדרות כדי להפעיל את המצלמה RoperScientific 512 אשד. ודא את המצלמה מוגדר מסגרת מצב ההעברה. הפעל את 'תצוגה מקדימה חיה על ידי הפעלת "רוכשת מוקד" הפקודה. הגדר את הקידומת מדד מיקום הקובץ שבו התמונות יישמרו.
- הפעל את תוכנית RSImage קלט את ההגדרות כדי להפעיל את התוכנית CoolSnap. מצב Clocking צריך להיות מוגדר נורמלי.
- הפעל את התוכנה DMD והמקום איריס שדה כהה בתפריט סקריפט, ואחריו את "Load ו איפוס" הפקודה להריץ את הסקריפט.
- שלח את האור אל המצלמה DMD 512 ו Cascade ידי הגדרת מיקרוסקופ optovar ו viewport כדי LSM. פעולה זו תשלח את התמונה דרך DMD לבין אופטיקה מיושר, מקרין את התמונה על DF-CCD. התמונה כהה (DF) בשדה יופיע על התצוגה המקדימה לחיות כבר לדרך IPlab. התאם את המיקוד קנס של המיקרוסקופ אם יש צורך למקד את התמונה על תצוגה מקדימה של חיים.
- קח תמונה של שדה הראייה באמצעות "לרכוש אחד" הפקודה. קבע את זמן החשיפה גבוה מספיק כדי להבטיח לפחות 10,000 עבירות של אות בתמונה. לאחר הרכישה, להשתמש "להציל באינדקס כמו" הפקודה כדי לשמור את התמונה בדיסק. דימוי זה של graticule מודד את גודלו של שדה הראייה (FOV).
- עכשיו, להעביר את המדגם graticule כך graticule הוא מעבר FOV כך רקע רק גלוי. רוכשת את תמונת רקע של שדה בזמן חשיפה מספיק כדי להבטיח כי לפחות 5000 סעיפים של אות נרכשת. תמונה זו תסייע ברקע חיסור של התמונות ללא סינון.
3. טעינת filterbank ושימוש ההתקנה לרכוש מסוננים-רקע תמונות
- עכשיו, אנחנו צריכים לרכוש גאבור סינון תמונות הרקע. טען את התסריט לסנן גאבור הבנק התוכנה לשלוט DMD. הפעל את התסריט כולו למאגר מסננים בזיכרון המשולב של DMD, זה עלול לקחת כמה דקות.
- לאחר שנאגרו התסריט כולו, עכשיו אנחנו יכולים לרכוש תמונות מסונן של הרקע. השתמש להתחיל ולהפסיק סמנים בתוך התוכנה DMD להורות DMD לטעון רק סט אחד של פילטרים המתאימים לסינון גאבור כמו אחד בכל פעם, להריץ את הסקריפט. תצוגה מקדימה לחיות צריך לשנות מן השדה כהה לתמונה סינון עבור המסנן.
- פתח את התסריט הרכישה IPlab מהדיסק. התאם את זמן החשיפה על מנת להבטיח כי לפחות 2000 סעיפים של האות הם הנרכשות. כמו תסריט DMD פועל, לבטל את התצוגה המקדימה של חיים IPlab ולהפעיל את התסריט הרכישה. זה יהיה באופן אוטומטי לרכוש, מדד ולשמור את התמונה מסוננים בדיסק.
- לאחר התמונה הראשונה היא רכשה, להפסיק את התסריט רץ בתוכנה DMD ולמחוק את פקודות מן הכתב. החלף את ההתחלה ואת הסמנים לעצור בתחילת ובסוף להגדיר את המסנן הבא. חזור על רכישת IPlab.
- חזור על שלב 3.4 עד filterbank כולו נעשה שימוש וכל התמונות מסוננים נרכשו והציל.
4. ציפוי התאים
- עד עכשיו, התאים בקרוב יהיה מוכן הצלחת הניסוי. חברו את המגהץ הלחמה על benchtop במעבדה. הסר את המדיום L15 צפייה חום 37 ° C. הפוך תחנת עבודה עם מגבת נייר Kimwipe. בצע מספר פתילות ידי קריעה, מסובב Kimwipes. פתילות תסייע בהעברת נוזל אל ומתוך צלחת התא.
- אחרי זה, אנחנו צריכים הצלחת המדגם. אנו עושים שימוש במדגם בעלי במכונה מתכת לצלחת התאים שלנו, עושה "כריך coverslip" עם לוחית מתכת בין. החלת חרוז דקה של שומן מן ואקום מזרק סביב בפריפריה העליון של החור צלחת מתכת הרחבת בערך במחצית הדרך עד קצה החריצים בכל צד. לחץ בעדינות לא נקי. 1 coverslip על השומן. תהפכו את הצלחת מעל למרוח משחה סביב החור. כבו את האורות בחדר.
- עכשיו אנחנו מקבלים את התאים מן האינקובטור, טיפול בתוכן חממה עם הבחינה nitrile כפפות מעוקרות עם אתנול 70%. הסר את לוחית התא מן האינקובטור, עוצרת את הנשימה שלך בזמן את הדלת פתוחה חממה. היזהר כדי למזער את החשיפה לאור החדר.
- הסר את coverslip אשר ישמשו לצורך הניסוי מהצלחת שש היטב, וציין כי הצד זה היה עם הפנים כלפי מעלה בבאר הוא הצד עם תאים המצורפת. בזהירות לייבש את coverslip משני הצדדים עד שהוא כמעט יבש לגמרי, תוך שמירה על מסלול של איזה צד של coverslip יש את התאים. אז בעיתונות, coverslip בצד התא כלפי מטה, לתוך צלחת מתכת משומן מעל החור צפייה, ולוודא כי אין פערים האוויר להישאר בתוך שכבת שומן. גריז חייב ליצור אטימה למים, כדי לאפשר לנו לטעון את התאים עם המדיום L15. ברגע שאתה בטוח בכך, להפוך את הצלחת חזרה מעל.
- פיפטה המדיום L15 לתוך התאים מצופה על ידי לאלץ את הנוזל דרך החריץ בין coverslip העליון את לוחית המתכת. Pipetting 200 μL בכל פעם עובד היטב. פיפטה הכרך הראשון אמור למלא את החלל דחוקה בין coverslips עם הנוזל הארכת כמעט החריץ בצד השני.
- פיפטה אחרת μL 200 של המדיום לתוך התאים מצופה, אבל הפעם, להחזיק הפתיל בחורשה מתנגדים כל כך בינוני זורם מצד אחד למשנהו. זה שוטף את התאים ומסיר עקבות של המדיום הישן. היזהר למנוע בועות מ טביעה בתוך הנוזל במהלך שלב זה. חזור על התהליך 2-3 פעמים באמצעות פתיל חדש עבור כל שטיפה.
- זכור את מלחם אנחנו מחוברים? עכשיו הוא הזמן מתרגל. תהפכו את הצלחת הפוך עוד פעם, לתמוך צלחת מן הקצוות כך נוזלי הוא לכוד בתוך המאגר התא לא יכול לטפטף כלפי מטה. טובלים את מלחם לתוך כוס valap. זה יהיה במהירות להמיס חלק valap אשר תוכל להיצמד קצה מלחם. בזהירות להחיל את valap מותכת מסביב לקצוות של coverslip התחתון (שעכשיו הוא פונה כלפי מעלה) באמצעות קצה מלחם כמו המוליך. המשך טבילה ויישום עד שאתה הולך את כל הדרך מסביב coverslip, איטום coverslip על צלחת המתכת.
- Coverslip התחתונה יש תאים גדל על זה, אולי שאריות בינוני עד מיובש בצד חשוף. נקו שאריות ממשטח coverslip ידי אוספת Kimwipe ו לנקותg coverslip בתנועה החלקה יחיד כמו ניקוי המטרה. הדבר מבטיח כי coverslip היא הנקייה במרכז איפה זה יהיה שנצפו.
- נתק את מלחם ולהחזיר את צלחת 6-היטב החממה התבוננות הבלימה זהה ונהלים עקרות. קח את התאים מצופה למעבדה אופטיקה הר על המטרה כמתואר צעדים 2.4 ו 2.5.
5. ביצוע הניסוי
- מצא את שדה נחמד למראה בריא של התאים.
- רוכשת את תמונת שדה כהה של שדה הראייה. יישר את מיקרוסקופ לעומת ההפרש התערבות (DIC) לרכוש תמונה DIC. ודא כי פעמים חשיפה מספיק ארוכה כדי להבטיח כי אות היא נאותה.
- עכשיו אנחנו צריכים להשיג את התמונות על המצלמה ניאון אחרים. כדי לקבל תמונות DIC על CoolSnap, אנו משתמשים כחולה LED המצורפת הקבל, והחלפתו והסרת אותו לפי הצורך. בעוד מיקרוסקופ מיושר עדיין DIC, שלח את האור CoolSnap על ידי קביעת optovar מיקרוסקופ כדי 1.0x ו viewport כדי המשקפת 100%. הפניית את התמונה בעינית המצלמה. מניחים את LED על הקבל כדי להאיר את השדה לצפות בתצוגה מקדימה של FOV ב RSimage ולהתאים להתמקד בסדר אם יהיה צורך. רוכשת את תמונת DIC ולשמור בדיסק. שים לב איך FOV הוא שונה מזה המתקבל מהמצלמה אשד. תמונות אלה יצטרכו להיות רשום בשלב ניתוח לאחר הניסוי.
- השג תמונה הקרינה על ידי התאמת קוביית לסנן את filtercube והעמסת. רוכשת תמונה על ידי לחיצה קצרה על עירור מפנה את הקרינה באמצעות מיקרוסקופ ואז לכבות אותו ברגע הרכישה הושלמה. מכיוון שאנו מתמקדים המדגם DIC, התמונה הקרינה מתמקדת גם כן. זה חוסך בזמן החשיפה הקרינה, ובכך להאט photobleaching. שמור את התמונה פלואורסצנציה בדיסק.
- עכשיו אנחנו צריכים לרכוש את התמונות מסונן. איפוס מיקרוסקופ לשדה חשוך שוב את האור דרך נמל LSM כמו 2.9.
- הפעל את התסריט כולו filterbank גאבור כמו 3.3-3.5. השלמנו עכשיו את הרכישה עבור נקודת נתונים פעם אחת.
6. החלפת אמצעי כדי לחשוף את התאים staurosporine (STS), ושמירה על אורך בינוני הניסוי
- בעוד התאים הם עדיין על הבמה, מבלי להפריע את שדה הראיה, לעבור את המדיום קבוע L-15 עבור אותו המכיל פתרון 1 מיקרומטר של STS עשוי פתרון 4 מ"מ המניות של STS ב DMSO. השתמש בשיטה המתוארת הפתילה 4.6 צעדים כדי לעבור את התקשורת.
- כעת, אנו חוזרים על שלבים 5.2-5.6 נקודות זמן לאחר מכן. אנו חוזרים על תהליך זה עד השלמת הניסוי.
- במהלך הניסוי, בינוני יותר יצטרכו להתווסף כך המדגם לא ליבש. מטרה זו מושגת על ידי pipetting בינוני לתוך חורשת הצלחת התא מבלי להסיר מן הבמה מבלי להפריע FOV.
7. נציג תוצאות
בסיום הניסוי, הנתונים שנאספו יכלול מספר רב של תמונות מסוננים כי צריך להיות מעובד כדי לחלץ את הנתונים המבניים subcellular. שתי דוגמאות מופיעות בבנק מסנן אופטי המורכב 9 גאבור כמו מסננים עם = תקופת S לסנן 0.95μm, סטיית תקן של גאוס המעטפה = S / 2 = 0.45μm, ו אוריינטציות Φ = 0 ° עד Φ = 160 ° ב 20 ° במרווחים. (ראה גם [1] לפרטים נוספים).
דוגמא 1: ימית diatom
אנחנו הראשונים ליישם הבנק אוריינטציה רגיש לסנן שלנו מדגם diatom ימיים (החברה קרוליינה אספקה ביולוגית) עם תכונות מוכוונת נראו בבירור בחושך שדה (DF) הדמיה (איור 1). התמונות מסוננים אופטית מוצגים לצד התמונה מסוננת המדגם להשוואה.
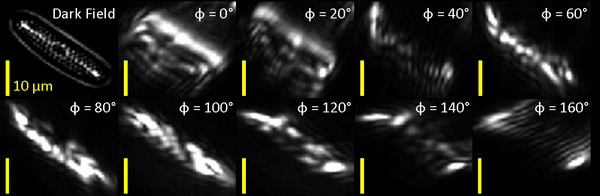
איור 1: שדה כהה (DF) ותמונה מסוננים אופטית של הצורניות ימיים. אנו מנתחים את diatom בפינה הימנית התחתונה של התמונה (חץ לבן בלוח ביותר משמאל).
קבוצה של תשעה גאבור סינון תמונות של diatom עובדו על ידי פיקסל פיקסל עבור אוריינטציה אובייקט עגלגלות. עיבוד כלל (1) סיכום התגובות מדודה של כל תשעת גאבור סינון תמונות על כל פיקסל לקבוע את היקף הכולל של התגובה את האות ובכך קידוד משמעות בתגובה, ו (2) למצוא את הכיוון לסנן גאבור, Φ, שבו התגובה היא מוגדל ולקחת את היחס בין תגובה זו מקסימלי התגובה הממוצע של כל הזוויות ובכך קידוד המידה שבה חפצים כל פיקסל יש כיוון מועדף. מידת האוריינטציה קשורה קשר הדוק יחס הממדים גיאומטרי של החלקיקים. באיור. 2B, התגובת דואר הכוללת של הפיקסל לבנק המסנן (פרמטר 1) ואת מידת האוריינטציה או יחס (פרמטר 2) מקודדים ב רוויית צבע וגוון, בהתאמה. יחס ליד 1 (כחול) נמצא באזורים בהם אין זווית התגובה המועדפת, בעוד ערכים יותר (אדום) מצביעים על תחומים שבהם תגובה זווית המועדפת גבוה הוא ההווה. החלקיקים אוריינטציה מסד מקודד במזימה אשפת (איור 2 ג), שבו כל שורה מקרוב הסכים עם אוריינטציה אובייקט הבסיס המקומי נראה לעין בתחום כהה ללא סינון (איור 2 א).

איור 2:: תמונה השדה האפל של diatom. ב ': אוריינטציה תמונה אובייקט. סולם צבעים מציין מידת האוריינטציה (יחס גובה), בעוד בהירות מקודד המשמעות של התגובה הכוללת מסנן גבור. C: אוריינטציה של עצמים בעוצמה בתגובה ≥ 10% לכל היותר. קטע הקו מציין ציר זמן של המבנה המתאים.
דוגמא 2: תאים אפופטוטיים
כאן אנחנו מראים תמונות מסונן של בתאי האנדותל שור שטופלו staurosporine (STS) שעובדו באותו אופן כמו diatom. איור. 3 מראה לא מסוננת כהה שדה (DF) תמונה של התאים יחד עם תשע תמונות מסוננים בכל זמן T =- 180 דקות. לפני הטיפול STS.
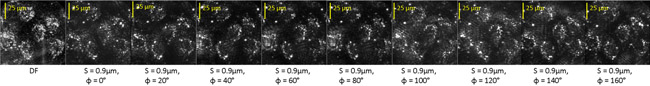
איור 3: שדה כהה (DF) ותמונות מסוננים אופטית של שדה המכיל תאים חיים מספר האנדותל.
התמונות מסוננים נרכשו לאחר מכן כל 20 דקות במשך תקופה של שלוש שעות לאחר הטיפול STS. איור. 4a מראה יחס מפה של התאים כפונקציה של הזמן. במקרה זה גוון הצבע מייצג את מידת האוריינטציה (orientedness שכותרתו) כמו גוון הצבע באיור. 2b לעיל. עם זאת, הבהירות יחס לא משוקלל על פי התגובה הסינון הממוצע. ההרשמה יחס הממדים שלנו מפות עם תמונות פלואורסצנציה של המיטוכונדריה שכותרתו בתאים אלה (איור 4 ב), קבענו כי היחס נמדד ירידה היבט היה מרותק האזורים הסלולרי המכיל מיטוכונדריה והיה במקביל עם פיצול המיטוכונדריה אשר יכול להיבחן ישירות התמונות הקרינה של תאים זהים. איור. 5 מראה מגרשים זמן המתאר את שינוי יחס כפונקציה של הזמן תאים העוברים אפופטוזיס. בתוך כל תא, יש ירידה יחס בבית ט = 60-100 דקות באזורים כי להירשם פלורסנט המיטוכונדריה, אך לא באזורים להירשם האזורים רקע עמום פלואורסצנטי.
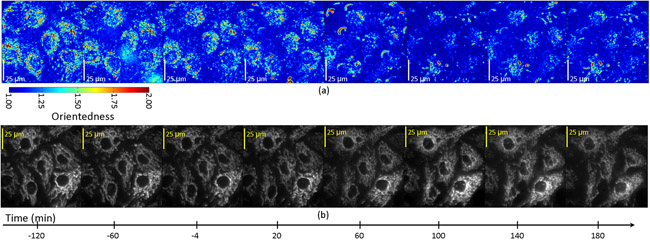
איור 4: יחס הממדים (א) ו פלואורסצנטי (ב) תמונות של בתאי האנדותל שטופלו inducer אפופטוזיס, staurosporine.
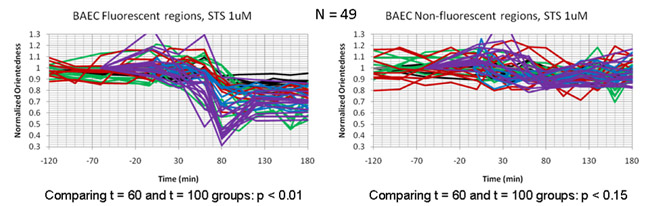
איור 5: מגרשים הזמן משווים את הירידה ביחס היבט החלקיקים (orientedness) בתאי האנדותל שטופלו staurosporine. עקבות אדם מייצגים חלקות הזמן בתוך תאים בודדים. הירידה orientedness מוגבל לאזורים של התאים להירשם (פאנל משמאל) המיטוכונדריה פלורסנט נעדר מאזורים רקע שאר הקרינה (מימין הפאנל).
עכשיו יש לנו נקבע כי ירידה יחס מתאים הפיצול המיטוכונדריה, אנחנו יכולים לגרום אפופטוזיס של התאים האלה, למדוד את הפיצול באמצעות שיטת פיזור אופטי שלנו מבלי התווית תאים, ללמוד את ההשפעה של התנאים גנטיים ניסויים שונים על זה דינמי.
Discussion
השיטה המתוארת לעיל מפות התשואות morphometric של האובייקט שעלול לקודד גודל החלקיקים או נטייה למשל. מידע זה מבניים ניתן להשתמש במספר דרכים:
- זה יכול לשמש כמסך ראשונית כדי לזהות רקמה או תא אזורים משתנים במהלך הטיפול מסוים ולא?...
Disclosures
Acknowledgements
המכשיר מיקרו מראה מחקר זה מומן על ידי מענק קרן ויטאקר RG-02-0682 לנ Boustany. העבודה השוטפת ממומנת על ידי מענק NSF-DBI-0852857 לנ Boustany. Pasternack RM נתמכה בחלקה על ידי מלגה לנשיאות בוגרת ראטגרס. אנחנו רוצים גם להודות לד"ר א לבן עבור התאים iBMK שימוש במחקרים שלנו ד"ר מטקסס ד.נ. לדיון שימושי לגבי אסטרטגיות סינון אופטי.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | Low glucose DMEM | |
| Liebowitz L15 medium | Invitrogen | Without phenol red | |
| L-glutamine | Invitrogen | ||
| Mitotracker Green | Invitrogen | ||
| Bovine Brain Extract | Clonetics | ||
| Fetal Bovine Serum | Gemini Bio Products | ||
| Heparin | Sigma-Aldrich | ||
| Staurosporine | Sigma-Aldrich | ||
| Dymethylsulfoxide | Sigma-Aldrich | ||
| Inverted microscope | Carl Zeiss, Inc. | Axiovert 200M | |
| DMD | Texas Instruments | TI 0.7 XGA DMD 1100 | |
| CCD | Roper Scientific | Cascase 512B | High (16 bit) dynamic range CCD |
| CCD | Roper Scientific | Coolsnap cf |
References
- Pasternack, R. M., Qian, Z., Zheng, J. -. Y., Metaxas, D. N., White, E., Boustany, N. N. Measurement of Subcellular Texture by Optical Gabor-Like Filtering with a Digitial Micromirror Device. Optics Letters. 33 (19), 2209-2211 (2008).
- Pasternack, R. M., Qian, Z., Zheng, J. -. Y., Metaxas, D. N., Boustany, N. N. Highly sensitive size discrimination of submicron objects using optical Fourier filtering based on two-dimensional Gabor filters. Optics Express. 17 (14), 12001-12012 (2009).
- Zheng, J. -. Y., Pasternack, R. M., Boustany, N. N. Optical scatter imaging with a digital micromirror device. Optics Express. 17 (22), 20401-20414 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved