A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Photoconversion של חלבונים מטוהרים פלורסנט ו Dual-בדיקה אופטי סימון בתאים חיים
In This Article
Summary
פרוטוקול זה מתאר גישה כללית לבצע photoconversion של חלבוני ניאון על מיקרוסקופ סורק לייזר confocal. אנו מתארים נהלים photoconversion של דגימות חלבון puried, כמו גם עבור dual-בדיקה אופטי הדגשת בתאים חיים עם mOrange2 ו Dronpa.
Abstract
חלבוני ניאון Photoconvertible (pc-FPS) הם קבוצה של חלבוני ניאון עם יכולת "סימון אופטי", כלומר, את צבע פלואורסצנטי ניתן לשנות על ידי חשיפה לאור באורך גל מסוים. הדגשת אופטית לא פולשנית מאפשרת סימון של subpopulation של מולקולות ניאון, ולכן הוא אידיאלי עבור מעקב אחר תאים בודדים או אברונים.
פרמטרים קריטיים עבור photoconversion יעיל הן בעוצמה את זמן החשיפה של האור photoconversion. אם העוצמה נמוכה מדי, photoconversion יהיה איטי או לא להופיע בכלל. מצד שני, בעוצמה רבה מדי או חשיפה ארוכה מדי יכולה photobleach החלבון ובכך להפחית את היעילות של photoconversion.
פרוטוקול זה מתאר גישה כללית כיצד להגדיר מיקרוסקופ לייזר confocal סריקה עבור PC-FP יישומים photoconversion. ראשית, אנו מתארים תהליך להכנת מטוהרים אגל דגימות חלבון. מתכונת זו מדגם מאוד נוח לחקר התנהגות photophysical של חלבוני ניאון מתחת למיקרוסקופ. שנית, אנו נשתמש מדגם טיפה חלבון כדי להראות כיצד להגדיר את המיקרוסקופ עבור photoconversion. ולבסוף, אנו נראה כיצד לבצע סימון אופטי בתאים חיים, כולל כפול בדיקה אופטי עם הדגשת mOrange2 ו Dronpa.
Protocol
1. הכנת דוגמאות אגל חלבון פלואורסצנטי
מדגם ניאון אגל חלבון מורכב תחליב 1-octanol/water עם חלבון פלואורסצנטי המתגוררים שלב המים. אמולסיה זו היא דחוקה בין שקופיות מיקרוסקופ ו 22 מ"מ מרובע זכוכית לכסות עבור יישומים במיקרוסקופ.
- לפני ביצוע דגימות חלבון פלואורסצנטי טיפה את השקופיות מיקרוסקופ ומשקפיים לכסות צריכים לנקות ומצופה סוכן הידרופובי.
- ניקוי זכוכית על ידי שטיפה 5 דקות עם אצטון ולהשאיר לייבוש באוויר. (לחלופין, לאחר ניקוי כלי זכוכית יכולים להיות מטופלים במשך 30 שניות שואב פלזמה כדי להשיג תוצאות אופטימליות ציפוי).
- הכן פתרון methyltrimethoxysilane 2% אצטון המעיל זכוכית במהלך הדגירה דקות 2 בפתרון זה. לאחר להסיר את ציפוי זכוכית מפתרון ולהשאיר לייבוש באוויר. לאחר מכן לשטוף עם אתנול 70% מבקבוק תרסיס ולהשאיר לייבוש שוב. (לחלופין, בשלב זה, כלי זכוכית ניתן לאפות במשך שעה 1 ב 80 ° C עד קוולנטית הקישור ציפוי זכוכית). כלי זכוכית מצופים יכול להיות מאוחסן במשך חודש אחד לפחות.
- חלבונים פלורסנט הם מטוהרים כמו חלבון 6-tagged שלו מ E. קולי 1. מדוד את ספקטרום הספיגה של החלבון מטוהרים להכין דילול המניה עם צפיפות אופטית של 0.1 ~ ב STE חיץ (150 mM NaCl, 10 mM טריס-HCl pH 8, 1 mM EDTA), המכיל 0.1% אלבומין בסרום שור (BSA) . בנוסף להכין 10 מ"ל של תערובת 01:01 של חיץ 1-octanol ו STE בצינור חרוטי 15 מ"ל וערבבו במרץ. לאחר לעזוב ערבוב עד הפרדת פאזות תושלם. השלב העליון הוא 1-octanol. (זהירות: מכיוון 1-octanol יש ריח חזק חשוב להשתמש מיכל פסולת סגור על כל מה בא במגע עם 1-octanol).
- כדי להפוך את פיפטה אמולסיה 45 μl 1-octanol ו 5 חלבון פלואורסצנטי μl בצינור microfuge. לחץ על צינור כמה פעמים עם האצבע להתחיל היווצרות של אמולסיה, ואז sonicate הצינור למשך 30 שניות באמבטיה sonication. ב בינתיים לקבל שקופיות מיקרוסקופ מצופה זכוכית לכסות מוכן. לאחר sonication אמולסיה צריך להיות מעונן לחלוטין. מיד לאחר אמולסיה sonication 4 פיפטה μl מאמצע הצינור לשקופית מיקרוסקופ מצופה ומכסים כיסוי זכוכית מצופה.
- אם ההליך נעשה בצורה נכונה אמולסיה צריך להתפשט באופן שווה בין שקופיות מיקרוסקופ ואת זכוכית האובייקט. בתוך דקות המדגם צריך להיות יציב, המורכב ~ 10 מיקרומטר טיפות פלורסנט עבה עם קוטר משתנה. הטיפות הגדולות קרובים במרכז המדגם קטן ממוקמים נוסף לעבר הקצוות.
2. הגדרת הניסוי photoconversion
ההליך הבא היא אסטרטגיה כללית להגדרת ניסוי photoconversion חלבון פלואורסצנטי. הליך זה יכול להיות מיושם על חלבונים טהורים, כמו גם עבור תאים חיים.
- הפרמטרים הבאים לספק נקודת התחלה בכלל להגדיר ניסוי photoconversion שלך:
טבילה 40X 1.3NA שמן אובייקטיבי
גודל תמונה = 512 x 512 פיקסלים
סריקה זום = 4
Pixel להתעכב זמן = 6 μsec.
Z-ברזולוציה (גודל חריר) = 3 מיקרומטר - הגדרת שני ערוצי גילוי הקרינה הראשוני photoconverted, כמו גם "ערוץ photoconversion". בדוגמה זו נשתמש מטוהרים mOrange2 חלבון, שהוא חלבון כתום אל אדום ניאון photoconvertible. מינים תפוז מזוהה באמצעות עירור 561 ננומטר לבין הקרינה נאסף בין 570 nm ו 630 nm. מינים אדומים photoconverted מזוהה באמצעות עירור 633 ננומטר לבין הקרינה נאסף בין 640 ננומטר ו -700 ננומטר. עבור "ערוץ photoconversion" עירור לבחור 488 ננומטר ולאסוף הקרינה בין 490 nm ו 540 nm. (הערה:. לערוץ הדמיה photoconversion הוא לא הכרחי)
- השתמש הערוץ עבור דימות פלואורסצנטי ראשוני עם סריקה רציפה כדי להתאים את כוח לייזר ולהשיג גלאי עבור איכות תמונה אופטימלית.
- הפעל את ערוץ photoconversion ובחר כוח לייזר נמוך. התחל הדמיה סדרה זמן לשגות ובהדרגה להגביר את הלייזר photoconversion משמעותי עד להלבנה של הקרינה הראשונית הוא ציין. המשך סריקה עד פלואורסצנציה הראשוני הוא כ -75% מולבן.
- בטל את הערוץ photoconversion ולהפעיל את ערוץ גילוי הקרינה photoconverted. התחל הדמיה עם רווח גלאי גבוהה כוח לייזר נמוך ובהדרגה להגביר את כוח לייזר עד פלואורסצנציה photoconverted מזוהה. ברגע שאתה מזהה את הקרינה photoconverted תוכל להתאים כוח לייזר ולהשיג גלאי עבור איכות תמונה אופטימלית.
- לבסוף, כוח לייזר המשמשיםעבור photoconversion וכן את משך הזמן של photoconversion צריך להיות מותאם. הגדלת כוח לייזר photoconversion יאיץ את קצב photoconversion, כוח לייזר עם זאת יותר מדי יהיה photobleach את החלבון.
- לאחר photoconversion אופטימלי לייזר כוח משך נקבעו, פרמטרים אלה ניתן להשתמש כדי להגדיר photobleaching סטנדרטי או מודול FRAP את "ערוץ photoconversion" הוא כבר לא נדרש.
3. Dual-בדיקה אופטי עם הדגשת mOrange2 ו Dronpa
בגלל אדום העביר תכונות ספקטרליות, mOrange2 ניתן להשתמש בשילוב עם Dronpa חלבון הפלואורסצנט הירוק photoswitchable עבור dual-הדגשת בדיקה אופטי לאפשר הדגשת סלקטיבי של תאים בודדים 4 (אברון) אוכלוסיות.
- התאים גדלים בתחתית צלחות זכוכית MatTek ו transfected 24 שעות לפני הדמיה באמצעות transfection תקן Lipofectamine2000 1.
- הגדרת מיקרוסקופ עבור photoconversion mOrange2 כמתואר בסעיף 2.
- הגדר את מיקרוסקופ עבור photoswitching Dronpa. Dronpa הקרינה ניתן הדמיה באמצעות "ערוץ photoconversion" mOrange2 (ראה שלב 2.2). (הערה: מזער את כוח לייזר המשמש הדמיה Dronpa, כי כוח לייזר רב מדי יגרום איון של Dronpa.) הוסף ערוץ photoactivation Dronpa. אנו משתמשים ב 800 ננומטר שני הפוטונים עירור עבור photoactivation, אבל לחילופין זו יכולה להיות מושגת באמצעות עירור 405 ננומטר. קבע את כוח לייזר נדרש הדמיה, photoactivation ו photoinactivation של Dronpa פלואורסצנטי.
- זהירות: photoconversion של mOrange2 ו איון של Dronpa הן מתרחשות על עירור 488 ננומטר. בגלל הכוח הלייזר גבוהה נדרש photoconversion mOrange2 זה יהיה גם להשבית Dronpa פלואורסצנטי. מצד שני, איון Dronpa מתרחשת כבר כוח לייזר נמוך בהרבה וניתן לבצעו ללא photoconversion mOrange2 משמעותי.
- לאחר הפרמטרים photoconversion mOrange2 ו photoswitching Dronpa מוגדרים, הדגשת בדיקה אופטי כפול מושגת באמצעות הצעדים הבאים. ראשית, להשבית Dronpa הקרינה בתחום שלם של נוף עם כוח נמוך עירור 488 ננומטר. שנית, לבחור אזור עניין mOrange2 photoconvert עם כוח גבוה עירור 488 ננומטר. לבסוף, בחר אזור של אינטרס להפעיל Dronpa פלואורסצנטי.
4. נציג תוצאות
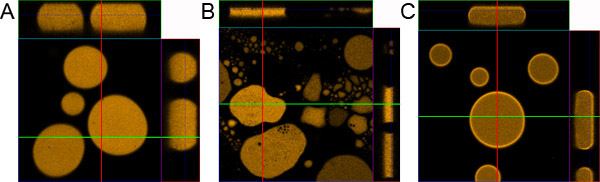
באיור 1. Droplet הכנת המדגם. מדגם) אגל מוכן כראוי. ב) Sample מוכן ללא ציפוי השקופית מיקרוסקופ זכוכית המכסה. ג) מדגם מוכן ללא הוספת BSA 0.1%.
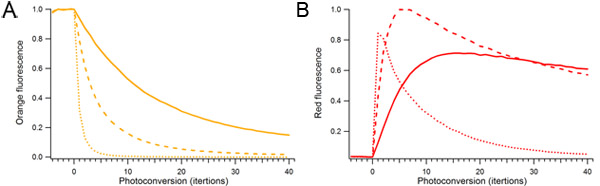
איור 2. השפעת כוח photoconversion לייזר משך על photoconversion mOrange2. טיפות יחיד המכיל חלבון mOrange2 היו photoconverted ברציפות באמצעות כמויות שונות של כוח לייזר 488 ננומטר. כוח לייזר יחסית המשמש photoconversion היה 10% (מוצק), 25% (מקווקו), ו -100% (מנוקד). א) כתום מינים ניאון. ב) מינים Photoconverted ניאון אדום.
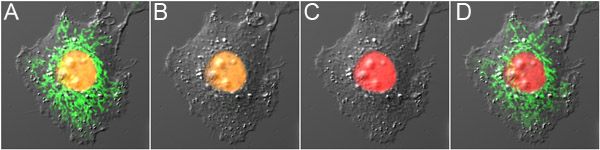
איור 3. Dual-בדיקה אופטי עם הדגשת mOrange2 ו Dronpa. Cell) להביע mOrange2-היסטון H2B ו-Dronpa מיטו לפני photoconversion, מראה הקרינה כתום בגרעין ו פלואורסצנטי ירוק במיטוכונדריה. ב) Dronpa הקרינה היה כבוי עם עירור נמוך 488 כוח ננומטר, גרימת photoconversion מינימלי של mOrange2. ג) היה mOrange2 photoconverted לאדום עם עירור גבוה 488 כוח ננומטר. ד) Dronpa הקרינה דלקה שוב באמצעות 800 ננומטר 2-פוטון עירור. הלוחות הם שכבות של תמונות פלואורסצנציה יחד עם התמונה התערבות ההפרש לעומת זאת.
Discussion
המדגם מטוהרים פלורסנט אגל חלבון הוא פורמט דגימה מאוד נוח אפיון photophysical של חלבוני ניאון, למשל ללמוד photobleaching קינטיקה קינטיקה photoconversion. נפח טיפה קטנה מאוד (~ 20 picoliter) מקלה photobleaching וניסויים photoconversion, אשר יכול להיות קשה לבצע במערכות קובט מבוסס. בנוסף, כפי שמוצג כאן המדגם אגל ?...
Disclosures
Acknowledgements
אנו מודים מייק W. דוידסון (פלורידה סטייט) למתן DNA פלסמיד קידוד חלבוני ניאון. עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות מענק GM72048 (עד בעירייה).
Materials
| Name | Company | Catalog Number | Comments |
| Microsope slides | VWR international | 48312-003 | |
| 22 mm cover glass | Corning | 2940-245 | |
| 1-octanol | Sigma-Aldrich | O4500 | |
| methyltrimethoxysilane | Sigma-Aldrich | M6420 | |
| MatTek dishes | MatTek Corp. | P35G-1.5-14-C | |
| Lipofectamine2000 | Invitrogen | 11668-019 |
References
- Kremers, G. J., Hazelwood, K. L., Murphy, C. S., Davidson, M. W., Piston, D. W. Photoconversion in orange and red fluorescent proteins. Nature Methods. 6, 355-358 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved