Method Article
Visualisation וכימות של אינטראקציות תאיים של Neisseria meningitidis ואת האדם α-actinin על ידי הדמיה confocal
In This Article
Summary
Neisseria meningitidis (ננומטר), שלילי גרם אדם ספציפי פתוגן הנשימה, ניתן לאגד את האדם α-actinin. כאן אנו מציגים פרוטוקול להדמיה של colocalisation של החיידק עם תאיים α-actinin לאחר כניסת חיידקים לתוך כלי הדם לתאי המוח האנושי האנדותל (HBMECs).
Abstract
החלבון OPC של Neisseria meningitidis (ננומטר, meningococcus) הוא משטח הביע קרום חלבון אינטגרלי החיצונית, אשר יכול לשמש adhesin ו invasin יעיל בתאי אפיתל אנדותל אנושיים. זיהינו אנדותל משטח הממוקם integrins כמו קולטנים מרכזי OPC, תהליך המחייב OPC להיקשר הראשון ligands integrin כגון vitronectin ובאמצעות אלה את התא הביע קולטנים 1. תהליך זה מוביל פלישה של חיידקים לתאי אנדותל 2. לאחרונה, צפינו אינטראקציה של OPC עם חלבון 100kDa למצוא lysates תא שלם של תאים אנושיים 3. בתחילה אנו נצפה זו אינטראקציה כאשר התא המארח חלבונים מופרדים על ידי אלקטרופורזה ומחתה על nitrocellulose היו ועליהן OPC-לבטא Nm. האינטראקציה היתה ישירה ולא לערב מולקולות ביניים. על ידי ספקטרומטריית מסה, הקמנו את זהות החלבון כמו α-actinin. כמו פני השטח לא הביע α-actinin נמצא על כל אחד שורות תאים eight שנבדקו, וכן אינטראקציות עם OPC לתאי אנדותל בנוכחות להוביל בסרום הכניסה חיידקים לתאי יעד, בחנו את האפשרות של שני החלבונים אינטראקציה intracellularly. לשם כך, אדם תרבותי כלי הדם במוח בתאי האנדותל (HBMECs) נדבקו OPC-לבטא Nm לפרקי ואת המיקומים של חיידקים הפנימו ו α-actinin נבחנו על ידי מיקרוסקופיה confocal. צפינו תלוי זמן עלייה של colocalisation Nm עם החלבון cytoskeletal, אשר היה ניכר לאחר תקופה לשעה שמונה internalisation חיידקי. בנוסף, שימוש בתוכנות הדמיה כמותי אפשרה לנו להשיג מידה יחסית של colocalisation של Nm עם α-actinin cytoskeletal וחלבונים אחרים. כאן אנו מציגים פרוטוקול להדמיה וכימות colocalisation של החיידק עם חלבונים תאיים לאחר כניסת חיידקים לתוך לתאי אנדותל אנושיים, למרות ההליך הוא גם החלים בתאי אפיתל אנושיים.
Protocol
1. Immunofluorescence פרוטוקול
, מתזמן זיהום & חיסונית מכתים
ההליכים הבאים מחייבים בטיחות מתאים לרמה רקמה תרבות ומתקני מעבדה מיקרוביולוגית.
יום 1
א הכנת תאים היעד עבור זיהום
- HBMECs Seed בנקודת המפגש 50% (~ 1.5x10 4 תאים / ס"מ 2) על coverslips זכוכית (16 מ"מ קוטר) להציב לתוך צלחת של 12 באר (3.8 2 ס"מ צמיחה אזור / טוב).
בינוני צמיחה: RPMI 1640 בתוספת חום מומת 15% (56 ° C, 30 דקות) FBS, גלוטמין 2 מ"מ, 1 נתרן pyruvate מ"מ, 100 U / mL פניצילין / סטרפטומיצין, 1% (v / v) ממ שאינם חיוניים אמינו חומצות פתרון ו -1% ממ פתרון ויטמינים. - תרבות על הלילה (O / N) בשעה 37 ° C, ב-CO 2 של 5% בחממה.
ב חיידקית תרבות
- לגדל את המתח עניין O / N (16-18 שעות) על עירוי נדרש למשל בינוני הלב המוח (BHI) צלחות אגר השלים עם דם 10% סוס מחומם על 37 מעלות צלזיוס באווירה 5% CO 2 4.
יום 2
א הכנה ההשעיה (נ meningitidis) חיידקית
- באמצעות לולאה תרבות 10 μL, לעשות השעיה של התרבות חיידקי לילה 2 מ"ל PBSB (PBS עם סידן ומגנזיום).
- אפשר אגרגטים חיידקי גדול להתיישב על ידי השארת את ההשעיה לעמוד למשך 5 דקות בטמפרטורת החדר (RT).
- מבלי להפריע גלולה, להעביר את ראש 1 מ"ל של ההשעיה (מניות inoculum) לתוך צינור סטרילי.
- כדי להעריך מספרי חיידקים inoculum המניות, להוסיף aliquots (20-50 μL) לצינורות המכיל כמויות 1mL של SDS 1% 0.1M NaOH ומערבבים בעדינות solubilise.
- מדוד את התוכן חומצות גרעין של הפתרון על ידי קביעת ספיגת ב 260nm (A260). בידיים שלנו, A260 של 1 מתאים 5x10 8 במושבה הקמת יחידות / מ"ל (CFU / mL). זה יכול להיות מאומת על ידי הכנת סדרה של דילולים של inoculum המניות PBSB, ציפוי על צלחות אגר והספירה מושבות לאחר דגירה O / N.
- מדולל aliquot של inoculum המניות בטווח הבינוני זיהום [(M199 בתוספת 2% decomplemented (56 ° C, 30 דקות) אדם נורמלי בסרום (NHS)] כדי להשיג את צפיפות חיידקים הדרושים זיהום של תאים היעד.
- במעבדה שלנו, יחס זיהום של 200-300 חיידקים לכל תא היעד משמש באופן שגרתי.
תרבות ב Cell זיהום
- שטפו את coverslips עם תאים בתרבית יעד 3 פעמים עם המדיום של האנק כדי להסיר כל זכר של אנטיביוטיקה.
- להדביק תאים עם השעיות חיידקי מוכן טרי (כמתואר לעיל) עבור שעות 3-8 שעות ב 37 ° C, ב 5% CO 2.
- בסוף תקופת ההדבקה, תאים לשטוף שלוש פעמים עם PBS ולתקן ב μL 500 paraformaldehyde של 2% (PFA) במשך 30-45 דקות על RT או O / N ב 4 ° C.
- קיבעון Paraformaldehyde בריכוז והשעה המוצגת לעיל נמצאה מתאימה לשימור מורפולוגיה חיידקים הסלולר.
- אחרי כביסה את paraformaldehyde, permeabilise paraformaldehyde-קבוע תאים על ידי דוגרים ב 0.1% Triton X-100 בדילול מלא PBS במשך 10 דקות.
- שטפו את דגימות 3 פעמים עם PBS.
- המשך מכתים-חיסונית, או לחלופין, לעזוב דגימות μL 500 של 1% BSA / PBST O / N ב 4 ° C.
יום 3
חיסונית-מכתים
הכתמה של חיידקים תאיים α-actinin יכול להתבצע ברצף או בו זמנית על ידי שימוש של נוגדנים ראשוניים ומשניים המתאים כדלקמן: כל ההליכים יכולים להתבצע גם 12 צלחות.
- חסום את coverslips המכיל את התאים permeabilised עם μL 500 של 3% BSA / PBST (PBS המכיל 0.05% Triton X-100) 30-60 דקות ב RT
- אחרי כביסה עם PBS, העברת כל coverslip לבאר יבשה חדשה צלחת 12 הבאר.
- מוסיפים את נוגדנים נגד חיידקים העיקרי α-actinin; שמונים 100 μL של נוגדנים לכל coverslip די אם הוסיף בזהירות כדי לכסות את פני השטח של coverslip. דגירה עבור 1h בטמפרטורת החדר.
- השתמשנו antiserum ארנב polyclonal נגד Neisseria meningitidis (מעבדה העלתה) ו נוגדן חד שבטי העכבר (מב) נגד α-actinin (Abcam) בו זמנית. בניסויים מסוימים, במקום אנטי α-actinin, מבז נגד אקטין או vimentin שימשו (Sigma).
- בסוף הדגירה, מוסיפים 200 μL של PBS לבאר, להרים את coverslip ומניחים באר חדשה המכילה 500 PBS μL.
- לאחר 5 דקות, להסיר PBS על ידי pipetting ולאחר מכן להוסיף PBS טריים. חזור פעמיים. העברת coverslips לגם יבשה חדש.
- הוסף את הנוגדנים המתאימים משני מצומדות כדי fluorochromes שונים בדילול של 1% BSA / PBST; לדגור על RT עבור 1h בחושך.
- לגילוי חיידקי, השתמשנו נגד ארנב איג מצומדות כדי TRITC ו לאיתור α-actinin אחרים חלבון cytoskeletal, השתמשנו אנטי עכבר איג מצומדות או כדי FITC-(סיגמא) או אלקסה פלואוריד 488 - (Invitrogen).
- בסוף הדגירה, רוחצים כמו שלבים 4 ו -5.
- מונה כתם עם 0.6 מיקרוגרם / מ"ל DAPI ב PBS (DNA כתם) 5 דקות ב RT בחושך.
- לשטוף עם PBS.
- הר coverslips (תאים כלפי מטה) בשקופיות עם ירידה של המדיום הרכבה (ה, ז Mowiol או Vectashield)
- חנות בחושך ב 4 ° C.
- דוגמאות מוכנים להסתכלות תחת המיקרוסקופ.
2. לייזר Confocal סריקה מיקרוסקופית (CLSM)
כדי לצפות ללכוד תמונות של חיידקים תאיים וגורמים cytoskeletal, השתמשנו דגימות immunolabelled ותמונות שנתפסו באמצעות SP5-AOBS לייקה מיקרוסקופ confocal סריקת לייזר המצורפת מיקרוסקופ DM I6000 לייקה epifluorescence הפוכה. כל התמונות נאספו באמצעות 63x NA 1.4 טבילה שמן אובייקטיבי תהליך עם תוכנת לייקה.
CLSM ההליך:
- כדי להתחיל את ההליך CLSM, מוסיפים טיפת שמן טבילה למטרה והמקום שקופיות הדגימה, coverslip בצד למטה, על הבמה מיקרוסקופ.
- הגדר את המיקרוסקופ למצב חזותית למצוא את השטח של עניין באמצעות חתיכות עין המיקרוסקופ.
- באמצעות תוכנות לייקה, לבחור את מצב הרכישה xyz.
- בחר את 512 x 512 פורמט (גודל מסגרת). עבור מחקרים colocalisation, הרזולוציה גבוהה יותר, מדויק יותר את התמונה, תוך התחשבות מגבלת הרזולוציה של המיקרוסקופ. ואז לבחור את מצב כיוונית X, אשר יגדיל את מהירות סריקה לעזור להפחית צילום הלבנה.
- הגדר את הגדרות הסריקה רציפים. לחץ על הפונקציה "seq" ולבחור באחד ממצבי סריקה. אנו משתמשים "בין השורות" מצב.
- אלומות לייזר בחר לפי fluorochromes מצומדות כדי נוגדנים משנית: 405 nm עבור DAPI (כחול), 488 nm עבור Alexa פלואוריד 488 (ירוק) ו 561 nm עבור TRITC (אדום). הפעל Tube מכפיל (PMT) 1, 2, 3, בהתאמה. התאם את הגדרות PMT לזהות את הגל הנכון פליטה.
- הגדרת העליון ("להתחיל") לבין התחתונים ("סוף") של Z-ערימות או סדרה. לאחר מכן, נדרש להגדיר את "Z-צעד גודל".
- Neisseria meningitidis הוא diplococcus (איור 1G) ומאז coccus כל בעל קוטר משוער של 0.5 מיקרומטר, גודל Z-צעד של 0.20 מיקרומטר נבחר כדי לשפר את ההסתברות של סריקת כל coccus לפחות פעמיים. זה גם בתוך גודל הצעד האופטימלי עבור רזולוציה של 0.1-0.2 מיקרומטר.
- הגדר את הפרמטרים הסריקה הסופית על ידי בחירת קו ממוצע של 3 על מנת לשפר את יחס אות לרעש.
- על ידי לחיצה על "התחל" תמונות כפולה או משולשת מוכתם מתקבלים על ידי סריקה סדרתית באורכי גל שונים לחסל צולבות לדבר בין chromophores שונים.
- לקבלת חיווי על מצב colocalisation שני fluorochromes, בחר את "כיסוי" הפונקציה למזג ערוצי נבחר לתוך תמונה אחת, למשל, כאשר הן Alexa 488 (ירוק) ו TRITC (אדום) fluorochromes colocalise, צבע צהוב יופיע בתמונה מעולף .
- Compile Z-ערימות או סדרה באמצעות הפונקציה "מקסימום הקרנת" לבניית תמונה 2D נדרש לדמיין colocalisation אפשרי. ניתוח מפורט יותר של colocalisation ניתן להשיג על ידי ניתוח של כל מקטע אופטי.
- לאחר שרכשה את Z-ערימות או סדרה, לעבד את הנתונים שלך כדי לקבל תמונה אורתוגונליים להדמיה של לוקליזציה תאיים של גורמים שונים (איור 1E).
3. כימות Colocalisation
ניתוחים סטטיסטיים של תמונות confocal מיקרוסקופ הסריקה מתבצעת עם תוכנת Volocity (אימפרוביזציה, PerkinElmer). תוכנה זו מספקת כלי שתוכנן במיוחד עבור ניתוח colocalisation כפי שתואר על ידי מאנדרס et al. (1993) 5. Colocalisation בהקשר של דימות פלואורסצנטי דיגיטלי ניתן לתאר זיהוי של אות ב voxel באותו מקום (נפח פיקסל) בכל ערוץ. שני ערוצי בנויים תמונות של שני fluorochromes שונים שנלקחו באזור מדגם זהה (הוראות שימוש Volocity). ניתוחים סטטיסטיים מבוצעות באמצעות תוכנת Volocity (אימפרוביזציה, PerkinElmer) באמצעות ניתוח כמותי Colocalisation המתוארים להלן.
Colocalisation ניתוח כמותי
- יצירת ספריה עם תמונות CLSM באמצעות תוכנת Volocity.
- בחר "להתמקד המורחבת" מן התמונה בסרגל העליון. כלי זה ירכז Z-ערימות בתמונה 2D להיות מנותח.
- בחר בכלי "Colocalization". שני ערוצי להיות מנותח צריך את עומק הצבע זהה.
- בחר את האזור שזה הולך להיות לכימות. קביעת סף להסיר כל הרקע.
- צור את הפלט colocalisation ידי בחירת "ליצור colocalization". הסטטיסטיקה Colocalisation נוצרות עבור אזורים של עניין שנבחרו קודם לכן.
- בחר מאנדרס "מקדמי R (מקדם חפיפה) ו. (מקדם colocalisation) שלי
- מקדמי 'מאנדרס אינם רגישים לעוצמת מכתים כפי שהם מנורמל נגד עוצמת פיקסל הכוללת, ולכן הם יכולים להיות מועסקים כאשר מכתים של אנטיגן אחד חזק יותר מהשני.
- חפיפה R מקדם פי מאנדרס 5,6 מייצג את התואר האמיתי של colocalisation, כלומר את מספר הפיקסלים כי colocalise לעומת המספר הכולל של פיקסלים.
- מצד שני, מקדם colocalisation, שלי, מתאר את תרומתה של הקרינה מחצית הנפוץ יותר (במקרה זה α-actinin, ירוק) כדי מחצית הנפוץ פחות (ב במקרה זה חיידקים, אדום), כלומר את מספר הפיקסלים אדום כי חפיפה עם פיקסלים ירוק לעומת המספר הכולל של פיקסלים אדומים.
- מקדמי 'מאנדרס בטווח שבין 1 ל 0, 1 זה colocalisation גבוהה, 0 אף להיות, אבל הם יכולים להיות מבוטא כאחוז לפרשנות קל.
- ייצוא נתונים ערכים למסמך Excel לצורך הצגת הנתונים.
4. נציג תוצאות
לוקליזציה תאיים של OPC-לבטא Neisseria meningitidis ו α-actinin
Confocal הדמיה של כלי הדם לתאי המוח האנושי אנדותל נגוע Nm עבור 3 ו - 8 שעות כפי שתואר לעיל colocalisation המצוין של α ו-actinin Nm שנראה פחות תכופים 3 ניסויים h זיהום (לא מוצג) לעומת תרבויות נגוע במשך 8 שעות ( איור 1 AF). Colocalisation להדגמה של α-actinin עם OPC-לבטא meningococci נצפתה בכל פעם> 5 ניסויים לשכפל. ניתוח סטטיסטי של colocalisation באמצעות תמונות confocal כמה בוצע כפי שתואר לעיל. בסך הכל, ב HBMEC נגוע OPC-לבטא meningococci,> חפיפה 25% ירוק (α-actinin) ואדום (ננומטר) פיקסלים הושג (תרשים 2B, חפיפה מקדם R). בניגוד α-actinin, ניסויים שבהם תיוג של חיידקים הפנימו ו או אקטין או vimentin בוצעה, colocalisation מזדמנים נצפתה עם אקטין אבל עם vimentin היה נדיר (Figure. 2B).
הנתונים נותחו גם באמצעות מקדם שלי, אשר לוקח בחשבון את השפע היחסי של כל מחצית. שלי היא למדוד תדירות הופעת האות שופע יותר (בירוק במקרה זה, α-actinin) בכל פעם את האות בשפע פחות (במקרה זה אדום, חיידקים) מתרחשת. צעד זה מראה על רמה מרשימה של המופע של α-actinin באזור meningococci הפנימו (איור 2A ו-C).
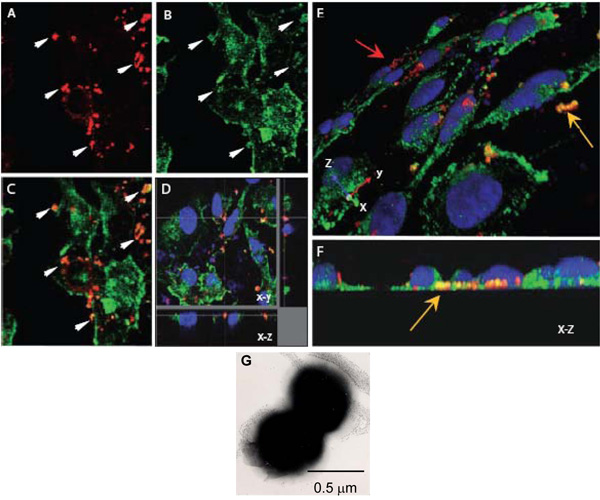
באיור 1. לייזר Confocal מיקרוסקופיית להעריך אינטראקציות תאיים של נ meningitidis עם α-actinin. AH. Monolayers אנדותל ומחוברות גדל על coverslips נדבקו עם OPC-לבטא (AF) נ meningitidis. אחרי 8 שעות, לא חסיד חיידקים היו לשטוף, תאים קבוע עם paraformaldehyde ו permeabilised עם 0.1% Triton X-100. כתוצאה מכך, חיידקים α-actinin היו מוכתמים כמתואר לעיל (α-actinin, ירוק, חיידקים, אדום).
AC. שדה אחד המציג תמונות xy המיקום של Nm (א) או α-actinin (B). התמונה כיסוי ב (ג) מציין מספר אזורים שבהם צהוב כתום צבע מופיע מציע colocalisation. חצים ב (א) ו - (ב) להראות באזורים בהם רמה גבוהה של הצטברות α-actinin נראה התרחשו סביב חיידקים.
ד לנתיחה אופטי של colocalisation HBMEC נגוע monolayer המציין סביב חיידקים תאיים הממוקמת בבסיס של תא.
שוב, זה לא colocalisation בשל הקרבה מקרית של α-actinin, כמו כללי הכתם של α-actinin באזור זה נמוכה.
E ו F. תמונות תלת ממדיות של monolayers HBMEC נגוע מעובד לעיל. מבט אלכסוני של פני השטח apical (ה) מראה חיידקים חסיד מוכתם אדום (החץ אדום), ואילו החיידקים מספר ממוקם לעבר הבסיס של משטחים בתאי האנדותל (חץ צהוב) הם כתום בבירור / צהוב בצבע. מיקום בסל ניתן לראות באופן ברור יותר (F) אשר מקצה על XZ חתך.
ג מיקרוסקופ אלקטרונים תמונה צבעונית שלילי של נ meningitidis המראה שלהdiplococcal השולט מ. Coccus כל כ 0.5 מיקרומטר קוטר.
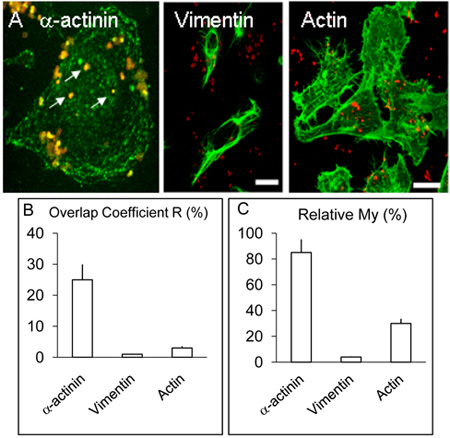
איור 2. Localisation והפצה של α-actinin, אקטין vimentin בתאים HBMEC.
Monolayers א מאשרום של HBMEC טופלו כמתואר במקרא לעיל אך בנוסף α-actinin, כמה coverslips שימשו לצורך זיהוי של אקטין או vimentin על ידי הליך דומה לזה של α-actinin. לעיל, α-actinin מרוכז סביב חיידקים הפנימו מספר (חצים לבנים). Vimentin ו אקטין לא colocalise עם החיידקים לרמות ניכר. בר מייצגת 20 מיקרומטר.
ב & C. הערכים של R ו מקדמי שלי התקבלו יותר משלושה ניסויים באמצעות תוכנות Volocity כמתואר לעיל.
Discussion
האפשרות של קשירת הפנימו OPC-לבטא meningitidis Neisseria ל α-actinin היה בחנו באמצעות HBMEC על ידי בדיקה של colocalisation של חיידקים cytoskeletal החלבון בתאים נגועים לאחר תקופה h 3 ו 8 הדגירה. על ידי מיקרוסקופיה confocal, colocalisation של Neisseria meningitidis עם α-actinin יכול להיות הפגינו. יש לציין, כי חיידקים הופנמו על 3 שעות, היה colocalisation קטנה עם α-actinin בנקודה זו בזמן. העמותה חיידקית עם החלבון cytoskeletal נראה דורשים תקופה ארוכה של מגורים תאיים כמו 8 שעות לאחר תקופה זיהום, מספר משמעותי של חיידקים היו α-actinin כנראה קשר הדוק. Alpha-actinin הוא חלבון רב תכליתיים, ואת האינטראקציות חיידקי עם אלמנט cytoskeletal יכול להיות השפעה משמעותית על תפקוד היעד התא שבו הוא נושא למחקרים הנוכחי.
כימות colocalisation כפי שתואר לעיל מחייב הכנת הדגימה מוקפד. תשומת לב מיוחדת יש לתת קיבעון הדגימה, חסימת דילולים התקופה נוגדן. עבור האות הטוב ביותר יחס רעש, נוגדן כל יסודי ותיכון צריכים להיות טיטרציה בניסויים ראשוניים על מנת לקבוע את ריכוז אופטימלי. מניסיוננו, Mowiol בינוני הרכבה הפיק תמונות טובות יותר.
Disclosures
Acknowledgements
המחקרים מומנו על ידי האמון Wellcome ודלקת קרום המוח בבריטניה. קו HBMEC תא סופק על ידי ד"ר KS קים. Confocal הדמיה במיקרוסקופ אלקטרונים בוצעו מתקן bioimaging וולפסון, מאוניברסיטת בריסטול. אנחנו רוצים גם להודות למר אלן Leard, ד"ר מארק ג'פסון (אוניברסיטת בריסטול), ומר אלן טילי (PerkinElmer) על עזרתם עצה.
Materials
1. לייזר Confocal סריקה מיקרוסקופית (CLSM):
Leica SP5 confocal מערכת הדמיה: מערכת זו, באמצעות שילוב של AOTF (acousto אופטי מסנן tuneable) ו AOBS (acousto אופטי קרן splitter), מפשט עירור עם אורכי גל מסוימים.
2-תוכנה:
לייקה confocal תוכנה LCS, Leica Microsystems, גרמניה.
Volocity 5, אימפרוביזציה, PerkinElmer, ארה"ב.
References
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved