Method Article
למבוגרים עובריים שרירי השלד Microexplant התרבות בידוד בתאי גזע שרירי השלד
In This Article
Summary
מיקרו גזור טכניקה explants היא שיטה חזקה ואמינה לבידוד שגשוג התאים שריר השלד מן, השרירים נוער למבוגרים או עובריים כמקור לתאי גזע שרירי השלד. באופן ייחודי, התאים האלה כבר נגזר clonally לייצר גזע שריר השלד שורות תאים המשמשים in vivo השתלה.
Abstract
בתרבית תאים עובריים ובוגרים שרירי השלד יש מספר שימושים שונים. מיקרו גזור explants הטכניקה המתוארת בפרק זה היא שיטה חזקה ואמינה לבידוד מספר גדול יחסית של שגשוג תאים שרירי השלד מן, השרירים נוער למבוגרים או עובריים כמקור לתאי גזע שרירי השלד. החוקרים השתמשו מיקרו גזור תרבויות explant לנתח את מאפייני הצמיחה של תאים בשריר השלד והשרירים wild-type ו dystrophic. כל אחד מרכיבי גידול רקמות, הישרדות התא כלומר, התפשטות, הזדקנות והבחנה ניתן לנתח בנפרד בשיטות שתוארו כאן. ההשפעה נטו של כל מרכיבי הצמיחה ניתן לקבוע באמצעות מדידת תולדה שיעורי explant. שיטת המיקרו explant ניתן להשתמש כדי להקים תרבויות העיקרי ממגוון רחב של סוגי שרירים בגילים שונים, כפי שמתואר כאן, הותאם על ידי המחברים, כדי לאפשר את בידודה של עוברי מבשרי שרירי השלד.
באופן ייחודי, מיקרו explant תרבויות שימשו כדי להפיק המשובטים (ממוצא תא בודד) שרירי השלד בתאי גזע (SMSC) קווים אשר ניתן להרחיב המשמש in vivo השתלה. SMSC בשנת vivo המושתלים מתנהגים כמו תפקודית, רקמות ספציפיות, תאים לווין אשר תורמים התחדשות סיבי שריר השלד, אך הם גם שמרו (בנישה התא לווין), כמו בריכה קטנה בתאי גזע שלא עברו התמיינות אשר ניתן מחדש מבודדים לתוך התרבות בשיטת מיקרו explant.
Protocol
שתי הגישות יכול להיות מועסק על מנת לבודד שגשוג התאים שריר השלד. ברקמות השריר הראשונים הם מתעכלים enzymatically לבודד תאים בודדים לפני ציפוי החוצה 1. השיטה השנייה היא explant פיסות של רקמת השריר לתוך התרבות כדי לאפשר לתאים לגדול החוצה במהלך הדגירה 2, 3. השיטה השנייה מתואר בפרוטוקול זה. תרבות רקמות עצמה יש שורשים בתרבות explant. שנת 2007 היתה שנה 100 הניסויים הקלאסיים של האריסון שבה הוא מתקבל על ידי בצמחים נוירון דוגרים explants העצב תלויה טיפות הלימפה 4. תרבות טכניקות Explant שימשו ומעודן במגוון בהקשרים שונים של 100 השנים הבאות כאמצעי ליצירת תרבויות העיקרי שגשוג של תאים עובריים מבוגרים 4, 5. העיקרון מאחורי הטכניקה explant, לעומת זאת, נשאר זהה, כדי למזער את הטראומה של בידוד תא ראשוני על ידי שמירה על מבנה תלת ממדי של רקמה ההורה בשלבים הראשונים מכרעת תולדה של התא, תוך מתן התאים התבגרות עם מדיה עשירה התזונתי שבה להתרבות. בשרירי השלד יש יתרון נוסף לשימוש תרבות explant כי פעולת חיתוך את רקמת השריר מחקה סיבי השריר טראומה, על ההדק הרגיל להפעלת תא הגירה הלוויין, התפשטות 3, 6. למבוגרים שריר השלד לווין התאים (המכונה גם myoblasts) הם גזע שגשוג התא האוכלוסייה אחראי לתקן שריר סיבים צמיחה 7.
Explants שרירי השלד ובכך לחקות את הסביבה vivo של השריר וממריץ את התחדשות תא גזע הגירה חלוקה. בעובר, רוב שרירי השלד חוליות (שרירים תא המטען איבר) נובע somites, למרות somitomeres וקשתות branchial להצמיח השרירים של ראש 8, 9. Myotome ניתן לזהות שתי קבוצות נפרדות של Myf-5 לבטא בתאי גזע הממוקם בשולי הגבי, המדיאלי ו לרוחב של somite הבחנה, בהתאמה. בהתאמה, תאים אלו מייצרים את השרירים epaxial הגב, אשר להבדיל באתרו, ואת השרירים hypaxial הגחון ו לרוחב (הגפיים, הבטן ושרירי הנשימה) אשר דורשים ההגירה של גזע לתאי שריר מן somite 10. שריר גזע עובריים נדידת תאים הוא תחת שליטה של פאקס 3 11. Myf-5 ביטוי הכרחי להקמת השרירים עובריים חשיבות נמשכת לשרירים לאחר הלידה שבו מעל 98% של תאים לווין מופעל להביע Myf-5 12. Myf-5 ולכן הוא סמן אמין ספציפית של גזע מתרבים השלד האוכלוסייה תא השריר ברקמות הן למבוגרים עובריים. גזע עובריים לתאי השריר (המכונה גם תא שריר אבות, מבשרי שרירי השלד, myoblasts או תאים עובריים לוויין אפילו) יכול להיות מבודד somites בשלב מוקדם של העוברים, עכבר חומוס צפרדע 13. על מנת לבודד תרבויות myogenic מן שרירי השלד עובריים של עוברים יותר מחברי יש להתאים את הטכניקה explant microdissected עבור רקמות עובריים. גישה דומה משמש Cossu et al. 14 כדי לייצר אוכלוסיות תאים משובט מן somite עובריים 14.
1. התרבות תאים במבחנה של בתאי גזע שרירי השלד (SMSC)
SMSC הם שורות תאים ממוצא תא בודד אשר כבר נגזר מן clonally העיקרי בתרבויות explant שרירי השלד. הם יכולים להיות מתורבת באמצעות מתודולוגיה סטנדרטית בתרבית רקמה אם אכפת מספיק נלקח. שים לב, אלא אם צוין אחרת, כל המניפולציות תיאר מתבצעות בתנאים aseptic באמצעות זרימה למינרית ברדס (Class 1 Class 2 או ארון סטרילי) וכל ריאגנטים תרבות הם חיממו על 37 מעלות צלזיוס באמבט מים לפני השימוש.
- כדי להביא SMSC של אחסון חנקן נוזלי (ראה סעיף 1.2 להקפאה את השיטה) cryovials צריך להיות מופשר במהירות התכנים מועברים לתוך 5 מ"ל prewarmed (37 ° C) DF10 בינוני תרבות צנטריפוגה מיידית (1,000 גרם דקות 3) כדי להסיר DMSO . השיטה הטובה ביותר להפשיר תאים באמצעות pipetting חוזר של כמויות קטנות של המדיום מראש חימם תרבות לתוך הבקבוקון לפני העברת הצינור צנטריפוגות. תהליך ההפשרה של תאים צריך להתבצע במהירות רבה מאז cryopreserved התאים מכילים 10% DMSO אשר רעיל לתאים בטמפרטורת החדר (LD50 כ 2 דקות).
- צנטריפוגה בעקבות supernatant היא להסיר את התאים נשטפים על ידי מחדש השעיית תא גלולה נוספת של 5 מ"ל DF10, אז צנטריפוגות כמו קודם.
- התא גלולה הוא מעורב אז בפעם השנייה עם 5 מ"ל של DF10 ואת השעיית התא וכתוצאה מכך הוא הועבר קטן יש 25 2 ס"מ תרבות פלסטיקssel.
- תרבויות מתוחזקים על 37 מעלות צלזיוס חממה humidified המכיל 5% CO 2 באוויר. אלא אם כן משמשים כלי עם מכסה מסונן, כובע של הבקבוק חייב להיות משוחרר מעט במשך כמה שעות על מנת לאפשר לאוויר מכלי תרבות לאזן עם החממה להפוך לחומצה המדיום לתרבות. ה-pH של המדיום הוא פיקוח באמצעות שילוב ה-pH אינדיקטור פנול אדום צבע לתוך המדיום לתרבות.
- תאים מופשרים חייב תמיד להיות במעקב 24 שעות לאחר ציפוי מחדש נמאס עם המדיום DF10 טרי כדי להבטיח סילוק פסולת ורעלים תא שיורי (ראו הערות 1 ו -2).
1.1. תת
עבור קווי SMSC הוקמה, כאשר תאים להגיע לכ 95% המפגש, הם צריכים להסיר כלי תרבותם, בדילול והניח לכלי טרי כדי לאפשר צמיחה נוספת. הליך זה תת יכולה להיות מושגת באמצעות מספר נהלים אנזימטיות שונות, טריפסין / EDTA להיות הנפוצות ביותר בשימוש (ראה הערה 3). זהו הנוהג המקובל (וטוב) לגדל תאים בצפיפויות המחייבים אותם להיות subcultured ביום השלישי של צמיחה. עבור מרבית קווי SMS תא זו יכולה להיות מושגת על ידי תאים פיצול 1 / 10 בשעה תת כל אחד. זה מאפשר מעקב צמוד של תאים אלה מאפשר ביצוע תרבית הרקמה מיד לזהות התנהגות צמיחה יוצא דופן (למשל צמיחה מהירה יותר) אשר יכול להצביע על שינויים פנוטיפי לקו תאים כגון שינוי או צמצום אפופטוזיס נגרמת על ידי הסתגלות לתנאים תרבות. בנוסף, שגרה subculturing עקבית וזהירה בהרבה מפחית את השכיחות של אירועים כאלה.
- עבור תת באמצעות טריפסין (trypsinisation) כלי יוסרו מן האינקובטור ובינוניים שלהם זרוקים על ידי שאיפה.
- תאים נשטפים לאחר מכן פעמיים עם סטרילי סידן ומגנזיום ללא פוספט בופר סליין (PBS), 10 מ"ל לכל לשטוף, להסיר כל פעם על ידי שאיפה.
- כדי לנתק את monolayer תאים (25 הבקבוקון 2 מ"מ) 1 מ"ל 1 טריפסין / EDTA הוא הוסיף והשאיר על תאים בטמפרטורת החדר למשך 3 דקות עד 2 התאים מתחילים לנתק (ראה הערה 4). ניתן לראות זאת על ידי המשתמש מנוסים כמו חורים קטנים להרכיב בשכבה אטומה מעט כאשר הבקבוק מוחזק לאור (ראה הערה 5). בעוד התאים צריכים להיות trypsinised זמן מספיק כדי להבטיח ההשעיה תא בודד, יש להיזהר שלא לחשוף יותר מדי כדי SMSC trypsinisation מאז זה יביא לרמות גבוהות של מוות תאים מצורף עניים כאשר התאים מחדש מצופה.
- כדי לעצור את התגובה טריפסין, סרום המכיל בינוני (DF10) הוא הוסיף לפחות נפח 2 (כלומר פעמיים הנפח של הפתרון טריפסין). כאשר subculturing 25 מ"מ 2 בקבוק נוח להוסיף 9 מ"ל DF10 בשלב זה. מפוצל 1 / 10 של תאים יכול להתבצע בקלות על ידי דילול 1 מ"ל של השעיה התא שנוצר לתוך בקבוקון חדש 25 2 מ"מ תרבות יחד עם עוד 9 מ"ל של מדיום DF10 טריים. התאים הנותרים ניתן להשתמש לצורך הרחבת התא (להעביר לכלי גדול יותר), cryopreserved (ראה סעיף 1.2) או נספרו מצופה במנות הניסוי, בארות או צלחות עבור מבחני שגשוג והישרדות, בידול, הטיפול גורם גדילה או למטרות אחרות (ראה להלן).
1.2. Cryopreservation של שורות תאים ותרבויות ראשי
- עבור תאים cryopreservation הם מנותקים מן monolayer שלהם תת (סעיף 3.1.1) ו pelleted ידי צנטריפוגה (3 דקות ב 1000 גרם).
- Supernatant היא השאיפה להסיר תאים הם בזהירות ובמהירות מחדש המרחפים 10 מ"ל של להקפיא את תמהיל (DMSO 10% DF10) לפני שהם מחדש pelleted על ידי צנטריפוגה.
- הפעם היא גלולה מחדש תלויה להקפיא מספיק כדי לאפשר את תערובת 0.5 מ"ל של השעיה לכל תא cryovial (ראה לוח 1) והניח מיד 80 ° C במשך הלילה.
- Cryovials מועברים חנקן נוזלי למחרת לצורך אחסון לטווח ארוך (ראה באור 6). כמו הפשרה של התאים, תהליך זה של cryopreservation חייב להתבצע במהירות. בעוד DMSO הוא מגן על קרומי התאים במהלך הקפאת הוא רעיל מאוד התאים בבית ללא הקפאה בטמפרטורות.
1.3. קביעת מספרי סלולרי
- כדי לקבוע את הריכוז של השעיה תא תא בודד (תת הבאים) haemocytometer Neubauer ניתן להשתמש. כדי להבטיח את הדיוק של הספירה coverslip חייב להיות מותקן בצורה מאובטחת על בסיס haemocytometer (ראה הערה 7).
- טיפה קטנה של השעיה התא ממוקם אז קרוב לקצה של coverslip יהיה תפוס על ידי פעולה נימי.
- תאים נספרים מכן באמצעות מיקרוסקופ עם תאורה הפוכה שלב ניגודיות. כדי להגביר את הדיוק של ריכוז התא הסופי, גאמות בחדר ספירת אין חפיפה, אם הם עושים את ההשעיה התא המקורי צריך להיות מדולל והתאים מחדש לספור. Clumping יש להימנע על ידי ניתוק יסודית של תאים במהלך trypsinisation ו 100-200 התאים על פני שטח פני השטח ידוע צריך להיות נספר לקבל אומדן מדויק של מספר התא. שיטה נוחה באמצעות haemocytometer Neubauer היא לספור תאים 2 או יותר 16 זוגות מרובע. צפיפות התאים למיליליטר מתקבל אז על ידי חלוקת סך במספר סטים ספרתי (למשל 2) ו - 10 על ידי הכפלת 4. לדוגמה, 100 תאים לספור על 2 x 16 סטים מרובע = 100 / 2 = 5 x 10 5 תאים / מ"ל.
2. הקמת השלד העיקרי Microexplant תרבויות שרירים
תרבות ראשיים מיקרו explant ניתן להשתמש כדי לבודד SMSC מ כל שריר השלד נגיש כולל השרירים בודדים של פני השטח ואת הגפיים האחוריות, הסרעפת, הגב ואת שרירי הבטן. השיטה להפקת תרבויות microexplant מהשרירים נוער ומבוגרים מתואר בפירוט על ידי סמית שופילד 3 ויש לו לאחר מכן נעשה שימוש נרחב כדי להפיק תאים SMS מ, השרירים נוער בוגרים בגילאי עכבר. השיטה יכולה לשמש גם כדי להפיק תאים בתרבית שרירי השלד מהדגים 24 שרירי השלד האנושי (ראו וסמית, לא פורסם). תולדה של SMSC מ microexplant שריר עכבר מתוארת באיור 1 א, ב. השיטה שונתה עבור בידוד של מבשר עובריים לתאי שריר (ראה סעיף 3). השיטה הבסיסית היא כדלקמן:
- דיסקציה אספטי של שריר היעד (ים) עכבר ונבחרים טרי מושגת באמצעות כלי סטרילי, שטח עבודה נקי להשתמש ליברלית של תרסיס אתנול 70%.
- שרירי מבודד נשטפים באמצעות שני שינויים של המדיום DF20 והם מכניסים בינוני DF20 טרי בצלחת 2 60 מ"מ. בעזרת מיקרוסקופ שרירי סטריאו לנתיחה הם microdissected בקפידה בתנאים סטריליים להוציא רקמת שומן, חיבור ועצמות.
- פיסות שריר ניקה נחתכים מכן לתוך 400 3 קוביות מיקרומטר אשר, בעזרת מלקחיים של צורף, ממוקמים בנפרד למרכז 60 בארות צלחת 96-היטב המכיל 50 μL DF20 (ראה הערה 8). וולס נבדקים תחת מיקרוסקופ והניח בחממה. בארות החיצוני מלוחים מלאים כדי למנוע התייבשות בארות המכיל explants (3).
- מצורף Microexplant ו תולדה הוא הבקיע לאחר הדגירה 24-48 שעות ואילך ב 48-72 במרווחים שעות (תלוי בקצב הצמיחה של השרירים להיות מתורבת).
- להרחבת ובידוד של תאים SMS, תרבויות תוצאה יש לעקוב באופן פרטני עבור תאים עם מורפולוגיה SMSC בעיקר, כלומר תאים mononucleate כדורית עם refractivity גבוהה אשר גדלים באשכולות צבירה (ראה איור 3.1b).
- לאחר תוצאה explant מוקמת בארות בודדים ניזונים (ראה הערה 9) על ידי תוספת של 50 בהפרשים μL של המדיום כאשר המדיום acidifies בשל צפיפות התאים גדלה. גם כאשר הוא מלא התא תרבות ומחוברות כמעט, בארות מוזנים על ידי החלפה של 50% של המדיום בכל פעם, כדי להבטיח את התחזוקה של גורמים "מיזוג" מופרש על ידי תאים (ראו הערות על מדיום מותנה תחת שיבוט, סעיף 2.1). כדי לדכא את הבידול, ב 60-70% בצמחים מפגש ראשוני explant מוחלפות לתוך בינוני סידן מדולדל ידי החלפת DF20 בינונית סידן מדולדל DMEM/F12 (תוספי כל נשארים זהים) להזנת התאים 3.
- Explant בינוני מותנה ניתן להכין מתרבויות בשלב זה ומאוחסנים לשימוש במהלך התרחבות שיבוט של SMSC הראשי (עבור שיטת השיבוט, ראה סעיף 2.1, איור 1 ג ו). תרבויות הם subcultured בשיטת dispase (ראה סעיף 3.5).
- SMSC נגזר Clonally ניתן לנתח in vivo על ידי זריקה תוך שרירית (איור 3.1 GK) 19.
- Karyotyping יכול להתבצע על הקווים SMSC נגזר clonally לאשר מצב דיפלואידי (ראה סעיף 2.2, 3.1 l איור) 25.
- שיטה זו יכולה להיות מותאם עבור שריר culturing עובריים (סעיף 3).
2.1. משובט גזירת
ראשי myoblast explant תרבויות (איור 1 א, ב) הם כלי יעיל ומדויק להקמת מגוון רחב של פרמטרים צמיחה שונים שרירי השלד wild-type ו מוטציה. הגזירה המשובטים, הבידוד של קו תאים מתא בודד, היא צעד חיוני בבידוד של בתאי גזע שרירי השלד והוא יכול לשמש גם כדי קווי subclone SMSC transfected עם בונה RNAi או transgenes. הוקמה תרבויות explant SMSC ו העיקריים הם מאוד תלויים בצפיפות ויהיה "cras h "(להתנתק המנה ולמות), אם מצופה החוצה צפיפות התאים נמוך מדי. הסיבה לכך היא כי גורמים SMSC לשחרר מסיסים אשר נדרשים לשמור על צמיחה הישרדות התא. כדי לדמות תרבות בצפיפות גבוהה ואספקת גורמים אלה במהלך תהליך השיבוט, SMSC הם משובטים במדיום עצמית מותנית. התוספת של מדיום מותנה נמצאה חיונית כדי לאפשר לתאים בודדים להתרבות בסביבה מבודדת.
- בינוני אילף מוכן מן SMSC מתרבים תרבותי עבור 48 שעות בין 33 ו - 75% מפגש.
- התקשורת שבו תאים אלה גדלים יוסר לאחר 48 שעות ו מסונן באמצעות מסנן מזרק 0.2 מיקרומטר; זה מבטיח סטריליות של המדיום מותנה ומסיר את כל שיירי תאים ופסולת.
- בינוני זה מותנה מעורבב ביחס של 1:1 עם המדיום תרבות טרי (בינוני השיבוט, ראה הערה 10), משמש לתקשורת תרבות שיבוט תא בודד.
- כדי להשיג אחד דילולים תאים סלולריים הם ניתק את ההשעיה תא בודד על ידי trypsinisation זהיר (הוקמה SMSC) או טיפול dispase (תרבויות explant העיקרי) ו מדולל לריכוז של תא אחד לכל 100 בינוני שיבוט μL.
- 50 μL של ההשעיה זה תא אז יכול להיות מצופה לתוך כל אחד 60 בארות במרכז צלחת 96-היטב.
- תאים מותר לצרף ידי הדגירה על 37 מעלות צלזיוס ב 5% CO 2 ל 6 שעות כל אחד גם הוא הבקיע אז בזהירות נוכחות של תאים. וולס המכיל 0 או יותר מתא אחד מנוכים בשלב זה.
- וולס המכיל תא אחד מצורף יחיד ציין בזהירות את המושבה נגזר תא יחיד זה הוא במעקב צמוד (יומיומי במהלך הימים הראשונים) על מנת להבטיח כי רק אחד מושבת, שמקורם בתא יחיד, הוא ההווה. שורות תאים נגזרו רק מבארות תא המכיל 1. איור 1c-e מדגים את הרחבת המושבה כזה תא בודד נגזר.
- ברגע המושבה מגיע מפגש בצלחת 96-טוב זה יכול להיות subcultured לתוך אחד טוב של צלחת 48-באר.
- שורות תאים משובטים לאחר מכן ניתן להרחיב בזהירות לתוך 24 - ו 6 צלחות היטב עד מספיק תאים זמינים צלחת לתוך בקבוקון 25 ס"מ 2.
- המקור בשרירי השלד של תרבויות אלה ניתן להדגים על ידי ביטוי של Myf-5 (איור 1f) או שרירי השלד הסמנים הספציפיים כגון MyoD ו פאקס 7.
- בשלב זה קווי מוקפאות למטה לפני להתרחבות נוספת (ראה לוח 1).
2.2. Karyotyping
Karyotyping היא שיטה חשובה של פנוטיפ התא ניטור. שורות תאים שהופקו על ידי גזירת המשובטים יש karyotyped כדי לוודא שהם שמרו השלמה כרומוזום דיפלואידי ללא rearrangements כרומוזומליות ברוטו שעלולות להשפיע על הפנוטיפ שלהם.
- עבור תאים karyotyping גדלים לשלב מאוחר מעריכי (80 ומחוברות%) ב -25 כלי 2 ס"מ תרבות (2 ימים לאחר subculturing) על מנת למקסם את חלקם של התאים mitotic בתרבות.
- עשרים וארבע שעות לפני karyotyping תאים ניזונים עם 10 בינוני תרבות טרי מ"ל. 0.2 מ"ל של קולכיצין מ"ג / מ"ל 10 (ראה הערה 11) הוא הוסיף אז אל התאים אשר מודגרת עבור שעות נוספות 1 ב 37 ° C.
- לאחר 1 שעה, התאים כפופים הליך תת תקן trypsinisation אלא שגם בינוני תרבות שוטף PBS נשמרות כדי למקסם את מספר התאים mitotic שנקטפו.
- התאים ניתק, שמרו בינוני שוטף PBS הם הסתחררו ב g 1000 דקות 3 עד גלולה התאים ואת supernatant הוסרו ומושלכים לתוך אקונומיקה.
- התא הוא גלולה מחדש תלויה 5 מ"ל של אשלגן כלוריד M 0.0075 4 דקות בדיוק, לפני תאים שוב pelleted על ידי צנטריפוגה.
- רוב supernatant הוא aspirated, להשאיר כמות קטנה (~ 50-100 μL) בצינור להשעיה מחדש. Resuspend תאים על ידי מצליף הבסיס של הצינור בז עד slurry תא מושגת. התאים ממוקמים אז על קרח קבוע מקבע קר כקרח טריים (מתנול: חומצה אצטית קרחונית ביחס 3:01) כדלקמן: 10 מ"ל של מקבע מתווסף לאט dropwise אל התאים באמצעות זכוכית קטן פיפטה פסטר ( זה מונע clumping התא).
- התאים ממוקמים על קרח למשך 30 דקות ולאחר מכן pelleted ידי צנטריפוגה שלאחריו תא גלולה מחדש תלויה מקבע 0.5 טרי מ"ל.
- שקופיות מיוצרים על ידי הטלת ההשעיה תא קבוע על גבי שקופיות שהוכנו (ראה סעיף 3.2.2.1) שנערך בזווית של 45 מעלות. כדי להבטיח היטב במרווחים metaphase פורשת את פיפטה צריך לקיים לפחות 30 ס"מ מעל השקופית.
- כדי להמחיש את הכרומוזומים, מגלשות מוכתמות דקות ב 2 של כתמים Leishman, בדילול מלא עם שלושת הכרכים של pH 6.8 חיץ Gurr קצר לפני השימוש.
- שקופיות ייבוש בטמפרטורת החדר רכוב בינוני DePex גובר.
ילדה = "jove_step"> 2.2.1. הכנת שקופיות עבור Karyotyping
- שקופיות הזכוכית (שקופיות מיקרוסקופ Premium, VWR הבינלאומי, בריטניה) מוכנים לשימוש בפרוטוקול karyotyping ידי הצבתם לילה בכלי (זכוכית) גדולות של חומצה גופרתית.
- שקופיות ממוקמות מכן, תחת ברז מים זורמים במשך 8 שעות ו מאוחסנים אז באתנול 70% עד הנדרשים.
- לפני השימוש, מגלשות יש לשטוף תחת ברז מים זורמים במשך 30 דקות נוספות אוויר יבש בטמפרטורת החדר למשך 1-2 ח
3. הקמת ראשיים Micro-explant תרבויות מעוברים
שלושה זנים עכבר שימשו כדי לאמת את השיטה הזאת, wild-type (C57BL/10) יחד עם MDX ו CAV3KO (הן מוטציות dystrophic). עכבר הדיסטרופין-MDX לקוי מקורו באופן ספונטני C57BL/10, קו זה התקבל במעבדה Bullfield בשנת 1991 ומאז שמרו הרף במושבה מולדת שלנו 26. עכברים CAV3KO dystrophic, אשר מכילים מוטציה בגן caveolin-3, היו bred על רקע C57BL/10 במשך 10 דורות לפני בשימוש במחקר זה 27. כל שורה עכבר שנוצר לשחזור וחסונה, תולדה שגשוג והישרדות פרופיל שהיה עובריים בשלב מסוים שונה עבור כל זן. פרוטוקולים הבאות הותאמו עבור עוברים מן סמית שופילד PN (1994) 3, למעשה כמו מריק 21.
3.1. העובר אוסף
- כדי להשיג מבוים עוברים, זוגות מוגדרים כמו (1:1) הזדווגויות טבעי ונקבות בדק כל בוקר עבור תקעים הנרתיק. ביום גילוי תקע, עוברים נחשבים E0.5 ימים (12 שעות לאחר ההפריה).
- לאחר תקעים הנרתיק זוהו הזכרים יוסרו מן הכלוב כדי להבטיח דיוק של ההיערכות עובריים.
- כאשר בשלב העוברי הרצוי הוא הגיע (E11.5 כדי E17.5) האמהות נהרגים על ידי נקע בצוואר, בבטן הוא מגולח, עור והסביבה הם swabbed עם אלכוהול 70% ו הרחם מוסר דרך חתך בבטן אופקי המתבצעות באמצעות מכשירים מנתחים סטרילית.
- הרחם הוא שטף אז פעם אחת לפני שיוצבו לתוך צלחת קטנה ובה PECM טרי לפני לנתיחה במדיום תרבות העיקרית explant (PECM).
- E11.5 כדי E17.5 עוברים הם גזור מן הרחם באמצעות מיקרוסקופ לנתח והניח בנפרד לתוך צלחות פטרי המכילות PECM לקראת microdissection מפורט.
3.2. העובר Microdissection
- עוברים בודדים גזור נוספת לבודד אזורים עשירים בשרירי השלד (ראה איור 2 א). הינד ו forelimbs (שרירי השלד hypaxial) הם גזור החוצה, כמו גם העליונה הקיר גוף תחתון (שרירי השלד epaxial בעיקר). כדי לעשות זאת חתך לאורכו של החזה, הבטן והאגן נוצר כדי לאפשר את האיברים הפנימיים של העובר כדי להסירו.
- כדי להעשיר את השלד עובריים לתאי גזע שריר (eSMSc), הראש, חוט השדרה ואת כל האיברים הפנימיים יוסרו אז.
- בשנת עוברים מבוגרים יותר (E15.5-E17.5 עוברי) אפשר גם להסיר את העור סחוס / עצם שוב כדי להגדיל את חלקם של התאים שריר התרבויות.
3.3. הגדרת Microexplant תרבויות עובריים
- לאחר forelimbs, hindlimbs והעליון וקירות הגוף התחתון היה גזור החוצה הם מכניסים PECM טריים microdissected נוספת לייצר קוביות קטנות של רקמה בגודל זהה (~ 0.5 מ"מ 3; איור 2a).
- Microexplants אלה לשים ואז תוך 60 בארות במרכז צלחת 96-היטב (אחד לכל explant היטב) המכיל PECM 50μL לכל טוב. מינימום של 60 בארות המכיל 1 explant לכל מבוססים היטב, לכל העובר למד.
- עבור עוברי culturing 60 בארות מרכז נחלקים האזורים המציין היכן explant נגזר (איור 2b). עיצוב זה מאפשר 15 בארות שכל אחת מהן מכילה, בהתאמה, forelimb, קיר הגוף העליון, התחתון hindlimb קיר הגוף explants 21.
3.4. ניטור תולדה
שיעור תולדה הוא מדד אמין קצב הצמיחה של העובר explants שרירי השלד בתנאים מבוקרים היטב שתוארו כאן לשחזור מאוד.
- Explants מודגרת ב 37 ° C ו 5% CO 2 למשך 3 שבועות, הבקיע ביום 3, 7, 14 ו 21 של culturing באמצעות מיקרוסקופ הפוכה. Explants הם הבקיע בהתאם לרמת של מפגש של תאים בנפרד היטב (איור 3 א, ה).
- צילום תמונות של תרבויות אפשר לקחת, למשל, באמצעות מצלמה SLR מחובר מיקרוסקופ ו 100 ASA פוג'י (צבע) או Kodak Tmax (שחור לבן) סרט מקצועי (איור 3f).
- השלדשרירים ספציפית נוגדנים ספציפיים עבור Myf-5 ניתן להשתמש כדי להדגים את המקור בשרירי השלד של eSMSc, בהתאם למתח 80 95% של תאים בודדים באמצעות שיטה זו הם Myf-5 חיובית. סמנים אחרים כגון MyoD ו 7 Pax יכול לשמש גם כדי להדגים את המקור בשרירי השלד של אוכלוסיות תאים אלה. בעוד תאים אלו מכילים שיעור גבוה מאוד של גזע עובריים לתאי שריר השלד לא ניתן להניח (במיוחד עבור צעירים עוברים) כי הם כולם ממוצא שרירי השלד או שהם כולם בתאי גזע. כדי לבודד אוכלוסיות תא גזע טהור יש צורך להפיק clonally תרבויות explant העיקרי כמתואר בסעיף 2.1.
3.5. ראשי Subculturing Explants עובריים
ומחוברות פעם, בתרבויות explant הצגת תכונות מורפולוגיות של SMSC (איור 3f) ניתן subcultured כמו 3 כדלקמן, 21:
- בינוני תרבות יוסר בארות נבחר, מסונן באמצעות 0.2 מיקרומטר Acrodisc R_ מזרק לסנן שמר לשימוש כאמצעי מותנה. המדיום יכול להיות מאוחסן על 4 מעלות צלזיוס במשך שבוע 1.
- 100 μL של 1:10 dispase מדולל PECM מתווסף כל טוב וצלחות מכן חזר 37 ° C חממה עבור 20 דקות.
- טיפ פיפטה מכן נעשה שימוש כדי לגרד בעדינות את התאים התיר מפני השטח של הבאר.
- המתלים התא centrifuged אז g 1000 דקות 3 עד גלולה התאים ואת supernatant מוסר וזנוח.
- תאים הם מחדש תלויה μL 200 של תערובת 01:01 של המדיום PECM ממוזגים.
- לערבב התא מועבר 48-היטב צלחות להתרחבות נוספת.
- עבור בתאים במבחנה ניתוח יכול להיות מצופה בצפיפות של 5 x 10 תאים 3 / 2 ס"מ או ב 48 גם צלחות (כל אחד המכיל 9 2 מ"מ זכוכית סטרילית coverslip) או 8-היטב זכוכית שקופיות קאמרית. לניתוח תאים בידול גדלים לילה מפגש 50-60% לפני שהם מועברים בינוני בידול מתירני (ראה סעיף 4 עבור בפרטים חוץ גופית בשיטה) במשך 3 ימים, לפני קיבעון.
4. ניתוח במבחנה של גזע לתאי שריר שלד ותרבויות ראשי
4.1. הכנת תאים
- Dispase subcultured (סעיף 3.3) תרבויות העיקרי explant עובריים הם מצופה במדיום PECM / מותנית על coverslips ב 48 גם צלחות בצפיפות של 3 × 3 תאים 10 / 2 ס"מ ואפשר לצרף.
- להערכת אפופטוזיס ו coverslips התפשטות נשטפים פעמיים PBS, קבוע paraformaldehyde 4% (ראה סעיף 4.2) ב-PBS עבור 20 דקות בטמפרטורת החדר, ואחריו עוד 10 דקות לשטוף PBS.
- Coverslips מוכן בדרך זו ניתן לאחסן על 4 מעלות צלזיוס עד 1 שבוע PBS או PBS / גליצין.
4.2. הכנת מקבע Paraformaldehyde
- במנדף קטר, שוקל 4 paraformaldehyde גרם (PFA; סיגמא אולדריץ, בריטניה) ולהוסיף בקבוק זכוכית של 100 מ"ל של PBS סטרילי עם stirrer מגנטי. מסכת פנים וכפפות יש ללבוש להגנה.
- במנדף קטר, הפתרון הוא מחומם ובחש הרף על פלטה חמה מגנטי עד שהאבקה מתמוססת. זה לוקח כ 5-10 דקות ב 65 ° C. יש להקפיד על מנת למנוע את הטמפרטורה עולה מעל 70 מעלות צלזיוס, כפי קיים סיכון של הפתרון מתפוצץ בטמפרטורות גבוהות.
4.3. אפופטוזיס ו Assay הפצת
- Coverslips קבוע (מוכן בסעיף 4.1) הם מוכתמים 10 מיקרוגרם / מ"ל DAPI דקות 3.
- Coverslips נשטפים פעם PBS (5 to10 דקות) ו - הפוך על נקודה של vectashield הרכבה בינונית על זכוכית שקופית 17, 18.
- הקצוות של coverslip חתומות עם מסמר לכה (ראה הערה 12).
- לאחסון, מגלשות הם עטופים בנייר כסף והניחה על 20 ° C.
- בשביל לספור, מגלשות נתפסים תחת פלואורסצנטי (פילטר UV) על מיקרוסקופ זקוף הבקיע עבור תאים אפופטוטיים ו mitotic באמצעות graticule העינית. עשרים רשתות המופצים באופן אקראי נספרים (המייצגים ~ 1000 תאים), ותאי מאופיינים מורפולוגית כלא אפופטוטיים, אפופטוטיים או mitotic (איור 3 גרם).
- מדדי mitotic ו אפופטוטיים מחושבים כאחוז מסך סך של תאים.
4.4. אימונוהיסטוכימיה
תאים קבוע על coverslips יכול לשמש גם עבור אימונוהיסטוכימיה. לאחזור אנטיגן באמצעות סיר לחץ coverslips חייב להיות מחובר היטב שקופיות הזכוכית באמצעות מהדקי נייר רגיל. Immunostaining יכול לשמש כדי לזהות תאים מתרבים, באמצעות נוגדן כדי Ki67 (1 / 1, 000 דילול), כדי לקבוע את זהותו, באמצעות נוגדן כדי Myf-5 (1 / 1, 000 דילול), או לחקור ביטוי גנים (ראהסעיף 4.5). Immunostaining יכולה להיות מושגת באמצעות מספר שיטות, את הדברים הבאים (שתוארו (28, 29)) משמש באופן שגרתי על ידי המחברים:
- ציטרט חיץ נתרן מראש מחוממת סיר הלחץ. לאחזור אנטיגן, שקופיות המכילות רקמות מחולק ממוקמות לתוך המאגר מחוממת מחומם בלחץ דקות 2. לחץ מושגת על ידי נעילת בחוזקה את המכסה סיר הלחץ הצבת על משקל. לאחר 2 דקות אחזור בזמן שחלף את סיר הלחץ אז הוא הניח בזהירות תחת זרם מי ברז קרים כדי להפחית את הלחץ. כדי למנוע את החיץ רותחים למעלה, יש להיזהר שלא להסיר את המכסה עד בלחץ יש להשוות עם הלחץ האטמוספרי. לחץ מופחת מספיק כאשר משקל ניתן להסיר בקלות (בלי כוח) ואת מכסה הסיר. שקופיות יוסרו אז מן המאגר ורחץ ב PBS בטמפרטורת החדר במשך 10 דקות.
- שקופיות הם מראש חסום על ידי שיקוע שלהם 3 מים מי חמצן / ברז% במשך 5 דקות ולאחר מכן לשטוף שלוש פעמים PBS + 0.05% Tween 20 (10 דק 'לכל לשטוף).
- חסימת מושגת על ידי הדגירה 30 דקות ב TNB חסימת חיץ (מסופק בערכה TSA) בטמפרטורת החדר.
- הנוגדן העיקרי הוא מדולל במאגר TNB כדי דילול המתאים (הגיע על ידי טיטרציה, ראה הערה 12) ו מודגרות לילה ב 4 ° C (או לחלופין 1-2 שעות בטמפרטורת החדר).
- לאחר שלוש שוטף 10 דקות ב PBS + 0.05% Tween 20, מגלשות מודגרת עבור h 1 בטמפרטורת החדר הנוגדנים המתאימים השני biotinylated מדולל TNB חיץ.
- לאחר שלושה 10 דקות שוטף נוסף ב PBS + 0.05% Tween 20, מגלשות מודגרת למשך 30 דקות ב streptavidin-HRP (מסופק בערכה TSA) מדולל 1:100 במאגר TNB ולאחר מכן לשטוף שלוש פעמים (10 דקות כל אחת) ב PBS + 0.05% Tween 20.
- Tyramide Biotinyl (מגיב הגברה, ערכת ה-TSA) הוא הוסיף לאחר מכן כל מקטע דקות בין 8 ל 15 (הזמן המדויק צריך להיות מתקבל על ידי ניסויים אופטימיזציה).
- בעקבות הגברה, לשטוף שקופיות שלוש פעמים (10 דקות כל אחת) ב-PBS + 0.05% Tween 20 ואז דגירה למשך 30 דקות ב SA-HRP.
- לאחר שלוש שוטף נוסף (10 דקות כל אחת) ב-PBS + 0.05% Tween 20, להמחיש באמצעות 3,3-_ diaminobenzidine tetrahydrochloride אב צבע (DAB) במשך 5 דקות עד 10. ואז לבצע את שני סופי שוטף במים לפני counterstaining שקופיות haematoxylin ו coverslipping. DAB הוא קרצינוגן ידוע יש לטפל בזהירות (כמו קולכיצין, סעיף 3.2.2).
4.5. הבחנה
- SMSC מצופה על coverslips או שקופיות קאמרית (ראה הערה 13) יכול גם להיות מובחן לפני קיבוע לניתוח myotube.
- בניסויים אלה הם תאים מצופה בצפיפות של 10 4 / 2 ס"מ ואיפשר לצרף עבור 6-8 ח
- תאים מופעלים אז לתנאים בידול מתירני במשך 3 ימים (ראה הערה 14).
- בינוני בידול מורכב DMEM + 0.5% FCS בתוספת סרום סוס 2% ו גלוטמין 1%. בינוני זה מתירני בידול תרבות מוחלף ב 48 שעות במרווחים.
- Coverslips קבועים אז כאמור לעיל (סעיפים 3.4.1 ו - 3.4.2) ב paraformaldehyde 4%.
4.6. Transfection של SMSC: הביטוי של Transgenes ובונה shRNAi
בתאי גזע ותרבויות העיקריים הם עקשן transfection עם רוב שיטות שיעור transfection ב SMSC ו העיקרי בתאי שריר השלד הוא נמוך מאוד (<10%), מניעת שימוש בשיטות transfection חולף. כדי להתגבר על זה כבר מקובל במעבדה שלנו לבודד derivates המשובטים מתרבויות transfected transgene (ראה סעיף 3.2.1) transfection הבאה עם סידן פוספט או lipofectamine. לחילופין ניתן תאים transfected ביעילות באמצעות זיהום של מבנים ארוזים virally. איור 1m מראה ביטוי יציב של galactosidase-β ב PD50A, נגזרת SMSC המשובטים מבודד תחת זיהום מבחר G418 הבאה עם pIRV, שכפול פגום רטרווירוס נושאת את הגנים לעמידות neo/G418 ו β-galactosidase (19). קו זה תא שימש רשמית להוכיח כי SMSC להתנהג כמו בתאי גזע פונקציונליים in vivo (ראה איור 3.1). בעוד דור של שורת תאים יציבה המשובטים להביע גן סמן רצוי בתא vivo ניסויים גזע להשתלה, היא שיטה זמן רב מספקים ניתוח פונקציה גן במבחנה. מסיבות אלו המחברים פיתחו לאחרונה שינוי אופטימיזציה של מגיב 2000 Lipofectamine transfection אשר מסוגל לספק שיעורי transfection של% 60-70. זה מאפשר ניתוח של תפקוד הגן באמצעות transfection חולף של transgenes או RNAi בונה לתוך SMSc או תרבויות explant הראשוני (איור 3h, ט). החוקרים להשתמש מכבנה קצר RNAi וקטור (pSHAG RNAi) (30) כדי לייצר מבנים shRNAi מסוגל גן מיקוד ספציפי של ביטוי mRNA ב SMSC. ההצלחה של טכניקת shRNAi תלויה בשני גורמים: (א) שיטה transfection יעיל (ב) את העיצוב של רצף סיכת שיער קצר במיוחד, אשר מזהה את הגן היעד. ShRNAi לבנות להפנות eGFP ניתן להשתמש כדי לאמת את שיטת מציאה RNAi (איור 3j, מ ').
4.7. ממוטב LipofectamineTM 2000 transfection פרוטוקול SMSC
- תאים הם מצופה ב 05-10 אפריל תאים / 2 ס"מ לתוך שקופיות קאמרית בינוני 250 DF10 μL תרבות תרבותי עבור 18 שעות כדי להגיע למפגש 95% (מפגש אופטימאלי עבור כל קו התא הוקם על ידי הערכת שיעורי transfection בצפיפויות שונות).
- עבור כל טוב, 0.5 מיקרוגרם של ה-DNA (וקטורים shRNAi, transgenes) מתווסף μL 33 של סרום ללא DMEM בתוספת גלוטמין 2 מ"מ מעורב בעדינות צינורית Eppendorf סטרילית.
- במשך כל טוב, 1.25 μL של Lipofectamine 2000 הוא מדולל בנפרד μL 33 נוספים בינוני סרום ללא DMEM + גלוטמין, מעורב בעדינות נשמר בטמפרטורת החדר למשך 5 דקות
- תערובות DNA ו lipofectamine הם ואז הוסיף במהירות ביחד, מעורבב בעדינות על ידי pipetting עבור 60 s ו מודגרות אז בטמפרטורת החדר למשך 19 דקות כדי לאפשר DNA Lipofectamine 2000 מתחמי הטופס.
- עבור transfection, 66 μL של תערובת מורכבת מתווסף קאמרית כל טוב שקופיות הם התנדנדה קלות עבור s 10 כדי להבטיח חלוקה שווה של קומפלקסים.
- תאים מודגרת עבור שעות 24-72 בשעה 37 ° C ו 5% CO 2. בהתאם הביטוי, לבנות גן פונקציונלי או מציאה shRNAi מזוהה הראשון בין 8 לבין 24 שעות שלאחר transfection.
5. נציג תוצאות
כאשר הם explants explanted בקפידה שרירי השלד מבוגר או מעוברים explants יתחיל לייצר תאים בתוך כמה שעות עד 72 שעות של דגירה על 37 ° C (5% CO 2 / אוויר) (איור 3A). הפעם נלקח הזה להתרחש תלוי במקור של explants: explants עובריים יתגבר מהר יותר מאשר מבוגרים explants מבוגר שרירי השלד. מניסיוננו עיתוי תוצאה ניתנת לשחזור מאוד 3, 29. הרחבת האוכלוסייה תא יתרחש על פני תקופה של ימים (explants העובר) או שבועות (מבוגרים explants שרירי השלד) כדי ליצור צפיפות גבוהה צבירה תרבויות SMS תא ראשוני (ראה איור 3 ב-F להמחשה של תרבויות אלה). איורים 1 ו 3 להראות תוצאות נציג הגזירה התרבות מוצלח של שרירי השלד explants עובריים, גזירת המשובטים ו in vivo השתלה של שריר השלד נגזר בתאי גזע בוגרים, β-galactosidase תיוג, karyotyping ו myf-5 אימונוהיסטוכימיה של SMSC עובריים כדי להמחיש מוצאם של שריר השלד . אוכלוסיות תאים איור 3 מראה תוצאה נציג הבקיע תוצאה (באמצעות Myf-5 אימונוהיסטוכימיה לדמיין SMSC); את המורפולוגיה של תאים עובריים השריר העיקרי; מכתים DAPI עבור אפופטוזיס ואת פרוטוקול transfection shRNAi. פרטים נוספים ניתן למצוא האגדות דמות הנוגעים אלה שתי דמויות. איור 2 ממחיש את ההליך של דיסקציה מיקרו העובר לייצר אוכלוסיות המועשר בתאי גזע עובריים של שרירי השלד.
טבלה 1: טבלת חישוב כדי להעריך את מספר cryovials נדרש כדאיות התא המקסימלי במהלך ההקפאה תא מטה פרוטוקולים
| צלחת / Flask / תא שקופית | נפח בינוני תרבות | PBS שוטף | נפח טריפסין | מספר להקפיא את צלוחיות (3.1.2) |
| 96-טוב | 50 μL | 2 X 100 μL | 25 μL | N / A |
| 48 גם | 150 μL | 2 X 200 μL | 50 μL | N / A |
| 24 גם | 500 μL | 2 X 700 μL | 200 μL | N / A |
| 6 טוב | 3 MLS | 2 X 3 MLS | 500 μL | 1 |
| קטן (25 ס"מ 2) | 10 MLS | 2 X 10 MLS | 1 מ"ל | 2 |
| בינונית (80 ס"מ 2) | 10 MLS | 2 X 10 MLS | 3 MLS | 4 |
| גדול (175 ס"מ 2) | 10 MLS | 2 X 10 MLS | 5 MLS | 8 |
| לשכת היטב | 500 μL | 2 X 500 μL | 100 μL | N / A |
N / A = לא רלוונטי; מספרים התא היו נמוכות מדי, אלא אם להקפיא את בארות רבות הוקפאו למטה ביחד.
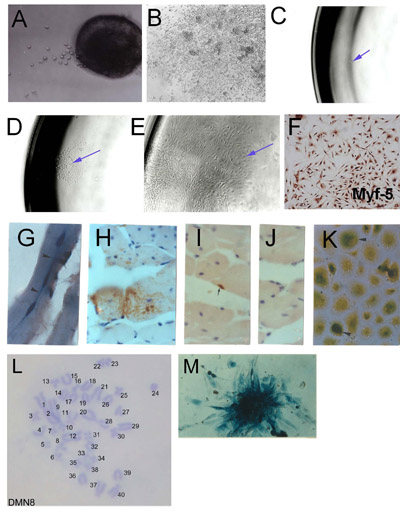
באיור 1. בידוד של שריר השלד בתאי גזע (SMSC) מ microexplants: (א) תוצאה מוקדם של שריר השלד explanted בוגרים (יום 2) (ב) תוצאה explant הוקמה מראה תרבויות מצטברים צפיפות התאים גבוהה.. הגזירה המשובטים של SMSC. (C) תא בודד ומבודד לתוך צלחת 96 באר. (ד) המושבה מוצא תא בודד. (E) הוקמה האוכלוסייה משובט. (ו) אימות הזהות באמצעות SMSC Myf-5 אימונוהיסטוכימיה. תאים שמקורם SMSC שיבוט PD50A (להביע β-galactosidase) בעכברים מארח בגיל 3 חודשים (G) (HJ) 14 חודשים לאחר הזרקה של תאים 2000 PD50A לתוך השריר tibialis עכבר הקדמי. (G) שלושה התמזגו לאחרונה (גרעינים במיקום מרכזי ) β-galactosidase חיובי תאים (כתם כחול) בתוך סיבי השריר (סעיף האורך). (H) התרומה נרחב galactosidase-β-חיובי תאים (כתם חום, זוהה על ידי נוגדן אנטי β-galactosidase) בסיבי השריר (סעיף רוחבי ). (אני) β-Galactosidase חיובי לווין תא (כתם חום, זוהה על ידי נוגדן אנטי β-galactosidase). (J) שליטה נוגדנים משני (ללא כתמים). (K) β-Galactosidase חיובי תאים (כתם כחול) להתרבות בתרבות כאשר מבודדים שרירים מארח מוזרק 12 חודשים לאחר ההזרקה. (L) קריוטיפ של קו עכבר משובט SMSC (DMN8) מראה דיפלואידי נורמלי כרומוזום משלימים. (M) Histochemistry מראה β-galactosidase ביטוי מושבה של תאים PD50A ( איור 3.1 גרם, k, לשכפל באישור AACR העיתונות, סמית שופילד, 1997).
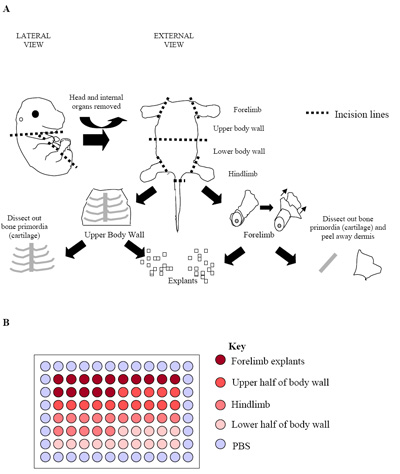
איור 2. (א) איור של התהליך העובר לנתיחה. הנתון מייצג העובר E15.5 שם עצם בראשיתי (סחוס) יכול בקלות להיות מזוהה גזור חינם של הרקמה המקיפה את שרירי השלד. בשלב זה, ועל עוברי בשלב מאוחר יותר (E15.5 E17.5), הדרמיס הוסר גם להגדיל את חלקם של התאים שריר השלד המתקבל. (ב) ההתקנה של תרבויות explant העיקרי צלחת 96-היטב. כל העובר היה בשימוש לייצר אחד צלחת כפי שראינו לעיל. הנוהג המקובל הוא משכפל צלחת של שלושה עוברי נפרד (שלוש צלחות = 180 בארות) לקבוע שיעורי תוצאה.
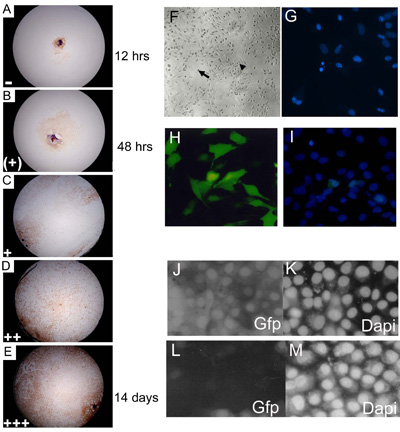
איור 3. עובריים תרבויות explant העיקרי דורגו ב 3, 7, 14 ו - 21 ימים של תרבות מוקצה רמה תולדה נציג רמת המפגש. (AE) C57BL10 E15.5 העיקרי explant תרבויות עובריים מוכתם Myf-5 כדי להמחיש 0 14% (); 15 24% (+), 25 49% (+), 50% (++); 74 75 100% ( + + +) הרמות של מפגש. חלקם של בארות מראה כל רמה של תוצאה (על כל יום של מניה) היה מוכפל במספר שרירותי (= 1; (+) = 2; + = 3; + + = 4 ו - + + + = 5) לפני באיסוף נתונים לתת ערך תוצאה סופית. כ 85% eSMSc (C57BL/10) wild-type העיקרי כתם על סמן תא שריר השלד Myf-5. ההגדלה הוא 10. (ו) תרבויות עובריים הוקמה יש מאפיינים מורפולוגיים של מבוגר SMSC, תאים דו קוטבית (חץ קטן) ותאי חד צורתי כדורית (חץ גדול). (G) זיהוי פיצול גרעינים אפופטוטיים באמצעות מכתים DAPI. (HI) רמות גבוהות (~ 75%) של transfection של מבנה ה-GFP-להביע לתוך שורות תאים באמצעות SMS Lipofectamine אופטימיזציה 2000 transfection שיטה. (אני) ספירת מספר התאים הכולל הוא נעזר DAPI counterstain. RNAi באמצעות pSHAGshRNAigfp (JM) מבטל ביטוי ב-GFP SMSC (ראה (29) למשל זה לבנות לשמש שליטה). (J) Control (transfection מדומה) מראה ביטוי של GFP בקו GFP SMSC. (K) DAPI מלאה . (L) shRNAiGfp 24 שעות לאחר transfection. (M) לשלוט DAPI עבור תאים shRNAiGfp transfected ב (L).
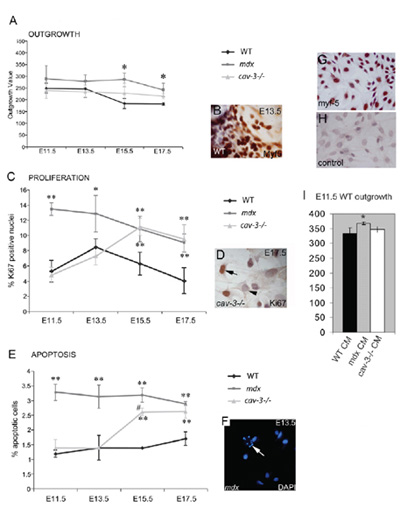
איור 4. , Dystrophic myoblast עובריים Myf5 חיובי הם hyperproliferative ונוטים אפופטוזיס. (א) שיעור תולדה של myoblasts עובריים מתרבות explant שריר אניזה עלה גם מוטנטים MDX מ E11.5 וב CAV-3 מוטציות (-/-) ב E15.5 ו E17.5 בהשוואה explants WT תרבותי במקביל. (ב) explant Myf5-immunostained. (C) Hyperproliferation של myoblasts עוברי מוטציות MDX מ E11.5 וב CAV-3 מוטציות (-/-) מ E15.5, כפי שנקבע על ידי immunoreactivity Ki67 חיובי (ד '). (E) אפופטוזיס גבוהות מן E11.5 בעוברים MDX מ E15.5 ב CAV-3 עוברי (-/-), כפי שמוצג על ידי מכתים DAPI (F); על החץ F נקודות לתא אפופטוטיים. * P <0.05 בהשוואה ל WT; ** p <0.01 בהשוואה ל WT; * p <0.05 כאשר משווים MDX עם CAV-3 (-/-) (G, H) E15.5 myoblasts העיקרי עובריים בתרבית WT עם מכתים Myf5. (G) שליטה הנוגדן השני (H). (אני) שיעור תולדה של explants E11.5 WT מוגברת (* p <0.05) במדיום E11.5 explant ממוזג MDX (CM), אך לא CAV-3 (-/-) או WT CM. ברים שגיאה עולה דמות סטיית תקן זה מובא תחת זכויות היוצרים סופרים פורסמה לראשונה על ידי החברה של הביולוגים של מריק et al. 2009.
6. הערות: השלבים הקריטיים והשינויים אפשרי
- כאשר תאים מופשר יש המצורפת על צפיפות התאים נמוך מאוד זה נבון להחליף רק חצי בינוני כדי למנוע התרסקות תרבות.
- SMSC מבודד שריר dystrophic רגישים אפופטוזיס וכך צריך להתייחס אליו בזהירות מסוימת. SMSC Dystrophic (כגון קו dfd-13 התא, אשר הוקמה מתוך שרירי השלד המתקבל dystrophic 5 שבועות בן (MDX) עכברים) צריך להיות מבוגר בצפיפויות התא גבוה מהרגיל עבור myoblasts. כאלה אפופטוזיס רגיש שורות תאים הם cryopreserved גם בצפיפויות גבוהות יותר (ראה סעיפים 1.1 ו -1.2) (19).
- שיטה חלופית של הסרת התאים בשכבה מנצל dispase, אשר מספק שיטה מתונה יותר של התא דיסוציאציה, עם יתרון שהוא יכול להתבצע בנוכחות FCS וסידן (גם נוכח DF10). Dispase ולכן יכול לשמש תת ולהרחיב את השלד העיקרי explant שריר תרבויות earlystage שיבוטים SMSC (ראה סעיפים 2 ו 3).
- עבור צלוחיות גדול כמות טריפסין / EDTA המשמש צריך להיות scaled עד כדלקמן: 75 מ"מ 2 בקבוקון (3 מ"ל טריפסין) ו 175 מ"מ 2 בקבוקון (5 מ"ל טריפסין). בדומה לאזורים משטח קטן להפחית את כמות טריפסין משמש (ראה לוח 1).
- לחלופין, דיסוציאציה ניתן לנטר באמצעות מיקרוסקופ הפוכה, זה מומלץ למתחילים.
- Cryopreservation של שורות תאים מתבצעת בדרך כלל באמצעות כלי ומחוברות גדול (175 מ"מ 2) פלסטיק. בין 7 ל 9 cryovials ניתן להשיג כלי אחד גדול כזה, בהתאם לפרופיל ההישרדות של הקו הסלולרי להיות cryopreserved. תרבויות ראשיים שורות תאים שהוקם לעיתים עקשן מאוד להקפיא את ההליכים. כדי לשפר את ההתאוששות ואת ההצלחה של הקפאת מטה תאים כאלה שתי הגישות יכול לשמש (בנפרד או בשילוב). (א) התוכן FCS ההקפאה למטה תערובת יכול להיות עלה מ 10% (עד למקסימום של 50%). (ב) להקפיא את התהליך יכול להיות האטה על ידי הצבת cryovials בשלב האדים של N2 עבור 12-24 שעות לפני העברת צלוחיות לשלב את הנוזל.
- דרך נוחה לבדוק את הקובץ המצורף של חברת coverslip haemacytometer היא לחפש טבעות של ניוטון (השתקפויות קשת בכוס) על coverslip או לחילופין, להחזיק את haemacytometer במהופך על יד פתוחה.
- וריאציה של השיטה explant יכול להיות מועסק עבור לטווח קצר תרבויות לשימוש מבחני, אימונוהיסטוכימיה התפשטות או אפופטוזיס. Explants Microdissected ממוקמות על זכוכית באמצעות 8-גם שקופיות קאמרית. שיטה חלופית היא להשתמש 9 מ"מ 2 coverslips להציב 24 גם הצלחות. בשני המקרים two explants מועברים גם כל אחד בינוני 150 DF20 μL. לחלופין, תרבויות העיקרי יכול להיות subcultured בשיטת dispase ו מצופה אל coverslips להציב 24 גם צלחות או ישירות לתוך 8-גם שקופיות קאמרית.
- לניתוח כמותי של שיעורי תולדה מינימום של 60 בארות המכיל 1 explant לכל מבוססים היטב, לכל שריר / זן העכבר. כדי ליצור פרמטרים הצמיחה זן לפחות שלושה בעלי חיים נפרדים יש להשתמש. צלחות ובארות הפרט לא ניזונים תוך תולדה מתבצעת הבקיע.
- עבור קווי שיבוט הוקמה SMSC זה די התאים תרבות אחת תערובת 01:01 של המדיום ממוזגים DF10 בינוני. עבור explants ראשוני זה הכרחי כדי להגדיל את התוכן בסרום של המדיום תרבות ל -20%.
- קולכיצין הוא רעיל מאוד קרצינוגן ידוע יש לטפל עם טיפול הולם. פעמיים עטה כפפות ועבודה לגבולות מגש המיועד הוא חיוני. כל disposables (כלומר Gilsonטיפים) ממוקמות בתוך כוס של אקונומיקה (נתרן hypochlorite 5%) לילה לפני סילוק עם כמויות של מים ביום follo כנף.
- אנו משתמשים כיום נוגדנים ספציפיים העיקרי Ki67 ו Myf-5 כל בדילול 01/01 000,. דילול אופטימלי עבור נוגדנים העיקרי צריך להיות אמפירי הוקמה עבור כל נוגדן כדי לשמש באופן אידיאלי גם עבור קבוצות שונות של נוגדנים עם זאת, גם כאשר מתקבל מאותו מקור.
- מגלשות לשכת יכול לשמש גם עבור assay זה. לפני תיקון התאים PFA 4%, בינוני התרבות מוסר ותאי נשטף פעמיים עם 37 ◦ C סטרילי PBS. חדרי היטב, אטם ודבק יוסרו שקופיות הזכוכית להציב צנצנת 50 מ"ל Coplin זכוכית המכיל paraformaldehyde 4% המוכן טרי בטמפרטורת החדר, אשר אז התנדנדה קלות במשך 25 דקות על Gyro-Rocker R_ שייקר. שקופיות נשטפים אז פעמיים PBS (טמפרטורת החדר) ומשמש גם מיד או לאחסן PBS ב 4 ◦ C (טווח קצר: 1-2 שבועות) לניתוח (IHC) immunohistochemical.
- אם היווצרות myotube נרחב יותר נדרש העיקרי בתאי שריר השלד יכול להיות מובחן של עד 8 ימים.
Discussion
תרבויות explant Microdissected ניתן להשתמש אמין reproducibly לבודד אוכלוסיות תאים המכילים אחוז גבוה מאוד (~ 85%) של Myf-5 שגשוג חיובי השלד גזע לתאי שריר (SMSC). בתנאים מבוקרים בקפדנות התרבות המתוארת כאן תרבויות explant העיקרי יכול לשמש כדי לאפיין את התנהגות הצמיחה של העכבר SMSC מוטציה גנטית יכולה לשמש כאמצעי ליצירת myotubes עבור ניתוח מפורט של תהליכי התמיינות חוץ גופית. תחזוקה מניפולציה זהיר של תרבויות אלה מאפשר לטווח ארוך התרבות הרחבה. השימוש בשיטות המתוארות כאן אפשר גם לגזור גזע משובטים השלד שריר שורות תאים מתרבויות explant באמצעות דילול תא בודד. כדי להשיג את התרבות התאים מבודדים אחד במהלך תהליך השכפול, "בינוני מותנה" משמש לחקות את הדרישה נורמלי של תאים אלה לתרבות בצפיפות גבוהה. השיטה ישימה (עם שינוי) אל, רקמות עובריים מבוגרים בגילאים מבוגרים, ובנוסף העכבר יכול לשמש כדי לבודד את התאים מן שרירי השלד של מינים אחרים, כולל בני אדם (ראו וסמית, לא פורסם), עובר אפרוח ודגים ( סלמון) 24. SMSC נגזר Clonally ניתן לנתח in vivo על ידי לשריר ו השתלה בתנאים אלה מוזרק SMSC ישלב עם myotubes מארח ליצור סיבי שריר היברידית. SMSC מוזרק לתוך שריר לא יוצרים גידולים נמצאו השרירים לארח בעמדה תא לוויין יותר משנה לאחר ההזרקה, מה שמראה כי הם כפופים לשלוט אנדוגני ידי התא בתאי גזע לווין niche.These ניתן מחדש מבודד מוזרק המארחים כמו SMSC שגשוג למעלה מ -12 חודשים לאחר ההזרקה לארח 19.
Disclosures
Acknowledgements
אנו מודים פטריק Paddison על מתנתו של וקטור המעבורת shRNAi. אנג'לה סלואן שנוצר התמונה RNAi GFP באיור 3. כמו כן, אנו מודים לגופים מימון הבאים על תמיכתם:
ניוון שרירים קמפיין להעניק מספר RA2/592/2; ניצוצות מספר מענק 02BHM04, החברה המלכותית להעניק מספר 574006.G503/1948./JE ו BBSRC מספר מענק 6/SAG10077.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
References
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved