A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פעמיים פלואורסצנטי באתרו הכלאה בסעיפים המוח טריים
In This Article
Summary
פרוטוקול זה כרוך לא רדיואקטיבי ב-situ הליך הכלאה המאפשר זיהוי סימולטני של שני מינים התמליל, ברזולוציה של תא בודד, בסעיפים דק של המוח החולייתנים.
Abstract
כאן אנו מתארים גירסה שונה של פלואורסצנטי כפול
Protocol
פרוטוקול זה פותח ומעודן מבוסס על תקן ב-situ שיטות רדיואקטיבי ולא רדיואקטיבי הכלאה, שפותח בעבר על ידי אותנו ואחרים כדי לזהות אחד או שני מינים תמליל ברקמת המוח 1-7. פרוטוקול המתואר להלן בעל אורך כולל של 2 או 3 ימים, תלוי במספר הפרעות פרוצדורליות שנבחרו על ידי משתמש הקצה. כל הצעדים המפורטים להלן הם להתנהל בטמפרטורת החדר, למעט השלב riboprobe הכלאה ופוסט הכלאה שוטף. הפתרונות ואת מאגרים חובה לכל השלבים הכרוכים בשיטה זו ניתן למצוא בסוף פרוטוקול זה.
1. רקמות הכנה חתך
- לערוף ולחלץ המוח של הנבדק במהירות, ולמקם אותו לתוך תבנית פלסטיק בגודל הולם.
- כיסוי בינוני רקמות המוח עם Tek-הטבעה במהירות למקום תבנית פלסטיק באמבטיה dry-ice/alcohol להקפאה מהירה. רקמה קפואים ניתן לאחסן -80 ° C עד השימוש.
- שימוש cryostat, לאסוף 2 או 3 חלקים במוח לכל שקופית על Superfrost פלוס שקופיות טעונה. עובי סעיפים צריך להיות 10-12 מיקרומטר. שקופיות ניתן לאחסן ב -80 ° C עד השימוש.
2. הכנת Sephadex G50 עמודות עבור טיהור Probe
"עמודות Sephadex ניתן לרכוש ממקורות מסחריים, לעומת זאת, אנו מספקים להלן אלטרנטיבה בעלות נמוכה עבור הדור של עמודות, אשר יידרש לטיהור בדיקה.
- כמות מספקת של אבקת מימה G50 Sephadex עם מים RNase ללא DEPC שטופלו, (למשל, 2 גרם של אבקת ב 100 מ"ל מים DEPC שטופלו), פתרון בקצרה לערבב לאחסן בטמפרטורת החדר כדי לזרז Sephadex עודף G50.
- הסר supernatant (השכבה העליונה של המים) בעקבות משקעים G50 Sephadex.
- חזור על התהליך מעל 3-5 פעמים.
- לאחר לשטוף הסופי, מחדש להשעות את הפתרון G50 Sephadex ב TE חיץ (1:1 יחס), ולאחסן בבית 4 ° C עד השימוש.
- המקום autoclaved צמר זכוכית לתוך מזרק 1 מ"ל סטרילי ו לדחוס אותו עם הבוכנה כדי ליצור שכבה קומפקטית בתחתית, ולאחר מכן למקם את המזרק לתוך צינור פלקון 15 מ"ל.
- מערבבים היטב את הפתרון של Sephadex G50 ב TE. מלאו את המזרק / טור עם הפתרון הזה.
- צנטריפוגה העמודה במשך 30 שניות בסל"ד 1000.
- חזור על נוהל זה עד טור מלא כמעט לחלוטין עם Sephadex G50 חרוזים.
- החלת 200 μl של חיץ טור כביסה לעמודה ו צנטריפוגה זה 2 דקות בסל"ד 1000. בטל זרימה דרך.
- החלת 200 μl של חיץ טור חסימת לעמודה ומסובב אותו 2 דקות בסל"ד 1000. חזור על פעולה זו 4-5 פעמים צעד לאזן העמודה. עמודות ניתן לאחסן 4 ° C עד השימוש אם חתום Parafilm.
3. סימון טיהור Riboprobes
להלן פירוט אנחנו דור וטיהור של riboprobe יחיד. עבור dFISH, הכנת כל בדיקה תכלול את המתודולוגיה זהה, פרט לכך אחד בדיקות תסווג digoxigenin (DIG)-tagged UTP ואילו אחרים עם ביוטין-tagged UTP.
- הכן מרוכז (> 150 ng / μl) וטיהר פתרון cDNA לינארית של עניין או ליצור תחושה (שליטה) או riboprobes antisense.
- בתוך צינור מ"ל 1.5 microfuge, להוסיף 0.5-1 מיקרוגרם של מטוהרים תבנית cDNA, 2 μl של חיץ בדיקה 5X תיוג, 1 μl DIG של 10X (או ביוטין) תיוג לערבב, 0.5 μl של RNasin ו 1 μl של פולימראז RNA המתאים , ולהביא את הנפח הסופי של הפתרון μl 10 עם RNAse חינם (DEPC שטופלו) מים.
- דגירה הפתרון באמבט המים 37 מעלות צלזיוס למשך 2 שעות.
- הוסף μl 1 של tRNA (מניות, 20 מיקרוגרם / μl), וכן 39 μl של חיץ טור חסימת לפתרון.
- הכן את העמודה G50 Sephadex לטיהור בדיקה. לשם כך, להוסיף 50 חיץ חסימת μl לעמודה ומסובב אותו במשך 10 שניות בסל"ד 1000.
חזור על פעולה זו 2-3 פעמים לאזן את העמודה (כלומר, 50 μl מלא להחיל בעמודה הם התאוששו לאחר מחזור של צנטריפוגה). - החלת הפתרון בדיקה העמדה G50 Sephadex טור, שפופרת microfuge חדש בתחתית העמוד, ואת זה ספין 3 דקות בסל"ד 1000 כדי להשיג את מטוהרים 50 μl של פתרון riboprobe.
- הערכת איכות תשואה של riboprobe שכותרתו או באמצעות תקן פורמלדהיד-agarose RNA ג'ל או ספקטרופוטומטר.
4. פוסט קיבעון, acetylation ו הכלאה
- הסרה של חלקים מן המקפיא -80 מעלות צלזיוס ולאפשר טמפרטורת חדר לאזן. לאחר מכן, דגירה מקטעים פתרון קר טרי מתוצרת, paraformaldehyde 3% עבור 5 דקות.
- בקצרה לשטוף מקטעים phosphate בופר סליין (PBS) פעמיים.
- ליבש חלקים באמצעות סדרה אלכוהול רגיל (70, 95, ו - 100%; 2 דקות כל אחד), ולתת להם אוויר יבש.
- דגירה מקטעים פתרון acetylation עבור 10 דקות.
- יש לשטוף את סעיפים 3 פעמים 2X SSPE.
- ליבש חלקים שוב דרך הסדרה אלכוהול רגיל שתוארו לעיל, ולאפשר להם אוויר יבש.
- הכן נפח נאותה פתרון הכלאה ולהוסיף גם riboprobes לפתרון (ריכוז בדיקה: 1 ng / μl בדיקה עבור כל אחד). נפח כולל של התמיסה ההכלאה נקבעת על פי מספר סעיפים להיות הכלאה (16 μl של הכלאה פתרון לכל קטע).
- החל נפח נאותה של הפתרון הכלאה לשקופיות רקמות coverslip להבטיח כי לא שכבת בועות אוויר הרקמה.
- המקום מחזיק שקופיות שקופיות מתכת. בעל לטבול באמבט שמן מינרלי נקבע על 65 מעלות צלזיוס למשך הלילה. ודא coverslips מתמודדים כלפי מעלה (כלומר, את ההיבט לרוחב של בעל שקופית צריך להיות במגע עם החלק התחתון של המיכל שמן מינרלי).
5. פוסט הכלאה רוחצת
- למחרת, להסיר בזהירות את מחזיק השקופיות מהאמבטיה שמן מינרלי בקצרה לשטוף אותו כלורופורם כדי להסיר עודפי שומן מן השקופיות.
- המקום שקופיות פתרון 2X SSPE 5-10 דקות. Coverslips צריך להתנתק שקופיות ואילו הפתרון.
- העברת שקופיות פתרון חדש SSPE 2X, ולשמור אותם במשך שעה 1 בטמפרטורת החדר.
- העברת חלקים לתוך תמיסה המכילה 2X SSPE לפוראמיד בתוספת 50%. הטמפרטורה של פתרון זה צריך להתאים את טמפרטורת השתמשו בהליך הכלאה בין לילה. שמור שקופיות פתרון זה עבור 1.5 שעות.
- העברת חלקים לפתרון 0.1X SSPE מראש התחמם לטמפרטורה באותו השלב הכלאה. דגירה סעיפים בפתרון זה למשך 30 דקות. חזור על שלב זה עבור 30 דקות נוספות.
6. איתור ויזואליזציה של Riboprobes
- העברת שקופיות למאגר TNT אשר מי חמצן 0.3% נוספה, במשך 10 דקות.
- לשטוף מקטעים TNT חיץ, 3 פעמים (10 דקות כל אחד).
- באמצעות עט DAKO, לצייר היטב סביב האזור המכיל את החלקים במוח. חשוב לציין, יש להיזהר כדי להבטיח חלקים שאינם יבשים.
- החלת 150 μl של חיץ TNB להחליק כל אחד, דגירה סעיפים בפתרון זה למשך 30 דקות, בתא לח.
- הסר פתרון TNB עודף על ידי הטיית שקופיות.
- החלת 150 μl של פתרון TNB המכיל-מצומדות peroxidase אנטי DIG נוגדן, ומחליק לאחסן בתא לח במשך שעה 2. ריכוז נוגדן צריך להיקבע בנפרד עבור כל תמליל של עניין לפני ביצוע dFISH.
- לשטוף מקטעים TNT חוצץ; 3 פעמים, 10 דקות כל אחד.
- החלת 150 μl של אלקסה 594-מצומדות פתרון tyramide פועלים כל שקופית, ולאחסן אותם בתא לח במשך שעות 1. פתרון זה אמור להיות מוכן על פי ההוראות של היצרן.
- לשטוף מקטעים TNT חוצץ; 3 פעמים, 10 דקות כל אחד.
- סעיפים דגירה במאגר TNT אשר מי חמצן 0.3% נוספה עבור 10 - 30 דקות.
- לשטוף מקטעים TNT חוצץ; 3 פעמים, 10 דקות כל אחד.
- החלת 150 μl של חיץ TNB לכל שקופית, ולשמור אותם בתא לח למשך 30 דקות.
- הסר פתרון TNB עודף על ידי הטיית שקופיות.
- הוסף 150 μl של פתרון TNB המכיל-מצומדות peroxidase אנטי ביוטין נוגדן, ומחליק לאחסן בתא לח במשך שעה 2.
- לשטוף מקטעים TNT חוצץ; 3 פעמים, 10 דקות כל אחד.
- החלת 150 μl של אלקסה 488-מצומדות פתרון tyramide עובד על השקופיות וחתכים דגירה עבור שעות 1. פתרון זה אמור להיות מוכן על פי המלצות היצרן.
- לשטוף מקטעים TNT חוצץ; 3 פעמים, 10 דקות כל אחד.
- הוסף 150 μl של Hoechst פתרון (1:1000 ב-TNT החיץ) בסעיפים ולשמור אותם בתא לח דקות 2.
- לשטוף את הסעיפים TNT חוצץ; 3 פעמים, 5 דקות כל אחד.
- Coverslip חלקים בינוני עם הקרינה תואמת הרכבה (למשל, Vectashield או להאריך antifade).
7. נציג תוצאות
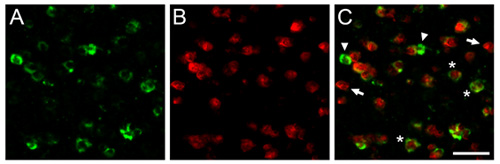
באיור 1. כאן אנחנו מראים תוצאות dFISH נציג להשיג במוח זברה פינק. המוצגים הם photomicrographs המתקבלים nidopallium caudomedial (מלח"י), אנלוגי ציפור שיר של קליפת המוח השמיעתית יונקים. חלקים במוח היו הכלאה עם riboprobe biotinylated נגד parvalbumin (A), סמן האוכלוסייה משנה של נוירונים מעכבים, ו-DIG שכותרתו riboבדיקה מכוונת נגד הפעילות תלויי גן zenk (ב), סמן אמין שיר מונחה נוירונים. ג) כיסוי של (א) ו - (ב) מראה אוכלוסיה של נוירונים מעכבים אשר מופעלים על ידי ניסיון שמיעתי. חצים וראשי חץ עולה תאים שכותרתו בלעדי עם כל אחד משני riboprobes ו כוכביות להראות נוירונים נציג במשותף להביע הן תעתיקים של עניין. בר סולם = 25 מיקרומטר.
Discussion
השתמשנו בפרוטוקול זה כדי ללמוד כיצד המוח חוליות מאורגן neurochemically והן מבחינה תפקודית, ולקבוע כיצד התנהגותית הרלוונטיים השפעת גירויים חושיים מנגנון גנטי של נוירונים במוח מבוגר 80-10. השתמשנו בשיטה זו בהצלחה ברקמת המוח של עכברים, חולדות, ציפורי שיר, אבל צופים כי פרוט...
Disclosures
Acknowledgements
עבודה נתמך על ידי מענקים של NIH / NIDCD וקרן שמיט אל RP.
Materials
פתרונות
- טור חיץ כביסה: 10 mM טריס-HCl, 0.15 M NaCl, 0.05 mM EDTA, 50 מיקרוגרם / μl tRNA, SDS 0.1% במים 50 DEPC שטופלו מ"ל.
- טור חיץ חסימה: 10 mM טריס-HCl, 50 mM NaCl, 0.1 mM EDTA במים 50 DEPC שטופלו מ"ל.
- TNT חיץ: 60 מ"ל של טריס 1 M-HCl, 18 מ"ל של 5 M NaCl ו - 1.8 מ"ל של טריטון X-100 ב 600 מ"ל מים DEPC שטופלו.
- TNB חיץ: 100 מ"מ טריס-HCl, 8.3 מיקרוגרם / μl BSA, 0.15 מ NaCl ו - 3% Triton X-100 במים DEPC שטופלו.
- TE חיץ: 10 mM טריס-HCl, pH 7.5 פלוס 1 mM EDTA, pH 7.5.
- פתרון acetylation: 2.7 מ"ל של triethanolamine בתוספת של 0.5 מ"ל אנהידריד אצטית ב 200 מ"ל מים DEPC שטופלו.
- פתרון Hybridization: לפוראמיד 50%, 2X SSPE, 2 מיקרוגרם / μl tRNA, 1 מיקרוגרם / μl BSA ו 1 מיקרוגרם / μl פולי במים DEPC שטופלו. הוא זקוק לכל סעיף 16 l.
References
- Jin, L., Lloyd, R. V. In situ hybridization: methods and applications. J Clin Lab Anal. 11, 2-9 (1997).
- Stoler, M. H. In situ hybridization. Clin Lab Med. 10, 215-236 (1990).
- Komminoth, P., Werner, M. Target and signal amplification: approaches to increase the sensitivity of in situ hybridization. Histochem Cell Biol. 108, 325-3233 (1997).
- Kessler, C. The digoxigenin:anti-digoxigenin (DIG) technology--a survey on the concept and realization of a novel bioanalytical indicator system. Mol Cell Probes. 5, 161-205 (1991).
- Panoskaltsis-Mortari, A., Bucy, R. P. In situ hybridization with digoxigenin-labeled RNA probes: facts and artifacts. Biotechniques. 18, 300-307 (1995).
- Qian, X., Lloyd, R. V. Recent developments in signal amplification methods for in situ hybridization. Diagn Mol Pathol. 12, 1-13 (2003).
- Mello, C. V., Jarvis, E. D., Denisenko, N., Rivas, M. Isolation of song-regulated genes in the brain of songbirds. Methods Mol Biol. 85, 205-217 (1997).
- Pinaud, R. GABAergic neurons participate in the brain's response to birdsong auditory stimulation. Eur J Neurosci. 20, 1318-1330 (2004).
- Velho, T. A., Pinaud, R., Rodrigues, P. V., Mello, C. V. Co-induction of activity-dependent genes in songbirds. Eur J Neurosci. 22, 1667-1678 (2005).
- Tremere, L. A., Jeong, J. K., Pinaud, R. Estradiol shapes auditory processing in the adult brain by regulating inhibitory transmission and plasticity-associated gene expression. J Neurosci. 29, 5949-5963 (2009).
- Pinaud, R., Mello, C. V., Velho, T. A., Wynne, R. D., Tremere, L. A. Detection of two mRNA species at single-cell resolution by double-fluorescence in situ hybridization. Nat Protoc. 3, 1370-1379 (2008).
- Pinaud, R., Jeong, J. K. Duplex fluorescence in situ hybridization in the study of gene co-regulation in the vertebrate brain. Methods Mol Biol. 611, 115-129 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved