A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד של תאים אנדותל valvular
In This Article
Summary
אנו מספקים שיטה בידוד אוכלוסיות culturing טהור של שסתום הלב תאים אנדותל (VEC). VEC יכול להיות מבודד צדי סף או העלעל ומיד הבאה, תא ביניים הבסיסית (ויק) בידוד היא פשוטה.
Abstract
שסתומי הלב הוא האחראי הבלעדי לשמירה על זרימת דם חד כיווני דרך מערכת הלב וכלי הדם. דקים אלה, סיבי רקמות חשופים מדגיש מכני משמעותי כפי שהם לפתוח ולסגור כמה מיליארדי פעמים על תוחלת חיים. סיבולת מדהימה של רקמות אלה נובע valvular התושב האנדותל (VEC) ותאי ביניים (ויק), כי כל הזמן לתקן לשפץ בתגובה לאותות מכני ביולוגי המקומית. רק לאחרונה התחלנו להבין את התנהגות ייחודית של תאים אלה, אשר בניסויים במבחנה יש תפקיד מפתח. מאתגר במיוחד הוא בידוד תרבות VEC. טיפול מיוחד יש להשתמש מרגע רקמה יוסר המארח באמצעות ציפוי הסופי. כאן אנו מציגים פרוטוקולים בידוד ישיר, בידוד צד מסוים, תרבות, ואימות של אוכלוסיות טהורות של VEC. אנו משתמשים עיכול אנזימטי ואחריו טכניקה גירוד עדין ספוגית כדי לסלק משטח תאים בלבד. תאים אלו נאספים אז לתוך צינור ו centrifuged לתוך גלולה. גלולה היא resuspended אז מצופה לתוך צלוחיות תרבות טרום מצופה מטריצה אני קולגן. פנוטיפ VEC הוא אושר על ידי מגע עכבות הצמיחה ביטוי של סמנים ספציפיים כגון PECAM1 האנדותל (CD31), פון Willebrand Factor (vWF), ואת הביטוי השלילי של אקטין אלפא שריר חלק (α-SMA). המאפיינים של פונקציונלי VEC קשורים עם רמות גבוהות של LDL acetylated. בניגוד לתאי אנדותל כלי הדם, VEC יש יכולת ייחודית להפוך mesenchyme, אשר בדרך כלל מתרחשת במהלך היווצרות שסתום עובריים 1. זה יכול להתרחש גם במהלך ומחוברות משמעותית לפרסם ממושך בתרבות חוץ גופית, ולכן הטיפול צריך להיעשות כדי המעבר ליד או מפגש. לאחר בידוד VEC, אוכלוסיות טהור של ויק אז יכול להיות נרכש בקלות.
Protocol
1. הכנה
- החיטוי במכשיר מכוסה מגש את הפריטים הבאים:
- משוננת מלקחיים רקמה - לטיפול ברקמת העלון
- רקמות מספריים (8 ס"מ) - לקבלת זמירה רקמות העלון cusps
- ספוגיות כותנה - בשביל לבודד את שכבת האנדותל מתוך העלון או סף
- בצע פתרון collagenase סטרילית
- הוסף 4.0 גרם של אבקת DMEM ל 250 מ"ל מים MΩ 18.
- מוסיפים 1.11 גרם של סודיום ביקרבונט.
- הוסף (600 U / mL) 180,000 יחידות של collagenase.
- הוסף 1% (3mL) פניצילין / סטרפטומיצין.
- התאם את ה-pH של התמיסה עד 7.2.
- תביא את הפתרון עד 270 מ"ל.
- לעקר את הפתרון על ידי עובר דרך מסנן 0.2 מיקרומטר.
- הוסף 10% (30 מ"ל) של נסיוב סטרילי שור העובר.
- הפוך את תא סטרילי בינוני אנדותל
- הוסף 6.7 גרם של אבקת DMEM ל 400 מ"ל מים MΩ 18.
- מוסיפים 1.85 גרם של סודיום ביקרבונט.
- הוסף (50 U / mL) 25,000 יחידות של הפרין.
- הוסף 1% (5 מ"ל) פניצילין / סטרפטומיצין.
- התאם את ה-pH של התמיסה עד 7.2.
- תביא את הפתרון עד 450 מ"ל.
- לעקר את הפתרון על ידי עובר דרך מסנן 0.2 מיקרומטר.
- הוסף 10% (50 מ"ל) של נסיוב סטרילי שור העובר.
- הפוך את תא סטרילי בינוני ביניים
- הוסף 13.37 גרם של אבקת DMEM ל 800 מ"ל מים MΩ 18.
- הוסף 3.7 גרם סודיום ביקרבונט.
- הוסף 1% (10 מ"ל) פניצילין / סטרפטומיצין.
- התאם את ה-pH של התמיסה עד 7.2.
- תביא את הפתרון עד 900 מ"ל.
- לעקר את הפתרון על ידי עובר דרך מסנן 0.2 מיקרומטר.
- הוסף 10% (100 מ"ל) של בסרום שור סטרילית.
2. בידוד של עלונים שסתום הלב
- שורש והבלו אבי העורקים מיד בסביבה נקייה מחיידקים מהלב לאחר הקרבה.
- ביסודיות לשטוף את שורש האאורטה דם עם DPBS סטרילי קר. זה הכרחי להסיר את כל מרכיבי הדם מוקדם ככל האפשר להגביל את מותו VEC וזיהום חיידקי. אנטיביוטיקה antimycotics לא מומלץ בשלב זה, שכן הם מזיקים אל VEC.
- בודד עלונים שסתום (3 לכל שסתום) ישירות מן השורש ומכניסים צינורית סטרילית 15 מ"ל חרוטי מלא 12 DPBS קר מ"ל. לנער מספר פעמים כדי להסיר שאריות ולמלא עם DPBS טריים.
- התחבורה בחזרה למעבדה על הקרח.
- בהגיעם במעבדה, במקום מכולה עם הרקמה מתחת למכסה המנוע סטרילית.
3. בידוד של שכבת האנדותל
- מלאו צלחת 35mm סטרילי עם 3mL של פתרון collagenase קר לכל שסתום (3 כרוזים).
- מניחים את כל שלושת עלונים מהצינור 15 מ"ל לתוך צלחת מלאה הפתרון collagenase.
- דגירה הרקמה למשך 5-10 דקות ב 37 ° C.
- בעדינות להסיר את שכבת האנדותל ידי סיבוב משטח סטרילי יבש על פני השטח של העלון. את כיוון הסיבוב ואת כמות להחיל גזירה היא קריטית עבור טוהר המדגם שלך. הסיבוב של ספוגית צריך להיות בכיוון ההפוך לתנועה קווית של היד שלך ליצור גזירה מבוקר. גזירה זה מה מרימה את לתאי אנדותל של הרקמה. כמות הכוח המופעל צריך להיות מספיק כדי להרגיש את ההתנגדות של הרקמה, אבל לא לחדור את הקרום במרתף.
- מדי פעם, להספיג את ספוגית בתוך הפתרון collagenase כדי לסלק תאים הסיבים קצה. לאחר בניקוי תושלם, את המרקם של שכבת האנדותל צריך להרגיש קצת חלק יותר מאשר לפני כן.
- אסוף את ההשעיה תא / collagenase והעברת צינור חדש 15 מ"ל סטרילי.
- צנטריפוגה צינורות ב 1000 סל"ד במשך 5 דקות עד גלולה כל התאים מבודדים לשאוב supernatant. אם לבודד תאים ביניים וכן, לבצע את הפרוטוקול בעוד תאים אלה נמצאים centrifuged.
- הוסף 3 מ"ל של מדיום חזירי האנדותל אל צינורות 15 מ"ל, צנטריפוגה בפעם השנייה, התקשורת לשאוב. זה צנטריפוגה second עוזר לסנן חלק מהחומר לא רצויות כגון סיבים קצה.
- Re-להשעות לתאי אנדותל centrifuged ב 5 מ"ל של מדיום חזירי האנדותל צלחת התאים בבקבוק T-25 מראש מצופה קולגן (שימוש 1 בקבוק לכל צינור צנטריפוגות).
- בואו התאים לגדול לפחות 2-3 ימים לפני שינוי בינוני האנדותל. זה עוזר לתאים להתאושש מאז לחלק את תהליך הבידוד היא קשה למדי התשואה התא עלול להיות נמוך. זה קריטי לתאי המעבר ליד מפגש מאז עיכוב הקשר יכול להוביל שינוי התא.
4. הכנת תבשיל 60 מ"מ התרבות בידוד ספציפיות סייד
- קו 60 מ"מ זכוכית פטרי מנות עם רדיד אלומיניום (2 כוס מנות לכל leafle t). רדיד אלומיניום מסייע להסיר את פרפין, כך צלחת פטרי מזכוכית ניתן לעשות שימוש חוזר עבור isolations אחרים.
- המקום חרוזים פרפין בתוך המנות, כמחצית מלא, כיסוי מעוקר.
- לאחר מעוקר הוא מלא פרפין הוא נמס, להעביר את הרכב המנה על משטח שטוח מגניב. כמו פרפין מתקררת, להקשיח אותו רצון ליצור שכבה כי יתמוך דקירות מחט.
- לאחר 30 דקות, צלחת מעוקרים יכולים לשמש חדר בידוד כדי לשתק את הרקמה העלון.
5. בידוד של שכבת האנדותל לוואי ספציפיות
- הסר את כרוזים מן הצינורות 15ml ומניחים על צלחת מוכן תרבות 60mm לבידוד ספציפי בצד.
- לתפעל את העלון כך שהצד ventricularis היא עם הפנים כלפי מטה על פני השטח פרפין עוזב את הצד fibrosa חשוף. הצמד את הקצוות של העלון כדי לחשוף את שכבת האנדותל.
- מניחים כמה טיפות של collagenase קר על פני השטח (הפונה כלפי מעלה) כל האנדותל דגירה הרקמה למשך 5-10 דקות ב 37 ° C.
- כמו בעבר, בעדינות להסיר את שכבת האנדותל ידי סיבוב משטח סטרילי יבש על פני השטח של העלון. את כיוון הסיבוב ואת כמות להחיל גזירה היא קריטית עבור טוהר המדגם שלך. הסיבוב של ספוגית צריך להיות בכיוון ההפוך לתנועה קווית של היד שלך ליצור גזירה מבוקר. גזירה זה מה מרימה את לתאי אנדותל של הרקמה ולא שום דבר אחר. כמות הכוח המופעל צריך להיות מספיק כדי להרגיש את ההתנגדות של הרקמה, אבל לא לחדור בתוך הרקמה.
- מדי פעם, להספיג את ספוגית בתוך הפתרון collagenase כדי לסלק תאים הסיבים קצה. לאחר בניקוי תושלם, את המרקם של שכבת האנדותל צריך להרגיש קצת חלק יותר מאשר לפני כן.
- אסוף את ההשעיה תא / collagenase והעברת צינור חדש 15 מ"ל סטרילי. ציין סגוליות צד על התווית (כרוזים מן שסתום אותו ניתן ונקווה יחד).
- מעבירים את העלונים לצלחת תרבות חדשה כך שהצד ventricularis נחשפת עכשיו וחזור על שלבים (5.3-5.6).
- לאחר השעיית כל תא / collagenase נאסף, צנטריפוגה צינורות ב 1000 סל"ד עבור 5minutes כדי גלולה כל התאים מבודדים לשאוב supernatant. אם לבודד תאים ביניים וכן, לבצע את הפרוטוקול בעוד תאים אלה נמצאים centrifuged.
- הוסף 3 מ"ל של מדיום חזירי האנדותל אל הצינורות, צנטריפוגה בפעם השנייה, ואת לשאוב התקשורת. זה צנטריפוגה second עוזר לסנן חלק מהחומר לא רצויות כגון סיבים קצה.
- Re-להשעות לתאי אנדותל centrifuged ב 5 מ"ל של מדיום חזירי האנדותל צלחת התאים בבקבוק T-25 מראש מצופה קולאז' (1 להשתמש בבקבוק לכל צינור צנטריפוגות).
- בואו התאים לגדול לפחות 2-3 ימים לפני שינוי בינוני האנדותל. זה עוזר לתאים להתאושש מאז לחלק את תהליך הבידוד הוא קשה למדי. אם אתה מבחין התשואה יהיה נמוך מאוד, שקול להעביר את בקבוקון קטן או צלחת יפה מאז תאים תאים הידבקות מקדם צמיחה התא. זכור המעבר ליד מפגש מאז עיכוב הקשר יכול להוביל שינוי התא.
6. בידוד של תאים ביניים
- מלאו צנטריפוגה סטרילי 15 מ"ל עם שפופרת 10 מ"ל של תמיסת collagenase לכל שסתום (3 כרוזים).
- לאחר שטיפת כרוזים בתאי האנדותל, מיד למקם אותם בצינור 15 מ"ל מתאים עם פתרון collagenase.
- דגירה של כ -12 עד 18 שעות (להתסיס בעדינות אם רוצים).
- מערבבים בעדינות את הרקמה מושפל עם טפטפת סרולוגיות עד ההשעיה תא / collagenase הופך הומוגני. Homogenization זה עוזר לשבור את הרקמות ולשחרר את התאים ביניים.
- צנטריפוגה רקמת מתעכל במשך 5 דקות ב 1000 סל"ד ו לשאוב supernatant.
- הוסף 5 מ"ל בינוני ביניים חזירי את צינורות 15 מ"ל, צנטריפוגה בפעם השנייה, ואת לשאוב supernate.
- Re-להשעות לתאי אנדותל centrifuged ב 5 מ"ל של מדיום חזירי ביניים צלחת התאים T-75 צפחת (1 להשתמש בבקבוק לכל צינור צנטריפוגות).
- בואו התאים לגדול לפחות 1-2 ימים לפני שינוי המדיום הסלולרי ביניים. יהיו פסולת רקמות הרבה יותר מאשר עם לתאי אנדותל, אך זה צפוי. התאים צריכים גם לגדול מהר יותר מאשר מפגש בתאי האנדותל בגלל התשואה התא הטבע שלהם.
7. נציג תמונות

באיור 1. מורפולוגיה של תאים מבודדים בבידוד בבית 2-3 ימים הדואר. (א) VEC מפגינים מורפולוגיה אנדותל טיפוסי הטופס אשכולות כדי לקדם צמיחה. (ב) ויק מורפולוגיה דומה myofibroblasts אשר בדרך כלל ציר בצורת להתפשט באופן שווה על פני הבקבוק.
class = "jove_content"> 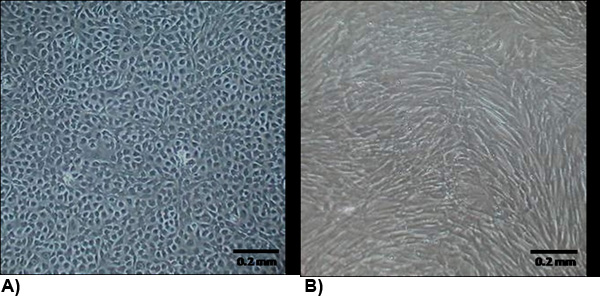
איור 2. מורפולוגיה של תאים מבודדים בבית confluency. (א) VEC מפגינים מורפולוגיה אופיינית האנדותל אשר בדרך כלל המרוצף וקשר צמיחה עכבות. (ב) ויק מורפולוגיה דומה myofibroblasts אשר בדרך כלל בצורת כישור ולא לפנות צמיחה עכבות.
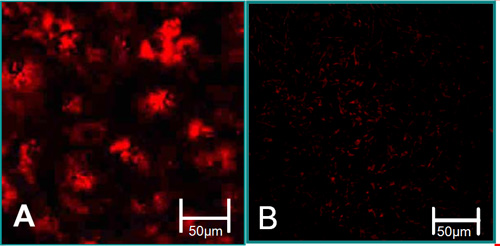
איור 3. המאפיינים פונקציה של תאים מבודדים 6. (א) VEC קשורים עם רמות גבוהות של LDL ספיגת acetylated (אדום). (ב) ויק קשורים עם רמות נמוכות של LDL ספיגת acetylated.
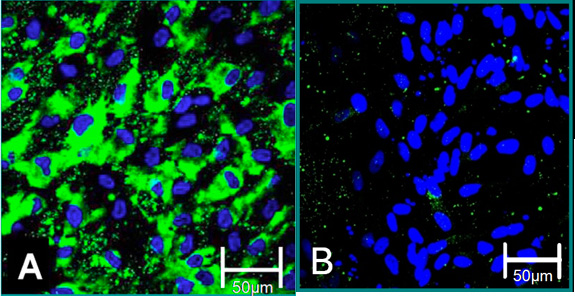
איור 4. סמנים נייד של תאים מבודדים 6. (א) פנוטיפ VEC הוא תרם מכתים חיובית פון Willebrand Factor (ירוק), כחול (גרעינים). (ב) פנוטיפ ויק הוא תרם מכתים שלילי גורם Willebrand פון.
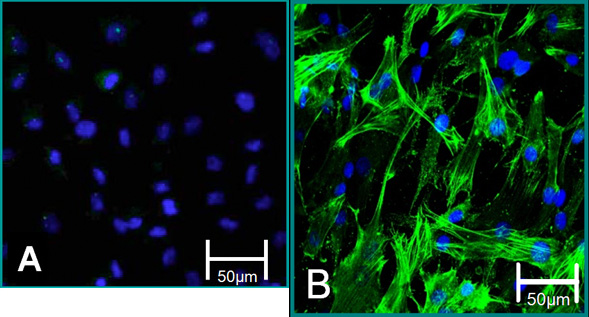
איור 5. סמנים נייד של תאים בודדים. (א) פנוטיפ VEC הוא תרם מכתים שלילי אלפא SMA (ירוק), כחול (גרעינים). (ב) פנוטיפ ויק הוא תרם מכתים חיובית SMA אלפא.
| דיסוציאציה Agent | דיסוציאציה טכניקה | תא אוסף | Cell כמות | תא טוהר | זיהום |
| EDTA (3mm) ללא CaCl 2 | 5, 20, 60 דקות. לפני CaCl 2 בנוסף | 20, 60, 120 דקות. לפני איסוף | - | + / - | + + + |
| EDTA (6 מ"מ) ללא CaCl 2 | 5, 20, 60 דקות. לפני CaCl 2 בנוסף | 20, 60, 120 דקות. לפני איסוף | + / - | + | + + + |
| טריפסין-EDTA (0.5 g / L) | 5, 10, 15 דקות. לפני שחרור משרות | בינוני נאסף מיד | + | + | + + |
| Collagenase II (300 U / mL) | 5, 10, 15 דקות. לפני שחרור משרות | בינוני נאסף מיד | - + + + | - + +, + | + |
| Collagenase II (600 U / mL) | 5, 10, 15 דקות. לפני שחרור משרות | בינוני נאסף מיד | + + +, + + + | + +, + +, - | - |
טבלה 1. תוצאות ראשוניות של פרוטוקולים valvular בידוד תא האנדותל.
Discussion
הבנה של הביולוגיה valvular נפגעה על ידי קשיים טכניים בידוד אוכלוסיות culturing טהור של בתאי האנדותל valvular. טכניקות בידוד אופייניים לערב עיכול אנזימטי של מטריקס הבסיס הבסיסי או כימי דיסוציאציה של אג"ח דבק אנדותל 2,3. ניסויים ראשוניים בידוד איכותית הוערכו על ידי סוכנים ?...
Disclosures
Acknowledgements
מחקר זה נתמך על ידי פרס קריירה NSF, הקרן Hartwell, ואת איגוד הלב האמריקני (# 0830384N).
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Modified Eagle Medium | Mediatech, Inc. | 50-103-PB | |
| Fetal Bovine Serum | GIBCO, by Life Technologies | 26140 | |
| Penicillin Streptomycin | GIBCO, by Life Technologies | 15140-122 | |
| 0.25% Trypsin-EDTA | GIBCO, by Life Technologies | 25200 | |
| Heparin Sodium Salt | Sigma-Aldrich | H4784-1G | |
| Collagenase Type 2 | Worthington Biochemical | LS004176 | |
| DPBS | GIBCO, by Life Technologies | 21300-058 | |
| Rat Tail Collagen | BD Biosciences | 354236 | |
| Critical Swabs | VWR international | 89031-270 | |
| Sodium Bicarbonate | Sigma-Aldrich | 55761 | |
| T25 Flasks | BD Biosciences | 353018 | |
| T75 Flasks | BD Biosciences | 353136 | |
| 24 Well Plate | Falcon BD | 353047 | |
| 60x15 mm Dishes | VWR international | 25384-092 | |
| 60x15 Glass Dishes | VWR international | 89000-310 | |
| Paraffin Embedding Wax | Electron Microscopy Sciences | 19304-01 | |
| Precision Glide Needles | BD Biosciences | 305165 | |
| 500 mL Nalgene Filters | VWR international | 73520-985 | |
| 1L Nalgene Filters | VWR international | 73520-986 | |
| Tissue Forceps | Fine Science Tools | 11023-15 | |
| FSC Tweezers #5 | Fine Science Tools | 11295-00 |
References
- Thompson, R. P., Fitzharris, T. P. Morphogenesis of the truncus arteriosus of the chick embryo heart: the formation and migration of mesenchymal tissue. Am J Anat. 154, 545-556 (1979).
- Johnson, C. M., Fass, D. N. Porcine cardiac valvular endothelial cells in culture: A relative deficiency of fibronectin synthesis in vitro. Lab Invest. 49 (5), 589-598 (1983).
- Manduteanu, I., Popov, D., Radu, A., Simionescu, M. Calf cardiac valvular endothelial cells in culture: production of glycosaminoglycans, prostacyclin and fibronectin. J Mol Cell Cardiol. 20 (2), 103-118 (1988).
- Cheunyg, W. Techniques for isolating and purifying porcine aortic valve endothelial cells. JHVD. 17 (6), 674-681 (2008).
- Paranya, G., Vineberg, S., Dvorin, E., Kaushal, S., Roth, S. J., Rabkin, E., Schoen, F. J., Bischoff, J. Aortic valve endothelial cells undergo transforming growth factor-beta-mediated and non-transforming growth factor-beta-mediated transdifferentiation in vitro. Am J Pathol. 159 (4), 1335-1343 (2001).
- Butcher, J. T., Penrod, A., Garcia, A. J. M., Nerem, R. M. Unique morphology and focal adhesion development of valvular endothelial cells in static and fluid flow environments. Arterioscler Thromb Vasc Bio. 24 (1), 1429-1434 (2004).
- Simmons, C. A., Grant, G. R., Manduchi, E., Davies, P. F. Spatial heterogeneity of endothelial phenotypes correlates with side-specific vulnerability to calcification in normal porcine aortic valves. Circ Res. 96, 792-799 (2005).
- Butcher, J. T., Tressel, S., Johnson, T., Turner, D., Sorescu, G., Jo, H., Nerem, R. M. Transcriptional Profiles of Valvular and Vascular Endothelial Cells Reveal Phenotypic Differences: Influence of Shear Stress. Arterioscler Thromb Vasc Biol. 26, 69-69 (2006).
- Parachuri, S., Yang, J. H., Aikawa, E., Melero-Martin, J. M., Khan, Z. A., Loukogeorgakis, S., Schoen, F. J., Bischoff, J. Human Pulmonary Valve Progenitor Cells Exhibit Endothelial/Mesenchymal Plasticity in Response to Vascular Endothelial Growth Factor-A and Transforming Growth Factor-β2. Circ Res. 99 (8), 861-869 (2006).
- Shi, Q. Evidence for circulating bone marrow-derived endothelial cells. Blood. 92, 362-367 (1998).
- Rehman, J., Li, J., Orschell, C. M., March, K. L. Peripheral blood endothelial progenitor cells are derived from monocyte/macrophages and secrete angiogenic growth factors. Circulation. 107, 1164-1169 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved