Method Article
פרופיל של Methyltransferases ועל אחרים S-Adenosyl- L-הומוציסטאין מחייב חלבונים על ידי ספקטרומטריית מתחם המיסה לכידה (CCMS)
In This Article
Summary
תרכובות לכידת הם מולקולות קטנות trifunctional כדי להפחית את המורכבות של proteome על ידי תפקודית אינטראקציה הפיך מולקולות חלבון קטן ואחריו crosslinking-צילום טיהור. כאן אנו משתמשים מתחם לכידת עם S-Adenosyl- L-הומוציסטאין מחייב כפונקציה סלקטיביות לבודד methyltransferases מ Escherichia coli התא כולו lysate לזהות אותם על ידי MS.
Abstract
יש מגוון של גישות כדי להפחית את המורכבות של proteome על בסיס פונקציונלי של מולקולות חלבון אינטראקציות קטנות כגון זיקה כרומטוגרפיה 1 או חלבון על בסיס פעילות פרופיל 2. תרכובות לכידת Trifunctional (CCS, איור 1 א) 3 הם בסיס לגישה גנרי, שבו שיווי המשקל הראשונית מונחה אינטראקציה בין בדיקה מולקולה קטנה (הפונקציה סלקטיביות, כאן S-adenosyl-L-הומוציסטאין, אדון, איור 1 א) חלבונים היעד הוא קבוע ובלתי הפיך על crosslinking-photo בין פונקציית צילום activable עצמאית תגובתיות (כאן phenylazide) של CC לבין פני השטח של חלבונים היעד. הפונקציה מיון (כאן ביוטין) משמש כדי לבודד את CC - conjugates חלבון מתערובות ביולוגיות מורכבות בעזרת בשלב מוצק (כאן חרוזים streptavidin מגנטי). שתי תצורות הניסויים הם אפשריים: "מחוץ חרוז" 4 או המתואר כיום "על חרוז" תצורה (איור 1B). הפונקציה הסלקטיביות עשויה להיות כמעט כל מולקולה קטנה של עניין (מצעים, מעכבי, מולקולות התרופה).
S-Adenosyl-L-מתיונין (SAM, איור 1 א) היא ככל הנראה, שני ATP, cofactor הנפוץ ביותר בטבע 5, 6. הוא משמש בתור התורם העיקרי קבוצת מתיל בכל היצורים החיים עם התגובה הכימית להיות catalyzed ידי SAM תלויי methyltransferases (MTases), אשר methylate 7-DNA, RNA 8, 9 חלבונים או מולקולות קטנות 10. לאור תפקיד מכריע של תגובות פיזיולוגיות מתילציה בתרחישים שונים (ויסות הגנים, אפיגנטיקה, מטבוליזם), פרופילים של MTases ניתן לצפות להיות חשיבות דומה proteomics פונקציונלי כמו פרופיל של קינאזות. כלים אנליטיים עבור פרופילים שלהם, לעומת זאת, לא היה זמין. אנו הציגה לאחרונה CC עם אדון כקבוצה סלקטיביות למלא את הפער הטכנולוגי (איור 1A).
אדון, תוצר של SAM לאחר העברת מתיל, הוא מעכב ידוע בכלל MTase המוצר 11. מסיבה זו וגם בגלל הטבעית cofactor SAM נמצא בשימוש על ידי אנזימים נוסף העברת חלקים אחרים של cofactor או ליזום התגובות הרדיקלי, כמו גם בגלל חוסר היציבות הכימית שלה 12, אדון הוא פונקציה סלקטיביות אידיאלי CC למקד MTases. כאן אנו מדווחים על השירות של אדון-CC ו CCMS ידי MTases פרופילים אחרים אדון מחייב חלבונים מן DH5α את המתח של Escherichia coli (E. coli), אחד הטובים ביותר, מאופיין פרוקריוטים, אשר שימש המודל המועדף האורגניזם מחקרים ביוכימיים, ביולוגיים ביוטכנולוגיים אינספור. תמונה המופעל crosslinking משפר את התשואה ואת הרגישות של הניסוי, ואת הספציפיות ניתן לבדוק בקלות עבור בניסויים התחרות באמצעות עודף של אדון חינם.
Protocol
1) הכנת E. תא DH5α coli lysate
- לחסן תרבות 2ml (מדיה LB במבחנה א) עם א ' coli DH5α זן ישירות המניה גליצרול לדגור על 37 ° C ו 250 סל"ד במשך 8 ח השתמש בתקשורת LB autoclaved (10 גר '/ ליטר Bacto-tryptone, 5 g / L תמצית שמרים, 10 גרם / L NaCl, pH 7.5).
- לחסן 250 LB התקשורת מ"ל בבקבוק 1 ליטר עם שייקר מתסכל עם התרבות 2 מ"ל ו לדגור על הלילה 37 מעלות צלזיוס ו 166 סל"ד באינקובטור עם שייקר מסלולית.
- לחסן four 5 L צלוחיות עם שייקר מתסכל שכל אחת מהן מכילה 2.5 LB מדיה L עם התרבות 250 מ"ל (50 מ"ל עבור כל בקבוק) ו דגירה התרבויות בשעה 37 ° C ו 166 סל"ד עד 600 OD של 0.8 הוא הגיע.
- קציר התאים על ידי צנטריפוגה ב 4 ° C, 3000X g עבור 20 דקות. בצע המשך הטיפול בבית 0-4 ° C או על קרח.
- Re-להשעות את החומר תא שנקטפו במים מילי-Q, לשלב בסל אחד צנטריפוגה צנטריפוגה דקות ו - 30 נוספים ב 6000x גרם ו - 4 ° C.
- חנות שהתקבל 20 תא חומר גרם ב -20 ° C או -78 ° C.
- Re-להשעות את התאים קרח 100 מ"ל חיץ תא קר הפתיחה (6.7 mM MES, 6.7 mM NaOAc, HEPES 6.7 מ"מ, 1 mM EDTA, 10 mM β-mercaptoethanol, 200 mM NaCl, pH 7.5, 10% (w / v) גליצרול; 0.2 מ"מ PMSF) ו sonicate שלוש דקות 1 בארבעה חלקים 25 מ"ל על הקרח באמצעות sonifier (למשל SONOPULS HD 2070 מ BANDELIN אלקטרוניים GmbH & Co KG, אמפליטודה מקסימאלית, פלט רציף).
- צנטריפוגה lysate מעל בלילה 2370x גרם ו - 2 ° C.
- לרכז את supernatant ל 14 מ"ל ידי ultrafiltration (למשל באמצעות iCON ריכוז, 7 mL/9K, מפירס) בשעה 2370x g ו 2 ° C.
- לרוקן את להתרכז צמיגה מן מולקולות קטנות כמו SAM או אדון על ידי סינון ג'ל על 2 מעלות צלזיוס (למשל זבה עמודות Desalt ספין, 10 מ"ל, מפירס, ארבעה עמודים; חיץ אחסון הוסר ב g 1000x 2 דקות, ארבע פעמים איזון עם 5 מ"ל תא קר קרח פתיחת חיץ חיץ הוסר ב g 1000x 2 דקות, בהתאמה; 3.5 מ"ל להתרכז מוחל על כל עמודה: 45 דקות צנטריפוגה ב g 24x, ואז פעמיים 2 דקות ב g 1000x)
- במוסף lysate וכתוצאה מכך 13 מ"ל עם 13 מ"ל גליצרול קרח קר רוש מיני קוקטייל מעכב פרוטאז טבליות, EDTA חינם. מערבבים לפזר את הלוחות.
- חנות lysate ב -20 ° C
- קבע את ריכוז החלבון הכולל ידי assay ברדפורד (21 מ"ג / מ"ל במקרה הנוכחי). מגיב ברדפורד: 100 מ"ג Coomassie בריליאנט בלו G-250 ב 50 מ"ל אתנול 95%, להוסיף 100 מ"ל חומצה זרחתית 85% (w / v), לדלל את L 1, כאשר צבע נמס לגמרי, לסנן דרך נייר Whatman 1 # רק לפני השימוש.
2) לכידת Assay (A), בקרת תחרות (C), הנפתח (PD), בקרת תחרות של הנפתח (עלות), ו Assay לכידת הנפתח משולב הפלוס (+ PD)
- עבור ניסויים ללכוד, caproKit אדון (caprotec bioanalytics GmbH) שימש, הכוללת את אדון-CC, ללא אדון כמתחרה, streptavidin מצופה חרוזים מגנטיים בקוטר 1 מיקרומטר (Dynabeads MyOne streptavidin C1, Invitrogen Dynal), מאגר ללכוד 5X (CB 5X, המכיל 100 HEPES מ"מ, 250 אצטט mM אשלגן, מגנזיום 50 mM אצטט גליצרול 50%), ולשטוף חיץ 5X (WB 5X, המכיל 250 מ"מ טריס HCl, pH 7.5, 5 mM EDTA, 5 M NaCl, 42.5 מיקרומטר octyl-β-D-glucopyranoside).
- עבור מספר ניסויים במקביל מומלץ להכין תערובת של מים מאסטר, ללכוד חיץ וא coli lysate ולבצע התגובות בתוך צינורות שונים של רצועת μL one-PCR 200 הצינור (מומלץ 0.2 מ"ל Thermo-הרצועה, Thermo Scientific, AB-1114). כאן, כמויות עבור צינור תגובה אחת מקבלים. תוצאות במשך חמישה ניסויים שונים יוצגו, אשר assay ללכוד (A), שליטה התחרות (C), הנפתח (PD), שליטה תחרות של הנפתח (עלות), ו assay ללכוד הנפתח בשילוב הפלוס (+ PD).
- עבור כל תגובה, להכין 1.5 מ"ל 1X WB על ידי הוספת 0.3 מ"ל ל WB 5X 1.2 מ"ל מים מילי-Q.
- הכן אדון-CC טעון streptavidin מצופה חרוזים מגנטיים (caproBeads) ב 200 רצועות μL PCR צינור. לכן, לערבב 25 μL של 100 מיקרומטר אדון-CC עם 50 μL של 10 מ"ג / מ"ל streptavidin מצופה חרוזים מגנטיים עבור כל aliquot, במרץ לנער את המתלים כתוצאה בטמפרטורת החדר למשך 2 דקות כדי לאפשר המחייב של מחצית ביוטין של אדון- עותק כדי streptavidin על פני השטח חרוז המגנטי, לאסוף את החרוזים באמצעות מגנט חזק (למשל ב כמוסות של רצועות צינור PCR השימוש במכשיר caproMagTM מגנטי, caprotec bioanalytics GmbH). בטל supernatants, מחדש להשעות את caproBeads וכתוצאה מכך 200 WB μL, מגנטית לאסוף את caproBeads (ב כמוסות של רצועות צינור PCR), וכן לבטל את WB supernating. צינורות סגור כדי למנוע ייבוש של החרוזים.
- הכן aliquots של כל DH5α E.colilysate תא צינורות חדשים PCR ב 0-4 מעלות צלזיוס באמצעות שילוב הורים (ראה 2.2). לקבלת תגובה אחת, תוספת נפח המים מילי-Q עבור נפח המיקס הסופי תגובת μL 100 עם 20 CB 5X μL. לערבב, להוסיף 0.26 מ"ג E. lysate coli, לערבב בעדינות על ידי היפוך. רק עבור C ו עלות לכל יום, להוסיף 20 מ"מ μL 10 אדון פתרון מתחרה לערבב בעדינות על ידי היפוך (להוסיף מילי-Q מים במקום הפתרון אדון עד, פ"ד, ו - A + PD). צייר מדגם 1 μL מ לניתוח נוסף (ראו בהמשך).
- להשעות את caproBeads ב lysate דגירה בהתאמה עבור 3 שעות ב 4 ° C לשמור את החרוזים ההשעיה על ידי סיבוב כדי לאפשר מחייב הפיך של חלבונים אדון מחייב לפונקציה הסלקטיביות של אדון אדון-CC.
- מניחים את המתלים A, C, ו-A + פ"ד ב caproBoxTM (מכשיר irradiating דגימות ביוכימיים עם האור האולטרה סגול וקירור בעת ובעונה אחת, caprotec bioanalytics GmbH) ו להקרין במשך זמן כולל של 30 דקות בתוך צינורות סגורים בין 0-4 מעלות צלזיוס כדי ליצור crosslink קוולנטיים בין פונקציית התגובה של אדון-CC של חלבונים מחייב אדון. לפיכך, להסיר את המתלים במרווחים לאחר הקרנה של 2.5 דקות, בהתאמה, מן caproBoxTM, מגניב במי קרח למשך 15 ~ s (במיוחד את המכסים), לערבב כמה פעמים על ידי היפוך, זמן קצר מאוד (~ 2 ים) צנטריפוגות כדי להסיר את ההשעיה הנותרים את העפעפיים, ואת המקום בחזרה caproBoxTM עבור מרווח הקרנה הבא.
- הוסף 20 פתרון μL אדון 10 מ"מ, או 20 מילי מים μL-Q ל-C, פ"ד, עלות לכל יום, ו A + פ"ד ו דגירה ההשעיה עבור 10 דקות ב 4 ° C כדי לתפוס, ב, חלבונים אדון מחייב לא crosslinked אל אדון-CC. שמור את החרוזים ההשעיה על ידי סיבוב ידני או על ידי לסירוגין מחדש את ההשעיה.
- אסוף את caproBeads מן השעיות באמצעות מגנט חזק (למשל caproMagTM), לבטל את supernatants, ולשטוף את החרוזים שש פעמים - על ידי השעיית מחדש ואיסוף - עם 200 μL 1X WB ופעם עם 200 מילי מים μL-Q.
- החרוזים ניתן לאחסן מים מילי-Q במשך מספר שבועות ב 4 ° C. פרוטוקולים אלטרנטיביים קיימים לעיבוד נוסף של חלבונים שנתפסו וזיהוי שלהם (ראה דיון).
- שטפו את החרוזים שלוש פעמים עם אצטוניטריל 200 60% μL (ACN) ולשחרר את החלבונים שנתפסו מן החרוזים על ידי הדגירה 10 דקות בטמפרטורת החדר תחת נמרץ רועד חומצה 200 60% μL trifluoroacetic ACN/0.2% (TFA) (להכין טרי) . השתמש LC-MS-כיתה ריאגנטים ומים.
- מגנטית לאסוף את החרוזים, נפרד לאדות את supernatant כדי יובש באמצעות המאייד צנטריפוגלי (למשל concentrator MiVac דנ"א GeneVac, Inc, בריטניה). מחק את החרוזים.
3) SDS-PAGE של חלבונים Captured
- עבור עמוד SDS, לפרק את החלבונים שנתפסו שוחררו מן חרוזים מגנטיים (התאדה ACN / TFA פתרונות משלב 2.12) במאגר 20 SDS μL המדגם (50 mM טריס HCl, 320 β-mercaptoethanol מ"מ, SDS 2.5%, 0.05% bromophenol כחול , 10% גליצרול, pH 6.8). מערבבים את המדגם 1 μL שנשאבו (ראה שלב 2.5) עם חיץ 19 SDS μL מדגם; להשתמש 5 μL של פתרון זה עבור ניתוח SDS-PAGE (0.25% assay). מחממים את דגימות דקות SDS חיץ מדגם 10 עד 95 ° C ולתת להתקרר לטמפרטורת החדר.
- ניתוח על ידי SDS-PAGE (ההגדרה הגנרית: OLS ® ProPage 4-20% טריס / גליצין מראש יצוק ג'לים; OLS OmniPage אלקטרופורזה מיני מערכת ג'ל; חיץ SDS ריצה: 25 מ"מ טריס הבסיס, 200 מ"מ גליצין, 0.1% SDS, ה-pH 8.3 ; לרוץ 90 דקות זמן במתח קבוע של 180 V תחת קירור קרח של המאגר פועל SDS).
- כסף הכתם ג'ל באמצעות שיטה כסף תואם MS כתם (למשל ProteoSilver ערכת כסף הכתם מן סיגמא). התוצאה נציג מוצג באיור 2.
4) ב-Digest Tryptic ג'ל של פפטיד חלבונים הפקת מלהקות ג'ל
- שטפו את הג'ל מוכתם כסף לפחות שלוש פעמים במים 100 מילי-Q מ"ל עבור 10 דקות לאחר פתרון כתם כסף להפסיק הוסר.
- חותכים את רצועות ג'ל (למשל באמצעות אזמל נקייה ולהעביר לתוך צינור 0.5 Eppendorf מ"ל) ולאחסן ב -20 ° C או ישירות התהליך. שטפו את להקות ג'ל במשך 15 דקות, בהתאמה, עם מים μL 100, 100 אתנול 50% μL, 100 μL מים, 100 אתנול 50% μL, ובמשך 5 דקות עם אתנול טהור. חזור על נוהל זה כביסה שוב.
- Re-מימה הלהקה ג'ל עם μL 10 ב-ג'ל פתרון העיכול (12.5 ng / μL רצף טריפסין כיתה אמוניום ביקרבונט 50 מ"מ, מכינים על ידי הוספת 7.5 מיקרוגרם μL 0.5 / פתרון טריפסין μL ב 1 mM HCl עד 292.5 50 mM אמוניום ביקרבונט μL ) במשך 45 דקות ב 4 ° C. הסר את supernatant ולהחליף ידי 20 μL ביקרבונט 50 מ"מ אמוניום (ללא טריפסין) ואחריו הדגירה על 37 ° C במשך הלילה תוך כדי רעד.
- אסוף את supernatant. להפקת פפטיד, דגירה הלהקה ג'ל עם חומצה פורמית μL 20 5% (FA) במשך 15 דקות תוך כדי רעד, להוסיף20 ACN μL וטופחו במשך 15 דקות אחר תוך רעד. מערבבים את supernatant עם supernatant הקודמת לחזור על התהליך מיצוי פפטיד שוב.
- להתאדות המשולב three supernatants עד יובש, מתמוססים FA 10 5% μL בעוד רועד ויישום אולטרסאונד (אמבטיה אולטרסאונד, למשל Sonorex מ Bandelin, גרמניה) להמשיך עם desalting (5.2 צעד ועוד).
5) תקציר Tryptic של חלבונים נתפסה הכנה של פפטידים עבור LC-MS/MS
- ממיסים את החלבונים שנתפסו שוחררו מן חרוזים מגנטיים (התאדה ACN / TFA פתרונות משלב 2.12) ב 10 μL אמוניום ביקרבונט 50 mM באמצעות אמבט אולטרסאונד vortexing, להוסיף 1 μL 0.5 מיקרוגרם / טריפסין μL ב 1 mM HCl ו דגירה על הפתרון 37 ° C במשך הלילה.
- Desalt הפתרון הכולל את פפטידים tryptic של חלבונים שנתפסו באמצעות חומר C18 (למשל 2-10 StageTips μL, 20 טיפ μL, Proxeon Biosystems A / S, אודנסה, דנמרק, הליך של היצרן: טרום מצב עם מתנול 10% μL 50 / 5 FA%, לאזן עם FA 10 μL 5%, עם עומס של חלבונים ופפטידים בשבי, לשטוף עם FA 10 5% μL, elute פעמיים עם מתנול 10 μL 50% / FA 5%).
- לאדות את פפטידים desalted ב מתנול 50% / FA 5% עד יובש, מתמוססים FA 5.5 0.1% בעוד μL רועד ויישום אולטרסאונד (אולטרסאונד אמבטיה) ולנתח את הדגימה על ידי nanoLC-MS/MS.
6) ניתוח NanoLC-MS/MS
- העברת דגימת לתוך צלחת מדגם צלחת מקום לתוך כרומטוגרפיה ננו זרימת הנוזל (nanoLC) מערכת (למשל כרומטוגרפיה nLC Easy-מערכת נוזלי; Proxeon Biosystems A / S, דנמרק).
- השתמש FA 0.1% במים כשלב ניידים ו 0.1% ב-FA ACN כמו ניידים שלב ב 'השתמש רק LC-MS ממיסים כיתה.
- טען 5 μL הפתרון פפטיד ישירות על גבי מראש עמודה (ביוספרית nanoflow למשל C18, 5 מיקרומטר, 120 א ', 20 x 0.1 מ"מ; NanoSeparations, הולנד) מצמידים את הטור אנליטית (ביוספרית nanoflow למשל C18, 5 מיקרומטר, 120 Å , 100 x 0.075 מ"מ; NanoSeparations, הולנד) באמצעות 5% FA ACN/0.1%.
- במהלך LC, פפטידים elute הדרגתי במהלך 80 דקות ליניארי בין 5% FA ACN/0.1% עד 40% FA% ACN/0.1 ואחריו 2 דקות נוספות 100% ACN/0.1 FA% הנותרים ב 100% ACN/0.1% FA 8 דקות אחר עם קצב זרימה מבוקרת של 400 NL / min.
- בצע spectrometric מסה (MS) ניתוח של פפטידים eluted על דיוק גבוהה המדינה-of-the-art ספקטרומטר מסה (למשל LTQ Orbitrap XL ספקטרומטר מסה: Thermo FisherScientific, גרמניה, מצויד מקור nanoelectrospray יון עבור יינון electrospray (ESI); Proxeon Biosystems A / S, דנמרק).
- ביצוע ניתוח spectrometric המונית במצב נתונים תלויי כדי לעבור באופן אוטומטי בין Orbitrap-MS (מצב פרופיל) ו LTQ-MS/MS (מצב centroid) הרכישה.
- הפיקוח על ספקטרומטר מסה מחזור ידי הגדרת זמן הזרקה אוטומטית לצבור שליטה.
- רוכשת סקר מלא לסרוק MS ספקטרה (מ m / z 300-2000) ב Orbitrap עם רזולוציה r = 60000 ב m / z 400 (לאחר צבירת ערך יעד של 500,000 חיובים במלכודת יון ליניארי).
- הגדר את מכשיר ברצף לבודד את היונים אינטנסיבי ביותר (עד חמישה, תלוי בעוצמת האות) עבור פיצול במלכודת יון ליניארי באמצעות התנגשות-Induced דיסוציאציה (CID) לפי שווי היעד של 10,000 חיובים. יונים שבר כתוצאה נרשמות LTQ.
- עבור מדידות מסה מדויק במצב MS, השתמש טעונה ביחידים polydimethylcyclosiloxane רקע יון (Si (CH 3) 2 O) 6 H + (m / z 445.120025) שנוצר בתהליך electrospray מהאוויר הסביבה כמו המסה לנעול זמן אמת פנימית recalibration.
- דינאמי להוציא יונים היעד כבר המוני שנבחרו CID למשך 60 s.
- הגדרת המדינה תשלום ההקרנה ודחייה של יונים עבור CID עם מטען לא מסומנים.
- יתר על הגדרות spectrometric מסה הן כדלקמן: להגדיר מתח ספריי ל -1.6 kV, טמפרטורה להגדיר העברת נימי מחומם ל -200 ° C, אנרגיה התנגשות מנורמל היא 35% עבור MS 2. האות המינימלי הנדרש עבור MS 2 הוא 500 סופר. החלת ההפעלה q = 0.25 ואת זמן ההפעלה של 30 מילישניות עבור MS 2 רכישות.
- כדי לנקות את מערכת LC, בצע אחת לרוץ ריק בין שתי המדידות CCMS רצופים.
7) פפטיד, חלבון זיהוי רצף באמצעות חיפוש אוטומטי מסד נתונים
- השתמש אלגוריתם זיהוי חלבון לנתח את MS / MS הנתונים (במקרה הנוכחי מאוחסנים קבצים גלם), SEQUEST למשל מיושם BioworksBrowser 3.3.1 SP1 (Thermo FisherScientific, גרמניה) X! טנדם (הארגון העולמי מכונת Proteome; גרסה 2007.01.01.1) מיושם Scaffold 3 התוכנה (גירסה Scaffold_3_00_03, Proteome Software Inc, ארה"ב).
- בצע חיפוש באתר אוטומטיות נגד UniProtKB האחרונה / שוויצרית Prot לשחרר www.expasy.org מסד הנתונים של האורגניזם נחקר (מסד נתונים המשמש המחקר הנוכחי: Escherichia coli, זן K12, לשחרר 57-11).
- השתמש את ההגדרות הבאות עבור מסד הנתונים באופן אוטומטי חיפוש בתוך SEQUEST: 5 עמודים לדקה מבשר סובלנות, 1 יון האמו סובלנות שבר, וספציפיות טריפסין מלא המאפשר עד שני השסעים החמיץ. אפשר גם זירחון שינויים משתנה על סרין, תראונין, ו טירוזין; חמצון methionines; deamidation ב asparagines ו גלוטמין; acetylation ב ליזין סרין; formylation ב ליזין, מתילציה ו ב ארגינין, ליזין, סרין, תראונין, ו asparagine. אין להשתמש שינויים קבועים לחפש במאגר.
- טען SRF או DTA והחוצה קבצים שנוצרו על ידי SEQUEST לתוך הפיגום 3, אשר מבצעת הערכת ההסתברות של מטלות פפטיד והזדהויות החלבון על ידי שילוב SEQUEST ו X! חיפושים טנדם מסד הנתונים. הפיגום שימושי בקלות להשוות באופן חזותי רשימות מתוך חלבון מספר דוגמאות (במקרה הנוכחי A, C, פ"ד, עלות לכל יום, ו A + PD).
- הגדר את הפרמטרים בתוך התוכנה הפיגום 3 לשקול פפטידים רק בהסתברות ≥ 95% כפי שצוין על ידי אלגוריתם הנביא פפטיד (ref.13). הגדרת הזיהוי הסתברויות חלבון למשימות פפטיד מרובים 95% ≥ לפי האלגוריתם חלבון הנביא 13. עבור ההזדהויות חלבון יחיד פפטיד, להגדיר באופן שרירותי הסתברות חלבון ≥ 50% באופן ידני לבדוק את הספקטרום המתאים MS / MS פפטיד. החלבונים המרכיבים פפטידים דומה ולא יכול להיות מובחן על סמך ניתוח MS / MS לבד מקובצים על ידי התוכנה כדי לספק את העקרונות של חסכנות. שיעור הגילוי המשוער שווא של ההזדהויות הפפטיד ניתן לקבוע באמצעות נתונים הפוכים גישה חלבון יש <1%.
- נציג תוצאות של ניסויים CCMS ניתנות טבלאות 1, 2 ו טבלה משלים S1 (לזכור כי מסד הנתונים של חלבון אינו מעלה עדכני עבור חלבונים מסוימים, למשל PrmB (aka YfcB) או RsmH (aka MraW)), כמו גם כמו באיור 3.
8) נציג תוצאות
טבלה 1:
| חלבון | ORF | MW / kDa | תאור | התשתית | ג | פ"ד | עלות לכל יום | + פ"ד | |
| DCM | b1961 | 53.5 | ה-DNA ציטוסין MTase | DNA (m5C) | 1 | 0 | 0 | 0 | 1 |
| RlmI | b0967 | 44.4 | 23S rRNA m5C1962 MTase | rRNA (m5C) | 17 | 0 | 17 | 0 | 20 |
| RlmL | b0948 | 78.9 | 23S rRNA m2G2445 MTase | rRNA (m2G) | 12 | 0 | 0 | 0 | 10 |
| TrmB | b2960 | 27.3 | tRNA (גואנין-N (7) -)-MTase | tRNA (m7G) | 11 | 0 | 0 | 0 | 13 |
| CmoA | b1870 | 27.8 | tRNA (cmo5U34)-MTase | tRNA (mcmo5U) | 7 | 0 | 0 | 0 | 4 |
| RsmG | b3740 | 23.4 | 16S rRNA m7G MTase | rRNA (m7G) | 6 | 0 | 1 | 0 | 5 |
| RsmH | b0082 | 34.9 | 16S rRNA m4C1402 MTase | rRNA (m4C) | 5 | 0 | 0 | 0 | 7 |
| RsmD | b3465 | 21.7 | 16S rRNA m2G966 MTase | rRNA (m2G) | 2 | 0 | 0 | 0 | 2 |
| RsmB | b3289 | 48.3 | 16S rRNA m5C967 MTase | rRNA (m5C) | 1 | 0 | 0 | 0 | 0 |
| MnmC | b2324 | 74.4 | חלבון bifunctional כולל tRNA (mnm (5) s (2) U34)-MTase | tRNA (mnm5s2U) | 1 | 0 | 0 | 0 | 0 |
| PrmB | b2330 | 35.0 | שנות ה -50 חלבון ריבוזומלי L3 Gln150 MTase | חלבון (Gln) | 13 | 0 | 0 | 0 | 15 |
| שר | b1884 | 32.8 | Chemotaxis MTase חלבון | חלבון (Glu) | 0 | 0 | 0 | 0 | 1 |
| CFA | b1661 | 44.9 | Cyclopropane שומניות פוספוליפידים-acyl-synthase | מולקולה קטנה | 15 | 0 | 0 | 0 | 14 |
| תם | b1519 | 29.0 | חוצה aconitate 2-MTase | מולקולה קטנה | 2 | 0 | 0 | 0 | 3 |
| CysG | b3368 | 50.0 | Synthase Siroheme כולל uroporphyrinogen III-C-MTase | מולקולה קטנה | 1 | 0 | 0 | 0 | 2 |
| SmtA | b0921 | 29.8 | חלבון smtA | (?) | 7 | 1 | 0 | 0 | 8 |
| MtnN | b0159 | 24.4 | 5'-Methylthioadenosine / אדון nucleosidase | מולקולה קטנה ב | 36 | 0 | 0 | 0 | 39 |
| GlnA | b3870 | 51.9 | גלוטמין synthetase | מולקולה קטנה ג | 90 | 0 | 0 | 0 | 97 |
| RplK | b3983 | 14.9 | שנות ה -50 חלבון ריבוזומלי L11 | חלבון MTase PrmA ד | 2 | 0 | 0 | 0 | 2 |
לא (לגמרי) מאופיין
ב אין מתילציה אבל המחשוף של האג"ח glycosidic של אדון
ג אין מתילציה אבל המחייב של אדון לתוך האתר מחייב ATP כפי שמוצג על ידי ניסויים CCMS עם ATP כמתחרה (מידע לא מוצג)
ד התשתית של ה -50 חלבון ריבוזומלי L11 MTase PrmA; זיהוי ספציפי לשחזור על ידי CCMS (מידע לא מוצג)
טבלה 1: MTases וחלבונים נבחרים אחרים שזוהו על ידי ניסויים CCMS. המספרים מציינים את מספר נתון פפטיד unweighted ספקטרלי לכל חלבון. דוגמאות הן כפילויות של אלה נותחו על ידי SDS-PAGE/silver כתם באיור 2. MTases הרבה יותר ושאר חלבונים מחייב אדון מזוהות assay CCMS (A) לעומת הנפתח (PD) וספציפיות אדון מוצג על ידי היעדר כמעט מוחלט של החלבונים האלה שולטים על התחרות (C).
טבלה 2:
| ג | פ"ד | עלות לכל יום | + פ"ד | ||
| 111 (64) | |||||
| ג | 65 (41) | 107 (46) | |||
| פ"ד | 25 (15) | 23 (13) | 61 (17) | ||
| עלות לכל יום | 23 (13) | 22 (12) | 20 (14) | 47 (14) | |
| + פ"ד | 87 (61) | 64 (41) | 23 (14) | 22 (12) | 124 (67) |
לוח 2: סך של חלבונים שזוהו פועל CCMS חפיפה בין החלבון מפעילה את. מספר חלבונים המזוהים עם לפחות 2 פפטידים ניתנים בסוגריים. שחזור גבוהה של השיטה ניתן להסיק את החפיפה חלבון גבוהה (חלבונים נוקבים בעיקר) בין ניסויים דומים (לעומת C ו במיוחד לעומת A + פ"ד אלא גם פ"ד לעומת עלות לכל יום) במיוחד עם חלבונים המזוהים עם וחסונה לפחות 2 פפטידים. ראה גם איור 3 עבור דיאגרמות ון ולוח S1 משלים עבור רשימה של כל החלבונים שזוהו.
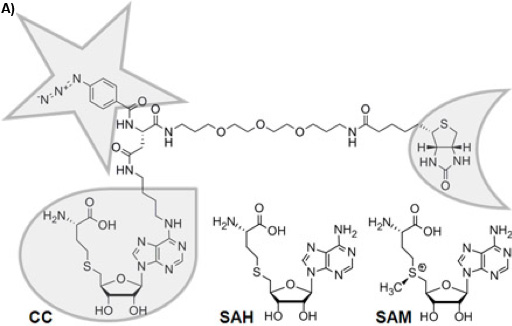
איור 1 א: המבנה הכימי של מגרש לכידת trifunctional (CC). הפונקציה סלקטיביות היא ממוסגרת עם אגל, הפונקציה תגובתיות עם כוכב, והפונקציה מיון עם חצי ירח. יציב מבחינה כימית S-adenosyl-L-הומוציסטאין (אדון) הוא מוצר cofactor של S-adenosyl-L-מתיונין (SAM) לאחר העברת קבוצת מתיל ידי SAM תלויי MTases, אשר אדון משמש מעכב מוצר.
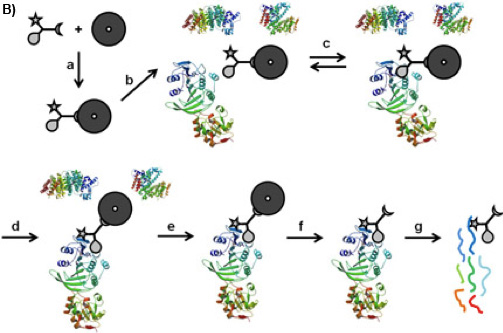
1B איור: CCMS "עלחרוז "זרימת עבודה. CC מחויבת על חרוזים מגנטיים ידי פונקציית המיון שלה (א), caproBeads יצרו כך מודגרת עם תערובת חלבונים מורכבים (ב), שבו שיווי משקל מחייב הפיך (ג) שנוצר בין הפונקציה הסלקטיביות של עותק ואת החלבונים היעד. עם קרינה UV (ד), הפונקציה תגובתיות טפסים crosslink קוולנטיים. אחרי שטיפת חרוזים מגנטיים הנושאת את החלבונים בשבי (ה), המחשוף של CC-חלבון מתחמי crosslinked מן חרוזים מגנטיים (ו) ו tryptic לעכל (ז), חלבונים כבשו ניתן לזהות על ידי ניתוח MS של פפטידים tryptic.
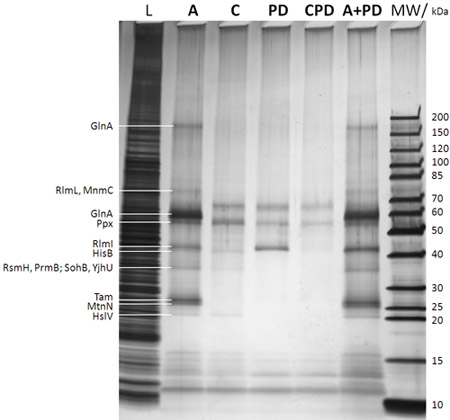
איור 2: SDS-PAGE/silver ניתוח כתם של חלבונים שנתפסו (לאחר f צעד 1B איור). התיאור נתיב ניתנת על גבי הג'ל (MW: סמן משקל מולקולרי עם משקולות מולקולרית המקביל הלהקות סמן ניתנה זכות מאוד; L: מדגם 0.25% שנשאבו lysate DH5a E. coli תא שלם לפני הוספת caproBeads בשלב ב 'ב 1B איור;: assay עם תוספת של עודף של אדון חופשי לאחר שלב ד קרינה UV ב 1B איור: C: שליטה assay כולל עודף של אדון חינם כמתחרה במהלך השלבים C ו-D ב 1B איור (חיוני כדי לקבוע כל אי - דיוק חלבונים שנתפסו); פ"ד: משמעות הנפתח אין קרינה UV שלב ד ב 1B איור ללא תוספת תשלום אדון, עלות לכל יום: שליטה הנפתח באמצעות אדון כמתחרה; A + פ"ד: assay הנפתח בשילוב בתוספת שום משמעות בנוסף של אדון חינם במהלך העבודה). החלבונים שזוהו על ידי MS מ לגזור את רצועות ג'ל חלבון לאחר ב-ג'ל לעכל tryptic ניתנים leftt מאוד. ברור כי צילום crosslinking משפר את התשואה ואת הרגישות של הניסוי, ואת הספציפיות ניתן לבדוק בקלות עבור בניסויים התחרות באמצעות עודף של אדון חינם. ראה לוח 1 עבור MTases וחלבונים נבחרים אחרים שזוהו על ידי ניסויים CCMS של דגימות כפולות מאלה שמוצג בתרשים הנוכחי.

איור 3: דיאגרמות ון explaning החפיפה של חלבונים שזוהו assay CCMS (A), שליטה על התחרות (C), ו הנפתח (PD). משמאל: מספר MTases ו nucleosidase אדון, רק, בהתייחסו טבלה 1. מימין: מספר כל החלבונים שזוהו בהתייחסו לוח 2 לוח S1 משלים. מספר חלבונים המזוהים עם לפחות 2 פפטידים ניתנים בסוגריים.
Discussion
אמצעי הזהירות הבאים והערות עשוי להיות שימושי כאשר בעקבות פרוטוקול תיאר: א) היתרון העיקרי של CCS טמון ביצירת קשר קוולנטי בין CC לבין MTase, כמו זה היתרי התנאים הבאים כביסה מחמירים. Crosslink קוולנטיים מושגת על ידי photoreaction מופעלות על ידי אור אולטרה סגול (310 ננומטר מקסימום.). אור המנורה רגיל מכיל רק חלק קטן של UV, לעומת זאת, להגן על אדון-CC מחשיפה עוד תקורה או אור השמש אפילו עד הקרנה מבוקרת מקורר caproBox. ב) דגימות ביולוגיות שממנו MTases הם להיות מבודדים עשויים להכיל חלבונים נוטים denaturation, ולכן זו חובה לשמור על הדגימות קריר להימנע מקציפים בכל עת. ג) caproBox מתקרר דגימות כדי 0-4 מעלות צלזיוס, המנורות פולטות אור UV, אך גם פולטים חום. לכן יש צורך בקצרה צנטריפוגות מבחנות לפני ההקרנה, ולכן חלבונים דבקות כמוסות או קירות הבקבוקון לא יכול להיווצר משקעים זרעים. ד) מחדש את ההשעיה של חרוזים מגנטיים (למשל הפתרונות לשטוף) לא ניתן יד, זמן קצר חלה אולטרסאונד על ידי הצבת דגימות לאמבטיה אולטרסאונד. ה) טרי להכין את הפתרון 0.2% ACN TFA/60%. מצאנו כי אחרת את החלבונים שנתפסו לא יכול להיות ביקע מן החרוזים. ו) בסופו של חלבונים שנתפסו מתבצעת על ידי LC-MS/MS. ספקטרומטריית מסה היא שיטה רגישה מאוד. זה הכרחי להשתמש ריאגנטים בלעדי LC-MS כיתה השלבים הסופיים (2.11 צעד ועוד). הימנע זיהום של ניסויים על ידי מקורות חלבון חיצוני, קרטין כגון אבק או שמקורם מן הנסיין. במיוחד במהלך השלבים העיכול הסופי, מומלץ לשים לב שטח עבודה נקי, ללבוש כפפות וחלוק מעבדה ואולי רשת שיער או באופן אידיאלי לבצע את השלבים הסופיים מתחת לספסל נקי. הכן את 50 mM אמוניום ביקרבונט המאגר משמש לעיכול tryptic במים MS LC כיתה, דרך מסנן 0.22 מיקרומטר, חנות לסנן, aliquot ב -20 ° C, ולהשתמש בכל aliquot רק פעם אחת, כדי למנוע זיהומים. הפתרון טריפסין (סידור כיתה, רוש, להכין 0.5 מיקרוגרם / פתרון μl ידי הוספת 1 mM HCl כדי lyophilized טריפסין) ניתן לאחסן 4 ° C למשך מספר שבועות. ז) כדי לקבל ספקטרום המוני אמין חיוני יש לרסס יציב בניתוח ESI-MS/MS. ח) עבור מערכות LC-MS/MS שונה מזו השתמשו במחקר הנוכחי, מדידת פרמטרים אלגוריתמים לזיהוי פפטידים חייב להיות מותאם באופן אינדיבידואלי.
את השינויים הבאים הם אפשריים ביחס פרוטוקול המתואר:) לחילופין כדי לשחרר את החלבונים מן החרוזים ידי TFA 60% ACN/0.2% (שלב 2.11), חלבונים ניתן ישירות מתעכל tryptically בתוך ההשעיה חרוז (כרכים זהה בשלב 5.1) או, SDS-PAGE, חלבונים ניתן שפורסמו על ידי השעיית וחימום החרוזים שנאסף לאחר שלב 2.9-95 מעלות צלזיוס למשך 10 דקות במאגר מדגם SDS (שניהם, את ההשעיה כולו או רק את supernatant ניתן לטעון לכיס ג'ל). מצאנו כי החרוזים לאט לשחרר כמויות קטנות של הפולימר לתוך בתמיסה מימית לעכל tryptic במהלך לעכל על חרוז tryptic גם לאחר מספר צעדים לשטוף מימית. זיהום פולימר מפריע זיהוי הפפטיד MS וניתן לשטוף את החרוזים באמצעות ACN 80% (לפחות שלוש פעמים). לאחר השלבים לשטוף 80% ACN, החרוזים יש לשטוף מיד עם מים לפני לעכל על חרוז tryptic. ב) כתמים המערבי באמצעות streptavidin-horseraddish peroxidase ואת המצע ECL יכול לשמש גם כדי להמחיש crosslinking מוצלח של CC ביוטין המכיל את החלבונים. לכן, גם הג'ל המתקבל לאחר שלב 3.2 ניתן מחק או, כי הרגישות היא על פי 10 גבוה יותר מאשר צביעת כסף של ג'לים, 10 דגימות μl אחרי צעד 2.7 עשוי גם להיות מנותח על ידי כתם המערבי. Mind כי במקרה האחרון חלבונים biotinylated endogeneously יהיה גם זוהה מלבד החלבונים biotinylated באופן מלאכותי על ידי אדון-CC. ג) מצאנו כי זה תלוי במערכת מיוחדת (lysate, התייחס חלבונים היעד, סלקטיביות ותפקוד תגובתיות של CC הוא), האם "off-חרוז" תצורה, שם את התגובה crosslinking מתרחש בין CC חופשית חלבון בתמיסה 4 או המתואר כיום "על חרוז" תצורה (איור 1B) מבצעת טוב יותר.
באופן כללי, השיטה צריכה גם להיות תואם עם כל מדינה-of-the איזוטופ יציב אמנות החלבון או הפפטיד תיוג הטכנולוגיה, או הערכה של המדגם ללכוד על ידי ג'ל אלקטרופורזה 2D. ב התצורה "off-חרוז", אפשר גם ללכוד חלבונים בתוך תאים שלמים (תוצאות לא פורסם). יתר על כן, התרופה או אתר cofactor מחייב של חלבון יכול להיות שתוארו על ידי קביעת עמדה מקרוב על ידי crosslinking של CC בתוך רצף החלבון על ידי רצף הפפטיד MS. מצב המחייב של מולקולה קטנה לחלבון ניתן לחקור באמצעות ג שונהמצורף עמדות hemical על הפונקציה סלקטיביות, והמקשר באורכים שונים. כפי שמוצג במחקר הנוכחי, גם שותפים חלבון מחייב של חלבונים פנה ידי הפונקציה סלקטיביות (RplK כמו המצע של PrmA) או לא ידוע חלבון קטן מולקולה אינטראקציות (אדון על GlnA) ניתן לזהות. סיכם, תכונה נוספת של CCS, תגובתיות צילום crosslinking, מאפשר בידוד וזיהוי של חלבונים בשפע נמוך או משפחות חלבון פונקציונלי מתערובות חלבון מורכב עם רגישות גבוהה ומספקת למדענים כלי נוסף ללימוד מולקולה קטנה - אינטראקציות חלבון .
Disclosures
Acknowledgements
עבודה זו נתמכה על ידי ארגון Human תוכנית Frontier Science (פרס HFSP 2007, RGP0058/2007-C). אנו מודים פרופ 'ריצ'רד רוברטס ליזום את הפרויקט לדיונים פוריים.
Materials
| Name | Company | Catalog Number | Comments |
| SAH caproKit™ | caprotec bioanalytics GmbH | 1-1010-050 (50 reactions) 1-1010-010 (10 reactions) | Includes the SAH-CC, SAH competitor, streptavidin coated magnetic beads, capture buffer, and wash buffer |
| caproBox™ | caprotec bioanalytics GmbH | 1-5010-003 (110 V) 1-5010-004 (230 V) | For reproducible photo-activation while cooling the samples |
| caproMag™ | caprotec bioanalytics GmbH | 1-5100-001 | For easy handling of magnetic particles without pipetting |
References
- Katayama, H., Oda, Y. Chemical proteomics for drug discovery based on compound-immobilized affinity chromatography. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 855, 21-27 (2007).
- Barglow, K. T., Cravatt, B. F. Activity-based protein profiling for the functional annotation of enzymes. Nat. Methods. 4, 822-827 (2007).
- Koster, H., Little, D. P., Luan, P., Muller, R., Siddiqi, S. M., Marappan, S., Yip, P. Capture compound mass spectrometry: a technology for the investigation of small molecule protein interactions. Assay Drug Dev. Technol. 5, 381-390 (2007).
- Dalhoff, C., Hueben, M., Lenz, T., Poot, P., Nordhoff, E., Koster, H., Weinhold, E. Synthesis of S-Adenosyl-L-homocysteine Capture Compounds for Selective Photoinduced Isolation of Methyltransferases. ChemBioChem. 11, 256-265 (2010).
- Lu, S. C. S-Adenosylmethionine. Int. J. Biochem. Cell. Biol. 32, 391-3952 (2000).
- Cantoni, G. L. Biological methylation: selected aspects. Annu. Rev. Biochem. 44, 435-451 (1975).
- Jeltsch, A. Beyond Watson and Crick: DNA methylation and molecular enzymology of DNA methyltransferases. ChemBioChem. 3, 274-293 (2002).
- Chow, C. S., Lamichhane, T. N., Mahto, S. K. Expanding the nucleotide repertoire of the ribosome with post-transcriptional modifications. ACS Chem. Biol. 2, 610-619 (2007).
- Grillo, M. A., Colombatto, S. S-Adenosylmethionine and protein methylation. Amino Acids. 28, 357-362 (2005).
- Fujioka, M. Mammalian small molecule methyltransferases: their structural and functional features. Int. J. Biochem. 24, 1917-1924 (1992).
- Borchardt, R. T., Salvatore, F., Borek, E., Zappia, V., Williams-Ashman, H. G., Schlenk, F. . The Biochemistry of S-Adenosylmethionine. , 151-171 (1977).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S-adenosyl-l-methionine. Biochemistry. 25, 4444-4449 (1986).
- Keller, A., Nesvizhskii, A. I., Kolker, E., Aebersold, R. Empirical statistical model to estimate the accuracy of peptide identifications made by MS/MS and database search. Anal. Chem. 74, 5383-5392 (2002).
- Nesvizhskii, A. I., Keller, A., Kolker, E., Aebersold, R. A statistical model for identifying proteins by tandem mass spectrometry. Anal. Chem. 75, 4646-4658 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved