A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סינפסות כימות: Assay Immunocytochemistry מבוססי לכמת מספר סינפסה
In This Article
Summary
פרוטוקול זה מפרט כיצד לכמת את מספר הסינפסות הן בתרבות העצבית הפרידו בסעיפים המוח באמצעות immunocytochemistry. שימוש ספציפי תא נוגדנים, אנו תווית מסופי presynaptic כמו גם באתרים של התמחות postsynaptic. אנו מגדירים סינפסות כנקודות של colocalization בין האותות שנוצר על ידי סמנים אלה.
Abstract
אחת המטרות החשובות ביותר בחקר המוח היא להבין את הרמזים מולקולרית להורות כי בשלבים המוקדמים של היווצרות הסינפסה. ככזה זה הפך להיות הכרחי לפתח גישות אובייקטיבי לכמת שינויים קישוריות סינפטי. החל מ קיבעון המדגם, זה פרטים פרוטוקול איך לכמת את מספר הסינפסות הן בתרבות העצבית הפרידו בסעיפים המוח באמצעות immunocytochemistry. שימוש ספציפי תא נוגדנים, אנו תווית מסופי presynaptic כמו גם באתרים של התמחות postsynaptic. אנו מגדירים סינפסות כנקודות של colocalization בין האותות שנוצר על ידי סמנים אלה. מספר colocalizations אלה היא לכמת באמצעות תקע Puncta Analyzer (שנכתב על ידי Bary ווארק, זמין על פי דרישה, cellbio.duke.edu c.eroglu @) תחת פלטפורמת תוכנה לניתוח ImageJ. Assay סינפסה המתואר פרוטוקול זה יכול להיות מיושם על כל הכנה או רקמה עצבית תרבות שעבורו יש לך סמנים טרום postsynaptic סלקטיבית. זה assay הסינפסה היא כלי רב ערך אשר יכול להיות מנוצל באופן נרחב במחקר של התפתחות הסינפטי.
Protocol
פתרונות להכין:
- נוגדן חוצץ:
- 150 mM NaCl
- 50 מ"מ טריס-Base (פישר, החתול לא:. BP152-5, 50 מ"מ) - 1.21 גרם
- 1% BSA (Sigma, חתול לא:. A2153, 1%) - 2.0 גרם
- 100 מ"מ L-ליזין (Sigma, חתול לא:. L-1137, 100 מ"מ) - 3.65 גרם
- התאם ל-pH 7.4
- 0.04% אזיד
- התאם את נפח 200 מ"ל עם מזוקקים H 2 O.
- סינון דרך מסנן 0.22μm (Millipore, חתול לא:. SCGPU02RE).
- PFA Diluant:
- 168 מ"ל 0.5 M Na 2 HPO 4 (dibasic)
- 72 מ"ל 0.5m Na 2 HPO 4 (monobasic)
- 660 מ"ל מזוקקים H 2 O
- 4% PFA מקבע עבור נוירונים בתרבית (פתרון # 2):
- 10 מ"ל 16% PFA פתרון (מדעי אלקטרונים מיקרוסקופית, חתול לא:. 15,711)
- 30 מ"ל 4% PFA diluant (פתרון # 2)
- 4% PFA ב PBS:
- 4 גרם PFA (אלקטרונים Microscropy למדעים, חתול לא:. 19,210)
- 100 מ"ל PBS (Invitrogen, חתול לא:. 20012-027)
- מחממים עד 40 מעלות צלזיוס, מערבבים לילה.
- סינון דרך מסנן 0.22μm (Millipore, חתול לא:. SCGPU02RE)
- חיץ חסימת (סה"כ נפח (עבור צלחת 24 היטב) = (# coverslips 1) x 200μl)
- נוגדן חיץ 50% (פתרון # 1)
- 50% עז סרום רגיל (Gibco, חתול לא:. 16,210)
- 0.2% Triton X-100 (Roche Diagnostics GmbH, חתול לא:. 9002-93-1)
- 30% סוכרוז ב PBS
- 30 גרם סוכרוז (Biomedicals מגה פיקסל, Inc, חתול לא:. 821713)
- 70 מ"ל PBS (Invitrogen, חתול לא:. 20012-027)
- מערבבים עם stirbar עד סוכרוז נמצא פתרון.
- תביאו את נפח של עד 100 מ"ל עם PBS
- סינון באמצעות מסנן 0.22 מיקרומטר (Millipore, חתול לא:. SCGPU02RE)
הכנת תרבויות העצבית:
פרוטוקול המתואר כאן הוא ישים כל התרבויות העצבית העיקרית גדל על זכוכית coverslips 12 מ"מ (קרל הכט, מס 'הו, לא חתול:. 99,010) ב 24 גם צלחות (Falcon, 35-3047). למשל, במעבדה שלנו אנו עכברוש תרבות הגנגליון ברשתית תאים (RGCs) מטוהרים מן הרשתית עכברוש שנקטפו מן 1,2 P5-7 חיות. התאים גדלים על coverslips זכוכית מצופה poly-d-ליזין (Sigma, חתול לא:. P6407) (. Cultrex, חתול לא: 3400-010-01) ועכבר laminin. אנו מנצלים זאת הכנה תרבות בכמה דרכים שונות עבור assay סינפסה שלנו. אחת מניפולציה שאנו מבצעים כרוכה RGCs culturing או בנוכחות או העדר astrocyte-המופרשים גורמים synaptogenic. לחלופין, אנחנו גם מעסיקים בתנאים אלה טיפול שונה בניסויים שבהם RGCs כבר transfected כדי overexpress חלבון של עניין. במקרה האחרון, אנו שיתוף transfect התאים עם תווית התא (למשל GFP או tdTomato). גישות אלו ניסויים שונים משפיעים על איך מבצעת צעדים מסוימים של assay סינפסה, אשר אנו להבהיר להלן.
1. תיקון RGCs מטוהרים ניתק
- הסר מדיה תרבות מן RGC המכילים בארות להוסיף 500 μl (עבור צלחת 24 היטב) paraformaldehyde 4% (PFA) prewarmed ל 37 ° C עד היטב כל אחד. אפשר התאים לתקן במשך 7 דקות בטמפרטורת החדר.
- קיבעון בעקבות לשטוף התאים 3 פעמים עם פוספט שנאגרו מלוחים (PBS) (Invitrogen, חתול לא:. 20012-027). חשוב: תאים לא צריך להיות שמאל ללא נוזל הבארות, פעם חיץ יוסר גם הוא צריך להיות מוחלף מיד על ידי חיץ הבא. בשלב זה, התאים מוכנים immunostaining.
2. חסימת אתרי הקישור נוקבים על RGCs
- הכן חוסם חוצץ המכיל 50% עז בסרום נורמלי (NGS, Gibco, חתול לא:. 16,210) ו -0.2% Triton X-100 (Roche Diagnostics GmbH, חתול לא:. 9002-93-1). לאחר הסרת PBS מכל טוב, מוסיפים 200 μl של למאגר חסימת היטב כל ולחסום במשך 30 דקות בטמפרטורת החדר.
- הסר חוצץ חסימת ולשטוף 3 פעמים עם PBS.
3. יישום פתרון נוגדן ראשוני
- חשוב: הקפד לבחור נוגדנים העיקרי סמנים טרום postsynaptic שלך מתקבלים מינים שונים.
- הכן דילול נוגדן ראשוני חיץ נוגדנים 90%, 10% NGS תמיסה המכילה את צמד נוגדנים מראש ו postsynaptic על פי בחירתך. עבור ארנב למשל אנטי synapחטא (סמן presynaptic) (1:750, תחום cytosolic, מערכות Synaptic) ועכבר אנטי הומר (סמן postsynaptic) (1:500, עכבר מערכות Synaptic). חשוב: צנטריפוגה דילול נוגדן ראשוני במשך 5 דקות במהירות מקסימלית בצנטריפוגה ספסל העליון כדי להסיר כל נוגדן זירז.
- הוסף 200 μl נוגדן הפתרון העיקרי היטב כל אחד.
- דגירה לילה בשעה 4 ° C. צלחת צריך להיות ממוקם בתוך מכולה גדולות אשר humidified כדי למנוע התייבשות של הפתרון העיקרי. BREAK POINT: תאים יכול להישאר תערובת הנוגדן העיקרי עד 3 ימים לפני המשך הפרוטוקול.
- למחרת, להסיר נוגדן ראשוני מבאר כל ולשטוף בארות 3 פעמים עם PBS.
4. יישום פתרון נוגדנים משני
- הכן פתרון נוגדנים משני המכיל נוגדנים המשני שלך בדילול 1:1000 במאגר המכיל נוגדנים NGS 10%. חשוב: צנטריפוגה דילול משני הנוגדנים במשך 5 דקות במהירות מקסימלית בצנטריפוגה ספסל העליון להסיר נוגדן זירז. דילוג על שלב זה תוצאות ברקע נוגדנים גבוהה משני.
תאים Untransfected: בהעדר תווית התא, השתמש Alexa-594 ו-Alexa 488 משניות מצומדות עבור תיוג סמנים טרום postsynaptic בהתאמה. לדוגמה נשתמש עז נגד ארנב Alexa594 לתייג את הנוגדן אנטי synapsin עזים אנטי עכבר Alexa-488 משני מצומדות לתווית הומר נוגדן אנטי. חשוב: השתמש ב-Alexa 488 משניות מצומדות עבור נוגדנים ראשוני עם אות חלש.
תאים transfected: בחר נוגדנים משני להכיל את ספקטרום עירור, פליטה של תווית תא פלורסנט שלך. לדוגמה, כאשר אנו תווית תאים transfected עם tdTomato אנו משתמשים Alexa-647 מצומדות עז נגד ארנב להכיר את הנוגדן אנטי synapsin ו-Alexa 488 מצומדות עז אנטי בעכבר כדי לזהות את הנוגדנים נגד הומר. כמו כן, השימוש של NGS בפרוטוקול זה הוא תוצאה של הבחירה שלנו של נוגדנים משני המיוצר עז. - הוסף 200 μl נוגדן פתרון משנית גם כל אחד.
- לאחר דוגרים במשך שעתיים בטמפרטורת החדר במקום חשוך, לשטוף 3 עד 4 פעמים עם PBS.
5. הרכבה Coverslips
- Coverslips הר לתוך Vectashield הרכבה בינונית עם DAPI (וקטור Laboratories Inc, חתול לא:. H-1200) על שקופיות הזכוכית (VWR מדעיים, חתול לא:. 48311-703).
- בעדינות להחיל לק ברור מסביב לקצוות של coverslip ולאפשר לו להתייבש במשך 30 דקות לפחות במקום יבש, חשוך. חשוב: יש להימנע דחיפות או העברת coverslips במהלך היישום של לק ציפורניים מאז זה יביא הסתייגותו של התאים.
6. הדמיה
עבור הדמיה, מיקרוסקופ פלואורסצנטי מצויד במצלמה המסוגלת לצלם ב 4 ערוצים שונים הוא הכרחי כדי להיות מסוגל תמונה הן סמנים סינפטי, התא שלך מלא גרעינים (DAPI / אופציונלי). תאים צריכים להיות צילמו באמצעות טבילה שמן אובייקטיבי 63x. אנו התמונה באמצעות מיקרוסקופ פלואורסצנטי AxioImager Zeiss עם DIC Zeiss 63x/1.4 תכנית-APOCHROMAT שמן ∞ / 0.17 אובייקטיבי.
- בחר בתאים לפחות שני קטרים תא הרחק שכניהם הקרובים. כדי למנוע הטיה ולהבטיח אקראיות של הברירה תא אם חזותי untransfected תאים, בחר בתאים בערוץ DAPI, ואז לקחת תמונות כל הערוצים. אם תאים transfected חזותי לבחור תאים בערוץ המקביל התווית ניאון כדי לזהות תאים transfected (למשל tdTomato).
- רוכשת את התמונות שלך:
תאים Untransfected: עבור כל תא שנבחר, להשיג תמונות 8 ביט ב-GFP וטקסס ערוצי האדום. התמונה pseudocolored גבי צריך סמנים טרום postsynaptic שלך אדום וירוק, בהתאמה.
תאים transfected: עבור כל תא נבחר לקבל 8 תמונות קצת GFP, טקסס האדום Cy5 (או Cy5.5) ערוצים. התמונה pseudocolored גבי צריך סמנים טרום postsynaptic שלך אדום וירוק, בהתאמה. צבע Pseudo הסלולרי שלך למלא בכחול.
7. תמונה ניתוח ושיתוף מקומי כימות Puncta
- אנו משתמשים בתוכנית Puncta Analyzer עבור כימות שותף מקומי puncta הסינפטי. Puncta תקע Analyzer ב נכתב על ידי Bary ווארק, והוא זמין על פי דרישה (cellbio.duke.edu c.eroglu @). Puncta Analyzer פועל ImageJ 1.26 (http://rsbweb.nih.gov/ij/, גרסאות חדשות יותר של ImageJ לא יכול להפעיל את היישום). כדי להתקין Puncta Analyzer פשוט למקם את תיקיית היישום להוריד את התיקייה "תוספים" במדריך ImageJ 1.26.
- פתח אחד של תמונות בעזרת ImageJ. השתמש באחד מכלי הבחירה מתאר לעצמיתפריט EJ כדי לקבוע את האזור של עניין (ROI). אנחנו בקביעות להשתמש בכלי בחירה עגול כדי לבחור אזור אחד בערך בקוטר של תאים רדיאלית סביב סומה של עניין.
- עם האזור העניין שלך (ROI) נבחר, גש לתפריט ה plugins ובחר "Puncta Analyzer".
- בחלון "אפשרויות ניתוח" שמופיעה, בחר "מסלול אדום", "המסלול הירוק", על "רקע הפחת" הראשון "התוצאות קובץ הגדר ...." לחץ על "אישור". אתם תתבקשו להגדיר את מיקום לשמירת התוצאות שלך פנימה תוצאות אלו ניתן לייצא ל-Excel לניתוח נוסף.
- בחלון שמופיע לצד, לוודא רדיוס הכדור מתגלגל של 50 מסומנת בטל את הסימון של "רקע לבן" האופציה (שינוי זה אינו נדרש אך הוא העדיף לעתים קרובות על ידי משתמשים של היישום על מנת להקל על ויזואליזציה). לחץ על "אישור".
- חלון חדש יופיע לצד מסכה המתאימה עם תמונה הערוץ האדום שלך. כוון את סף עד שאתה מרגיש את המסכה אדום מתאים, כמו גם אפשרות כמו puncta רבים הפרט דיסקרטית ללא החדרת יותר מדי רעש. זהו אחד הצעדים סובייקטיבית ביותר של פרוטוקול זה, כך ידאג לפתח גישה עקבית. לחץ על "בוצע". הגדר את הגודל המינימלי puncta עד 4 פיקסלים לשנות שום דבר אחר. לחץ על "אישור".
- חזור על השלב הקודם, הפעם במסלול הירוק.
- לאחר השלמת השלב הקודם, התוסף יספק כימות המתאים puncta בכל ערוץ בנפרד כדי puncta colocalized בין שני הערוצים.
המוח חלקים:
Assay סינפסה ניתן ליישם cryosections מן המוח, מערכת לרקמות אחרות כל העצבים (כגון חוט השדרה או ברשתית) ובלבד שיש זוג מתאים סמן טרום postsynaptic (עם נוגדנים שפועלים היטב בסעיפים) כי יכול להיות נוצלו כדי לזהות את הסינפסות אתה רוצה לכמת. Assay סינפסה יכול לחשוף את תקנה הזמני של היווצרות הסינפסות באזור המוח נתון יכול לכמת תופעות על הקישוריות הסינפטית בבעלי חיים מהונדס או במדגם כי כבר לטפל בצורה אחרת.
1. מסיק רקמת המוח מן העכברים
הנהלים כל חיה צריך להיעשות הקונקורדנציה עם פרוטוקולים חיה IACUC.
- להרדים עכברים ידי exsanguination ו זלוף עם PBS. זלוף עם PBS הוא קריטי עבור הסרת דם תפחית האות רקע ההליכים מכתים. חשוב: אל perfuse עם fixatives כגון PFA 4%. זה ישפיע לרעה על התוצאות מכתים.
2. קיבוע
- תקן את המוח כולו בתוך PFA 4% PBS ב 4 ° C למשך הלילה. למחרת יש לשטוף את מוחם 3 פעמים עם PBS.
- Cryoprotect המוח על ידי הצבת אותם סוכרוז 30% ב-PBS. הרקמה יהיה בתחילה לצוף. שמור על 4 מעלות צלזיוס עד רקמת כיורים לתחתית. בשלב זה cryoprotection תושלם.
3. הטבעת / Cryosectioning
- שבץ מוח על האוריינטציה הרצויה עבור חתך (למשל sagittal או העטרה) בתמיסה 02:01 של סוכרוז 30% (. רקמות-Tek, חתול לא: 4583) אוקטובר ב PBS. הקפאת המוח מוטבע על משטח שטוח של קרח יבש. המוח מוטבע קפואים אפשר לשים שקיות הקפאה והמשיך ב -80 עד שנה לפני חתך.
- Cryosection הרקמה לתוך 12-16μm מדורים הר בשקופיות זכוכית (Sigma, חתול לא:. S4651). שקופיות ניתן לאחסן עד שבוע ב -80 ° C לפני מכתים.
- שקופיות להיות מוכתם צריך להיות מיובש על 37 מעלות צלזיוס במשך 30 דקות ושטף 1x עם PBS להסיר אוקטובר שיורית.
4. חסימת מדורים
- בלוק הסעיפים 20% עז בסרום נורמלי (NGS) ב-PBS שעה אחת בטמפרטורת החדר. חשוב: אין לכלול טריטון X-100 בשלב זה. לפני כן הפתרון חוסם, תוכל ליצור חיץ הידרופובי סביב הסעיפים בשקופית שלך באמצעות עט PAP עלית (DBS, חתול לא:. K039)
5. יישום נוגדנים ראשי
- מדולל נוגדנים הראשי שלך ב-PBS עם טריטון 0.3% ו NGS 10%.
- בקטעים המוח אנו משתמשים PSD-95 (Zymed, שפן, 1:500) לתייג תאים postsynaptic glutamatergic ו VGlut1 או VGlut2 (Chemicon, חזיר ים, 1:2500) לתייג מסופי presynaptic glutamatergic. צנטריפוגה דילול נוגדן ראשוני במשך 5 דקות במהירות מקסימלית בצנטריפוגה ספסל העליון להסיר נוגדן זירז אם הוא קיים.
- סעיפים דגירה בתמיסה הנוגדן העיקרי 36-60 שעות 4 ° C.
6. יישום נוגדנים משני
- לשטוף את הנוגדן הראשוני את ידי טבילה השקופיות 3x ב PBS במשך 15 דקות כל אחד. לאחר שלב זה לוודא להגן על השקופיות של אור ישיר.
- לדללנוגדנים משני בדילול של 1:200 במאגר זהה כמתואר עבור נוגדנים ראשוניים. לדוגמה עבור מכתים VGlut/PSD95 אנחנו משתמשים נגד עז חזירי הים Alexa 488 (Vglut) ואנטי עז ארנב Alexa 594 (PSD-95) (Invitrogen).
- דגירה מקטעים פתרון נוגדנים משני 2 שעות בטמפרטורת החדר בחושך.
- שוטפים את הנוגדנים מאוגד משני את השקופיות ידי טבילה השקופיות 4x ב PBS במשך 15 דקות כל אחד.
7. הרכבה
- הוסף טיפות קטנות של Vectashield הרכבה בינונית עם DAPI (וקטור Laboratories Inc) על שקופיות הזכוכית (VWR מדעית) ולאחר מכן לכסות את השקופיות עם coverslips (VWR מדעי, מס '1.5, 48,393 241). החל לק לעכב תנועת coverslips.
8. הדמיה
חשוב: מיקרוסקופ confocal עם לפחות 3 ערוצי נדרשת הדמיה המתואר כאן. אנו התמונה על מיקרוסקופ SP5 לייזר סריקה לייקה confocal באמצעות המטרה 63x טבילה שמן.
- אזורים במוח Synaptic עניין יש לבחור לסריקה באופן עקבי בין הסעיפים. לדוגמה, assay סינפסה שלנו רשתית תא גנגליון סינפסות על נוירונים collicular מעולה, אנחנו התמונה האזור החיצוני collicular מעולה הסמוך colliculus הנחות הכולל את שכבת הסינפטי שמקבל מסופי retinocollicular 7,8,9. אנו התמונה לכמת את הסינפסות של 150 מיקרומטר העליון אזור סינפטיים של colliculus מעולה שבו RGCs ידועים ליצור קשרים סינפטיים 9.
- עבור כל סעיף, הן 488 ו - 594 ערוצים, אנחנו סדרתי תמונה אופטי סעיפים ב 0.33 במרווחים מיקרומטר עומק על סך של 5 מיקרומטר עבור סכום כולל של 15 חלקים אופטיים. לפחות 3 קטעים מתוך כל חיה חייבת להיות הדמיה לפחות 3 חיות יש לכלול ממצב ניסיוני נתון.
- תחזיות בעוצמה מירבית (MIPS) נוצרות מקבוצות סעיפים 3 ברציפות מניב 5 MIPS המייצג 1μm עומק כל אחד. MIPS אלה לכימות.
9. תמונה כימות
- ניתן לבצע בדיוק כפי שתואר עבור RGCs, אולם את הצורה ואת הגודל של ROI ישתנה כפונקציה של האזור שבו הדימויים שאתה רוצה לכמת.
המפתחות להצלחה:
מטוהרים RGCs:
- לפני תיקון RGCs מטוהרים (או תרבות ניתק אחרים) לוודא מראש חם PFA 4% באמבט מים מוגדר 37 מעלות צלזיוס במשך 20-25 דקות ~ (חנות ב 4 ° C בכל זמן אחר, אין להשתמש דילולים PFA יותר מ 7 ימים).
- במיוחד עבור לנוירונים בתרבית, רצוי לא להשתמש aspirator ואקום שוטף במהלך כל לשטוף מדרגות. שיטות עדין כגון באמצעות פיפטה פסטר נורה יניקה ניכר לשפר את איכות מכתים שלך.
- תשמרי על עצמך ולא לתת לתאים שלך להתייבש במהלך השלבים לשטוף שלך.
- הימנע דחיפות או העברת coverslips שלך במהלך היישום של לק כמו לעשות זאת יכול לגרום הגז של התאים על coverslip שלך.
- ספין את כל הנוגדנים יסודי ותיכון לחסל את כל הנוגדנים זירז כי יהיה להשפיע לרעה מכתים.
- הקפד לבחור נוגדנים העיקרי סמנים טרום postsynaptic שלך גדל מינים שונים. הימנעות מלעשות זאת יבטל את היכולת שלך להבחין בין שני אותות לאחר היישום של נוגדנים משני.
המוח מדורים:
- אל perfuse עכברים עם fixatives כגון PFA.
- אין לכלול טריטון X-100 בפתרון חסימת שלך עבור חלקים במוח. פעולה זו פוגעת באיכות מכתים עבור presynaptic סמנים, סמנים presynaptic במיוחד המשויכים שלפוחית סינפטית.
- שימוש במיקרוסקופ confocal הדמיה נדרש לרכישת התמונה באיכות מספיק טובה כדי לבצע ניתוח סינפסה.
נציג תוצאות:
Assay סינפסה שתואר לעיל נועד ללכוד שינויים הקישוריות הסינפטית במבחנה in vivo. במעבדה שלנו, אנו מנצלים את assay סינפסה כדי לקבוע את ההשפעה של מולקולות או astrocyte-מופרש בודדים או מרובים על היווצרות הסינפסה. אנחנו בדרך כלל לבצע את assay סינפסה על RGCs מטוהרים שאנחנו תרבות במבחנה.
ההשפעה של יישום היטיב לתאר כרונית של astrocyte ממוזג התקשורת (ACM) ב מטוהרים תרבויות RGC היא להגדיל מספר פי במספר הסינפסות כי נוצרות בין RGCs 3,4,5,6. איור 1A ו-1B להראות תמונות של נציג RGCs מטוהרים untransfected שטופלו או התקשורת או עם צמיחה הבסיס ACM. לאחר מכתים עבור סמנים טרום postsynaptic מעוררים, העלייה ACM-Induced sהיווצרות ynapse ניכר איכותית (איור 1A, 1B). אכן, ממצא זה כבר אומתו על ידי מספר מחקרים השתמשו electrophysiology להראות כי ACM-Induced סינפסות הן במיקרוסקופ אלקטרונים פונקציונלי להראות כי הסינפסות הן נורמליות ultrastructurally 3,4,6. עבודה אחרים במעבדה שלנו זיהה את תעלות סידן למקטע α2δ-1 כמו קולטן עצבי עבור מולקולה astrocyte-מופרש synaptogenic חזק, thrombospondin 3. כאן אנו כוללים את התוצאות של ניסוי מטוהרים RGCs כי בוצעה כדי לקבוע אם רמות גבוהות של α2δ-1 משפר עוד יותר את ACM-Induced היווצרות הסינפסה (איור 3).
RGCs היו cotransfected עם וקטור או ריק או עם קידוד לבנות α2δ-1 עם לבנות נפרד קידוד tdTomato לאחר 5 ימים במבחנה (DIV5). בעקבות טיפול כרוני עם או ACM או ג'נרל מוטורס, RGCs קובעו ונצבעו על DIV 11. בעקבות immunolabeling של סמנים טרום postsynaptic של סינפסות מעוררות אנו רואים עלייה ברורה במספר איכותית סינפסה מטוהרים RGCs להביע או וקטור ריק (pcDNA3.1) או α2δ-1 (איור 1C, 1D). אנו לכמת את ההשפעה של synaptogenic ACM באמצעות Puncta מנתח לספור מספר סינפסה (איור 2) לפחות 15 נוירונים ממצב זה. טעות הדגימה למדגם בגודל זה מאפשר לנו לחשב את המספר הממוצע של סינפסות לכל נוירון ולמצוא משמעות סטטיסטית, ~ 10-לקפל עלייה סינפסות הוקמה על ידי ACM שטופלו נוירונים מביעים וקטור ריק (איור 3, סרגלים אפורים). יתר על כן, אנו מראים כי ביטוי יתר של α2δ-1 מובילה potentiation משמעותית של היווצרות ACM-Induced סינפסה (~ 20 של פי. איור 3, פסים שחורים).
בנוסף לנוירונים בתרבית, אנו יכולים לכמת צפיפות סינפטי באזורי מוח שונים באמצעות טכניקה זו. Colliculus מעולה הוא מבנה המוח מקבל תחזיות retinocollicular, שמקורם RGCs ברשתית 7,8,9. במהלך התפתחות הלידה, על מספר סינפסות מעוררות שהוקמה על ידי RGCs על המטרות שלהם colliculus מעולה מגדיל באופן דרמטי מ P7 ל p21 7,8,9.
באמצעות טכניקה כימות שלנו, אנו מראים כי מספר הסינפסות retinocollicular נוצרו עולה מעולה colliculus מ P7 ל P14. כדי לעשות זאת, אנו לכמת הצפיפות הסינפטית ב P7 ושוב P14. אנו הכתם colliculus מעולה עבור PSD-95 (postsynaptic) ועבור VGlut2 (סמן presynaptic ספציפית סינפסות RGC ב colliculus מעולה). האזור הסינפטי החיצוני של colliculus היה מעולה הדמיה (איור 4A) ושותף מקומי VGlut2/PSD-95 סינפסות היו לכמת (איור 4B, 4C) לפחות מ 3 חלקים לכל החי ומן לפחות 3 בעלי חיים בכל נקודת זמן. כימות את הנתונים המתקבלים בבירור עלייה מעל פי שלושה משמעותי במספר הסינפסות בין P7 ו P14. תוצאות אלו עולות בקנה אחד עם הממצאים שפורסמו בעבר תוך שימוש במיקרוסקופ אלקטרונים (איור 4D) 9.
לסיכום, שיטת כימות מספר סינפסה אנו מתארים כאן הוא כלי שימושי כדי לקבוע מספר סינפסה וצפיפות בתרבות ברקמות עצביות, ומאפשרת לנו לחקור את ההשפעות של מניפולציות היווצרות הסינפסה או במבחנה in vivo.
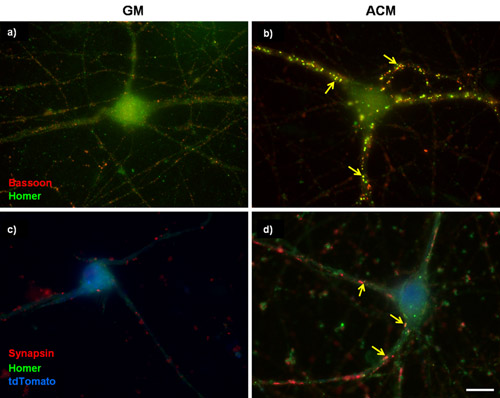
איור 1: מכתים הסינפטי נציג מטוהרים RGCs. (A ו-B) 3 ימים במבחנה (DIV) RGCs היו בתרבית או ב (א) התקשורת צמיחה הבזליים (GM) או (ב) בעד synaptogenic astrocyte עכבר מדיה מותנה (ACM) עבור 6 ימים נוספים. התאים תויגו ואז בסון (presynaptic, אדום) הומר (postsynaptic, ירוק). עכבר ACM מאוד מגרה היווצרות הסינפסה בין RGCs כפי שנקבע על ידי הגידול במספר של שותף מקומי בסון והומר puncta. (C ו-D) RGCs 5DIV היו transfected עם הפלסמיד כדי overexpress ערוץ סידן למקטע α2δ-1. תאים transfected זוהו עם מילוי תא tdTomato (כחול) ואת כבר מוכתם עבור synapsin סמן presynaptic והומר סמן postsynaptic. החצים מצביעים על סינפסות. בר סולם מייצג 20 מיקרומטר.
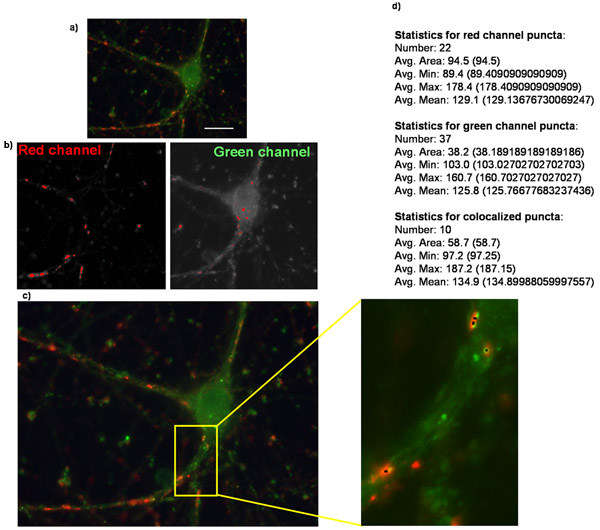
איור 2:. כימות מספר סינפסה באמצעות Puncta Analyzer המוצג כאן הוא דוגמה (א) התמונה המקורית של הקולטן מטוהרים רשתית תא הגנגליון overexpressing thrombospondin α2δ-1 ו הוא מוכתם עבור synapsin סמן presynaptic והומר סמן postsynaptic. (ב) תמונות המתאימות המסכות נוצרו כל ערוץ בניתוח puncta ב Puncta Analyzer. (ג) Puncta Analzyer תיצור תמונה כמו זו המוצגת כאן, שבו puncta מסומנים על ידי נקודות שחורות קטנות (הבלעה). כמו כן shown הוא (ד) את הפלט המספרי של היישום שבו מספר puncta יחד עם פרמטרים אחרים ניתנים בצורה טקסטואלי / מספרי (טקסט מודגש הוסיף לשם הדגשה).
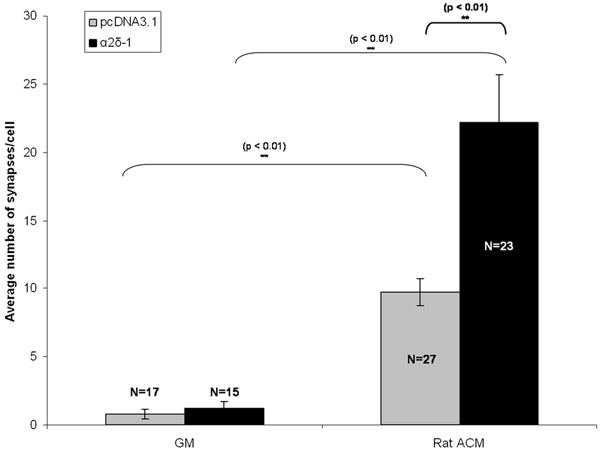
איור 3:. תוצאה נציג עבור assay סינפסה המוצג כאן הוא האפקט synaptogenic של טיפול כרוני RGCs עם astrocyte ממוזג התקשורת (ACM) ב RGCs transfected להביע או וקטור ריק (pcDNA3.1, סרגלים אפורים) או הקולטן thrombospondin α2δ-1 . ברים שגיאה לייצג את SEM. GM = Media צמיחה. ACM = (עכברוש) מדיה Contitioned Astrocyte.
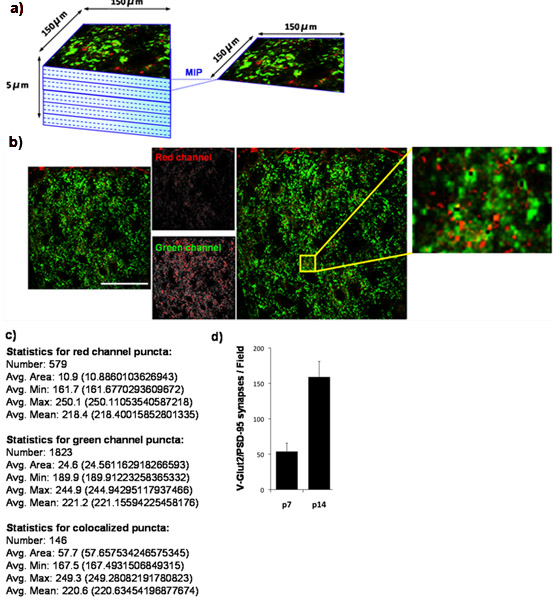
איור 4:. כימות צפיפות הסינפטי בעכבר מעולה colliculus (א) כדי לקבוע את השינויים התפתחותיים במספר הסינפסות glutamatergic הוקמה על ידי RGCs על מטרות מעולה collicular במוח מכרסם, אנו מוכתם cryosections מהמוח עכבר עם נוגדנים נגד presynaptic סמן VGlut2 (ירוק) לבין הסמן postsynaptic, PSD-95, (אדום). אנחנו צילמו החיצונית 150 x 150 מיקרומטר באזור מעולה של העכבר colliculus (SC) המתאים לאזור המיקוד הסינפטי עבור RGCs באמצעות סריקת לייזר מיקרוסקופ confocal. Z-מחסנית עבור כל מקטע SC נאסף על עומק סך של 5 מיקרומטר (15 x 0.33 חלקים אופטי מיקרומטר). תחזיות תמונה מקסימלי (MIPS) נוצרו עבור קבוצות של 3 סעיפים אופטי ברציפות מניב 5 MIPS / כל קטע מייצג 1 מיקרומטר עומק. המוצג להלן MIP נציג שנלקחו colliculus מעולה של עכבר WT P14. סמן presynaptic, VGlut2, מוצג בירוק את הסמן postsynaptic, PSD-95, מוצג באדום. (ג) נומרית פלט המיוצר על ידי מנתח Puncta. (ד) כימות ניתוח של מספר סינפסה לפחות 3 קטעים לכל חיה עם 3 בעלי חיים בכל נקודת זמן (ברים שגיאה מייצגים SEM). בר סולם מייצג 50 מיקרומטר.
Discussion
Assay סינפסה שתוארו לעיל מבוסס בהקשר של מטרות הניסוי שלנו, שבו אנו מתמקדים בעיקר על תחזיות מעוררות של RGCs, לא מטוהרים תרבות או בחלק המוח. סיפקנו שולחן התייחסות לרישום נוגדנים פועלות היטב עבור תיוג סינפסות מעוררות (טבלה 1).
Assay זה סינפס?...
Disclosures
Acknowledgements
במעבדה של בן א בארס (אוניברסיטת סטנפורד).: Puncta Plug-in עבור תמונה J נכתב על ידי בארי ווארק (ייעוץ Physion הכתובת הנוכחית) Analyzer
מימון;
- אלפרד פ 'סלואן קרן
- אסתר א ויוסף Klingenstein קרן, Inc
- רחבה מחקר ביו קרן
- תרופה יוזמת מחלת הנטינגטון s
Materials
| Name | Company | Catalog Number | Comments | |||||
| אנטיגן | מין | חד שבטיים / polyclonal | מוכר | מספר קטלוגי | מהילה | יצירות תרבות | העבודות בסעיפים | |
| Presynaptic | Synapsin | ארנב | Polyclonal | Synaptic מערכות | 106004 | 1:750 | Y | ND |
| Synapsin | עכבר | חד שבטיים | Synaptic מערכות | 106001 | 1:500 | Y | Y | |
| בסון | עכבר | חד שבטיים | Assay עיצובים | VAM-PS003F | 1:500 | Y | Y | |
| בסון | קביה | Polyclonal | Synaptic מערכות | 141004 | 1:1000 | Y | ND | |
| Synaptotagmin 1 | ארנב | Polyclonal | Synaptic מערכות | 105002 | 1:750 | Y | N | |
| Synaptobrevin 2 (C1.69.1) | עכבר | חד שבטיים | Synaptic מערכות | 104211 | 1:500 | Y | Y | |
| Synaptophysin (C1.7.2) | עכבר | חד שבטיים | Synaptic מערכות | 101011 | 1:500 | Y | Y | |
| VGlut1 | עכבר | חד שבטיים | Millipore | MAB5502 | 1:2500 | N | Y | |
| VGlut1 | קביה | Polyclonal | Millipore | AB5905 | 1:2500 | N | Y | |
| VGlut2 | קביה | Polyclonal | Millipore | AB2251 | 1:2500 | N | Y | |
| Postsynaptic | PSD-95 (6G6 1C9-clone) | עכבר | חד שבטיים | זיקה ביו ריאגנטים | MA1-045 | 1:750 | Y | N |
| PSD-95 | ארנב | Polyclonal | Zymed | 51-6900 | 1:500 | N | Y | |
| הומר | עכבר | חד שבטיים | Synaptic מערכות | 160011 | 1:500 | Y | ND | |
| הומר | עכברוש | Polyclonal | Millipore | AB5875 | 1:500 | Y | Y | |
| Gephyrin | ארנב | Polyclonal | Synaptic מערכות | 147003 | 1:500 | Y | Y | |
| Gephyrin | עכבר | חד שבטיים | Synaptic מערכות | 147 | 1:200 | Y | Y |
טבלה 1: רשימת דוגמאות של סמנים טרום postsynaptic טוב שיש לנו מנוצל בהצלחה assay סינפסה שלנו. שימו לב כי זו אינה רשימה ממצה של כל סמנים זמינים. Y = כן, N = לא, ND = לא נקבע.
| מגיב | חברה | חתול. לא. |
| PBS | Invitrogen | 20012-027 |
| poly-d-ליזין | סיגמא | P6407 |
| Laminin | Cultrex | 3400-010-01 |
| טריטון X-100 | Roche Diagnostics GmbH | 9002-93-1 |
| עיזים רגיל סרום | Gibco | 16210 |
| VectaShield עם DAPI | וקטור מעבדות | H-1200 |
| אוקטובר | רקמות-Tek | 4583 |
| טריס-Base (50 מ"מ) | דיג | BP152-5 |
| שור סרום אלבומין | סיגמא | A2153 |
| L-ליזין | סיגמא | L-1137 |
| 16% PFA פתרון | מיקרוסקופית אלקטרונים למדעים | 15711 |
| גרעיניים PFA | מיקרוסקופית אלקטרונים למדעים | 19210 |
| 24 גם תרבות צלחת | בז | 35-3047 |
| אנטי עכבר עיזים אלקסה נוגדנים מצומדות | Invitrogen | --- |
| אספקה | חברה | חתול. לא. |
| 12mm, מס '0 זכוכית coverslips | קרל הכט GmbH | 1105209 |
| מס '1.5 זכוכית coverslip (עבור פרוסות) | VWR מדעי | 48393241 |
| שקופיות הזכוכית | VWR מדעי | 48311-703 |
References
- Barres, B. A., Silverstein, B. E., Corey, D. P., Chun, L. L. Y. Immunological, morphological, and electrophysiological variation among retinal ganglion cells purified by panning. Neuron. 1, 791-803 (1988).
- Meyer-Franke, A., Kaplan, M. R., Pfrieger, F. W., Barres, B. A. Characterization of the signaling interactions that promote the survival and growth of developing retinal ganglion cells in culture. Neuron. 15, 805-819 (1995).
- Eroglu, C. Gabapentin receptor alpha2delta-1 is a neuronal thrombospondin receptor responsible for excitatory CNS synaptogenesis. Cell. 139, 380-392 (2009).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 .
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinocollicular projections in the mouse. J. Comp. Neurol. 230, 552-575 (1985).
- Schmidt, J. T. Formation of retinotopic connections: selective stabilization by an activity-dependent mechanism. Cell. Mol. Neurobiol. 5, 65-84 (1985).
- Sachs, G. M., Jacobson, M., Caviness, V. S. Postnatal changes in arborization patterns of murine retinocollicular axons. J. Comp. Neurol. 246, 395-408 (1986).
- Elmariah, S. B., Oh, E. J., Hughes, E. G., Balice-Gordon, R. J. Astrocytes regulate inhibitory synapse formation via Trk-mediated modulation of postsynaptic GABAA receptors. J. Neurosci. 25, 3638-3650 (2005).
- Hughes, E. G., Elmariah, S. B., Balice-Gordon, R. J. Astrocyte secreted proteins selectively increase hippocampal GABAergic length, branching and synaptogenesis. Moll. Cell. Neurosci. 43, 136-145 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved