A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בזמן אמת הדמיה של leukotriene B 4 Cell Migration מתווכת ו BLT1 אינטראקציות עם β-arrestin
In This Article
Summary
מאמר זה מתאר את המתודולוגיה כדי לקבוע את התגובה chemotactic של לויקוציטים אל ligands ספציפיים לזהות אינטראקציות בין משטח קולטני התא וחלבונים cytosolic באמצעות טכניקות הדמיה תא חי.
Abstract
קולטני G-חלבון בשילוב (GPCRs) שייכים למשפחת seven חלבון הטרנסממברני ולתווך התמרה של אותות תאיים לתגובות תאיים. GPCRs לשלוט תפקודים ביולוגיים מגוונים כגון chemotaxis, שחרור סידן תוך תאי, ויסות הגנים באופן ליגנד תלוי דרך heterotrimeric G-חלבונים 1-2. ליגנד גורם מחייב סדרה של שינויים קונפורמציה המוביל heterotrimeric ההפעלה של ה-G-חלבונים לווסת את רמות שליחים second כגון monophosphate מחזורי אדנוזין (cAMP), אינוסיטול טריפוספט (IP3) וגליצרול diacyl (DG). בד בבד עם הפעלת הכריכה ליגנד לקולטן גם יוזם סדרה של אירועים, כדי לרכך את הקולטן איתות באמצעות קיבוע הפחתת רגישות, ו / או הפנמה. תהליך הפחתת רגישות של GPCRs מתרחשת באמצעות זירחון רצפטור על ידי G-חלבון קולטן קינאז (GRKs) ומחייבת הבאות של β-arrestins 3. β-arrestins הם חלבונים cytosolic ו translocate קרום על הפעלת GPCR, קשירה לקולטנים פוספורילציה (ברוב המקרים) לשם הקלת הפנמה קולטן 4-6.
Leukotriene B 4 (LTB 4) הוא מולקולה הפרו דלקתי שומנים שמקורם מסלול חומצה arachidonic ומתווך פעולותיה באמצעות GPCRs, LTB 4 קולטן 1 (BLT1; קולטן זיקה גבוהה) ו LTB 4 קולטן 2 (BLT2; קולטן זיקה נמוכה ) 7-9. מסלול 4-BLT1 LTB הוכח להיות קריטי מספר מחלות דלקתיות, כולל דלקת מפרקים אסטמה, טרשת עורקים 10-17. המאמר הנוכחי מתאר את מתודולוגיות שפותחו כדי לפקח LTB 4-Induced הגירה ליקוציט ואת האינטראקציות של BLT1 עם β-arrestin ו, טרנסלוקציה קולטן בתאים חיים באמצעות מיקרוסקופ טכניקות הדמיה 18-19.
מוח העצם נגזר מן התאים הדנדריטים C57BL / 6 עכברים בודדו בתרבית כפי שתואר לעיל 20-21. תאים אלו נבדקו שיטות הדמיה לחיות תא להפגין LTB 4 הגירה המושרה תא. BLT1 האדם היה מתוייגים עם חלבון פלואורסצנטי אדום (BLT1-RFP) בתחנה הסופית-C ו-β-arrestin1 מתוייגים עם חלבון פלואורסצנטי ירוק (β-arr-GFP) ו transfected הן פלסמידים לתוך עכברוש Basophilic Leukomia (RBL-2H3) שורות תאים 18-19. קינטיקה של האינטראקציה בין החלבונים האלה ולוקליזציה נוטרו באמצעות מיקרוסקופ וידאו חי התא. מתודולוגיות במאמר הנוכחי מתארים את השימוש בטכניקות מיקרוסקופיות לחקור את התגובות תפקודית של G-חלבון קולטנים יחד בתאים חיים. המאמר הנוכחי מתאר גם את השימוש Metamorph התוכנה לכמת את עוצמות הקרינה כדי לקבוע את הקינטיקה של הקולטן אינטראקציות חלבון cytosolic.
Protocol
מתודולוגיה
תיאור של מיקרוסקופ
חיים הדמיה ניסויים תא שבוצעו באמצעות TE-FM Epi-Fluorescence המערכת מחוברת מיקרוסקופ Nikon הפוך Eclipse TE300. מיקרוסקופ המצויד בשלב החימום. הצמד מגניב HQ דיגיטלי B / W CCD (רופר מדעי) המצלמה LAMDA 10-2 מחליף מסנן אופטי (חברה סאטר מכשיר) מחובר מיקרוסקופ. אורכי גל עירור ופליטה נשלטים עם גלגלים לסנן נשלט על ידי בקר 10-2 גלגל Lamba לסנן, סאטר מכשירים ושות זמן חשיפה 500 ms צריך להיות מספיק כדי להציג RFP או ה-GFP בתאים חיים. בקרת חומרה רכישת תמונות נשלטים על ידי תוכנה Metamorph. הבחירה של מסננים עבור המחקר הנוכחי הן, מסנן ערכות S480/20x, S525/40m ו S565/25x, S620/60m עבור ה-GFP ו RFP, בהתאמה; EGFP / DsRed כפול טכנולוגיה dichroic, Chroma. זה גלגל הסינון יכול להכיל עד שישה סטים הסינון. מיקרוסקופ מצורף עם בקר לפני שלב Proscan עם מקל ג'וי. כל הקבצים המצורפים אלה החומרה יכול להיות נשלט על ידי תוכנה Metamorph. המיקרוסקופ מחובר גם עם Micromanipulators להחזיק את micropipettes.
א מדידת leukotriene ב 4 במאי נדידת תאים דנדריטים
באמצעות הגדרה לעיל מיקרוסקופ תיאר, פיתחנו שיטות הבאות ביים ליגנד תאים דנדריטים הגירה בזמן אמת. שני micromanipulators (Narishige) מחוברים המיקרוסקופ. Chemotaxis של מח העצם עכבר נגזר תאים דנדריטים (BMDCs) לכיוון שיפוע 4 LTB נרשמה. כאן, אנו מתארים את שיטות להכנת מיקרו pipettes באמצעות מיקרו פיפטה חולץ, טעינת ליגנד לתוך מיקרו פיפטה והקמת הניסוי chemotaxis על הבמה מחומם של המיקרוסקופ כדי לעקוב אחר כיווני ההגירה של תאים. שיטה זו יכולה להיות מיושמת על מנת לבחון את היעילות של chemoattractants ברורים גרימת הגירה כמו גם ההשפעה של מעכבי chemotaxis בתאים חיים. הבידוד של BMDCs 21 מתוך עכבר תוארה במספר פרסומים כולל יופיטר 22.
1. הכנת BMDCs
- פלייט BMDCs (לאחר culturing במשך 10 ימים) על מנת לכסות את המנה להחליק למטה Fluoro ולאפשר להם לגדול במשך 16 שעות לפני הניסוי.
- לשטוף את התאים עם 3 מ"ל של 1X PBS לפחות 2 פעמים (על ידי הוספת 3 מ"ל של 1X PBS על הצלחת aspirating החוצה חיץ).
- הוסף 2 מ"ל של 1XPBS לצלחת. התאים מוכנים כעת לניסוי. שמור את התאים 37 ° C חממה לפני הניסוי.
הכנת ליגנד טעון מיקרו פיפטה:
- תיקון צינורות זכוכית נימי (זכוכית רגילה, 0.75 מ"מ x 0.4 מ"מ; 6 ", חתול # 625500, AM Systems, Inc) על האנכי micropipette חולץ (Narishige הבינלאומי ארה"ב, Inc).
- שמרו על טמפרטורה 52 ° C ולאפשר הזכוכית כדי להמיס ולמשוך בנפרד כדי ליצור טיפים קצה חד.
- תקן את פיפטה על בעל מיקרו פיפטה.
- להחליק את הקצוות הגסים של מיקרו פיפטה באמצעות מיקרו לזייף M-900 (Narishige הבינלאומי ארה"ב, Inc) על ידי צפייה במיקרוסקופ.
- הכן לפחות 10-20 pipettes עבור כל ניסוי. הערה: micropipettes ניתן גם לרכוש מכשירים Precision העולם (TIP μ, T1801TW1F).
- קח את הריכוז הרצוי (500 μL של 100 ננומטר LTB 4 בניסוי הנוכחי) של ליגנד לתוך צינור 1 effendorf מ"ל ולשמור את קצה פיפטה מיקרו בפתרון ולאפשר הפתרון להיכנס פיפטה מיקרו (חזרה מילוי).
- קח 1 מ"ל של ליגנד לתוך המזרק (1 סמ"ק טוברקולין מזרק) ולאט לאט למלא את ליגנד באמצעות מיקרו מלא מחט (MF 28G-5, מכשירים העולם Precision) לתוך פיפטה מיקרו מלמעלה.
- חבר את צינורות, אשר נכנס בחוזקה פיפטה אל פיפטה ואת הצינורית אל המחט (21 G 02/11) מצורף מזרק 1 מ"ל, אשר מתמלא ליגנד.
- כעת, בזהירות להזיז את ליגנד מלא מיקרו פיפטה לשלב מיקרוסקופ ולתקן על מיקרו המניפולטורים.
- החל הלחץ מעט מן המזרק לעשות ליגנד בטוח הוא לאט משחררים מקצה.
- תביאו את BMDCs בשלה מצופה אל המיקרוסקופ ולשמור אותם על צלחת מחוממת (37 מעלות צלזיוס) שלב.
- הסר את מכסה צלחת fluoro.
- פוקוס על התאים באמצעות טבילה שמן אובייקטיבי 60x עדשה.
- בזהירות, להפיל את ליגנד טעון בעזרת פיפטה "גס Manipulator ידני MN-188NE" הקרבה של התאים.
- פוקוס בעזרת פיפטה "Micromanipulator פיין הידראולי MN-188 NE".
- החל הלחץ מעט מן המזרק כדי לוודא ליגנד מפרסמת לתוך צלחת.
- הגדר את הפרמטרים רכישת תמונה לרכוש ב בהיר הגיש (10 חשיפה ms) בכל 15 שניות 2 שעות באמצעות תוכנת Metamorph.
- שמור על ניטור כל 30 דקות עבור יחסי ציבורogression ההגירה כלפי ליגנד.
- אם תאים צפופים בקצה פיפטה, לשנות את המיקום של קצה בצלחת להמשיך את ההגירה של הניסוי.
ב מדידת GPCR (BLT1) ו חלבון Cytosolic (β-arrestin) אינטראקציות, טרנסלוקציה בתאים חיים
1. הכנת בונה פלסמיד דנ"א
הפרטים של בונה פלסמיד דנ"א תוארו ג'אלה et al. (2005) 18.
2. Transfection של האדם BLT1-RFP ו-β-GFP Arrestin לתוך RBL-2H3 תאים
- שמירה על עכברוש Basophilic Leukomia (RBL-2H3) תאים (60 עד 70% מפגש) בשעה 37 ° C באווירה humidified אוויר 95%, 5% CO 2 כמו תרבויות monolayer בתקשורת צמיחה (DMEM בתוספת 15% FBS, 2 mM L-גלוטמין, 100 U / mL פניצילין ו -100 מיקרוגרם / מ"ל סטרפטומיצין) ב T75 צלוחיות.
- ניתוק התאים מצלחת / צלוחיות באמצעות 6 מ"ל של טריפסין-EDTA (0.05 טריפסין%, 0.53 mM EDTA) ו דוגרים במשך 5 דקות ב 37 מעלות צלזיוס באווירה humidified אוויר 95%, 5% CO 2. נער בעדינות את צלוחיות לפקח על מידת הניתוק של התאים.
- הוסף 6 מ"ל של התקשורת הצמיחה בקבוקון המכיל 6 מ"ל של טריפסין-EDTA לאסוף את התאים על ידי ערבוב אותם pipetting מעלה ומטה מספר פעמים. העברת התאים לתוך צינורות 15 מ"ל בז.
- ספירת התאים באמצעות hemocytometer ולקחת 4 x 10 6 תאים 15 צנטריפוגות צינורות מ"ל ו צנטריפוגות בסל"ד 480g 3 דקות ו resuspend ב 200 μL של התקשורת transfection (DMEM, 20% FBS, 50 HEPES mM). אם אתם מתכננים לבצע 3 transfections, להכין את התאים התקשורת tranfection בהתאם במספר התא הגדלת נפח בינוני transfection.
- הכן את פלסמידים להיות transfected על ריכוזים של לפחות 1.5 מיקרוגרם / μL. אנחנו מכינים את ה-DNA פלסמיד דנ"א באמצעות QIAGEN מקסי ערכת פלסמיד. מוסיפים את הפרט או שניהם קידוד DNAs פלסמיד עבור האדם BLT1-RFP (25 מיקרוגרם) ו β-arrestin1-GFP (15 מיקרוגרם) כדי cuvettes אלקטרופורזה סטרילי, (Bio-Rad # 16552088), אשר יש אלקטרודה 0.4 הפער ס"מ.
- קח 200 μL של תאים resuspended מעל למקם אותם cuvettes המכיל גם hBLT1-RFP או β-arrestin1-GFP או שניהם יחד לערבב אותם בעדינות עם פיפטה 1 מ"ל סטרילי.
- השאירו את cuvettes מעל בטמפרטורת החדר למשך 10 דקות.
- Electroporate התאים ג'ין Pulser II עם מתח 250 v ו 500 קיבולת μF.
- לאחר electroporation לתת התאים להישאר בטמפרטורת החדר למשך 10 דקות.
- קח 1 מ"ל של מדיום הגידול רגיל לערבב אותו עם תאים electroporated ב cuvettes.
- הפץ 300 μL של תערובת זו לתוך הרקמה 35 מ"מ זכוכית התחתונה מנות התרבות (צלחת Fluoro, Precision Instruments העולם) המכיל 2 מ"ל של התקשורת צמיחה קבוע דגירה עבור שעה 1 ב 37 ° C באווירה humidified אוויר 95%, 5% CO 2. אפשר התאים לדבוק התחתון של המנה.
- החלף את המדיה 1 לאחר שעות של דגירה עם התקשורת צמיחה קבוע ולאפשר להם לגדול ב 37 ° C באווירה humidified אוויר 95%, 5% CO 2 באינקובטור במשך 18-24 שעות.
3. תא חי דימות
רכישת תמונות
- לאחר 18-24 שעות, לשטוף את התאים פי 2 או 3 עם 2 מ"ל של פנול אדום חם חינם RPMI המכיל 10 HEPES מ"מ, pH 7.55 (הוסף 2 מ"ל של התקשורת חם ישירות לצלחת התקשורת לשאוב. חזור על 2 או 3 פעמים). הוסף 1.8 מ"ל של פנול אדום חם חינם RPMI המכיל 10 HEPES מ"מ.
- מקום 30 מ"מ זכוכית coverslip בעל תחתית תרבות מנות המכילות RBL-2H3 תאים, transfected עם hBLT1-RFP ו-β arrestin1-GFP על הבמה מיקרוסקופ מחוממת (37 מעלות צלזיוס).
- איסוף התמונות התא בהגדלה 600x באמצעות 60 X אובייקטיבי Nikon תוכנית Apo 60X/1.4 הצמצם המספרי שמן טבילה העדשה (זמין במערכת מיקרוסקופ שלנו).
- לשים טיפה אחת שמן על עדשת 60 x אובייקטיבי למקד את התאים עם שדה בהיר רגיל מועבר על ידי נגיעה קלה בתחתית הצלחת.
- כדי לבדוק את הקרינה של חלבונים transfected, לעבור מתחום בהיר (האור המועבר) כדי לסנן את הקרינה (RFP לסנן, אם אתה רוצה לראות את קולטן ה-GFP או, אם אתה רוצה לראות β-arrestin1).
- בחר את התא מבריק ובריא, המבטא hBLT1-RFP על פני התא באמצעות RFP לסנן ללכוד את התמונה.
- ואז לעבור GFP לסנן לוודא כי β-arrestin-GFP הביע בציטופלסמה ללכוד את התמונה. ואז צבע פסאודו גם תמונות, לפני זמן לכידת תמונות שפקע תא חי כדי לוודא לדמם דרך של הקרינה אינו נוטל המתרחשים בין RFP ו-GFP.
- לאחר הבחירה של הסלולרי שלך עשה, להגדיר את הפרמטרים לפי המטרה שלכם באמצעות תוכנה (Software Metamorph במקרה זה).
- בהפגנה הנוכחית, שש עשרה תמונות קצת נרכשים עם באra להגדיר binning עד 1 X 1 בשילוב עם תוכנית 60 X Nikon אובייקטיבי Apo 60X/1.4 הצמצם המספרי שמן העדשה טבילה.
- איסוף התמונות הקרינה עבור RFP ו-GFP fluorochromes בו זמנית במרווח זמן 30 שניות (אם את האינטראקציות טרנסלוקציה / הם מהר מדי, אפשר לצמצם את מרווחי הזמן) של הגלגלים האלה באמצעות מסנן נשלט על ידי תוכנה Metamorph.
- החשיפה פעמים מצלמה מוגדר 1000 msec עבור RFP ו-GFP. (הגדרת פעמים חשיפה ספציפית על פי עוצמת הניאון של RFP ו-GFP).
- ראשית לאסוף את התמונות דקות 1 ללא הוספת ליגנד, אשר משמש כנקודת זמן 0.
- מוסיפים את μL 200 של ליגנד (מתוך מלאי של 10 מיקרומטר עד ריכוז סופי של 1 מיקרומטר) לאחר 1 דקות מבלי להפריע את הצלחת / או מיקום התא.
- התמונות הקרינה נאספים במשך 60 דקות לאחר הוספת ליגנד ומאוחסנים כמו תמונות TIFF עם סדר הולך וגדל של שמות הקבצים.
- כל הקבצים הללו יכולים להתבצע כקובצי מחסנית עם תמונות פלואורסצנציה הפרט / בשילוב עם חותמות זמן השימוש בתוכנה.
תהליך של תמונות וכימות של הקרינה של חלבונים לוקליזציה
- רוכשת את התמונות עם התקשורת רגיל (ללא תאים) עם מסננים RFP ו-GFP פלורסנט ולשמור אותם כתמונות רקע. השתמש בתמונות אלה כדי לגרוע תמונות הנתונים בפועל השיג לעיל.
- הכן את ערימת התמונות בנפרד עבור תמונות RFP ו-GFP.
- בחר / להגדיר את האזורים השונים (משטח לעומת cytosolic) כדי למדוד את עוצמת הקרינה של RFP ו-GFP (BLT1 ו β-arrestin טרנסלוקציה)
- מגרש את הקרינה כמות בעוצמות כפונקציה של הזמן. גרף זה יספק מידע על קינטיקה של טרנסלוקציה של מולקולה נתונה.
נציג תוצאות
א מדידת leukotriene ב 4 במאי נדידת תאים דנדריטים
השיטה המתוארת פרוטוקול זה שימש כדי לקבוע את נדידת תאים דנדריטים כלפי leukotriene B 4 (איור 1 וידאו מצורף 1) 21. אנחנו יכולים ליישם מתודולוגיה דומה כדי לקבוע את קיבולת chemotactic התאים ליגנד מסוים בתאים חיים.
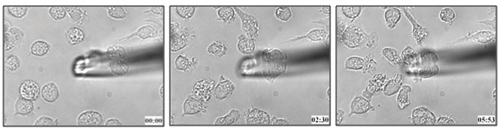
1. איור עכבר מוח העצם נגזר נדידת תאים דנדריטים לכיוון 100 ננומטר LTB 4.
וידאו 1. נדידת תאים חיים של BMDCs כלפי LTB 4. לחץ כאן כדי לראות וידאו .
ב מדידת GPCR (BLT1) ו חלבון Cytosolic (β-arrestin) אינטראקציות, טרנסלוקציה בתאים חיים
עם השלמת הליך זה, ניתן לקבל את המידע הבא באירועים GPCR איתות.
- לוקליזציה של GPCR וחלבונים cytosolic ו גרעין (איור 2).
- ליגנד אינטראקציה המושרה על פני GPCR (BLT1 במקרה זה) עם חלבון cytosolic (β-arrestin במקרה זה) (איור 3).
- קינטיקה של הפנמה הקולטן β-arrestin טרנסלוקציה קרום ואחריו הפנמה יחד עם קולטנים (איור 4) (ג'אלה et al. 2005) 18.
- אפשר לקבוע את הקולטן תלוי ליגנד הפעלת מצב בתאים חיים (מצורף וידאו 2) ולקבוע מוטיבים קריטי או התהליכים הכרוכים הפעלת קולטן (ג'אלה et al. 2005) 18.
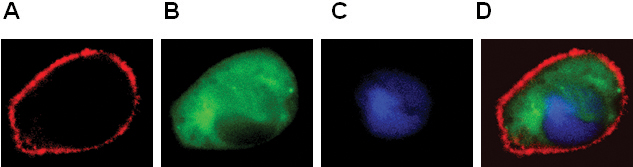
איור 2. הבעת BLT1-RFP (A), β-arrestin-GFP (ב), pNuc-CFP (C) לתוך RBL-2H3 תאים. צבע התמונה המשולבת הראו בלוח ד
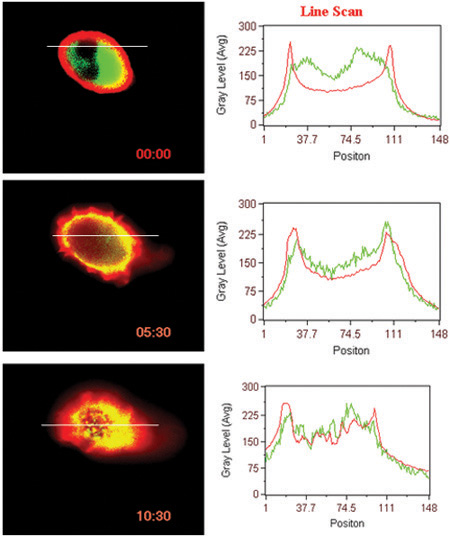
איור 3. טרנסלוקציה ליגנד המושרה של הקולטן β-arrestin. סריקה הקו בעוצמות פלורסנט בתאים מוצגים.
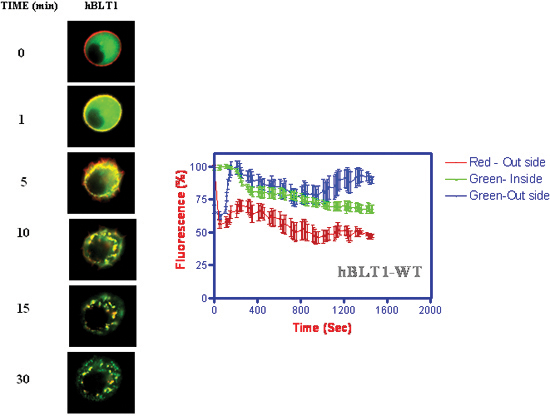
איור 4. קינטיקה של הפנמה הקולטן β-arrestin טרנסלוקציה על תוספת של 1 מיקרומטר LTB 4. עוצמות הקרינה שנמדדו כפונקציה של זמן ומקומות cytosolic קרום התא.
2 וידאו הדמיה חיה של תאים לבטא BLT1-RFP ו-β arrestin-GFP על תוספת של 1 מיקרומטר LTB 4. לחץ כאן כדי לצפות וידאו
Discussion
הדמיה תא חי הוא כלי רב עוצמה כדי להדגים את הפונקציה ואת האינטראקציות של חלבונים מסוימים כפי שהם מתרחשים בזמן אמת. השיטות שתוארו בכתב היד הזה מראים בבירור כי LTB 4 יכול לגרום להגירה מהירה של תאים דנדריטים. שיטות אלה לא רק להרחיב את ההיבטים של פונקציה 4 LTB לסוגי...
Disclosures
Acknowledgements
המחקר נתמך על ידי המכונים הלאומיים לבריאות מענקים AI-52381, CA138623 וקנטקי לחקר סרטן הריאות פורום תמיכה מוסדית של ג'יימס גרהאם בראון Cancer Center.
Materials
| Name | Company | Catalog Number | Comments |
| Rat Basophilic Leukomia Cell line (RBL-2H3) or HEK293 cells. | ATCC | CRL-2256 | |
| Delbecco’s modified Eagle’s Medium (DMEM) | Invitrogen | 11995 | |
| Phenol red free RPMI or DMEM | Invitrogen | 11835-030 | |
| Fetal Bovine Serum | Invitrogen | 16000-044 | |
| L-Glutamine (200 mM) | Invitrogen | 25030 | |
| Penicillin-streptomycin (10000 U/mL) | Invitrogen | 15140 | |
| Trypsin, 0.05% (1X) with EDTA 4Na, liquid | Invitrogen | 25300 | |
| HEPES (1M) | Invitrogen | 15630 | |
| 35 mm sterile glass coverslip-bottomed Fluoro dishes (0.17 mm thick) (WillCo-dish) | World Precision Instruments, Inc. | FD35-100 | |
| Sterile Gene Pulser Cuvette (0.4 cm electrode gap) (Bio-Rad) | Bio-Rad | 16552088 | |
| Gene Pulser II electroporater | Bio-Rad | ||
| TE-FM Epi-Fluorescence system attached to Nikon Inverted Microscope Eclipse TE300 | Nikon Instruments | ||
| Metamorph Software | Universal Imaging | ||
| Vertical Micro-pipette puller | Narishige International | ||
| Micro-Forge M-900 | Narishige International | ||
| Hadraulic Micromanipulator MO-188NE | Narishige International | ||
| Coarse Manual Manipulator, MN-188NE | Narishige International | ||
| cDNA constructs: | |||
| cDNA of G-Protein coupled receptor tagged with red fluorescence protein at C-terminus (hBLT1-RFP) | Jala et al 2005 | ||
| cDNA of cytosolic protein tagged with GFP (β-arrestin1-GFP in present study). | Jala et al 2005 |
References
- Wess, J. G-protein-coupled receptors: molecular mechanisms involved in receptor activation and selectivity of G-protein recognition. FASEB J. 11, 346-354 (1997).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21, 90-113 (2000).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Lefkowitz, R. J. G. protein-coupled receptors. III. New roles for receptor kinases and beta-arrestins in receptor signaling and desensitization. J Biol Chem. 273, 18677-18680 (1998).
- Shenoy, S. K., Lefkowitz, R. J. Multifaceted roles of beta-arrestins in the regulation of seven-membrane-spanning receptor trafficking and signalling. Biochem J. 375, 503-515 (2003).
- . Beta-arrest or. Nature. 383, 447-450 (1996).
- Serhan, C. N., Haeggstrom, J. Z., Leslie, C. C. Lipid mediator networks in cell signaling: update and impact of cytokines. Faseb J. 10, 1147-1158 (1996).
- Tager, A. M., Luster, A. D. BLT1 and BLT2: the leukotriene B(4) receptors. Prostaglandins Leukot Essent Fatty Acids. 69, 123-134 (2003).
- Toda, A., Yokomizo, T., Shimizu, T. Leukotriene B4 receptors. Prostaglandins Other Lipid Mediat. 68-69, 575-585 (2002).
- Haribabu, B. Targeted disruption of the leukotriene B(4) receptor in mice reveals its role in inflammation and platelet-activating factor-induced anaphylaxis. J Exp Med. 192, 433-438 (2000).
- Subbarao, K. Role of leukotriene B4 receptors in the development of atherosclerosis: potential mechanisms. Arterioscler Thromb Vasc Biol. 24, 369-375 (2004).
- Jala, V. R., Haribabu, B. Leukotrienes and atherosclerosis: new roles for old mediators. Trends Immunol. 25, 315-322 (2004).
- Heller, E. A. Inhibition of atherogenesis in BLT1-deficient mice reveals a role for LTB4 and BLT1 in smooth muscle cell recruitment. Circulation. 112, 578-586 (2005).
- Miyahara, N. Requirement for leukotriene B4 receptor 1 in allergen-induced airway hyperresponsiveness. Am J Respir Crit Care Med. 172, 161-167 (2005).
- Terawaki, K. Absence of leukotriene B4 receptor 1 confers resistance to airway hyperresponsiveness and Th2-type immune responses. J Immunol. 175, 4217-4225 (2005).
- Shao, W. H., Del Prete, A., Bock, C. B., Haribabu, B. Targeted disruption of leukotriene B4 receptors BLT1 and BLT2: a critical role for BLT1 in collagen-induced arthritis in mice. J Immunol. 176, 6254-6261 (2006).
- Kim, N. D., Chou, R. C., Seung, E., Tager, A. M., Luster, A. D. A unique requirement for the leukotriene B4 receptor BLT1 for neutrophil recruitment in inflammatory arthritis. J Exp Med. 203, 829-835 (2006).
- Jala, V. R., Shao, W. H., Haribabu, B. Phosphorylation-independent beta-arrestin translocation and internalization of leukotriene B4 receptors. J Biol Chem. 280, 4880-4887 (2005).
- Jala, V. R., Haribabu, B. Real-time analysis of G protein-coupled receptor signaling in live cells. Methods Mol Biol. 332, 159-165 (2006).
- Del Prete, A., A, . Regulation of dendritic cell migration and adaptive immune response by leukotriene B4 receptors: a role for LTB4 in up-regulation of CCR7 expression and function. Blood. 109, 626-631 (2007).
- Salogni, L. Activin A induces dendritic cell migration through the polarized release of CXC chemokine ligands 12 and 14. Blood. 113, 5848-5856 (2009).
- Boudreau, J., Koshy, S., Cummings, D., Wan, Y. Culture of myeloid dendritic cells from bone marrow precursors. J Vis Exp. , (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved