A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Assay Slice Organotypic עבור זמן לשגות הדמיה ברזולוציה גבוהה נדידת הנוירונים במוח אחרי לידה
In This Article
Summary
פרוטוקול זה מתאר assay פרוסה organotypic אופטימיזציה עבור המוח לאחר הלידה ברזולוציה גבוהה זמן לשגות הדמיה של הגירה neuroblast בזרם נודדות מקורי.
Abstract
Neurogenesis במוח לאחר הלידה תלוי ותחזוקה של שלושה אירועים ביולוגיים: הפצת ובתאים, הגירה של neuroblasts, כמו גם ההבחנה והאינטגרציה של נוירונים חדשים לתוך מעגלים עצביים הקיימים. עבור neurogenesis הלידה של נורות חוש הריח, אירועים אלה הם נפרדים בתוך שלושה תחומים מובחנים מבחינה אנטומית: התפשטות מתרחשת בעיקר באזור subependymal (SEZ) של החדרים לרוחב, נודדות neuroblasts לעבור דרך הנחל נודדות מקורי (RMS), ו נוירונים חדשים להבדיל לשלב בתוך נורות חוש הריח (OB). שלושת התחומים לשמש פלטפורמות אידיאליות ללמוד את מנגנוני הסלולר, המולקולרית, ואת פיזיולוגיים המווסתים את כל האירועים ביולוגי מובהק. מאמר זה מתאר assay פרוסה organotypic אופטימיזציה עבור רקמת המוח לאחר הלידה, שבה התנאים תאיים מקרוב לחקות את הסביבה vivo להעברת neuroblasts. אנו מראים כי assay שלנו מספק לתנועה אחידה, אוריינטציה, ומהירה של neuroblasts בתוך RMS. Assay זה יהיה מתאים במיוחד ללימוד תקנה תא אוטונומית ובלתי אוטונומי של הגירה העצבית על ידי ניצול צולבות השתלת גישות מעכברים על רקע גנטי שונה.
Protocol
י נהלים
הטכניקות הבאות צריכה להתבצע בתנאים סטריליים, במנדף זרימה למינרית, תוך שימוש בכלים מעוקרים.
הכנה של מנות תחתית זכוכית פרוסות organotypic
- המנות חייב להיות מוכן בסביבה סטרילית שימוש בכלים מעוקרים.
- ירידה 150μL של המדיום פרוסה (ראה מתכונים) ממוקם במרכז החלק זכוכית בתחתית הצלחת בזהירות כדי למנוע בועות אוויר במדיום.
- עם מזרק חד פעמי מצויד 23 מחט מד, כתמים רבים של דבק (גומי מלט -, של אלמר חתול # E904) ממוקמים בשולי הכיכר הסמוכה coverslip בחוזר כי תופסת את מרכז הצלחת התרבות, תוך השארת צד אחד העשתונות לצורך החלפת נוזל (איור 1). סוג של דבק ברשימה אינו רעיל את פרוסות או התאים מיושם כמו בפרוטוקול זה. הטיפול חייב להינתן כדי למנוע הצבת כל דבק על להחליק את מכסה זכוכית כמו זה יהיה פוגעים ולחסום הדמיה הפרוסות מאוחר יותר. קרום nucleopore (קוטר 25 מ"מ, גודל הנקבוביות 8.0μm - Whatman, חתול # 110614) הוא מונח על גבי coverslip הזכוכית, באמצעות נקודות דבק כדי לאבטח אותו במקומו. זה צריך להיעשות באמצעות מלקחיים מיקרו, תוך הקפדה כי בועות אוויר לא לכודים בין coverslip הזכוכית הממברנה.
- הוסף 1 מ"ל בינונית פרוסה על גבי הממברנה. המנות מונחות באינקובטור במשך 30 דקות ולאחר מכן על הקרח, עד מוכן לשימוש.
מיצוי של המוח לאחר הלידה המוקדמת
התוצאות הטובות ביותר מושגות כאשר פרוסות מוכנים מעכברים הלידה צעירים (P1-P10).
- גורים מורדמים סופניים (מנת יתר) על ידי שיטות אישרה isofluorane או אחר. ראש ניתן לרסס עם אתנול 70% כדי להגדיל עקרות, ואחריו עריפת ראש מהיר באמצעות מספריים חדים.
- הראש הוא התייצב על ידי כיווץ הלסת התחתונה עם מלקחיים מיקרו. העור הוא נכרת longitudinally מהצוואר אל החרטום. הגולגולת היא לחתוך longitudinally ו anteriorly החל צ'יסטרנה magna, על ידי ביצוע המדיאלי 1 ו 2 חתכים לרוחב (אחד בכל צד - 2A איור). יש להקפיד למזער מגע עם הרקמה הבסיסית בקליפת המוח כמו דשי גולגולתי יוסרו מן המוח.
- כדי לשפר את היציבות של הרקמה במהלך חתך vibratome, לרוחב, רוב ההיבטים של המוח מוסרים על ידי ביצוע שני חתכים sagittal. ההיבט הזנב של המוח מוסר גם על ידי ביצוע חתך בבסיס מקורי של המוח הקטן (2B איור).
- שתי ההמיספרות מופרדים על ידי ביצוע חתך חלקה לאורך הבקע קו האמצע, ושתי האונות אסף בזהירות את הגולגולת והניח, המשטח המדיאלי למטה, עובש הטבעה (איורים 2C-D).
חתך של המוח מארח
- שתי ההמיספרות במתכונת הטבעה מכוסים מיד עם מומסת 3% נקודת התכה נמוכה DNA כיתה agarose ג'ל (פישר, חתול # BP1360-100) מומס חיץ רקמות הכנה שמתוחזק על 37 מעלות צלזיוס (ראו מתכון). אחרי 2 דקות של ייצוב על משטח אופקי שטוח כדי להבטיח גם התקשות של agarose, תבניות ממוקמים על הקרח כדי להשלים את ההגדרה.
- לאחר ג'ל המכיל את ההמיספרות מוגדר, היא להסיר עובש וגזוז, והשאיר 2-3mm של ג'ל סביב רקמת המוח.
- ג'ל מוטבע הרקמה מותקן אז בדיסק של הדגימה vibratome, עם השטח המדיאלי כלפי מעלה, מאובטח עם דבק cyanoacrylate (המקבילה בדבק מגע או דבק). יש להקפיד להפעיל רק כמויות מינימליות של דבק, כמו יותר מדי יהיו ההשפעות הרעילות על פרוסות תאים נודדים. דבק יותר מדי על הצדדים של הבלוק גם לעכב את החיתוך, גרימת נזק פוטנציאלי לרקמות.
- הדיסק מותקן במגש הדגימה vibratome מלא מדיום קר כקרח הכנה רקמות.
- הרקמה מחולק על עובי 150μm, עם מהירות vibratome להגדיר על מגוון איטי עד בינוני (תלוי vibratome בשימוש, וכך צריכה להיקבע באופן עצמאי עבור תוצאות אופטימליות). בידיים שלנו, את תדירות הרטט הוא אופטימלי כאשר נקבע מקסימלית. פרוסות הראשונים עשוי להיות מושלך.
- ברגע RMS המכילים פרוסות משתחררים להב (RMS גלוי בעין בלתי מזוינת כמבנה אפור בצורת U המשתרעת SEZ אל OB), הם התגרו בזהירות מתוך התבנית ג'ל, וגרף בעזרת מרית קטנה flathead. פרוסות ממוקמות על הממברנה nucleopore של הזכוכית התחתונה מנות המכילות בינוני פרוסה (איור 3A-B). המוח טיפוסי מוקדם לאחר הלידה עכבר תניב כ 2-3 סעיפים RMS לכל בחצי הכדור כאשר לחתוך ב 150 מיקרומטר. זה קריטי, כי הטיפול פרוסות היא למינימום כפי שהם מאוד שביר. מנות עם פרוסות מועברים לאחר מכן באינקובטור.
התורם המוחחתך ו RMS השתלה
- מוחות התורם (המוח לבטא כתבים ניאון נודדות neuroblasts) הם מחולק על עובי 250μm ופרוסות נאספים למאגר קר כקרח הכנה רקמות.
- Slices ממוקמות מיד תחת מיקרוסקופ עם יכולת לנתח epifluorescence, ואת ה-RMS הוא microdissected בעדינות, בעזרת מלקחיים מיקרו. אחת מלקחיים משמש כדי לייצב את נתח בעוד השני משמש כדי להפוך את חתכים קטנים סביב RMS עד שהוא שוחרר מן הפרוסה. RMS נכרת אז הוא חתך לתוך explants קטן (כ 200-500 מיקרומטר קוטר) לפני ההשתלה.
- זכוכית התחתונה מנות המכילות פרוסות המארחת ממוקמת על מסנני nucleopore יוסרו מן האינקובטור והניח מתחת למיקרוסקופ לנתח. בעזרת האור הנראה, RMS מזוהה בבירור חתך קטן עשוי במגזר הראשוני של ה-RMS.
- שימוש pipettor מצויד טיפ 20 μL, תורם יחיד RMS explant מועבר לאתר מחורצים ב RMS המארח. Explant הוא דחף בעדינות לתוך החתך ליצור קשר בין 2 רקמות. כדי להבטיח את הקשר הזה הוא יציב, explants הם דחפו מעט בין פרוסה לבין קרום nucleopore.
- ברגע שכל פרוסות המארחת עם RMS מושתלים, המנות חזרו בחממה במשך שעה לפחות 1, כדי לאפשר את הסעיפים להתיישב על הממברנה. Neuroblasts צריך להתחיל לעבור מ explant לתוך המארח RMS לאחר כ 1-2 שעות.
זמן לשגות הדמיה של נדידת נוירונים
- זכוכית התחתונה המנות מועברות מן החממה לחדר מודגרות על המיקרוסקופ (איור 3 ג). Neuroblasts פלורסנט ניתן הדמיה במרווחים שנעים בין 0 ל 10 דקות תלוי בסוג הניתוח המבוקש. לדוגמה אנו התמונה הדינמיקה cytoskeletal במהלך מחזור הנדידה של neuroblasts הפרט על ידי הגדרת מרווחי שלנו פחות או שווה ל 2.5 דקות. עם זאת, הדינמיקה באוכלוסייה כגון התמצאות מהירות ההגירה נלכדים יותר במרווחי זמן הנעים בין 5 עד 10 דקות. בחירת היעדים היא משתנה מאוד בהתאם למותג של המיקרוסקופ. עבור מיקרוסקופ Nikon C1 confocal, אנו מוצאים את העדשה 20x יבש (ניקון פאן פלואוריד, 0.75 NA, WD 0.35mm) הוא המתאים ביותר עבור מנתח שלנו. לקבלת התוצאות הטובות ביותר במערכת זו confocal, חריר נפתח לגודל בינוני (60μm קוטר). עבור התנהגות הנדידה המתאימה ביותר, הדמיה מוגבל תאים עמוק בתוך עובי של RMS, לפחות 20 מיקרומטר הרחק אחד משטחי לחתוך של הפרוסה. כוח לייזר צריך להיות מותאם כך שהוא לכל הפחות, אבל את הפרטים של neuroblasts בודדים נשארים גלויים.
- לאחר השלמת הדמיה פרוסות יכול להיות קבוע עם קר קרח, שזה עתה הוכנו paraformaldehyde 4%, immunostained, רכוב על שקופיות עבור דימות נוספות. מכיוון שאנו לא מעיל ממברנות שלנו עם כל חסיד מצעים כגון laminin, פרוסות בדרך כלל לצוף הרחק הממברנה פעם הם שקועים מאגרים מכתים. מדורים הם צילמו תוך שמירה על עובי 150 מיקרומטר שלהם. זה גם אפשרי cryopreserve ולהקפיא את פרוסות ולהשתמש cryostat להשיג חלקים של מדלל את פרוסות המקורי. עם זאת, זה יגרום לעלייה בשכיחות חפצים מכתים כמו גם לשנות את שלמות הרקמה.
השנייה. חומרים / ציוד
הכנה של מנות תחתית זכוכית פרוסות organotypic
- מזרקים קטנים (1 מ"ל)
- 23 מד מחטים
- עקוב אחר Nucleopore-Etch ממברנה - 25mm קוטר, 8.0μm גודל הנקבוביות - Whatman, חתול # 110614
- תחתית זכוכית תרבות צלחות - צלחת פטרי 35mm, 14mm microwell, מס '1.5 coverglass - MatTech, חתול # P35G-1.5-14-C
- גומי מלט -, של אלמר חתול # E904
- בינוני הנשר בסל - Gibco, חתול # 21010
- Hepes 1M (pH7.4)
- 1M D-גלוקוז
- 100mm CaCl 2
- MgSO 100mm 4
- 1M NaHCO 3
- DH 2 O
- 200mm L-גלוטמין
- פניצילין, סטרפטומיצין
המוח חילוץ והטבעה
- הרדמה (isofluorane, וכו ')
- מיקרוגל
- התכה נמוכה agarose - פישר, חתול # BP1360-100
- הדבק בדבק מגע - חתול # KG585
- פיל-A-Way והטבעה תבניות חד פעמיות (R-40) - מלבני 22mmx40mm, 20mm עמוק - Polysciences, חתול # 18646C
מוח חתך ו RMS השתלה
- Vibratome - לייקה VT1000S ואת כל הרכיבים אביזר להכנת פרוסה
- האנק 10X של פתרון מאוזן מלח - Gibco, חתול # 14185
- מלקחיים Microdissecting # 5 - Roboz, חתול # RS-4976
- Microspatula - פישר, חתול # 21-401-15
- Stereomicroscope
זמן לשגות הדמיה שלorganotypic פרוסות
- החממה Humidified, 5% CO 2
- הפוך מיקרוסקופ המצויד באינקובטור קאמרית למרחקים ארוכים מטרות העבודה (NA של 0.6 ומעלה)
ג. מתכונים
מאגר פתרון לנתיחה רקמה והכנת פרוסה (הכנת החיץ רקמה)
| במלאי פתרון | נפח | סופי Concetration |
| 10X HBSS | 50 מ"ל | 1X |
| Hepes 1M (pH 7.4) | 1.25 מ"ל | 2.5mm |
| 1M D-גלוקוז | 15 מ"ל | 30mm |
| 1M CaCl 2 | 0.5 מ"ל | 1mm |
| 1M MgSO 4 | 0.5 מ"ל | 1mm |
| 1M NaHCO 3 | 2 מ"ל | 4 מ"מ |
| DH 2 O | 430.75 מ"ל |
סנן לעקר עם מסנן 0.2 מיקרומטר ולאחסן ב 4 ° C.
תרבות בינונית פרוסות organotypic, השתלת רקמות הדמיה (בינונית פרוסה)
| במלאי פתרון | נפח | הריכוז הסופי |
| בינוני בסל הנשר | 35 מ"ל | |
| הכנת רקמות החיץ | 12.9 מ"ל | |
| 1M D-גלוקוז | 1.35 מ"ל | 20mm |
| 200mm L-גלוטמין | 0.25 מ"ל | 1mm |
| פניצילין, סטרפטומיצין | 0.5 מ"ל | 100units / mL פניצילין 0.1mg / mL סטרפטומיצין |
סנן לעקר עם מסנן 0.2 מיקרומטר ולאחסן ב 4 ° C.
הכנת נקודת התכה נמוכה agarose ג'ל
התכה נמוכה נקודות agarose הוא מדולל במאגר הכנת הרקמה ב 0.3g / mL בצינור חרוטי 50 מ"ל (ראו מתכון). הצינור הוא במיקרוגל במרווחים של 5-10 שניות בהספק גבוה. מספר במרווחים תלוי הנפח הכולל, עבור 10 מ"ל, שלוש במרווחים (10-8-5 שניות כל אחד) צריך להספיק. כובע הצינור היא פתחה בזהירות בין במרווחים חימום לשחרר את לחץ האוויר ולמנוע פיצוץ של צינור. זהירות יש לנקוט את תוכן הצינור יהיה חם מאוד. לאחר agarose הוא נמס לגמרי, הצינור נשמר בתוך אמבט מים 37 מעלות צלזיוס במשך לפחות 5 דקות, כדי לאפשר הטמפרטורה לייצב לפני השימוש. חשיפה ממושכת בטמפרטורת החדר יהיה להקשיח את הג'ל. למרות זאת יש להימנע ככל האפשר, ג'ל מוקשה ניתן מחוממים מחדש נמס לשימוש מיידי בתוך 24 שעות של הכנה הראשונית.
אימונוהיסטוכימיה על פרוסות organotypic
בעקבות הדמיה על מיקרוסקופ confocal, פרוסות עשויים להיות קבועים לילה עם פורמלין 4% PBS ב -4 מעלות צלזיוס. מדורים חסומים אז לילה ב 4 ° C, בסרום עיזים 10% עם 1% טריטון X (Sigma, חתול. # S26-36-23) ב-PBS ואחריו הדגירה לילה עם נוגדנים העיקרי ב 4 ° C. נוגדנים עזים fluorescently-tagged משניים משמשים להדמיה (כל 1:1000 בדילול מלא, 1 הדגירה שעה בטמפרטורת החדר). פרוסות תווית נשטפים ביסודיות 5-6 פעמים עם קרח קר PBS לפני הרכבה בשקופיות זכוכית coverslipping.
IV. נציג תוצאות
התרבות שלנו פרוסה פרוטוקול organotypic נבדק ביסודיות על אופטימיזציה כי בשנים האחרונות עבור עקביות דפוס הגירה והכיוון. ניתוח של תאים מהגרים מן explants שהתקבלו בעכברים בהם ביטוי של חלבון פלואורסצנטי אדום, TD-עגבניות, מושרה תחת האמרגן Nestin (Nestin-Td עגבניות), מגלה הגירה אוריינטציה מאוד מהירה של tdTomato + neuroblasts לתוך המארח RMS ( איור 4 א). הגדלה גבוהה זמן לשגות ניתוח מדגים ברזולוציה מצויינת של אורך neuroblast נודדות במהלך 20 דקות הדמיה (איור 4 ב).
פרוסות עם התורם TD-עגבניות + תאים היו קבועים immunostained עבור רכיבים סלולריים שונים בתוך ה-RMS. GFAP + האסטרוציטים ו CD31 + כלי הדם התגלו באמצעות אימונוהיסטוכימיה ניאון (איור 5 א). הגדלה גבוהה ניתוח של פרוסות מוכתם עבור אקטין את החלבונים טובולין cytoskeletal ולחשוף לא אחידה ביטוי של מרכיבים אלה על ידי תא בעיצומה של ההגירה (איור 5 ב).
נוגדנים המשמשיםאלה דוגמאות: שפן נגד RFP (Abcam, 1:250), ארנבת אנטי GFAP (Dako, 1:1000), חולדה אנטי CD31 (BD Pharmigen, 1:100), עכבר אנטי אקטין (סנטה קרוז, 1: 500), ארנבת אנטי טובולין (Sigma, 1:1000), עז אנטי עכבר Cy3 (Chemicon, 1:1000), נגד ארנב עז AlexaFluor 647 (Invitrogen, 1:1000), חולדה אנטי עז AlexaFluor 488 (Invitrogen , 1:1000), עז נגד ארנב AlexaFluor 488 (Invitrogen, 1:1000).
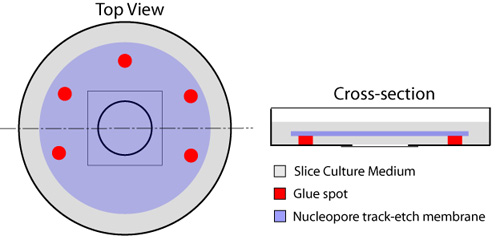
באיור 1. הכנת זכוכית התחתונה מנות עבור פרוסות organotypic. כתמים מרובים של דבק ממוקמים סביב מרכיב הזכוכית התחתונה חוזר של המנה (אדום), עוזב צד אחד פתוח חילופי בינוני מתחת המסנן. ירידה 150μL של המדיום פרוסה ממוקמת במרכז coverslip הזכוכית. קרום nucleopore (כחול) מוחל אז, הצד המבריק כלפי מטה, תוך הקפדה כי אין בועות אוויר לכודות בין coverslip הזכוכית הממברנה. אחת למיליליטר של המדיום פרוסה (אפור) משתרע על גבי קרום, ומנות מודגרת ב 37 מעלות לפני השימוש.
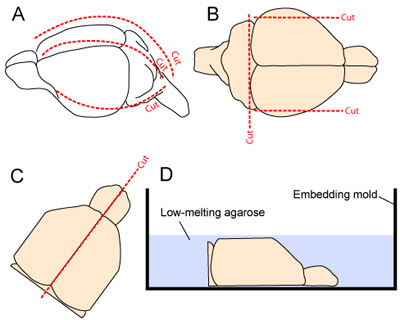
איור 2. המוח מיצוי והכנה חתך. (א) הגולגולת נחשף על ידי חריטה הקרקפת מהצוואר אל החוטם (קו מקווקו לאורך קו האמצע). הגולגולת היא לחתוך אז longitudinally ו anteriorly החל צ'יסטרנה magna, על ידי ביצוע המדיאלי 1 ו 2 חתכים לרוחב (אחד בכל צד, א '2). (ב) לרוחב, רוב ההיבטים של קליפת המוח לבין ההיבט הזנב של מערכת העצבים המרכזית הם resected כדי לשפר את יציבות של הרקמה במהלך חתך vibratome. (CD) שתי ההמיספרות מופרדות אז והניח הפנים המדיאלי למטה עובש הטבעה לפני היישום של ג'ל agarose 3% מומס חיץ הכנה רקמות.
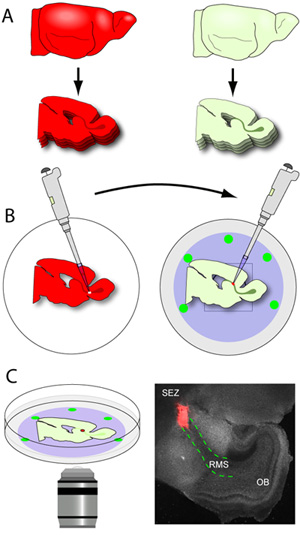
איור 3. מוח חתך ו צולבות השתלה. (א) רקמה מארח מחולק על עובי 150μm, ואת RMS המכילים קטעים ממוקמים בזהירות שטוח על הממברנה nucleopore זכוכית התחתונה מאכלים קרים. (ב) תורם מוח (המוח לבטא כתבים ניאון RMS) הם מחולק ב עובי 250μm, ואת פרוסות נאספים למאגר קר כקרח הכנה רקמות. RMS התורם הוא microdissected וחותכים explants קטן. שימוש pipettor מצויד טיפ 20 μL, הפרט explants RMS מועברים לאתר חרוט המארח RMS. (ג) לאחר 1-2 שעות של דגירה, המנות מועברות בשלב מודגרות על מיקרוסקופ confocal והגירה נתפס באמצעות זמן לשגות הדמיה. Photomicrograph הוא נציג תמונה בהגדלה נמוכה פרוסת טיפוסי (אפור) להגדיר 1 שעה לאחר ההשתלה (explant אדום tdTomato + RMS עכבר התורם; אדום מתווה קווים מקווקווים RMS ב פרוסה המארחת).
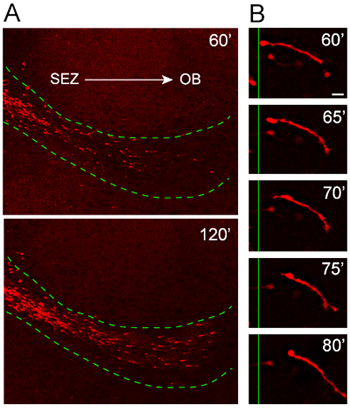
איור 4. הגירה של neuroblasts מ explants לתוך RMS המארח. (א) Nestin-tdTomato + neuroblasts (אדום) להגר מן explants לתוך המארח RMS (קו ירוק מקווקו) 1 שעה לאחר ההשתלה. tdTomato + תאים פולשים RMS של המארח פרוסות organotypic לנוע בצורה מכוונת מאוד מהירה הרחק SEZ וכלפי OB. (ב) מחזור הנדידה ניתן לצפות כוח גבוהה זמן לשגות תמונות של neuroblast מעל כ 20 דקות התקופה. בר סולם = 10 מיקרומטר.
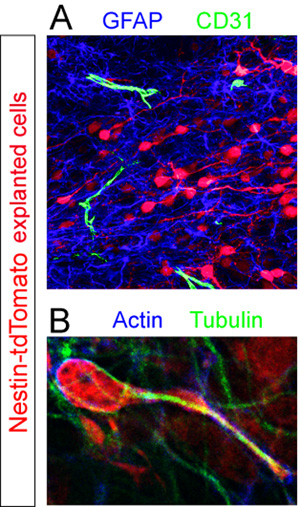
איור 5. הערכה immunohistochemical של פרוסות organotypic. Neuroblasts Explanted (אדום) נקבעו בעיצומו של הגירה 12 שעות שלאחר ההשתלה. (א) מכתים immunohistochemical פלורסנט של הפרוסה מגלה בריכה צפופה של GFAP + האסטרוציטים (כחול) מפוזרים CD31 + כלי דם (ירוק) בתוך ה-RMS של הפרוסה המארח. (ב) cytoskeleton של tdTomato מבודדים + תא נודדות (אדום) בתוך שורה RMS מתגלה על ידי שיתוף immunostaining באמצעות נוגדנים נגד אקטין (כחול) טובולין (ירוק).
Discussion
נדידת נוירונים ב-RMS היא מרכיב חיוני של neurogenesis הלידה של נורות ההרחה 1. הגירה דרך RMS מתרחשת במטוס משיק אל פני השטח של המוח. Neuroblasts בעקיפין נודדות נבדלים רדיאלית נודדות תאים בהתבסס על המיקום של מקור אב שלהם, כמו גם גורלם השונה של מוצרים העצבית הסופי 1, 2, 3. אוכלוסי...
Disclosures
Acknowledgements
אנו מודים דן McWhorter עבור המספרת על פרוטוקול בסרטון. עבודה זו נתמכת על ידי NIH גרנט 5R01NS062182, מענק הפדרציה האמריקאית לחקר הזדקנות, מוסדיים וקרנות הוענק HTG.
References
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved