Method Article
דימות אופטי של נוירונים גנגליון סרטן Stomatogastric עם מתח רגיש צבעים
In This Article
Summary
כאן אנו מציגים את המתודולוגיה של מהיר הדמיה ברזולוציה גבוהה פלואורסצנטי מתח רגיש צבען של פעילות מפורט של נוירונים הגנגליון stomatogastric סרטן.
Abstract
מתח רגיש הדמיה צבען של נוירונים היא מתודולוגיה מפתח להבנת אופן רשתות נוירונים מאורגנים וכיצד פעילות סימולטנית של הנוירונים המשתתפים מוביל הופעתה של פונקציונליות אינטגרלי של הרשת. כאן אנו מציגים את המתודולוגיה של היישום של טכניקה זו כדי לייצר נוירונים דפוס מזוהה ב הגנגליון סרטן stomatogastric. אנו מדגימים את הטעינה של הנוירונים האלה עם הניאון מתח רגיש לצבוע Di-8-ANEPPQ ואנחנו מראים כיצד התמונה את הפעילות של הנוירונים טעון לצבוע באמצעות MiCAM02 מהירות גבוהה ברזולוציה גבוהה מצלמה CCD מערכת הדמיה. אנו מדגימים את ניתוח הנתונים הדמיה רשמה באמצעות תוכנת הדמיה BVAna הקשורים MiCAM02 מערכת ההדמיה. הדמיה סימולטני מתח רגיש לצבוע פעילות מפורט של נוירונים מרובים הגנגליון סרטן stomatogastric מיושם יחד עם טכניקות מסורתיות electrophysiology (הקלטות תאיים תאית) נפתח באופן קיצוני הזדמנויות חדשות להבנה של איך לעבוד מרכזי גנרטור דפוס רשתות עצביות.
Protocol
1. הכנה של מערכת העצבים סרטן Stomatogastric
למבוגרים סרטן pagurus ל נתקבלו ממקורות מקומיים (אוניברסיטת ניוקסל, דאב ימית מעבדות) ונשמרות, מי ים מסוננים סודה (10-12 ° C). בעלי חיים היו הרדים אותם על ידי אריזה קרח למשך 20-40 דקות לפני החיתוך. היינו מבודדים מערכת העצבים stomatogastric (STNS) 1. STNS היו מרותקים סיליקון מצופה אלסטומר (ELASTOSIL RT-601, וואקר, מינכן, גרמניה) צלחת פטרי superfused ברציפות (7-12 mL / min) עם תמיסת מלח צונן (10-13 ° C). תמיסת מלח פיזיולוגית מורכבת (mmol * l-1): NaCl, 440; MgCl 2, 26, CaCl 2, 13; KCl, 11; trisma בסיס, 10; חומצה maleic, 5. מלוחים נשמר בטמפרטורה קבועה של 11-13 מעלות צלזיוס, ב-pH 7.4-7.6.
הצעדים המפורטים של הניתוח STNS והכנה, כולל desheathing של הגנגליון stomatoastric (STG), מוצגים במאמר יופיטר על ידי Guttierez ו Grashow 1. כל הניסויים בוצעו בהתאם להוראה המועצה האירופית של הקהילות ה 24 נובמבר 1986 (86/609/EEC). איור 1 א מציג תרשים סכמטי של STNS ו-1B איור מראה STG desheathed טיפוסי שיש נוירונים שלו מסודרים כמו בחצי עיגול שטוח בחלקו האחורי של הגנגליון.
צלחת פטרי עם STNS הוא קבוע לפלטפורמת הפעלה של המיקרוסקופ הדמיה (BW51 WI, אולימפוס, טוקיו, יפן) עם פלסטלינה. שניהם, בשלב מיקרוסקופ מיקרוסקופ הם רכובים על השולחן רטט מבודדים (Scientifica, אוקפילד, בריטניה) כדי למנוע חפצים תנועה במהלך ההקלטה האופטי. דפוסי המנוע שנוצר הגנגליון stomatogastric (STG) מנוטרים באמצעות הקלטות תאי 2-4. הדבר נעשה באמצעות השלבים הבאים:
- תא גלילי וזלין מבוסס בנויה סביב קטע של העצב המוטורי הראשי (lvn) כדי לבודד חשמלית את העצב מהאמבטיה (זה נעשה על הבמה לנתיחה לפני צלחת פטרי מושם על פלטפורמת ההפעלה של המיקרוסקופ הדמיה ).
- אחד שני חוטים אלקטרודה נירוסטה ממוקם בתא הזה, והשני באמבטיה כמו אלקטרודה התייחסות.
- האות ההפרש נרשם, מסונן מוגבר עם מגבר ההפרש AC (Univ. קייזרסלאוטרן, גרמניה).
- הפעילות המוטורית של הגנגליון היא לנטר באמצעות אוסצילוסקופ (DL708E; Yokogawa, טוקיו, יפן) נרשם בנוסף באמצעות לוח רכישת נתונים (Power CED, 1401, קיימברידג' Electronic Design, קיימברידג', אנגליה) ואת ספייק 2 v6.10 תוכנה (Electronic Design קיימברידג', קיימברידג', בריטניה). קבצים מנותחות באמצעות ספייק 2 v6.10 (Electronic Design קיימברידג', קיימברידג', בריטניה).
2. הכנת הפתרון דיי
השתמשנו פלורסנט מתח רגיש לצבוע Di-8-ANEPPQ (קיימברידג' Bioscience) 5, שבו יש מטען חיובי כפול המאפשרת טעינה של צבע באמצעות microelectrodes באמצעות פולסים הנוכחית חיובי. הפתרון לצבוע צריך להיות מוגן מפני אור ככל האפשר. הפתרון לצבוע מוכן כדלקמן:
- 5 מ"ג של צבע מעורבב עם 1 מ"ל של חומצת ה-F-127 Pluronic בתמיסה (Invitrogen) DMSO.
- בקבוקון פלסטיק המכילים את צבען מומס הוא centrifuged במשך 20 דקות על 12,000 סיבוב / דקה Microcentrifuge 14/01 סיגמא (Sigma, Osterode, גרמניה) על מנת להפריד חלקיקי צבע גדולים שעלולים לסתום את microelectrode.
- Supernatant (μL העליון 200) של הפתרון לצבוע מופרד באמצעות pipettor ומאוחסנים בקבוקון פלסטיק נפרדת. צלוחיות שניהם עטופים בנייר אלומיניום, כדי למנוע חשיפה לאור.
- הפתרון הוא לצבוע קפוא ב -20 ° C.
- לפני השימוש פתרון צבע הוא נמס ידי הצבת את הבקבוקון סגור עטוף חם (25 ° C) מים במשך 10-15 דקות.
3. טוען דיי על ידי Injection תאיים באמצעות Microelectrodes שארפ
השתמשנו microelectrodes חדה כדי לטעון את הנוירונים עם הצבע. כדי לבדוק את טעינת לצבוע אנו משתמשים במערכת הדמיה MiCAM02 (SciMedia, טוקיו, יפן) 6. מערכת הדמיה יש שתי מצלמות CCD: מצלמה HR יש שבב חיישן גדול יותר (6.4 מ"מ x 4.8 מ"מ) מספק רזולוציה מרחבית טובה יותר עם רזולוציה הזמני הכי טוב להיות 1.4 ms, המצלמה HS יש קטן יותר (2.9 מ"מ x 2.1 מ"מ) אך מהר שבב חיישן המאפשר הדמיה מהר לאחר 0.7 מילישניות כמו הפתרון הטוב ביותר שלה הזמני. השלבים של טעינת לצבוע הן כדלקמן:
- Microelectrodes נמשכים עם P-97 לוהטים - בראון (סאטר מכשירים, Novato, קליפורניה, ארה"ב) חולץ באמצעות אלקטרודה 10 ס"מ אורך, 1 החיצונית מ"מ קוטר צינורות זכוכית עם נימה (GB100TF 8P, מוצרים המדע, Hofheim, גרמניה). האלקטרודות נמשכים יש התנגדות בטווח של 25-40 MOhm ב 3M KCl (עבור המתאים הגדרות פרמטר מושך אחרי בישול פיפטה המסופקים על ידי היצרן של חולץ את האלקטרודה).
- הפתרון הוא לצבוע קפוא מותך כמות קטנה מאוד של זה נשאב לתוך מחט microfil (MicroFil - 34g, מכשירים Precision העולם, סרסוטה, פלורידה, ארה"ב) - הצבע נשאב ממלא סביב rd 2 / 3 של המחט microfil .
- הפתרון לצבוע את המחט microfil מוזרק לתוך קצה microelectrode. Microelectrode ממוקם תיבת חשוך במשך 15 דקות.
- Microelectrode היא backfilled עם פתרון KCl 3M. האלקטרודה ממוקמת ואז חזרה עוד 10-20 דקות לתוך תיבת אלקטרודה כהה אחסון כדי לאפשר את פתרון לצבוע להגיע טיפ נאה של האלקטרודה על ידי שאיבה של כוח נימי הפועל microelectrode.
- Microelectrode מוכן מכניסים בעל אלקטרודה קבוע על headstage של המגבר תאיים (IA-251A, וורנר מכשירים Corporation, Hamden, קונטיקט, ארה"ב).
- המגבר תאיים מחובר ללוח רכישת נתונים שמספק איתות הדופק לנהוג פולסים הנוכחי microelectrode.
- Microelectrode ממוקם בעדינות לתוך הממברנה של נוירון STG באמצעות מניפולטור microelectrode (PatchStar, Scientifica בע"מ, אוקפילד, בריטניה). כיוון ומרחק עבודה המטרה 10x (UMPLFL10XW, NA 0.30, WD 3.3mm, אולימפוס Corporation, טוקיו, יפן) של המיקרוסקופ הדמיה הוא קטן מאוד, microelectrode יש להציב בעמדה אלכסונית (כ ° 30) והתנועה של microelectrode אל המיקום הנכון דורש מספר שלבים מחדש התמקדות המטרה מיקרוסקופ והזזת microelectrode. כדי להפעיל את microelectrode מועבר במצב כזה כי קצהו מעל STG. המטרה מיקרוסקופ הוא הוריד עד קצה האלקטרודה מופיע להתמקד. אז הוא הוריד עוד אבל לא הרבה כמו לגעת microelectrode. Microelectrode הוא הוריד עד שהוא מחדש מופיע למקד את המטרה. שלבים אלה חוזרים על עצמם עד נוירונים מופיעים בבירור במישור המיקוד של המטרה. ואז microelectrode הוא הוריד עד שהיא נוגעת בעדינות חודרת את הממברנה של הנוירון STG שנבחר. זהו פיקוח באמצעות אוסצילוסקופ.
- אלקטרודה תאיים משמש כדי להקליט את הפעילות של הנוירון STG שנבחרו כדי לזהות את נוירון נתון פרופיל הפעילות שלה ואת מערכת היחסים בין פעילותה לבין פעילות STG רשמה האלקטרודה תאיים 2,3,7.
- המגבר תאיים מופעלת למצב זריקה הנוכחי משמש במשך 30 דקות כדי להזריק 10 NA השלבים הנוכחיים חיובית לתוך microelectrode כי האחרון לרגע 1 ו מופרדים 1 הפערים השני עם מוזרק שום הנוכחי microelectrode. הכוננים הנוכחי הזריקו מולקולות צבע חיובי לתוך הנוירון מוקלט. אם הציוד זמין נוירונים מרובים ניתן להזריק בו זמנית.
- עשר דקות לתוך תקופת הזרקה לאחר תום ההזרקה להפיץ את צבען בתוך הנוירון מסומנת. לשם כך אנו משתמשים במערכת MiCAM02 הדמיה (SciMedia בע"מ, טוקיו, יפן) במטרה תאורה 10x ועל ידי מקור Ultra-Low הלוגן אור אדווה (HL-151; Moritex, טוקיו, יפן) דרך MSWG2 הקוביה לסנן (עם עירור 480-550 ננומטר מסנן: Olympus Corporation, טוקיו, יפן). מערכת הדמיה מוגדר להשתמש במצלמה HR עם רזולוציה 192 x 128 פיקסלים, 40 ms זמן הדמיה, במצב "hbin ', ו 10 מסגרות לשנייה מושב הדמיה. אם המילוי הוא מצליח לצבוע הדמיה צריך להראות תיקון צבוע הנוירון סביב המיקום של microelectrode, וזה תיקון צבוע צריך לגדול בין תמונות שצולמו לאחר 10 דקות לאחר 30 דקות. אם התפשטות של צבע אינה מספיקה אחרי 30 דקות, זמן הזרקה יותר מוענקת. לחלופין, אלקטרודה צבע חדש עשוי לשמש.
- אלקטרודה הוא שלף של נוירון לבין הנוירון נשאר לנוח לפחות 2-30 דקות. תוך זמן זה, הנוירון הבא ניתן להזריק עם צבע.
4. הדמיה של נוירונים צבוע
הפעילות של נוירונים ניתן הדמיה לאחר ההליך מילוי הצבע. לחילופין שניים או יותר נוירונים עשוי להיות מלא לתמונה פעילות סימולטני של נוירונים STG מספר. בעיקרון רבים ואולי כל הנוירונים STG יכול להיות מלא עם צבע. הדמיה של נוירונים נעשית עם מערכת הדמיה 02 MiCAM שימוש במצלמה HR. ההליך של הדמיה הוא כדלקמן:
- המטרה היא לשנות מיקרוסקופ אור גבוהה הילוכים יעילות 20x אובייקטיבי (XLUMPLFL20XW/0.95, NA 0.95, WD 2.0mm: Olympus Corporation, טוקיו, יפן) משמש לאיסוף נתונים הדמיה. מטרה זו אוספת הרבה יותר קל כי מטרת 10x וגם נותן הגדלה גבוהה מתן תמונה מפורטת יותר של הנוירונים. ביין g אמצעי יעיל יותר אור, כי כמות קטנה של צבע טוען כבר גלוי עם יעד זה, וגם כי אנחנו יכולים להשתמש בעוצמת אור נמוכה עבור הדמיה לצמצם את הנזק הפוטנציאלי תמונה שעלול להיגרם לתאי העצב על ידי הצבע.
- שלב ההפעלה של מיקרוסקופ ממוקם כך הנוירונים, כי הם אמורים להיות צילמו הם בתחום המבט של המטרה ואת המטרה ממוקדת על אותם.
- הנתונים הקלטה תאיים מוזן גם דרך ערוץ קלט אנלוגי שלה אל תוך מערכת MiCAM 02 הדמיה. זה מאפשר בקלות יחסית המתייחס של אותות אופטיים ודפוסי המנוע המקביל או קוצים רשמה extracellularly בשלב ניתוח.
- המערכת 02 MiCAM מוגדר להשתמש 96 x 64 פיקסלים עם הזמן 2.2 הדמיה ms או 48 x 32 פיקסלים עם הזמן דימות 1.5 ms. בשני המקרים "hbin" הגדרת ניתן להשתמש אם צביעה של נוירונים אינו חזק מאוד.
- רמת האור מוגדר נמוך ככל האפשר (כלומר לצבוע בנוירונים צריך ליצור עדיין הקרינה מספקת הדמיה), כדי למנוע צילום אפנון נזק תמונה של הנוירונים מוקלט.
- התאורה בחדר, וכל שאר מקורות אור כבויים. בנוסף, וילון שחור יכולות להיות סגורות סביב המתקן את ההקלטה, כדי למנוע חשיפה לאור ממקורות חיצוניים.
- המפגשים הדמיה נקבעים להיות בין 4-16 שניות ארוכות.
- פעילות ספונטנית של הנוירונים צבוע נרשם על מפגשים הדמיה מספר.
5. ניתוח של נתוני דימות אופטי
כדי לנתח את הנתונים הדמיה השתמשנו בתוכנה BVAna (גרסה 10.08; SciMedia בע"מ, טוקיו, יפן) הקשורים למערכת הדמיה MiCAM 02. התוכנה תומכת ויזואליזציה של נתונים הדמיה מספקת מגוון של כלי ניתוח גם כן. השלבים של ניתוח נתונים ופרשנות הן כדלקמן:
- האזור מעגלי המתאים עניין נבחרה על כל הנוירונים מוקלט. בדרך כלל אנו משתמשים 2-3 רדיוס פיקסל אזורים של עניין לחקירת נוירונים ב ברזולוציה 48 32 פיקסלים, ו 6-8 רדיוס פיקסל אזורים של עניין לחקירת נוירונים ברזולוציה 96 x 64.
- החלקה הזמני של הנתונים עשוי להיות נחוץ, במיוחד אם צבע מפיק כמות נמוכה יחסית של ערך (הקרינה רקע נמוך בנתונים מצביע על זה, זה יכול להיות בגלל רמת האור נמוכה המשמש או טעינה נמוך צבע ברמה, למשל ב neurite של הנוירון מוקלט). בדרך כלל במקרים כאלה השתמשנו החלקה הזמני עם 3-5 יחידות זמן.
- בנוסף הקלטות אופטי לנו גם להציג את הקלטת תאיים על ידי בחירה כדי להציג את קלט אנלוגי של מערכת הדמיה.
- הפרמטרים עבור להדמיה של נתונים אופטיים קלט אנלוגיים צריך להיות מוגדר כהלכה כדי לראות את כל הקלטות על מסך המחשב.
- בהתחשב הקלטות אופטי של נוירונים, ההקלטה תאיים מ lvn, ואת הסיווג של הנוירון מבוסס על ההקלטה תאיים קודם לכן, ניתן לקבוע את זהותו של הנוירון ולהתייחס פעילותה לפעילות עצבית מוקלט מן עצב.
- צפוי כי ההקלטות אופטי להראות בבירור, ללא צורך בממוצע על אירועים דומים רבים, הפעילות העצבית המתאים קוצים רשמה extracellularly וגם אירועים התת כגון הפוסט סינפטי פוטנציאל מעכבות הנגרמת על ידי פעילות של נוירונים אחרים.
- נתוני היצוא תכונות של התוכנה BVAna ניתן להשתמש כדי לייצא את ההקלטות אופטי מחושב עבור אזורים נבחרים של עניין וגם קלט אנלוגי המכיל את ההקלטה מתוך lvn. הנתונים המיוצא ניתן לעבד ולנתח נוסף באמצעות תוכנת ניתוח נתונים אחרים, כמו גם (למשל במקרה הפשוט ביותר של Microsoft Excel (מיקרוסופט ברדמונד, וושינגטון, ארה"ב) עשוי לשמש ראיה נוספת לעיבוד נתונים).
6. נציג תוצאות
איור 2 מראה את ההקלטה בו זמנית של שני נוירונים (LP, לרוחב השוער נוירון, פ"ד, השוער המרחיב נוירון) במחולל דפוס השוער המרכזי של סרטן STG יחד עם ההקלטה של lvn. הקלטות אופטי של הנוירונים LP ו פ"ד מזוהה על סמך הקלטות תאיים שלהם מראים כי אכן אלה תואמים היטב את הקלטות תאיים המתאים נוירונים LP ו PD. יש עיכוב עקבי 12 מילישניות בין הקלטות אופטיים lvn של פסגות ספייק (ראה הבלעה של איור 2), בשל עיכוב בהעברת axonal בין הגנגליון ואתר הקלטה תאיים. הנתונים המוצגים גם מראה כי פעילות עצבית סומה המתאים קוצים של נוירונים מוקלט ניתן לזהות בבירור.
s/ftp_upload/2567/2567fig1.jpg "alt =" איור 1 "/>
איור 1. דיאגרמה) סכמטי של מערכת העצבים stomatogastric (STNS). בורג, הגנגליון commissural; OG, הגנגליון הושט;, STG הגנגליון stomatogastric, STN, עצב stomatogastric; lvn, עצב חדרית לרוחב. ב) הגנגליון סרטן stomatogastric (STG) - התמונה מראה את הסדר אחורי בצורת חצי עיגול של נוירונים STG.
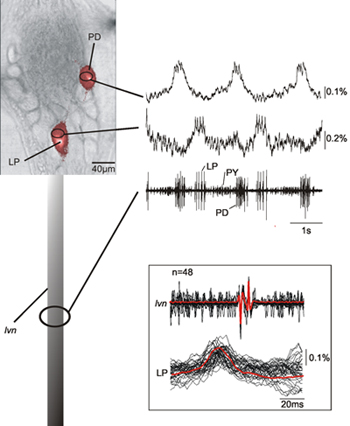
איור 2. ההקלטה סימולטני לטאטא יחיד של PD ו נוירון LP יחד עם הקלטה של lvn. הנתונים מראים כי ההקלטות אופטיים עצב להתאים היטב כי אנו יכולים לזהות את הפעילות העצבית המקביל רשמה דוקרנים בצורת עצב. הבלעה מראה כיסוי של מטאטא כמה פוטנציאל פעולה LP - הן אופטית חשמלית הקליט - ואת הממוצע שלהם הוכחת ההתאמה בין אופטית ופעילויות רשמה חשמלית. בשל העובדה כי שיטת הקלטה אופטית שלנו לא לסנן את רכיבי תדירות נמוכה של הנתונים אנחנו גם מסוגלים להקליט איטי פוטנציאל הממברנה משתנה האופייני עבור פ"ד ו LP נוירונים 14.
Discussion
צבען רגיש מתח הדמיה 8,9 של STG נוירונים בשילוב עם שיטות מסורתיות electrophysiology (הקלטות אלקטרודה תוך תאית ו) מאפשר הבנה משופרת של כמה קטן זה, עובד ידוע ומורכב עדיין המערכת העצבית. STG היא אב טיפוס של גנרטור דפוס מרכזי (CPG) רשתות נוירונים (זה כולל קצב השוער ובקיבה טחנת רשתות) 10, 11, וכך להבין טוב יותר את המאפיינים תפקודית מתהווה של STG גם יעזור להבין איך בכלל רשתות CPG ליצור רמה הרשת שלהם פונקציונליות. רשתות CPG לשחק תפקיד קריטי שליטה מוטורית 12 וגם יותר פונקציות קוגניטיביות 13, וכתוצאה מכך הבנה טובה יותר של תכונות מתהוות שלהם עשויה להיות השפעה גדולה בתחומים רבים של מדעי המוח.
Disclosures
Acknowledgements
אנו מכירים תמיכה על ידי בית הספר למדעי מחשוב הפקולטה למדעי החקלאות, והנדסה של אוניברסיטת ניוקסל, על ידי אוניברסיטת Ulm, ועל ידי SciMedia בע"מ (טוקיו, יפן).
Materials
| Name | Company | Catalog Number | Comments |
| MiCAM02 | SciMedia | Imaging system | |
| BVAna v.10.08 | SciMedia | Data analysis software for the MiCAM 02 imaging system | |
| HL-151 | Moritex, Tokyo, Japan | Ultra-low ripple halogen light source | |
| BX51 WI | Olympus Corporation | Upright microscope for epifluorescence imaging | |
| 20x imaging objective | Olympus Corporation | XLUMPLFL20XW/0.95 | NA 0.95, WD 2.0mm |
| 10x imaging objective | Olympus Corporation | UMPLFL10XW | NA 0.30, WD 3.3mm |
| Filter cube with 480-550 nm excitation filter and 590nm emission filter | Olympus Corporation | MSWG2 | |
| Antivibration table | Scientifica Ltd | 63-534 | |
| PatchStar electrode manipulator | Scientifica Ltd | PS-7000C | Micro-electrode manipulator |
| CED Power 1401 | Cambridge Electronic Design | Data acquisition board | |
| DL708E Oscilloscope | Yokogawa | Intracellular amplifier | |
| AC differential amplifier | University of Kaiserslautern, Germany | Extracellular amplifier | |
| P-97 Flaming – Brown type electrode puller | Sutter Instrument Co. | Electrode puller | |
| Sigma Microcentrifuge 1-14 | Sigma-Aldrich | Centrifuge | |
| Genex Pipettors Mline | Scientific Laboratory Supplies LTD | PIP7774 | PIP7774 |
| Glass micropipette with filament | Science Products | GB100TF 8P | Glass for micr–lectrodes |
| MicroFil – 34G | World Precision Instruments, Inc. | Microfil needle | |
| Spike 2 v6.10 | Cambridge Electronic Design | Electrophysiology software | |
| Di-8-ANEPPQ | Cambridge BioScience | BT61014 | Fluorescent voltage sensitive dye |
| F-127 Pluronic Acid, DMSO | Invitrogen | P-3000MP | Solvent |
| NaCl | Sigma-Aldrich | S9888 | Crab saline component |
| CaCl2 . 2H2O | Sigma-Aldrich | C3881 | Crab saline component |
| KCl | Sigma-Aldrich | P3911 | Crab saline component, electrolyte solution |
| MgCl2 . 6H2O | Sigma-Aldrich | M9272 | Crab saline component |
| Trizma base | Sigma-Aldrich | T1503 | Crab saline component |
| Maleic acid | Sigma-Aldrich | M0375 | Crab saline component |
| Elastosil RT-601 | Wacker, Munich, Germany | Lining of Petri dishes |
References
- Gutierrez, G. J., Grashow, R. G. Cancer borealis stomatogastric nervous system dissection. J Vis Exp. , (2009).
- Bartos, M., Nusbaum, M. P. Intercircuit control of motor pattern modulation by presynaptic inhibition. J. Neurosci. 17, 2247-2256 (1997).
- Blitz, D. M., Nusbaum, M. P. Motor pattern selection via inhibition of parallel pathways. J Neurosci. 17, 4965-4975 (1997).
- Stein, W., Smarandache, C. R., Nickmann, M., Hedrich, U. B. Functional consequences of activity-dependent synaptic enhancement at a crustacean neuromuscular junction. J Exp Biol. 209, 1285-12300 (2006).
- Loew, L. Potentiometric dyes: Imaging electrical activity of cell membranes. Pure & Appl Chem. 68, 1405-1409 (1996).
- Tominaga, T., Tominaga, Y., Yamada, H., Matsumoto, G., Ichikawa, M. Quantification of optical signals with electrophysiological signals in neural activities of Di-4-ANEPPS stained rat hippocampal slices. J Neurosci Meth. 102, 11-23 (2000).
- Heinzel, H. G., Weimann, J. M., Marder, E. The behavioral repertoire of the gastric mill in the crab, Cancer pagurus: an in situ endoscopic and electrophysiological examination. J Neurosci. 13, 1793-1803 (1993).
- Zecevic, D., Wu, J. -. Y., Cohen, L. B., London, J. A., Höpp, H. P., Falk, C. X. Hundreds of neurons in the Aplysia abdominal ganglion are active during the gill-withdrawal reflex. J Neurosci. 9, 3681-3689 (1989).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. J Neurosci. 26, 10925-10933 (2006).
- Nusbaum, M. P., Beenhakker, M. P. A small-systems approach to motor pattern generation. Nature. 417, 343-350 (2002).
- Marder, E., Bucher, D. Understanding circuit dynamics using the stomatogastric nervous system of lobsters and crabs. Ann Rev Physiol. 69, 291-316 (2007).
- Grillner, S. Biological pattern generation: the cellular and computational logic of networks in motion. Neuron. 52, 751-766 (2006).
- Yuste, R., MacLean, J. N., Smith, J., Lansner, A. The cortex as a central pattern generator. Nat Rev Neurosci. 6, 477-483 (2005).
- Stein, W. Modulation of stomatogastric rhythms. J Comp Physiol A. 195, 989-1009 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved