A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השתלה של תאים סטרומה החלב ותאי קרצינומה של עכברים C57BL/6J
In This Article
Summary
בדו"ח זה, אנחנו מדגימים מערכת לבודד התורם התרבות תאים מבלוטת החלב העכבר, ו orthotopically השתלת תאים אלה בעכברים הנמען לנתח סטרומה: אינטראקציות אפיתל במהלך התפתחות הגידול החלב.
Abstract
ההשפעה של תאים סטרומה, כולל fibroblasts על התקדמות הגידול החלב תועד היטב באמצעות מודלים העכבר, בעיקר באמצעות השתלה של תאים סטרומה ותאי אפיתל של בלוטת החלב של עכברים. מודלים השתלת נוכחי לעתים קרובות כרוכות בשימוש בעכברים immunocompromised בשל רקע גנטי שונה של תאים סטרומה ותאי אפיתל. מטריצות תאיים משמשים לעתים קרובות כדי להטביע את שני סוגי תאים שונים עבור תאים תאים אינטראקציות עקבי, אבל כרוכות בשימוש Matrigel או קולגן עכברוש הזנב, אשר מצעים immunogenic. חוסר בתאי T פונקציונלי מעכברים החיסון מונע הערכה מדויקת של תאים סטרומה על התקדמות הגידול החלב in vivo, עם השלכות חשובות על פיתוח התרופה ויעילותה. יתר על כן, העכברים immunocompromised הם יקרים, קשה להתרבות דורשים תנאים טיפול מיוחד. כדי להתגבר על מכשולים אלה, פיתחנו גישה orthotopically השתלת תאים סטרומה ותאי אפיתל לעכברים מרקע גנטי זהה לגרום להיווצרות גידול עקבי. מערכת זו כוללת איסוף נורמלי, קרצינומה fibroblasts הקשורים, PyVmT בתאי סרטן השד ו קולגן מעכברים התורם C57BL/6J. התאים המוטבעים אז קולגן המושתלים בתוך בלוטות החלב של הנקבה מפשעתי עכברים C57BL/6J. השתלה של תאים PyVmT לבד בצורה מוחשית השתלת גידולים ימים 30-40 פוסט. ניתוח Endpoint ב 60 ימים מציין כי שיתוף השתלת עם fibroblasts משפר את צמיחת הגידול החלב לעומת התאים המושתלים PyVmT לבד. בעוד תאים מטריצה מעכברים C57BL/6J שימשו במחקרים אלה, בידוד של תאים מטריקס גישה השתלת ניתן להחיל כלפי עכברים מרקע גנטי שונה הוכחת צדדיות. לסיכום, מערכת זו יכולה לשמש כדי לחקור אינטראקציות מולקולריות בין תאים סטרומה ותאי אפיתל, וגם מתגבר על מגבלות קריטי מודלים העכבר immunocompromised.
Protocol
1. בידוד החילוץ של קולגן התורם מעכברים C57BL/6J
- הקורבן בוגר בעכברים נורמליים נקבה C57BL/6J בשיטות IACUC אושרה.
- קציר זנבות ומשרים אתנול 70% במשך 45 דקות לעקר רקמות. יבש זנבות בנייר טישו, לעטוף בנייר אלומיניום. חנות זנבות ב -20 ° C עד הצורך.
- מניחים את זנבות בסביבה סטרילית כמו מכסה המנוע זרימה למינרית. בעזרת מספריים, לפצל את העור בשורש הזנב לקלף מהזנב. הסר 0.5-1 ס"מ בשני הקצוות של הזנב ולחלק את הזנב שנותר לשלוש או ארבע חתיכות. מנתחים את הגידים של זנבות נפרד הגידים לתוך סיבי בודדים באמצעות סכין גילוח או אזמל.
- מעבירים את סיבי הגיד למיכל סטרילי ולשטוף עם מים מזוקקים סטריליים. העברת גידים מזנב של עכברים 5-7 על צינור חרוטי 50 מ"ל המכיל 35 מ"ל סטרילי דה מיוננים מים המכילים 50 יחידות / מ"ל פניצילין פניצילין, 50 מיקרוגרם / מ"ל ו - 250 סטרפטומיצין ng / ml amphotericin, ו 0.034 N חומצה אצטית מדוללת מ פתרון המניות של חומצה אצטית קרחונית (17 N). מניחים על הנדנדה על 4 מעלות צלזיוס במשך שבוע כדי לחלץ את הקולגן.
- ספין למטה פסולת בצנטריפוגה בראש הטבלה בבית ג'3000 במשך 15 דקות. העברת supernatant, כ 30 MLS שני צינורות פוליקרבונט המותאמים הרוטור 50.2 טי Beckman ספין על 35,000 גרם (כ 17,000 סל"ד) במשך שעה 1.
- נפח supernatant יהיה צריך להיות מופחת כדי להשיג ריכוז של 1-2 מ"ג / מ"ל. מעבירים את supernatant אל יחידת 50 ultracel Amicon סינון k ו ספין בצנטריפוגה בטבלה למעלה בסל"ד 3000 למשך 15 ב 4 ° C. מעבירים את תסנין אל צינור חרוטי סטרילי ושמור. חזור על צנטריפוגה עד נפח מצטמצם מ"ל 5-6.
- קרא את ריכוז החלבון. אנו משתמשים תקן ברדפורד assay (Biorad), באמצעות ארגון ה-BSA סטנדרטים (Biorad) דגימות חי. מדוד מדגם תסנין שלך, כביקורת שלילית.
- יתר על כן לבדוק טוהר ממוצא לפתרון על ידי מדגם של קולגן מטוהרים על ג'ל SDS 6% polyacrylamide, 10 נתיבים, ג'ל 1.5 מ"מ עובי. הכן 20 מיקרוגרם של המדגם ב 30 חיץ טעינת μl SDS-PAGE 1x המכיל 63 mM טריס HCl גליצרול 10%, 2% כחול SDS bromophenol 0.0025% ב 1.5 מ"ל צינורות Eppendorf. הכן כמות שווה של חלבון מסוג קולגן זנב חולדה אני כביקורת חיובית. בנוסף, להכין סט של סטנדרטים BSA ב 2.5, 5, 10, 20 מיקרוגרם מדולל PBS ו חיץ 1X הטעינה. מרתיחים את דגימות ב 95 מעלות צלזיוס למשך 5 דקות.
- בואו הדגימות קריר microfuge בקצרה (מהירות מרבית של 10 שניות) כדי לסובב את העיבוי.
- טען את דגימות דגימות יחד עם סמן משקל מולקולרי. לדוגמה, עומס 5 μl של תקן Biorad קליידוסקופ חלבון. Electrophorese ב 150 וולט במשך שעה בערך 1 או עד בחזית לצבוע מגיע לתחתית.
- הסר את הג'ל ואת כתם כחול coomassie חיץ. הכן זה חוצץ על ידי ערבוב של 2 גרם coomassie כחול, 75 מ"ל חומצה אצטית קרחונית, 500 מ"ל אתנול בהיקף כולל של 1000 מ"ל המכיל דה מיוננים מים. גם להכין את אותה כמות של חיץ destain באמצעות מתכון פרט ללא מגיב כחול coomassie. מכסים את הג'ל עם נפח מספיק coomassie בכחול מקום על כיסא נדנדה.
- רוק בעדינות במשך שעה 1 ב RT ו למזוג את הכתם. החלף את הפתרון destain כאשר מתברר כחול כהה. לעצור את ג'ל לילה או עד להקות בודדות נפתרות על הג'ל. אתר שתי רצועות קולגן (משקולות מולקולרי = 90 KDA ו 130 KDA) וציין את כוחו של הלהקות נגד תקנים שולטת. תמונה הג'ל באמצעות מערכת doc ג'ל, במידת הצורך.
2. בידוד והתרבות של החלב תורם לתאי סרטן וגם fibroblasts מ נורמלי PyVmT עכברים C57BL/6J
- גיל הקורבן מתאימים נקבה העכברים הטרנסגניים רגיל או PyVmT לאחר 10 שבועות של גיל כאשר גידולים ניכרים ומוחשי של העכברים הטרנסגניים PyVmT בשיטות IACUC אושרה.
- לחשוף את העכבר על גבו על גבי משטח שטוח לשתק את הגפיים באמצעות סרט דביק.
- תן הפוך חתך T בין הפטמות של בלוטת החלב ובית החזה מפשעתי ולמשוך את דש העור לאחור כדי לחשוף את בלוטות החלב. הסר את רקמת השד ואת לקצץ לחתיכות קטנות באמצעות מספריים כירורגיות.
- הכן 100 מ"ל של קוקטייל עיכול אנזימטי המכיל: 200 מ"ג טריפסין, 500 מ"ג collagenase, 4 מ"ג DNAse, 100,000 יחידות hyaluronidase ב PBS סטרילית אנטיביוטיקה לילה על הקרח ואז על 3 שעות ב 37 ° C.
- הוסף 10 מ"ל של PBS המכיל 10% בסרום שור העובר (FBS) לדגום כל תא צנטריפוגות גלולה בצנטריפוגה בטבלה למעלה בסל"ד 1500 למשך 5 דקות ב 4 ° C.
- לשאוב בעדינות supernatant ו resuspend התא גלולה ב 5-7 מ"ל של FBS% PBS/10. חזור על ספין ולשטוף פעמיים נוספות.
- Resuspend התא גלולה ב 10 מ"ל של DMEM FB המכיל 10%S המכילה 50 יחידות / מ"ל פניצילין, 50 מיקרוגרם / מ"ל ו - 250 סטרפטומיצין ng / ml amphotericin על 10 מנות ס"מ מצופה קולגן מסוג I. כדי צלחות מעיל עם קולגן, לדלל את מ"ל 1 קולגן (באמצעות מניות 1.5 מ"ג / מ"ל) לתוך 39 מ"ל של 0.02 N חומצה אצטית מדוללת במים מזוקקים סטריליים או PBS. 5 Pipet MLS של קולגן עובדים פתרון על 10 ס"מ צלחות. דגירה בטמפרטורת החדר למשך מינימום 10 דקות. לשאוב עודפי קולגן. Parafilm צלחות בשימוש ולאחסן ב 4 מעלות צלזיוס במשך שבוע.
- שנה את התקשורת 2 - 3 פעמים בשבוע. עיכול מוצלח של רקמות יאופיין על ידי נוכחות של מוקדים אפיתל מוקף תאים דמויי כישור fibroblastic.
- הפרד את fibroblasts ותאי אפיתל על ידי tryspinization סלקטיבית. לשאוב התקשורת לשטוף את התאים עם PBS פעם. Pipet 1 מ"ל של 0.25% trypsin/0.54 mM EDTA על תאים דגירה בטמפרטורת החדר. Fibroblasts יותר חסיד רופף מאשר תאי אפיתל. בדוק ניתוק פיברובלסטים מתחת למיקרוסקופ אחרי 2 דקות, התאים צריכים להיות צף השעיה או אספו בעוד מוקדים אפיתל עדיין צריך להיות דבק אל פני השטח.
- קלות להקיש על צלחת כדי לשחרר את fibroblasts בעדינות 10 pipet MLS של המדיום סרום המכיל בצלחת כדי להסיר את fibroblasts.
- Pipet התקשורת המכיל fibroblasts בצינור חרוטי 15 מ"ל ו צנטריפוגות כמתואר בשלב 5). Replate תאים אלה על גבי מצופה קולגן 10 מנות ס"מ וחזור על התהליך trypsinization סלקטיבית עד fibroblasts ותאי אפיתל מופרדים לחלוטין.
- בדוק על ידי תא טוהר מכתים immunofluorescence עבור סמנים האפיתל כגון CK14 ו CK18 וסמנים פיברובלסטים כגון אלפא אקטין שריר חלק (α-SMA).
3. מכתים immunofluorescence של תאים בתרבית
- המקום coverslips זכוכית 6 מנות ס"מ. לעקר בחשיפה UV במשך 5 עד 10 דקות במנדף זרימה למינרית.
- המעיל coverslip עם 1-2 מ"ל של עבודה קולגן פתרון המניות במשך 10 דקות בטמפרטורת החדר (RT). לשאוב עודף.
- Trypsinize צלחת 200,000 לתאי האפיתל או fibroblasts לדגימה. הוסף 3-5 מ"ל של מדיה מלאה דגירה למשך 24 שעות.
- לשאוב התקשורת, לשטוף תאים עם PBS ולתקן ב מתנול קרח קר -20 מעלות צלזיוס למשך 7 דקות.
- שטפו תאים עם PBS פעמיים כדי להסיר אתנול, ולחסום עם 1-2 מ"ל של PBS המכיל 1% FBS שעה 1 ב RT.
- בעזרת מלקחיים, להסיר את coverslips מקום במיכל רדוד גדול מכוסה parafilm או משטח הידרופובי אחרים.
- לדלל את הנוגדנים ראשוני הבאים 1:100 פתרון לחסימת: אנטי אקטין שריר חלק (α-SMA, אנטי CK14 (סמן אפיתל הבסיס), אנטי CK18 (סמן אפיתל luminal).
- 100 Pipet μl של נוגדנים ישירות על coverslips שעה 1 ב RT. דגירה coverslip נפרד של תאים פתרון חסימת; מדגם זה ישמש לשלוט נוגדנים משני.
- לשאוב נוגדנים ואת pipet 1 מ"ל של PBS ישירות על coverslip כדי לשטוף. לשאוב וחזור 3-5 פעמים.
- לדלל את נוגדנים משני הבאים פתרון לחסימת: אנטי עכבר Alexa 488 בשעה 1:100, עכבר אנטי biotinylated על 1: 500, אנטי עכבר Alexa-568.
- עוטפים את המיכל עם coverslips בנייר אלומיניום. Pipet 100 μl של נוגדנים משני המתאים ישירות על coverslips: α-SMA עם אנטי עכבר Alexa 568, מכתים 14 CK עם העכבר אנטי biotinylated ו CK18 עם אנטי עכבר Alexa 488. מכסים את המיכל כדי להגן על דגימות מן האור הנראה.
- נוגדן לשאוב ולשטוף עם PBS כמו בשלב 9). השאירו את דגימות PBS, למעט מכתים CK14.
- מדולל streptavidin מצומדות כדי Alexa 568 ב PBS 1:500. דגירה CK14 דגימות מוכתם strepatividin-Alexa 568 במשך 30 דקות ב RT בחושך. שטפי ב PBS כמו בשלב 9)
- מדולל DAPI 1: 500 ב-PBS. לשאוב PBS ממדגמים ו דגירה עם DAPI במשך 10 דקות RT בחושך.
- לשטוף עם דגימות PBS. 100 μl של Pipet להאריך אנטי לדעוך מגיב על שקופיות זכוכית, להפוך את coverslip על כך התאים מול שקופיות הזכוכית. הטה את coverslip לזווית אחת בעדינות ליצור קשר עם התקשורת גובר.
- תמונה הדגימות באמצעות מיקרוסקופ immunofluorescence. שמור את דגימות בחושך כדי להגן על האות immunofluorescence, שיימשך כ 2 שבועות.
4. הכנת התאים קולגן מוטבע עבור השתלת
- כדי להטביע תאים קולגן, יש צורך להוריד את ה-pH של קולגן כדי להשיג פילמור על ידי ערבוב של קולגן עם פתרון ההגדרה. הכן את פתרון ההגדרה ידי ערבוב 100 מ"ל של תמיסת מלח מאוזן של ארל 10X (EBSS) עם 2.45 גרם של NaHCO3, 7.5 מ"ל של NaOH M 1 ו - 42.5 מ"ל של מים מזוקקים סטריליים. יתר על כן לעקר באמצעות למעלה בקבוק 0.22 מיקרון יחידת מסנן מצורף בקבוק סטרילי.
- מערבבים את הקולגן (ריכוז מניות 1 מ"ג / מ"ל) עם הגדרת פתרון בבית 4 מתחילים: 1 יחס. עבור שתל אחד, לערבב 100 μl של קולגן עם 25 μl של הגדרת פתרון בצינור Eppendorf. וורטקס בקצרה או pipet המדגם מעלה ומטה כדי לערבב היטב את המדגם.
- הוסף קולגן או פתרון ההגדרה במרווחים μl 5-10 ומערבבים היטב עד שהצבע האדום פנול בשינויים התערובת באור ורוד לצבע כתום, המשקף pH נייטרלי. צבע צהוב מציין pH חומצי ואילו ורוד כהה משקפת pH בסיסי. שמור את התערובת על הקרח כדי למנוע פילמור.
- הסר את fibroblasts ותאי אפיתל מהצלחת על ידי trypsinization. ראשית, לשאוב התקשורת לשטוף עם 5 מ"ל של PBS. Pipet 1 מ"ל של 0.25% trypsin/0.54 mM EDTA ב HBSS לכל צלחת. דגירה fibroblasts ב RT במשך 2-5 דקות. דגירה לתאי האפיתל ב 37oC במשך 2-6 דקות. הקש על צלחות בעדינות כדי לשחרר את התאים. בדוק ניתוק באמצעות microscope.Quench טריפסין על ידי pipetting 9 מ"ל של מדיום שלם על הצלחת ולהעביר את התאים צינור סטרילי מ"ל 15 חרוטי.
- הסר 50 ul ולספור את התאים על ידי hemocytometer. רשום את הנפח הכולל של כל התאים בצינור (כ -10 מ"ל).
- גלולה התאים בסל"ד 1500 דקות 5 ב RT. לשאוב התא גלולה ו resuspend את התאים ריכוז של μl cells/100 100.000. לדוגמה, resuspend 500,000 תאים בנפח כולל של 500 μl של מדיה מלאה.
- מערבבים 250,000 תאים סטרומה (250 μl) לבין 100,000 תאים סרטניים (100 μl) בצינור נפרד. Microfuge 10 שניות סל"ד 1000, להסיר supernatant ידי pipetting. הוסף 50 μl של הפתרון מותאם קולגן לתאים. Pipet מעלה ומטה כדי לפזר את התאים באופן שווה. Pipet μl 50 ב צלחת סטרילי 6 ס"מ תרבות רקמות כדי ליצור ירידה מעגלית. דגירה השתל על 37 מעלות צלזיוס למשך 10 דקות לפלמר.
- בעדינות להוסיף 5 MLS התקשורת להשלים בצלחת על ידי הצלחת הטיה בזווית לאט pipetting התקשורת על ידי צד אחד של הצלחת. הטה את הצלחת סביב מכסה עד בתקשורת את השתל.
- דגירה במשך 24 שעות ב 37 ° C. להשתלות מיד.
5. Orthoptic השתלה של תאים קולגן מוטבע בעכברים C57BL/6J
- לפברק מוט זכוכית דקה לניתוח השתלה. מחממים pipet פסטר זכוכית באמצעות מבער בונזן. בעזרת מלקחיים, למתוח את קצה pipet החוצה כדי 2-3 מ"מ עובי. תן מגניב, לעקר ע"י אתנול 70%.
- לעקר את מכשירי ניתוח הבאה על ידי מעוקר אתנול ו 70%: מספריים כירורגיות בסדר, מספריים כירורגיות בוטה, מלקחיים בוטה, מלקחיים דק, קליפים פצע, פצע מצרך
- הרדימי באמצעות העכבר עם 2-3% isoflurane באמצעות מכונת הדחה isoflurane. הממוצע O 2 קצב הזרימה משמש הוא 1 ליטר / דקה דרך האף קונוס.
- הנח את העכבר על הגב שלה לשתק את הגפיים עם קלטת או דבק נשלף אחר. הסרת שיער באמצעות מסיר שיער כימיים כגון נאיר. לעקר את הבטן עם כותנה בשטיפת לחילופין בין 70% אתנול ו בבטאדין באופן היעד דמוי.
- החזק את חלק של העור על ידי בלוטת החלב באמצעות מלקחיים בוטה ביד אחת. עם זאת, באמצעות מספריים כירורגיות בוטה לעשות הפוך חתך-T בין # 9 ו # 10 הפטמות או # 4 ו # 5 הפטמות של בלוטות החלב מפשעתי לחשוף את בלוטות החלב.
- ביצוע חתך כיס תחת הצומת לימפה או עורק החלב עם מספריים קטנים באביב כירורגית.
- הסר את השתל קולגן מצלחת התרבות רקמות באמצעות מלקחיים. הסרת נוזל עודף השתל על ידי קולגן בעדינות מספיגה על סטרילית לנגב והחלק את השתל קולגן לחלוטין לכיס באמצעות מוט זכוכית דק.
- לתפור את דש העור באמצעות # 2 תפרים נספגים במעי או סיכות הפצע.
- בואו העכבר להתאושש בכלוב.
- צג העכברים פעמיים בשבוע לכל הפחות, מישש עבור גידולים. הקורבן עכברים כאשר הגידולים להגיע 1 ס"מ קוטר. קציר רקמות לצורך ניתוח.
6. נציג תוצאות:
בידוד החילוץ של קולגן מעכברים C57BL/6J
נהלים אלה הותאמו מ -1. מיצוי של חלבון הקולגן מפני זנבות עכבר 5-7 התשואות כ 1-1.5 מ"ג / מ"ל נפח סופי 6 מ"ל, או 6-9 מ"ג של חלבון. עד coommassie כתם, להקות המתאים 90 KDA ו 130 KDA מזוהים בסמטאות עמוסה בדגימות שנלקחו זנבות עכבר, המעידים על נוכחות של קולגן סוג I ו-pro-קולגן בהתאמה (איור 1).
בידוד תרבות קרצינומה של תאים ו fibroblasts החלב מן נורמלי PyVmT עכברים C57BL/6J.
הנהלים הותאמו מ 2. קרצינומה של תאים PyVmT ו fibroblasts ניתן להבחין על ידי הבדלים מורפולוגיה תאים ביטוי מרץ אפיתל mesenchymal ספציפיkers. קרצינומה של תאים PyVmT מזוהים צורה המרוצף ושיתוף להביע CK18, סמן אפיתל luminal ו CK14, סמן אפיתל הבסיס, אך לא להביע α-SMA (איור 2). Fibroblasts החלב הם תאים גדולים עם פנוטיפ כישור בצורת ולהביע רמות גבוהות של SMA-α, אך אינם מבטאים CK14 או CK 18 (איור 2). נתונים אלו מצביעים על טוהר 95% התא fibroblasts ותאי אפיתל באמצעות ההנחיות המתוארות.
Orthoptic השתלה של תאים קולגן מוטבע בעכברים C57BL/6J
נהלים אלה הותאמו מ 3, 4. השתלה בעכברים הנמען מוקרבים כאשר גידולים בקבוצה או ניסיוני להגיע 1.0 ס"מ קוטר, או כ 60 ימים. בזמן השתלה של תאים לבד תוצאות PyVmT בגידולים מוחשית לאחר 3-40 ימים, והגיע מסה גידול ממוצע של 0.335 גרם ב 60 ימים, שיתוף השתלה של תאים PyVmT קרצינומה עם תוצאות fibroblasts החלב במסה גידול ממוצע של 0.630 גרם, המעיד על שיפור של הגידול על ידי fibroblasts (איור 3).
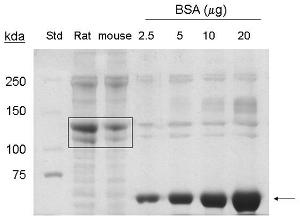
באיור 1. ניתוח Coomassie כתם מסוג קולגן אני חילוץ מתוך זנבות עכבר. BSA (~ 66 KDA) מצוין על ידי חץ. עכברוש מסחרי זנב קולגן (20 מיקרוגרם חלבון), וטיהר זנב עכבר קולגן (20 מיקרוגרם חלבון) מסומנים על ידי תיבה (~ 130 KDA, ~ 90 KDA חלבונים). Std = משקל מולקולרי רגיל.
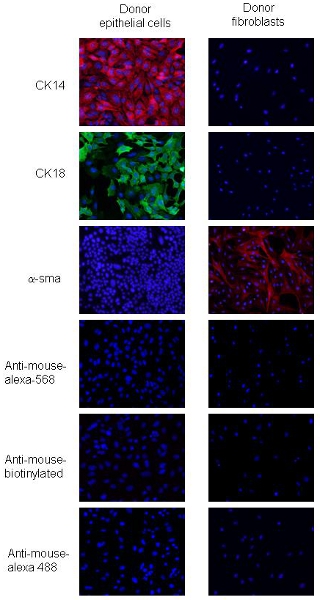
איור 2. מכתים immunofluorescence של PyVmT התורם בתאי סרטן השד ו fibroblasts. פאנלים a ו-b מייצגים PyVmT בתאי סרטן השד immunostained עבור נוגדנים CK14 ו CK18. לוח ג מייצג fibroblasts מוכתם נוגדנים SMA-α. תמונות מוצגות עם DAPI כיסוי בהגדלה 20x.
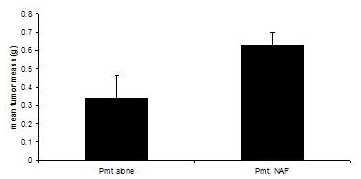
איור 3. התפתחות גידולים בעכברים החלב C57BL/6J בנוכחות או העדר fibroblasts. גידולים החלב נבצרו מעכברים המושתלים עם תאים PyVmT קרצינומה בנוכחות או העדר fibroblasts החלב ומשקלו. ממוצע + טעות תקן של הממוצע. N = 6 בכל קבוצה.
Discussion
התרומה התפקודית של fibroblasts בהתקדמות הגידול הוכח באמצעות מודלים השתלה, שבו קרצינומה fibroblasts הקשורים שיתוף המושתלים עם תאים שפירים אפיתל תוצאות החלב בתוך הגידול גדל הפולשנות 5. גישות השתלת קונבנציונלי יש מעורבים את השימוש של עכברים SCID או בעירום לשתף השתלת תאים סטר?...
Disclosures
ניסויים בבעלי חיים:
ניסויים בבעלי חיים בוצעו בהתאם להנחיות והתקנות שנקבעו על ידי הוועדה IACUC באוניברסיטת קנזס המרכז הרפואי.
Acknowledgements
פרויקט זה מומן באמצעות מענק במספר NIH / NCI R00 CA127357 ואת אוניברסיטת קנזס Cancer Center הקרן.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | הערות (אופציונלי) |
|---|---|---|---|
| C57BL/6N עכברים | הרלן | N / A | |
| MMTV-PyVmT העכברים הטרנסגניים | ג'קסון מעבדות | 002374 | |
| סרום שור עוברית | דיג | SH3039603PR | |
| DMEM | VWR | 10000113873 | |
| פניצילין / סטרפטומיצין | דיג | MT-30-001 | |
| amphotericin | דיג | BP2645-20 | |
| Amicon עמודות סינון ultracel 50k | Millipore | UFC905008 | |
| צינורות עבור Beckman TI הרוטור | Beckman | 355618 | |
| זנב עכברוש קולגן | דיג | CB 40236 | |
| 10x EBSS | סיגמא אולדריץ | E7510-100 מ"ל | |
| טריפסין 1X, 0.25% בשנת סידן w / o HBSS ו מגנזיום | דיג | MT-25-050-CI | |
| חומצה אצטית קרחונית | דיג | A491-212 | |
| Coomasie כחול | דיג | BP101 25 | |
| טריפסין | סיגמא אולדריץ | T3924-100 מ"ל | |
| Collagenase | סיגמא AldrichC0130-50 | ||
| hyalronidase | סיגמא אולדריץ | H3884 | |
| DNase | סיגמא אולדריץ | D5025 | |
| חלבון סטנדרטי קלידוסקופ | Biorad | 1610375 | |
| שקופיות הזכוכית | דיג | 12545-78 | |
| זכוכית coverslips | VWR | 101400-042 | |
| Vimentin נוגדן S-20 | סנטה קרוז ביוטכנולוגיה | SC-7558 | |
| α חלקה אקטין בשריר נוגדן | Abcam | ab5694 | |
| CK14 נוגדן | סנטה קרוז ביוטכנולוגיה | SC-53253 | |
| CK18 נוגדן | Abcam | ab668 | |
| DAPI | סיגמא אולדריץ | D9542 | |
| אנטי עכבר biotinylated | וקטור מעבדות | BA9200 | מופץ באמצעות פישר |
| אנטי עכבר Alexa-568 | Invitrogen | A10037 | |
| אנטי עכבר Alexa-488 | Invitrogen | A11001 | |
| Streptavidin-Alexa-488 | Invitrogen | S11226 | |
| DAPI | Invitrogen | D21490 | |
| להאריך antifade | Invitrogen | P-36930 | |
| כירורגי מספריים | המדע כלים פיין | 91400-12 | |
| באביב מספריים פיין | המדע כלים פיין | 15000-02 | |
| בלאנט מלקחיים | המדע כלים פיין | 11002-12 | |
| # 5 מלקחיים קנס | המדע כלים פיין | 11251-10 | |
| כרומית גוט תפר | דיג | NC9326254 | |
| זכוכית pipet פסטר | דיג | 22-042-815 | |
| אתנול | דיג | A406P 4 | |
| בבטאדין | דיג | NC9386574 | |
| פצע קליפים | דיג | 12032-07 | |
| פצע מצרך | דיג | 12031-07 |
References
- Hayward, S., Haughney, P. C., Rosen, M. A., Greulich, K. M., Weier, H. U., Dahiya, R., Cunha, G. R. Interactions between adult human prostatic epithelium and rat urogenital sinus mesenchyme in a tissue recombination model. Differentiation. 63, 131-131 (1998).
- Cunha, G., Hom, Y. K., Young, P., Brody, J., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Ethier, S. P., Ammerman, C. A., Dziubinski, M. L., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Medina, D., Kittrell, F., Asch, B. B., Ip, M. M. . Methods in Mammary Gland Biology. , (2000).
- Kalluri, R., Zeisberg, M. Fibroblasts in cancer. Nat Rev Cancer. 6, 392-401 (2006).
- DeNardo, D. G., Johansson, M., Coussens, L. M. Immune cells as mediators of solid tumor metastasis. Cancer Metastasis. 27, 11-18 (2008).
- Naito, M. Macrophage differentiation and function in health and disease. Pathol Int. 58, 143-155 (2008).
- Firestein, G. S. The T cell cometh: interplay between adaptive immunity and cytokine networks in rheumatoid arthritis. J Clin Invest. 114, 471-474 (2004).
- Cheng, N., Chytil, A., Shyr, Y., Joly, A., Moses, H. L. Enhanced Hepatocyte Growth Factor Signaling by Type II Transforming Growth Factor-{beta} Receptor Knockout Fibroblasts Promotes Mammary Tumorigenesis. Cancer Res. 67, 4869-4877 (2007).
- Qiu, T. H. Global expression profiling identifies signatures of tumor virulence in MMTV-PyMT-transgenic mice: correlation to human disease. Cancer Res. 64, 5973-5981 (2004).
- Schaffhausen, B. S., Roberts, T. M. Lessons from polyoma middle T antigen on signaling and transformation: A DNA tumor virus contribution to the war on cancer. Virology. 384, 304-316 (2009).
- Cepko, C. L. Immortalization of neural cells via retrovirus-mediated oncogene transduction. Annu Rev Neurosci. 12, 47-65 (1989).
- O'Hare, M. J. Conditional immortalization of freshly isolated human mammary fibroblasts and endothelial cells. Proc Natl Acad Sci U S A. 98, 646-651 (2001).
- Shay, J. W., Wright, W. E., Werbin, H. Defining the molecular mechanisms of human cell immortalization. Biochim Biophys Acta. 1072, 1-7 (1991).
- Gudjonsson, T., Villadsen, R., Ronnov-Jessen, L., Petersen, O. W. Immortalization protocols used in cell culture models of human breast morphogenesis. Cell Mol Life Sci. 61, 2523-2534 (2004).
- Raschke, W. C., Baird, S., Ralph, P., Nakoinz, I. Functional macrophage cell lines transformed by Abelson leukemia virus. Cell. 15, 261-267 (1978).
- Shen, G. Immortalization of endothelial cells differentiated from mouse embryonic stem cells. Shi Yan Sheng Wu Xue Bao. 35, 218-228 (2002).
- Wang, S. J., Greer, P., Auerbach, R. Isolation and propagation of yolk-sac-derived endothelial cells from a hypervascular transgenic mouse expressing a gain-of-function fps/fes proto-oncogene. In Vitro Cell Dev Biol Anim. 32, 292-299 (1996).
- Tiede, B. J., Owens, L. A., Li, F., DeCoste, C., Kang, Y. A novel mouse model for non-invasive single marker tracking of mammary stem cells in vivo reveals stem cell dynamics throughout pregnancy. PLoS One. 4, e8035-e8035 (2009).
- Guzman, R. Intracarotid injection of fluorescence activated cell-sorted CD49d-positive neural stem cells improves targeted cell delivery and behavior after stroke in a mouse stroke model. Stroke. 39, 1300-1306 (2008).
- Duda, D. G. Differential transplantability of tumor-associated stromal cells. Cancer Res. 64, 5920-5924 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved