A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
במבחנה מערכת לחקר תרדמת גידול ואת החלף ל גידול גרורתי
In This Article
Summary
שונה 3-D במבחנה מערכת מוצג אשר מאפיינים הצמיחה של מספר שורות תאים סרטניים קרום במרתף מחדש לתאם עם התנהגות רדום או שגשוג של תאים סרטניים באתר משנית גרורתי In vivo.
Abstract
הישנות של סרטן השד לעיתים קרובות בעקבות תקופה סמויה ארוכה שבה אין סימנים של סרטן, גרורות לא נראות לעין קלינית עד שנים רבות לאחר הסרת הגידול הראשוני כטיפול משלים. הסבר סביר לתופעה זו הוא כי תאים סרטניים יש seeded אתרים גרורתי, עמידים לטיפולים קונבנציונליים, ולהישאר רדום במשך תקופות זמן ארוכות 1-4.
קיומם של תאים סרטניים רדומים באתרים משני תוארה בעבר תאים בודד שקט שלא מתרבים ולא לעבור אפופטוזיס 5-7. יתר על כן, תאים אלה בודד הוכח להפיץ מן הגידול הראשוני בשלב מוקדם של 8-10 התקדמות המחלה ואת מתגוררים צמיחה נעצר במח העצם של החולים, הדם ואת בלוטות הלימפה 1,4,11. לכן, הבנת המנגנונים המווסתים תרדמת או לעבור למדינה שגשוג קריטית על גילוי מטרות הרומן התערבויות למניעת הישנות המחלה. עם זאת, התרת מנגנוני ויסות לעבור תרדמת הגידול בצמיחה גרורתי כבר הקשו על ידי היעדר מערכות מודל זמין.
in vivo לשעבר מערכות vivo במודל כדי לחקור התפתחות גרורות של תאים סרטניים תוארו בעבר 1,12-14. אולם מערכות אלה מודל לא סיפקו בזמן אמת ובאופן גבוהה התפוקה תובנות מכניסטית לתוך מה מעורר את הופעתה של תאים סרטניים בודדים רדומים להתרבות כמו מחלה גרורתית. פיתחנו לאחרונה 3D במערכת במבחנה למודל במאפייני vivo צמיחה של תאים התנהגות רדום או גרורתי (D2.OR, MCF7, K7M2-AS.46) או שגשוג (D2A1, מד"א-MB-231, K7M2) in vivo. אנחנו הראו כי תאים סרטניים כי התערוכה תרדמת in vivo באתר גרורתי להישאר שקט כאשר בתרבית תמצית 3-ממד (3D) במרתף קרום (BME), ואילו התאים גרורתי מאוד in vivo ברצון להתרבות בתרבות 3D אחרי המשתנה, אבל קצר יחסית תקופות של קפאון. חשוב לציין כי על ידי שימוש במערכת מודל 3D במבחנה הראינו לראשונה כי בהרכב ECM ממלא תפקיד חשוב בוויסות אם תאים סרטניים רדומים יעבור למצב שגשוג ו אישרו זאת במחקרים vivo 15-17. לפיכך, מערכת מודל שתוארו בדו"ח זה מספק שיטה חוץ גופית כדי תרדמת הגידול מודל ולחקור את המעבר לצמיחה שגשוג המושרה על ידי microenvironment.
Protocol
1. תרבית תאים ותחזוקה של רדום גרורתי שורות תאים סרטניים
- לגדל תאים סרטניים רדומים (D2OR / MCF7/K7M2-AS.46) ו גרורתית (D2A1 / MDA-MB-231 / K7M2) ב 10 תרבות צלחות ס"מ המכיל בינוני השתנה Dulbecco של הנשר (DMEM) גלוקוז גבוהה ו -10% בסרום שור עוברית ( FBS) ואנטיביוטיקה. לאחר שהתאים מגיעים מפגש 70-80%, המשך מבחני הבאה.
2. התפשטות תאים assay של תאים סרטניים רדומים (שקט) ו גרורתית (מתרבים) בתרבית מערכת 3D-BME
Culturing תאים רדומים / גרורתית במערכת 3D
- הפשירי Cultrex גורם הגדילה מופחת מרתף ממברנה חלץ (BME) ב 4 ° C במקרר לילה לפני ביצוע assay. שים לב BME יש לנהוג על קרח בכל עת.
- למחרת, במקום צלחת 96 היטב על מגש של קרח בתוך ברדס למינרית. מעיל אחד טוב עם 50-100μl של BME קרח קר באמצעות מתקן עם מזרק. ודא שאין בועות נוצרות הבארות. מניחים את צלחת 96 גם מצופה ב BME חממה humidified עם 5% CO 2 על 37 מעלות צלזיוס במשך 30 דקות.
- בינתיים לשאוב התקשורת של תאים סרטניים רדומים או גרורתי (מוכן בסעיף 1). לשטוף צלחות תרבות עם 10 מ"ל בופר פוספט pH מלוחים, 7.4 (PBS). לשאוב PBS ולהוסיף 2ml טריפסין מראש התחמם ב 37 מעלות צלזיוס, על צלחות תרבות. דגירה צלחות של 5% CO 2 humidified על 37 מעלות צלזיוס, במשך 5 דקות.
- העברת התאים צינור חרוטי 15 מ"ל המכיל 5 מ"ל של גלוקוז DMEM גבוהה בתוספת FCS ואנטיביוטיקה 10% לספור את התאים.
- ספין את מספר הסלולרי הכולל להיות מתורבת בצנטריפוגה תרבות רקמות במהירות של 1500g, בטמפרטורת החדר למשך 5 דקות. ב מבחני שלנו אנו מכינים 2x10 3 תאים / גם עבור כל קו התא או נקודת זמן כדי להיבחן. עם זאת, זה עשוי להשתנות בהתאם לקווי תא בשימוש.
- בזהירות לשאוב supernatant. שימו לב, ברוב המקרים גלולה אינה גלויה. לכן, להשאיר מאחורי התקשורת. לחץ על החלק התחתון של צינור חרוטי 15 מ"ל עם האצבעות על מנת להבטיח כי השעיה של תאים בודדים מתקבל. Re-להשעות את גלולה עם גלוקוז DMEM נמוך עם אנטיביוטיקה בתוספת 2% FCS BME + 2% (assay התקשורת). 100 μl של התקשורת assay יש להוסיף עבור כל 3 תאים 2x10. Triturate התאים פעמים רבות עם פיפטה 5 מ"ל להבטיח כי ההשעיה תא יחיד נשמרת.
- 100μl פלייט של התערובת לכל תא היטב על גבי צלחת 96 מצופה היטב BME. לצורך ההערכה רקע (בסעיף 2.8) צלחת 100μl בנוסף לכל היטב רק התקשורת assay על גבי צלחת 96 מצופה BME היטב. דגירה מתורבת 96 צלחות היטב humidified 5% CO 2 באינקובטור ב 37 ° C. תאים צריך להיות מחדש נמאס כל 4 ימים עם התקשורת assay.
הפצת assay:
- Assay הפצתו של התאים: להוסיף את הבארות בזמן הרצוי נקודות 20 μl של תאים titer 96 מימית פתרון אחד ערכת התפשטות תאים assay. מדגירים את humidified 5% CO 2 באינקובטור ב 37 מעלות 2h. שימוש Reader פלייט אליסה להקליט את ספיגת ב 490nm. לצורך ההערכה רקע וחיסור, להוסיף 20μl של titer תא 96 מימית פתרון אחד ערכת התפשטות תאים assay כדי מצופה מראש בארות עם BME ויצף רק עם התקשורת assay. שימוש Reader פלייט אליסה להקליט את ספיגת ב 490 ננומטר.
3. מכתים Immunofluorescent עבור התא מולקולות איתות (שקט) תאים רדומים הגידול ו / או גרורתי (מתרבים) תאים סרטניים
Culturing תאים רדומים / גרורתית במערכת 3D עבור מכתים immunfluorescence
* פרוטוקול הבא הוא שינוי של הפרוטוקול תרבות 3D בהוצאת Debnath J ואח' 18.
- הכן BME כמתואר בסעיף 2.1. למחרת: מקום 8-קאמרית שקופיות מערכת זכוכית על מגש של קרח בתוך ברדס למינרית. מעיל טוב עם כל 50ul של BME קרים כקרח באמצעות pipetman 200μl. ודא BME הוא להתפשט באופן שווה וללא בועות נוצרות הבארות. הנח את זכוכית חדר 8 שקופיות מצופה BME ב CO של 5% humidified 2 ב 37 מעלות צלזיוס למשך 20 דקות.
- קציר תאים רדומים או גרורתי מסעיף 1 ולהכין לתרבות, כמתואר בסעיף 2.3-2.4. אסוף את המספר הכולל של תאים בתרבית להיות צינור חרוטי 15 מ"ל. אנחנו מכינים 5 x10 3 תאים / היטב עבור כל שורה התא נקודת זמן כדי להיבחן. ספין למטה התאים בצנטריפוגה רקמות התרבות במהירות של 1500g, בטמפרטורת החדר למשך 5 דקות. לשאוב supernate בזהירות. שים לב גלולה אינה גלויה, ולכן להשאיר כמה התקשורת מאחור. לחץ על החלק התחתון של צינור חרוטי 15 מ"ל עם האצבעות על מנת להבטיח כי השעיה תא בודד מתקבל.Re-להשעות את גלולה עם התקשורת assay. 400μl של התקשורת assay יש להוסיף עבור כל 3 תאים 5x10. Triturate התאים פעמים רבות עם פיפטה 5 מ"ל. שלב זה חשוב מאוד כדי להבטיח כי ההשעיה תא יחיד נשמרת.
- פלייט 400μl של התערובת לכל תא היטב על גבי כל אחד 8 חדרים מצופה BME. דגירה תרבותי 8 לתאי מערכת שקופיות הזכוכית humidified 5% CO 2 באינקובטור ב 37 ° C. תאים צריך להיות מחדש נמאס כל 4 ימים עם התקשורת assay.
Immunofluorescence מכתים:
- בנקודות הזמן הרצוי, לשאוב את השכבה העליונה של התקשורת ולהוסיף 200μl של מקבע Paraformaldehyde המכיל 4% (PFA), סוכרוז 5% ו 0.1% Triton X-100 ו דגירה בטמפרטורת החדר במשך 5 דקות. לשאוב מקבע ולהוסיף 200μl של PFA 4% סוכרוז המכיל 5% ו דגירה בטמפרטורת החדר למשך 25 דקות.
- לשאוב מקבע, מוסיפים 400 μl של בופר פוספט (PBS) היטב כל אחד. דגירה במשך 10 דקות בטמפרטורת החדר. לשאוב PBS ולהוסיף 400 μ PBS המכיל 0.05% Tween 20 במשך 10 דקות בטמפרטורת החדר.
- בלוק תאים קבוע בטמפרטורת החדר עם 200μl של חמור או בסרום של 10% או 3% עם BSA עבור 1hour (חסימת פתרון לשמש יש לקבוע באופן אמפירי עבור כל נוגדן ראשוני).
- לשאוב את הפתרון חוסם ולהוסיף 200μl של הנוגדן הראשוני (דילול צריך להיקבע באופן אמפירי עבור כל נוגדן ראשוני לשמש). לדלל את הנוגדן העיקרי בסרום חמור של 10% אם 10% חמור בדם שימש חסימה או לדלל הנוגדן העיקרי BSA 3% 3% אם פתרון BSA חסימת היה בשימוש. דגירה עם הנוגדן העיקרי בין לילה ב 4 ° C.
- לשאוב את הנוגדן, לשטוף את הבארות עם 400μl PBS במשך 15 דקות וחזור פעמיים. לשאוב PBS ולהוסיף 200μl חמור נגד המיוחסים-IgG מצומדות כדי rhodamine אדום (דילול צריך להיקבע באופן אמפירי), לכסות את השקופית 8 קאמרית עם רדיד אלומיניום דגירה במשך שעה 1 בטמפרטורת החדר.
- לשטוף את הבארות עם 400μl PBS (3x15 דקות כל אחד לשטוף). לשאוב PBS. רכוב עם VECTASHIELD הרכבה בינונית עם DAPI. מגלשות יבש במשך 40 דקות בטמפרטורת החדר בחושך. שקופיות יכולים להישמר במשך שבוע 1 ב 4 ° C. אחסן את השקופיות בחושך. תמונה שקופיות באמצעות מיקרוסקופיה confocal.
4. נציג תוצאות:
דוגמה לניתוח התפשטות של D2.0R רדום גרורתי D2A1 תאים סרטניים בתרבות 3D מוצג באיור 1 א. תאים D2.0R הם רדומים (שקט) דרך כל התקופה ניסיוני 14 תרבות יום ואילו גרורתי מאוד D2A1 התאים נשארים רדומים רק 4-6 ימים לאחר מכן הם מתחילים להתרבות. במהלך השלב הראשוני רדומים, תאים רבים להישאר בודד בתרבות 3-D (איור 1B, יום 4) ואילו תאים שאינם מתרבים אחרים בצורה רב הסלולר spheroids. המעבר של D2A1 תאים רדומים המדינה שגשוג בתרבות 3-D (איור 1B, יום 12) קשורה עם שינויים דרמטיים מורפולוגיה התא. לפיכך, assay זה יכול לשמש כדי לבחון מה גורם / s עלול לעורר תאים רדומים D2.0R לצאת ממצב רדום שלהם ומה גורם / ים עשוי למנוע D2A1 תאים המעבר ממצב רדום שלהם. איור 2 הוא דוגמה של סוכן מניעת D2A1 תאים רדומים המעבר למצב שגשוג. כמוצג באיור 2, טיפולים של D2A1 תאים עם מעכב ספציפי של קינאז אור שרירן רשת (ML-7) שמרו D2A1 בתאים במצב רדום.
תא האיתות של תאים סרטניים בתרבית רדום מתרבים במערכת 3D ניתן ללמוד על ידי מכתים immunofluorescence עבור מולקולות התא איתות. כמוצג באיור 3 עלייה משמעותית זרחון שרשרת שרירן אור D2A1 תאים (כתמים אדומים) ואחריו ארגון מחדש של ה-F-אקטין חוטים ויוצרים מתח סיבי אקטין (כתמים ירוקים) מתרחשת במהלך המעבר שלהם תרדמת (1-4 ימים) כדי התפשטות (יום 7). עם זאת, חסימת שרשרת שרירן אור קינאז פעילות D2A1 תאים על ידי shRNA או תרופה מסוימת (ML-7) שומרת D2A1 בתאים במצב רדום תוצאות עיכוב זרחון שרשרת שרירן אור F-אקטין סיבים מתח הארגון (איור 4).
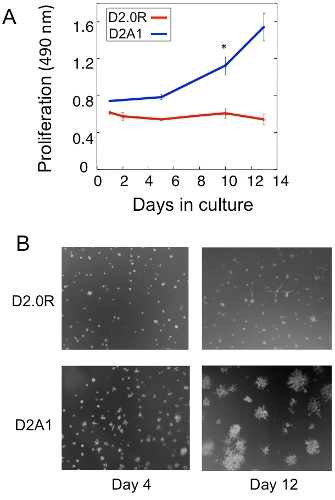
באיור 1. במודל חוץ גופית ללמוד הגידול בודד תא רדום והמעבר לצמיחה גרורתי. א) הפצת D2.0R רדום גרורתי D2A1 ב 3-D Cultrex BME, n = 8 (ממוצע ± SE). תוצאות נציג של שלושה ניסויים (* p ≤ 0.05). ב) תמונות במיקרוסקופ אור D2.0R ו D2A1 תאים בתרבית בתוך 3-D X20 Cultrex BME ההגדלה.איור שונה מן ברקן ואח' 17.
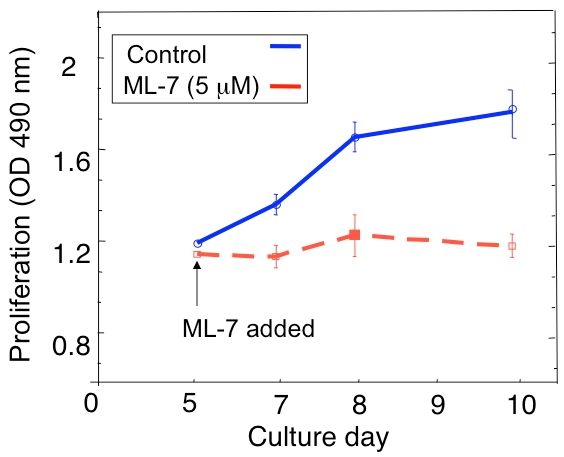
איור 2. מניעת מעבר של D2A1 תאים רדומים (קפאון) לשגשוג במערכת התרבות 3D על ידי עיכוב קינאז אור שרירן שרשרת (MLCK). כמובן זמן של התפשטות תאים בתרבית D2A1 3-D Cultrex BME, n = 8 (ממוצע ± SE). תאים היו מטופלים (שליטה), או שטופלו מעכב ספציפי של MLCK (ML-7, 5 מיקרומטר) לתחילת 48 שעות ביום תרבות 5. איור שונה מן ברקן ואח' 17.
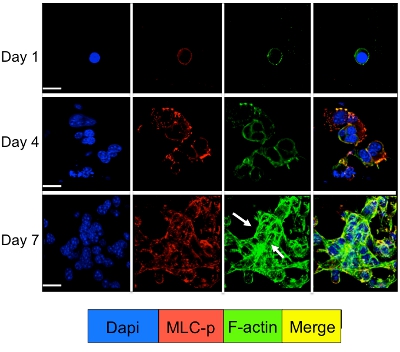
איור 3. זירחון שרירן שרשרת אור ואחריו ארגון מחדש F-אקטין במהלך המתג של D2A1 תאים רדומים לצמיחה שגשוג. D2A1 התאים בתרבית 3-D Cultrex BME בשקופית 8 זכוכית קאמרית. תאים קובעו ונצבעו עם DAPI (כחול) עבור לוקליזציה גרעיני, phalloidin (ירוק) עבור מטוסי F-אקטין עם נוגדן נגד בצורת פוספורילציה של שרשרת אור שרירן (MLC-p) (אדום), כפי בנקודות זמן שונות. מיזוג של אקטין-f, ו-p מכתים MLC (צהוב). הביטוי של MLC-p הוגדל במהלך המעבר של D2A1 תאים רדומים (days1-4) צמיחה שגשוג (יום 7) ואחריו היווצרות מתח סיב אקטין (חיצים). מיקרוסקופיה confocal, הגדלה x63. לבן בר שווה 20 מיקרון. איור שונה מן ברקן ואח' 17.
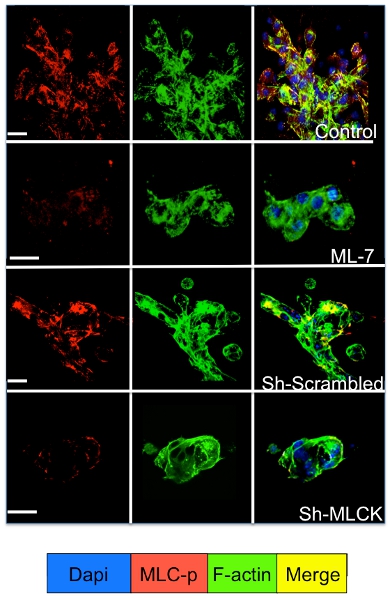
איור 4. . עיכוב של קינאז אור שרירן שרשרת (MLCK) סיבים בתיווך F-אקטין מתח היווצרות של תאים D2A1 D2A1 תאים היו מטופלים (שליטה), או שטופלו במעכבי עבור MLCK (ML-7, 5 מיקרומטר), על תחילת 48 שעות ביום תרבות 5, או שטופלו מקושקשות או MLCK shRNA ומוכתמת לטופס פוספורילציה של שרשרת אור שרירן (MLC-p) (אדום), F-אקטין (ירוק), גרעינים (כחול). מיזוג של אקטין-f, ו-p מכתים MLC (צהוב). מיקרוסקופיה confocal, הגדלה x63. לבן בר שווה 20 מיקרון.
Discussion
המנגנונים ששומרים המופץ תאים סרטניים במצב רדום או תוצאה במעבר שלהם לצמיחה גרורתי אינם ידועים ברובם. תופעה זו כבר קשה מאוד ללמוד בחולים אנושיים 4,12 ו במודלים פרה כמה פותחו כדי לטפל בבעיה זו. עם זאת, כמה in vivo לשעבר vivo מערכות מודל תרדמת הגידול היה מאופיין (הנסקר...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
מחקר זה מומן בחלקו על ידי תוכנית המחקר עירונית של המוסד הלאומי לסרטן.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| DMEM גלוקוז גבוה | Invitrogen | 11965-118 | |
| DMEM נמוך גלוקוז | Invitrogen | 11885-092 | |
| עוברית שור בסרום (FBS) | Invitrogen | 10091-148 | |
| גורם צמיחה מופחת ממברנה 3-D Cultrex חלץ מרתף | Trevigen בע"מ | ריכוז חלבון בין 14-15mg/ml | |
| D2.0R ו D2A1 שורות תאים | 5,19 | ||
| K7M2 ו K7M2AS1.46 תאים | 20 | ||
| MCF-7 ו מד"א-MB-231 תאים סרטן השד | ATCC | ||
| 8 זכוכית תא שקופיות מערכת | (Lab-TEK, Thermo Scientific) | 177402 | |
| תא titer 96 מימית פתרון אחד התפשטות תאים assay ערכת | Promega | G3580 | |
| VECTASHIELD הרכבה בינונית עם DAPI | וקטור מעבדות בע"מ | H-1200 | |
| רגיל חמור בדם | ג'קסון ImmunoResearch | 017-000-121 | |
| אליסה פלייט Reader | Bio-Tec | שיא 490nm | |
| Confocal מיקרוסקופ | Zeiss, LSM-510 | הגדלה x63 |
References
- Aguirre-Ghiso, J. A. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846 (2007).
- Pantel, K., Woelfle, U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agents. 18, 120-125 (2004).
- Naumov, G. N. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases. Breast Cancer Res Treat. 82, 199-206 (2003).
- Klein, C. A. Framework models of tumor dormancy from patient-derived observations. Curr Opin Genet Dev. , (2010).
- Naumov, G. N. Persistence of solitary mammary carcinoma cells in a secondary site: a possible contributor to dormancy. Cancer Res. 62, 2162-2168 (2002).
- Townson, J. L., Chambers, A. F. Dormancy of solitary metastatic cells. Cell Cycle. 5, 1744-1750 (2006).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2, 563-572 (2002).
- Pantel, K. Differential expression of proliferation-associated molecules in individual micrometastatic carcinoma cells. J Natl Cancer Inst. 85, 1419-1424 (1993).
- Demicheli, R. Tumour dormancy: findings and hypotheses from clinical research on breast cancer. Semin Cancer Biol. 11, 297-306 (2001).
- Braun, S. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 353, 793-802 (2005).
- Pantel, K., Alix-Panabieres, C., Riethdorf, S. Cancer micrometastases. Nat Rev Clin Oncol. 6, 339-351 (2009).
- Goss, P. E., Chambers, A. F. Does tumour dormancy offer a therapeutic target. Nat Rev Cancer. 10, 871-877 (2010).
- Mendoza, A. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120, 2979-2988 (2010).
- Naumov, G. N. A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype. J Natl Cancer Inst. 98, 316-325 (2006).
- Barkan, D. Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment. Cancer Res. 70, 5706-5716 (2010).
- Barkan, D., Green, J. E., Chambers, A. F. Extracellular matrix: A gatekeeper in the transition from dormancy to metastatic growth. Eur J Cancer. , (2010).
- Barkan, D. Inhibition of metastatic outgrowth from single dormant tumor cells by targeting the cytoskeleton. Cancer Res. 68, 6241-6250 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Morris, V. L. Mammary carcinoma cell lines of high and low metastatic potential differ not in extravasation but in subsequent migration and growth. Clin Exp Metastasis. 12, 357-367 (1994).
- Khanna, C. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 10, 182-186 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved