Method Article
ניתוח כמותי של רענון שלפוחיות Synaptic בריכת ב Cultured נוירונים גרגיר cerebellar באמצעות צבעים FM
In This Article
Summary
טכניקת דימות פלואורסצנטי לחיות לכמת את חידוש והתגייסות של שלפוחית סינפטית ספציפי (SV) בריכות במסופי העצבים המרכזית מתוארת. שני סיבובים של SV מיחזור מנוטרים על מסופי העצב אותו מתן הבקרה הפנימית.
Abstract
לאחר שחרור הנוירוטרנסמיטר במסופי העצבים המרכזית, SVS מאוחזרות במהירות על ידי אנדוציטוזה. SVS קטגוריה הם ומילא אז עם העצבי להצטרף בריכה מיחזור, כהגדרתו SVS הזמינים 1,2 exocytosis. הבריכה מיחזור בדרך כלל ניתן לחלק לשתי בריכות נפרדות - הבריכה releasable בקלות (RRP) ובריכת מילואים (RP). כמו שמותיהם לרמוז, RRP מורכב SVS כי הם מיד זמין עבור היתוך בעוד RP SVS משתחררים רק במהלך 1,2 גירוי עז. חשוב יש assay אמין כי הדיווחים חידוש ההפרש של בריכות אלה SV כדי להבין 1) איך SVS תנועה לאחר מצבים שונים של אנדוציטוזה (כגון אנדוציטוזה clathrin תלויי ופעילות תלויי אנדוציטוזה בתפזורת) ו 2) את המנגנונים שליטה על גיוס של שני RRP ו RP בתגובה לגירויים שונים.
צבעים FM הם מעסיקים באופן שגרתיעורך הדו"ח כדי כמותית מחזור SV במסופי העצבים המרכזית 3-8. יש להם זנב פחמימני הידרופובי המאפשר חלוקת הפיך ב bilayer השומנים, וקבוצה ראש הידרופילי כי מעבר אבני דרך ממברנות. צבעים יש הקרינה קטנה בתמיסה מימית, אך התשואה הקוונטים שלהם גדל באופן דרמטי כאשר למחיצות בקרום 9. כך צובעת FM הם בדיקות ניאון אידיאלי עבור מעקב פעיל מיחזור SVS. הפרוטוקול הסטנדרטי לשימוש FM לצבוע הוא כדלקמן. תחילה הם מוחלים על נוירונים נלקחים במהלך אנדוציטוזה (איור 1). אחרי לא הפנימו צבע נשטף הרחק הממברנה פלזמה, ממוחזר להפיץ SVS בתוך הבריכה מיחזור. SVS אלה מתרוקנים מכן באמצעות גירויים פריקה (איור 1). מאז FM תיוג צבען של SVS הוא quantal 10, הירידה הקרינה המתקבלת היא פרופורציונלית לסכום של שלפוחית שפורסמו. לפיכך, מיחזור היתוך של SVS שנוצר יח"צבסיבוב evious של אנדוציטוזה ניתן לכמת באופן מהימן.
כאן, אנו מציגים פרוטוקול שונתה כדי להשיג שני מרכיבים נוספים של מידע. ראשית, גירויים פריקה רציפים משמשים דיפרנציאלי לפרוק את RRP לבין RP, על מנת לאפשר כימות של חידוש המלאי של בריכות SV ספציפיים. שנית, כל מסוף העצב עובר את הפרוטוקול פעמיים. לכן, התגובה של המסוף העצב באותו S1 ניתן להשוות נגד הנוכחות של חומר המבחן בשלב S2 (איור 2), מתן הבקרה הפנימית. זה חשוב, שכן היקף מיחזור SV ברחבי הטרמינלים עצב שונים משתנה מאוד 11.
כל התרבויות חסיד עצבי ראשוני יכול לשמש עבור פרוטוקול זה, אולם צפיפות ציפוי, פתרונות התנאים גירוי מותאמים נוירונים גרגיר cerebellar (CGNs) 12,13.
Protocol
1. גרגיר cerebellar Neuron הכנה
- החיטוי כ 100 בקוטר 25 מ"מ coverslips (טבלה 1).
- המקום coverslips בצינור סטרילי המכיל 50 מ"ל פתרון סטרילי poly-D-ליזין (טבלה 2). מניחים על משטח מסתובב במשך שעות על 2 המעיל coverslips.
- Coverslips מצופה יבש על נייר סטרילי במנדף זרימה למינרית (טבלה 1).
- Coverslips המקום לתוך 6 צלחות גם סטרילית Coverslips חם CO 2 באינקובטור (טבלה 1). יכול להיות מאוחסן במשך חודש 1 ב 4 מעלות לפני השימוש.
- להרדים חולדה 7 יום הישן ספראג Dawley הגור על פי הנחיות הוועדה המקומית אתית. אנו מורדמים גורים באמצעות נקע בצוואר הרחם.
- מנתחים את המוח הקטן והנח אותו בצלחת פטרי סטרילי המכיל מלחי פוספט שנאגרו פתרון (פתרון ב ', לוח 3).
- חזור על שלבים 1.5 ו -1.6 עבור 4-6 גורים עכברוש.
- Cerebella ממוקמות אז על הבמה סטרילית של רקמות צ'ו McIlwainpper (טבלה 1). רקמה היא קצוץ על 375 מיקרומטר במרווחים לפני סיבוב דרך שלב 90 ° ולחזור על התהליך.
- Cerebella קצוץ מועברים לתוך פתרון טריפסין (פתרון T, לוח 4), אשר בעבר חימם עד 37 ° C.
- דגירה cerebella על 37 מעלות צלזיוס במשך 20 דקות עם תסיסה עדינה בערך כל 5 דקות.
- במהלך העיכול tryptic, להבה לק three pipettes זכוכית סטרילית (טבלה 1) באמצעות להבה בונזן. השתמש כדי ליצור את הלהבה משעמם בסדר, משעמם בינוני משעמם רחב על פיהם בהתאמה של טפטפות.
- לאחר הדגרה 20 דקות ב T פתרון, להוסיף 20 מ"ל של תמיסת טריפסין / DNase מעכב (פתרון W, לוח 5) על השעיית cerebellar ותאי גלולה ב g 1000 דקות 1 בצנטריפוגה benchtop (טבלה 1).
- למזוג supernatant ו resuspend התא גלולה ב 1.5 מ"ל של מרוכזת טריפסין / DNase מעכב (פתרון C, לוח 6) בעזרת פיפטה נשא הרחב ביותר.
- Triturate התאים בעזרת פיפטה הראשון רחב לשעמם, אז המדיום נשא ולבסוף נשא צר עד ההשעיה תא הומוגנית. זהו צעד מפתח, ההשעיה חייבת להיות הומוגנית בשלב זה.
- שכבת תאים השעיה על גבי 10 מ"ל של prewarmed (37 ° C) שור בסרום אלבומין Earles בתוספת מלחים פתרון מאוזן (לוח 7) בתוך שפופרת 15 מ"ל סטרילי.
- צנטריפוגה ההשעיה דקות 5 גרם ב 1500 ו resuspend התא גלולה ב 2 של ה-MLS prewarmed (37 ° C) בינוני תרבות (לוח 8).
- אומדן מספר הסלולרי באמצעות haemocytometer (טבלה 1) ו לדלל את ההשעיה התא צפיפות סופי של 3.3 x 10 6 תאים לכל מיליליטר.
- תאים הם מצופה על ידי הוספת 75 μl של השעיה התא למרכז poly-D-ליזין מצופה coverslips (צפיפות הסופי 2.5 x 10 5).
- צלחות התרבות המכיל את coverslips ממוקמים CO 2 באינקובטור במשך 60 דקות כדי לאפשר לתאיםdhere.
- הוסף 1.5ml של המדיום תרבות לתוך זה גם נזהרת שלא להפריע את התאים מצופה להחזיר את הצלחות התרבות של CO 2 באינקובטור.
- למחרת להחליף את התרבות בינוני עם בינוני תרבות טרי השלים עם arabinoside מעכב mitotic ציטוזין (לוח 8). התפשטות זו מעצרים של ותאי גלייה בתרבות.
2. ניסיוני ההתקנה
- התקנה ניסיונית בסיסית צריכה להיות מורכבת מאלה (ראה לוחות 1 ו - 9 עבור ציוד תוכנה ספציפיים בשימוש):
- הפוך עלית מיקרוסקופ פלואורסצנטי
- מצלמת CCD מקורר
- מקור אור פלורסנט (monochromator או גלגל לסנן)
- זלוף הכבידה מנגנון
- הדמיה תא עם אלקטרודות פלטינה במקביל
- חשמל ממריץ
- מחשב
- רכישת תמונה תוכנה
- ניסויים יש לבצע בחושך או תחת יות אור אדוםitions עם תאורה פלורסנט מינימום המדגם, כדי למנוע הלבנת לצבוע FM.
- הניסויים מתבצעים בטמפרטורת החדר. אם הטמפרטורה פיזיולוגית נדרשת, מערכת בקרת טמפרטורה זלוף ניתן להשתמש.
3. לדוגמה הכנה
- תרבויות יש להשתמש לאחר 8-12 ימים במבחנה.
- העברת coverslip יחיד תמיסת מלח (לוח 10) במשך 10 דקות בטמפרטורת החדר כדי לאפשר ייצוב במדיום החדש.
- הסר את coverslip, יבש התחתון שלה והסביבה התאים המצורפת עם חתיכה קטנה של נייר מגבת או נייר סופג.
- באמצעות גריז סיליקון (טבלה 2), דבק coverslip לחלק התחתון של החדר הדמיה. תאים צריכים להיות בין שני חוטים מקבילים. גריז סיליקון מספיק יש להשתמש כדי לאטום לחלוטין את תא שומן אך ללא כל הנכנסים למרכז חדר אמבטיה.
- בעדינות למלא את חדר האמבטיה עם ~ 260 μl saקו פתרון ולאחר מכן למלא את צינור הזנה עם פתרון זהה.
- דבק coverslip נקי עם גריז סיליקון לחלק העליון של החדר כדי לאטום אותו. צינורות קלט ופלט ניתן להשתמש כדי להסיר בועות אוויר שנלכדו בחדר. חשוב כי מעגל חשמלי אינו מופרע על ידי בועות אוויר.
- Immobilise הקאמרית הדמיה פלטפורמה נירוסטה לבדוק אם קיימת דליפה ידי בעדינות המרוססת תמיסת מלח דרך צינור ההזנה.
- הר קאמרית כינס על הבמה של מיקרוסקופ הפוכה, ולחבר את חדר למערכת זלוף הכבידה, לאחר דרוך הראשון מפרצון עם תמיסת מלח.
- צרף חיבור חוטים של החדר כדי ממריץ החשמל.
- מוסיפים טיפת שמן טבילה למטרה אם העדשה שמן משמש. פוקוס על התאים באמצע החדר באמצעות תאורה בשדה בהיר.
4. S1 שלב
- נוירונים Perfuse עם 1.5 מ"לצבען של FM (לוח 2) בדילול מלא תמיסת מלח.
- לעורר נוירונים לעורר ספיגת צבע באמצעות ממריץ המצורפת.
- לאחר גירוי, הנוירונים perfuse עם תמיסת מלח טרי 2 דקות לשטוף עודף FM צבען (קצב הזרימה 7 mL / min). זיהום גליה במערכת התרבות CGN הוא פחות מ 5% 14, ולכן זו מסגרת זמן מספיקה כדי להסיר צבע .
- השאירו נוירונים לנוח דקות 8.
- במהלך ההפסקה הזו, אתר רשתות axonal שבו הפרט FM לצבוע טעון מסופי העצבים גלויים אורכי גל והעמסת משתמש (עירור, 480 ננומטר; פליטה,> 550 ננומטר). הימנע שטחים עם אשכולות של תאים. שמור תאורה למינימום בשלב זה, שכן עירור אינטנסיבי יכול לגרום phototoxicity לצבוע. סימנים ברורים לכך הן blebbing של אקסונים וחוסר צבען פריקה (בשל צבע תיקון).
- Re-להתמקד בתמונה מיד מאז סחיפה קלה לפני רכישת התמונה ייתכן שאירעו במהלך תקופת מנוחה.
- בגין זמן לשגות רכישת התמונה בשיעור של 1 מסגרת כל 4 s.
- לאחר רכישת 5-10 תמונות בסיסית, לעורר exocytosis של RRP על ידי מתן גירוי 30 הרץ 2 s (60 פוטנציאל פעולה) 8 להתחיל גירוי ידני מיד לאחר לכידת מסגרת..
- לאחר רכישת עוד 10 תמונות, לעורר exocytosis SV של RP באמצעות שלושה גירויים של 40 הרץ במשך 10 שניות (400 פוטנציאל פעולה), כל 30 שניות חוץ 8.
- רוכשת עוד 5-10 תמונות ואז התמונה הרכישה הפסקה.
5. שלב השחזור (ראה איור 2)
- אפשר נוירונים להתאושש על לפחות 20 דקות.
- אופציונלי - אם את ההשפעה של תרופה על אנדוציטוזה הוא להיבדק, הנוירונים perfuse עם פתרון התרופה בתקופה זו (איור 2b) 3,8.
6. S2 שלב
- חזור על פרוטוקול שלב S1 (סעיף 4) עבור ניסוי לשלוט באמצעות אותו שדה הראייה כמוב S1.
- אופציונלי - אם את ההשפעה של תרופה על אנדוציטוזה הוא להיבדק, perfuse נוירונים עם פתרון התרופה בתוספת FM צבען (איור 2b) 3,8.
- אופציונלי - לחילופין אם השפעות התרופה על exocytosis הם עניין, הנוירונים perfuse עם פתרון התרופה גם לפני וגם במהלך RRP ו RP גירויים פריקה (איור 2 ג) 3.
7. ניתוח נתונים
- השתמש ImageJ ו-Microsoft Excel או תוכנה דומה לניתוח נתונים.
- לניתוח, רצף תמונה בתבנית ערימה נדרשת. כמה תוכנות הדמיה עשויה לייצא רצפים כתמונות יחיד. אם זה המקרה, להמיר תמונות ערימה באמצעות ImageJ מובנית פונקציית תמונה> ערמות> תמונות מחסנית.
- התאם את הבהירות והניגודיות של מחסנית כדי למקסם את הטווח הדינמי. תמונה> התאם> בהירות / ניגודיות (איור 3 א).
- אם להיסחף אופקי משמעותי התרחש במהלך tהוא הניסוי, לרוץ StackReg ( http://bigwww.epfl.ch/thevenaz/stackreg/ ) ו TurboReg ( http://bigwww.epfl.ch/thevenaz/turboreg/ ) plugins על ImageJ ליישר מחסנית תמונה (איור 3 ב) .
- הפעל סדרות עתיות Analyzer תוסף ( http://rsbweb.nih.gov/ij/plugins/time-series.html ) (איור 3c).
- הגדרת אזורים של עניין (ROIs) על לפחות 90 מסופי העצב. אלה צריכים להיות זהים (ROIs עגולה בקוטר 1.5 מיקרומטר) זה מועיל כדי לעבור בין התמונות לפני ואחרי לצבוע פריקה לחשוף מסופי העצב הפעילים (לחילופין גירוי טרום התמונה ניתן מפחיתים את התמונה שלאחר גירוי). האידיאלי גודל ההחזר על ההשקעה הוא אחד כי הוא מעט גדול יותר מסוף עצב טיפוסי (איור 3c).
- השג את עוצמת הכל / משולב הקרינה של כל ROI על timדואר ולייצא ל-Microsoft Excel (איור 3D ו 4 א).
- Normalise עקבות ROI ערך שרירותי זהה על ידי יישור עקבות המטוס של ציר ה-Y עבור הגירוי הפריקה הראשונה שלבי הן S1 ו - S2 (איור 4 ב-c). זה כדי לשלוט על שינויים קטנים בעוצמת הקרינה רקע.
- מדוד את הירידה מוחלטת הקרינה עורר על ידי גירוי כל פריקה ביחידות הקרינה שרירותי עבור S1 ו - S2 כדלקמן (איור 4d):
- RRP = שינוי פלואורסצנטי (ΔF) מופעלת על ידי 30 הרץ 2 s
- RP = סכום ΔF מופעלות על ידי 3 x 40 10 Hz s
- בריכת מיחזור סה"כ = RRP + RP
- עבור כל פרמטר רלוונטי 7.9, לחשב את הערך הממוצע על כל מסופי העצבים של ניסוי יחיד.
- לניתוח סטטיסטי, כלומר הערכים שהתקבלו בניסויים עצמאית מרובות ניתן בממוצע. מספר coverslips ולא במספר מסופי העצב צריך לשמש statisticaאני n.
8. נציג תוצאות:
הניסוי פקד שבו CGNs עברו שני סיבובים של צעדים זהים העמסה ופריקה מיוצג באיור 5. כאשר החל סדרה של ניסויים, זה חיוני כי ניסוי בקרה כגון זה מתבצע כל יום, כדי לאשר כי S1 ו - S2 דומים לפני משתנים תנאי הניסוי במהלך S2.
בדוגמה זו, CGNs עמוסות 10 מיקרומטר FM1-43 באמצעות 80 הרץ 10 גירוי s (איור 5 א). תרשים 5b מראה FM1-43 טעון מסופי עצב מיוצג על ידי puncta ניאון. ROIs הוגדרו מעל 90 מסופים עצב כפי שמוצג באיור 5c. אותה קבוצה של ROIs שימש הן S1 ו - S2. במהלך פריקת שני, RRP היה פרקו הראשון עם 30 הרץ (2 ים) גירוי ואחריו RP פריקה עם 3 40Hz רציפים (10 י) לגירויים (ציור 5a). ירידה הקרינה במהלך כל גירוי ניתן להבחין באופן ברור לכמת (תרשים 5d-e). כאשר בדקו, הקרינה יורדת המתאימים RRP, היו RP ובריכת מיחזור הכולל דומה בשני S1 ו - S2. בנוסף, 20% SVS ממוחזרים התגורר RRP בעוד 80% התגוררו RP בשני S1 ו - S2.
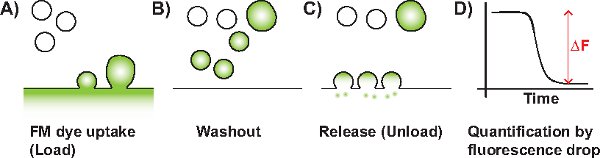
תרשים 1 תרשים סכמטי של ניסוי FM טיפוסי. א) אנדוציטוזה SV מופעלת בנוכחות FM צבען (המיוצגים ירוק). צבע הוא נלקח על ידי קרום invaginating (SVS יחיד או בתפזורת endosomes). ב) Non-הפנימו לצבוע על קרום הפלזמה הוא נשטף על ידי זלוף. ג) לאחר יישום של גירוי פריקה, שכותרתו SVS שהפכו זמינים עבור הפתיל שחרור עם קרום הפלזמה שגורם לאובדן של הקרינה. D) השינוי פלואורסצנטי (ΔF) אשר עומדת ביחס לכמות SVS שכותרתו שוחרר לאחר מכן ניתן לכימות.
_upload/3143/3143fig2.jpg "/>
איור 2 דיאגרמות סכמטי של פרוטוקולי הניסוי אפשרי. א) תרשים זרימה של ניסוי שבו תאים בקרת לעבור שני סיבובים של FM לצבוע העמסה ופריקה (S1 ו S2). תאים ניתן לטעון באמצעות מגוון של גירויים שונים. צעדים פריקה זהים כי RRP הוא פרקו עם 30 הרץ עבור 2 s ואחריו RP לפרוק באמצעות 3 פעמים 40 הרץ ל -10 ש ' RRP ובמילואים הבריכה לגירויים פריקה הופרדו על ידי 40 שניות, כל גירוי אחרות של 30 שניות. תאים הם עזבו להתאושש במשך 20 דקות בין S1 ו - S2. תרשימי זרימה של שינויים אפשריים על מנת לבחון את ההשפעה של חומר על או B) אנדוציטוזה או C) exocytosis מוצגים גם. התרופה מבחן מקבילים ניתן perfused החדרה בתקופות המצוין.
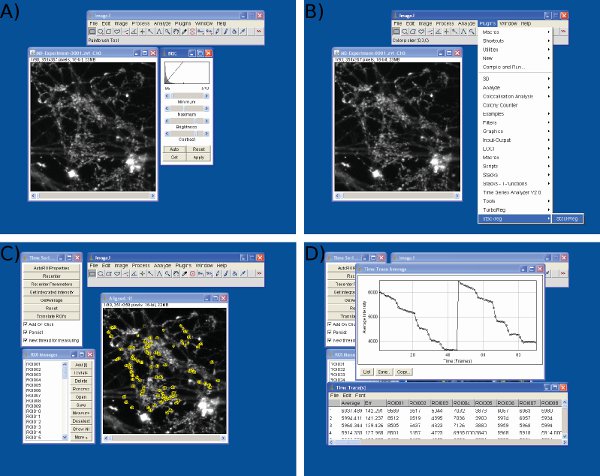
איור 3 צילומי מסך של ניתוח נתונים ב-J תמונה. מוצגים צילומי מסךלמען הבהירות) והתאמה לעומת זאת, ב ') יישור מסגרת, ג) בחירה ROIs, ו-D) ערכי עוצמת השאיבה באמצעות תמונה ג'
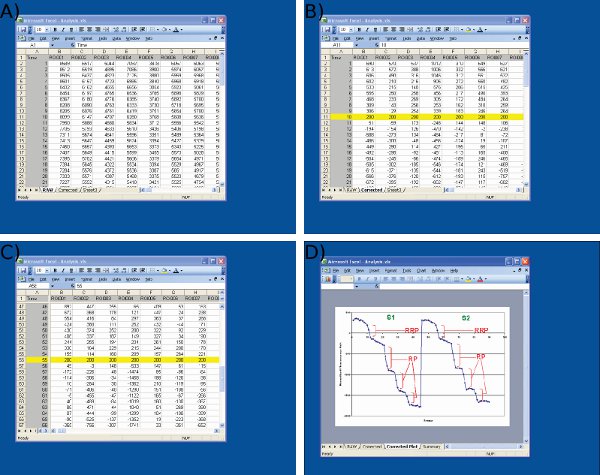
איור 4 תמונות מסך של ניתוח נתונים ב-Microsoft Excel. מסך מוצגים עבור A) ייבוא נתונים גולמיים תמונה J (1 טור רח' = מסגרת מספר, טורים הנותרים = נתונים מסופי עצב בודדים) ב) התאמת ערכי הבסיס S1 (מסגרת 10) ערך שרירותי (200) בתחילת הגירוי הראשון, ג) התאמה של ערכי הבסיס S2 ב 55 מסגרת באמצעות פרוטוקול זהה S1, ו-D) מדידה של טיפות הקרינה באמצעות Microsoft Excel. שימו לב לאתר בממוצע מוצגים D משמש להגדרת נקודות זמן לפני ואחרי כל טיפה. גודל טיפות הקרינה עבור ההחזר על ההשקעה כל צריך להיקבע מתוך ערכים על הגיליון שמוצג ג

איור 5. נציג הניסוי שליטה. א) תרשים זרימה של ניסוי לשלוט בו CGNs עמוסות 10μM FM1-43 באמצעות 80 הרץ (10 י) גירוי. שלבי S1 ו - S2 זהים. RRP ובמילואים הבריכה לגירויים פריקה הופרדו על ידי 40 שניות, כל גירוי אחרות של 30 שניות. ב) התמונה מראה מסופי העצב עמוסה FM1-43. ג) תמונה זהה ב 90 מראה ROIs ממוספרים שנבחר לניתוח. D) תמונות של אזור מתואר על ידי קופסה אדומה B בנקודות הזמן שנבחר. = Basal לפני גירוי, 30 הרץ = לאחר גירוי 30 הרץ 2 s; 40 הרץ 1,2,3 = 40 אחרי גירוי של 10 הרץ כל אחד. תמונות אלה מוצגות pseudocolor כדי להמחיש שינויים פלואורסצנטי (בר ספקטרום המוצג בצד ימין). E) ממוצע ± עקבות SEM המתקבל 90 מסופי העצב מתואר גירויים ג בודדת מיוצגים על ידי מוטות אופקיים. ברים סולם = 10 מיקרומטר.
Discussion
צבעים FM נמצאים בשימוש נרחב לחקור פונקציה מסוף עצב בהכנות עצבי רבים. הם היו מועסקים בעיקר כדי לפקח על היקף אנדוציטוזה או SV, מחזור SV או קינטיקה של exocytosis 6. פרוטוקול תיאר מרחיב את המחקרים הללו כדי לבחון את ההפרש פריקה של בריכות SV ספציפיים. זה מספק מידע נוסף על חידוש של בריכות SV וגם היקף הגיוס שלהם.
צבעים FM ניתן להשתמש בתווית מספר סיבובים של מיחזור SV בתוך מסופי העצב אותו. אנחנו צריכים לנצל את רכוש שנועד פרוטוקולים בהם תחלופה SV בטרמינל אחד יכול להיות במעקב פעמיים מסופי העצב אותו. זה מספק בקרה פנימית מדויק, שהוא חיוני בשל אופי הטרוגני של מיחזור SV במסופי עצב מקביל 11. באמצעות שימוש של השלב S1 כמו שליטה פנימי, המילוי של RRP, RP לבין סךבריכת SV בנוכחות תרופות ניתן להשוות באופן אמין וישיר.
בנוסף לאספקת מידע על גודל מוחלט של מיחזור, בריכות RRP ו RP בתנאי גירוי שונים, פרוטוקול זה יכול גם לספק נתונים הבאים - 1) חלוקת SVS בין RRP ו RP כפונקציה של הבריכה מיחזור עבור S1 ו - S2, 2) את הגודל היחסי של בריכות S2 (RRP ו RP) כפונקציה של הבריכה הכולל מיחזור S1 ו - 3) את הגודל היחסי של כל הבריכה SV S2 מוגדרת כפונקציה של הבריכה באותו S1. זה פרוטוקול מסוים לא תספק מידע על קינטיקה פריקה עם זאת, מאז הרכישה הזמן הוא איטי מדי (עבור מדידות הקינטית פעמים הרכישה צריך להיות מהיר ככל האפשר ופריקה אוטומטית מסונכרן לכידת תמונה).
30 הרץ שלנו 2 גירויים s מעורר מידה זהה של RRP הפריקה כדי סוכרוז hypertonic 8. מאז גודל RRPמוגדר על ידי סוכרוז hypertonic הפריקה 15, אנו יכולים לקבוע כי פרוטוקול זה פורק כל SVS RRP, בהסכמה עם מחקרים נוירונים בהיפוקמפוס 16. הבריכה מילואים מתרוקן כמעט לחלוטין על ידי שלוש רכבות של 400 גירויים (כל אחד 40 הרץ זה 10) מאז הגירוי הזה פורק סכום זהה של צבע על פרדיגמה (2 גירויים עם 50 מ"מ KCl) כי מכלה 95% מכלל צבען שכותרתו SVS 8,17. כימות מדויק של גודל הן RRP ובמילואים בריכה תלוי גם בהשגת מידע בטווח דינאמי ליניארי של המצלמה CCD.
פרוטוקול זה פשוט יכול גם להיות שונה יותר. העוצמה של גירויים טוען גם יכול להיות מגוונות כדי לקבוע כיצד הפעילות העצבית מצבי אנדוציטוזה שונה להשפיע על חידוש SV הבריכה. יתר על כן, יותר מאשר שני מחזורים של טעינה ופריקה יכול גם להתבצע אם נדרש. פרוטוקול זה יכול לשמש גם בתאים transfected עם ביטוי יתר אוshRNA וקטורים. בשל היעילות הנמוכה של תרבויות transfection עצבי ראשוני, חלבונים הביע חייב להיות מתוייגים עם חלבוני ניאון. זה חיוני כי אלה תגי פלורסנט לא להפריע לאות לצבוע FM (שימוש ציאן או חלבונים אדום, למשל). במקרה זה, מסופי עצב מתאי transfected ולא transfected באותו שדה הראייה יכול להיות גם בהשוואה בקרה נוספת 8. בניסויים כגון השוואה של מידת הטעינה בין המון S1 ו S2 הוא בעל ערך קטן, שכן ההפרעות שוהה במהלך עומסי שניהם. מחיצות של צבע בין בריכות SV עדיין יכול להיות דמיינו אולם 8.
כתבים גנטית בשם pHluorins יכול גם להיות מועסק כדי לפקח exocytosis אנדוציטוזה SV ובתרבות עצבי ראשוני. בדיקות אלו להשתמש בחלבון ה-pH רגיש פלואורסצנטי ירוק לסביבה pH של תחומים luminal של חלבונים SV מתויג כגון נצלנית, synaptophysin ו VGLUT1 18 . כאשר משתמשים בשילוב עם מעכבי שלפוחי ATPase, pHluorins יכול לדווח הן קינטיקה והיקף גיוס בריכה SV 19. הגישה FM-צבע מבוסס המתואר כאן יש כמה יתרונות על פני הטכניקה pHluorin, ראשית, צבעים FM לספק מידע על מצב שבו SV אנדוציטוזה ומחדש RRP ובריכות מילואים 8. ספציפי שנית בריכות SV יכול להיות מתויג עם צבעים FM כי יש תכונות ספקטרליות שונות 20 ולבסוף אין דרישה transfection. צבעים FM לא יכול לספק מידע על התנועה SV בין מנוחה ומיחזור בריכות SV זאת (בניגוד pHluorins 19), שכן מעצם הגדרתו SVS להיות עמוסה לצבוע במהלך אנדוציטוזה יהיו גלויים. כך גם צובעת FM ו pHluorins יש נקודות חוזק וחולשה הם החזקים ביותר כאשר מנוצל ניסויים עצמאיים לכתובת אותה השאלה.
תמונות באיכות גבוהה הן חיוניות לצורך ניתוח reproducib תקףle התוצאות. בעוד להיסחף אופקי ניתן לתקן בקלות, ניסויים שבהם יש סחיפה של ציר Z-לא ניתן לשחזר. מסיבה זו, חשוב למקד מחדש את התמונות לפני תחילת פורקת S1 ו - S2. במקרים כאשר ריקבון פלורסנט משמעותי התרחש, תיקונים עששת עלול להיות מיושם (בדרך כלל על ידי הפחתת עקבות שהוקלטו בעבר מ-FM טעון תאים בהעדר גירוי). עם זאת, הוא הציע תיקון ריקבון מבוצע רק עבור ייצוג גרפי ולא לשמש עבור כל ניתוח כמותי.
Disclosures
אין לנו שום דבר לגלות.
Acknowledgements
עבודה זו נתמכה על ידי מענק של קרן Wellcome (Ref: 084,277).
Materials
| Name | Company | Catalog Number | Comments |
| שם | חברה | קטלוג לא. | |
|---|---|---|---|
| AxioCam MRM הכומר 3 מצלמה דיגיטלית | Carl Zeiss | 4265099901000 | |
| Axio מיקרוסקופ Observer.A1 | Carl Zeiss | 4310040000000 | |
| צלחות תרבית תאים (6 בארות) | גריינר ביו אחד | 657160 | |
| צנטריפוגה (Universal 32R) | Hettich Zentrifugen | 1610 | |
| CO 2 באינקובטור | Heraeus מכשירים | 51014042 | |
| פלקון צינורות (15 / 50 מ"ל) | גריינר ביו אחד | 188271/210261 | |
| Fluar 20X / ∞ 0.75 / 0.17 המטרה | Carl Zeiss | 4401459901000 | |
| זכוכית coverslips (Ø25mm) | VWR הבינלאומי | 631-1584 | |
| זכוכית פסטר pipettes (230 ננומטר) | גריינר ביו אחד | 612-1799 | |
| Haemocytometer | VWR | 15170-170 | |
| הדמיה קאמרית | וורנר | RC-21 BRFS | |
| זרימה למינרית ברדס | BIOHIT | VLF BHS 1200 | |
| McIlwain ופר רקמות | Mickle מעבדה הנדסה בע"מ | MTC / 2 | |
| מרקורי מנורה | Carl Zeiss | HBO 103 | |
| MultiStim מערכת חשמל ממריץ (100mV, 1ms רוחב pluse) | Digitimer בע"מ | D330 | |
| זלוף משאבה | ווטסון, מרלו | 313S | |
| Pipettes סרולוגית (5/10/25 מ"ל) | גריינר ביו אחד | 606180/607180/760180 | |
| תריס בקר | Carl Zeiss | MAC5000 | |
| מזרק (20 מ"ל) | BD Plastipak | ST01-B002 | |
| מזרק מסננים (Minisart - 0.20 מיקרומטר) | סארטוריוס Stedim | 16532 | |
| VC-6 שש שסתום ערוץ בקר | וורנר | 64-0135 | |
| YFP Filter סט (סט 46) | Carl Zeiss | 1196-681 |
טבלה 1. ציוד מכשירים ספציפיים המשמשים
| שם | חברה | קטלוג לא. | ריכוז |
|---|---|---|---|
| FM1-43 | Bioscience קיימברידג' | BT70021 | 10 מיקרומטר |
| FM2-10 | Bioscience קיימברידג' | BT70044 | 100 מיקרומטר |
| Poly-D-ליזין | סיגמא | P7886 | 15 מיקרוגרם / מ"ל |
| סיליקון גריז | סיגמא | 85403 | - |
טבלה 2. ריאגנטים ספציפיים המשמשים
| שם | חברה | קטלוג לא. | ריכוז |
|---|---|---|---|
| שור סרום אלבומין (BSA) | סיגמא | A4503 | 0.3% |
| D-גלוקוז | סיגמא | G5767 | 0.25% |
| MgSO 4 ° 7H 2 O | סיגמא | M2773 | 1.5 מ"מ |
| D-PBS | Gibco | 21300 | 960 מ"ל mg/100 |
-לעשות 100 מ"ל טרי להכנת כל
סטרילי, מסנן לפני השימוש
לוח 3. הפתרון B להכנת CGN
| שם | חברה | קטלוג לא. | ריכוז |
|---|---|---|---|
| פתרון ב ' | - | - | 19 מ"ל |
| טריפסין (5 מ"ג / מ"ל המניות, -20 ° C) | סיגמא | T9201 | 1 מ"ל |
לוח 4. פתרון T להכנת CGN
| שם | חברה | קטלוג לא. | ריכוז |
|---|---|---|---|
| פתרון ג | - | - | 3.2 מ"ל |
| פתרון ב ' | - | - | 16.8 מ"ל |
לוח 5. הפתרון W עבור CGN הכנה
| שם | חברה | קטלוג לא. | ריכוז |
|---|---|---|---|
| Deoxyribonuclease (DNase, 500 U לכל המניות 0.5 מ"ל, -20 ° C) | סיגמא | D5025 | 0.5 מ"ל |
| MgSO 4 ° 7H 2 O | סיגמא | M2773 | 1.5 מ"מ |
| פתרון ב ' | - | - | 10 מ"ל |
| סויה מעכב טריפסין (SBTI, 0.5 מ"ג לכל המניות 0.5 מ"ל, -20 ° C) | סיגמא | T9003 | 0.5 מ"ל |
לוח 6. פתרון C עבור CGN הכנה
| שם | חברה | קטלוג לא. | ריכוז |
|---|---|---|---|
| שור סרום אלבומין (BSA) | סיגמא | A4503 | 4% |
| ארל פתרון מאוזן של מלח (EBSS) | Gibco | 24010 | 10 מ"ל |
| MgSO 4 ° 7H 2 O | סיגמא | M2773 | 3 מ"מ |
לוח 7. EBSS פתרון להכנת CGN
| שם | חברה | קטלוג לא. | ריכוז |
|---|---|---|---|
| ציטוזין β-D-arabinofuranoside (ערה-C) * | סיגמא | C1768 | 10 מיקרומטר |
| Foetal שור סרום | Gibco | 10106 | 10% |
| D-גלוקוז | סיגמא | G5767 | 30 מ"מ |
| L-גלוטמין | סיגמא | G3126 | 2 מ"מ |
| KCl | סיגמא | P5405 | 25 מ"מ |
| בינוני Essential מינימלי (מ) | Gibco | 21090 | 500 מ"ל |
| פניצילין (P) / סטרפטומיצין (S) | Gibco | 15140 | 100 U / ml (P), 100 מיקרוגרם / מ"ל (S) |
* ערה-C יש להוסיף בינוני מ 1 ואילך DIV
לוח 8. תרבות מדיה להכנת CGN
| שם | גרסה | חברה |
|---|---|---|
| AxioVision Rel. | 4.8 | Carl Zeiss |
| ImageJ | 1.42q | המכונים הלאומיים לבריאות |
| Microsoft Excel | 2003 | מיקרוסופט |
לוח 9. תוכנת מחשב ספציפיים המשמשים
| שם | חברה | קטלוג לא. | ריכוז |
|---|---|---|---|
| CaCl 2 · 2H 2 O | סיגמא | C7902 | 1.3 mM |
| גלוקוז | סיגמא | G5767 | 5 מ"מ |
| KCl | סיגמא | P5405 | 3.5 מ"מ |
| KH 2 PO 4 | סיגמא | P9791 | 0.4 mM |
| MgCl 2 · 6 שעות 2 O | סיגמא | M0250 | 1.2 מ"מ |
| NaCl | Fluka | 71378 | 170 mM |
| NaHCO 3 | Fluka | 71627 | 5 מ"מ |
| Na 2 SO 4 | BDH מעבדה ספקי | 10264 | 1.2 מ"מ |
| TES | סיגמא | T1375 | 20 מ"מ |
לוח 10. תמיסת מלח (pH 7.4)
References
- Rizzoli, S. O., Betz, W. J. Synaptic vesicle pools. Nat. Rev. Neurosci. 6, 57-69 (2005).
- Sudhof, T. C. The synaptic vesicle cycle revisited. Neuron. 28, 317-320 (2000).
- Evans, G. J., Cousin, M. A. Activity-dependent control of slow synaptic vesicle endocytosis by cyclin-dependent kinase 5. J. Neurosci. 27, 401-411 (2007).
- Clayton, E. L., Cousin, M. A. Differential labelling of bulk endocytosis in nerve terminals by FM dyes. Neurochem. Int. 53, 51-55 (2008).
- Clayton, E. L., Evans, G. J., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J. Neurosci. 28, 6627-6632 (2008).
- Cousin, M. A. Use of FM1-43 and other derivatives to investigate neuronal function. Curr. Protoc. Neurosci. Chapter 2, Unit 2-Unit 2 (2008).
- Clayton, E. L. The phospho-dependent dynamin-syndapin interaction triggers activity-dependent bulk endocytosis of synaptic vesicles. J. Neurosci. 29, 7706-7717 (2009).
- Cheung, G., Jupp, O. J., Cousin, M. A. Activity-dependent bulk endocytosis and clathrin-dependent endocytosis replenish specific synaptic vesicle pools in central nerve terminals. J. Neurosci. 30, 8151-8161 (2010).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Curr. Opin. Neurobiol. 6, 365-371 (1996).
- Ryan, T. A., Reuter, H., Smith, S. J. Optical detection of a quantal presynaptic membrane turnover. Nature. 388, 478-482 (1997).
- Murthy, V. N., Sejnowski, T. J., Stevens, C. F. Heterogeneous release properties of visualized individual hippocampal synapses. Neuron. 18, 599-612 (1997).
- Tan, T. C. Cdk5 is essential for synaptic vesicle endocytosis. Nat. Cell. Biol. 5, 701-710 (2003).
- Anggono, V., Cousin, M. A., Robinson, P. J. Styryl dye-based synaptic vesicle recycling assay in cultured cerebellar granule neurons. Methods. Mol. Biol. 457, 333-345 (2008).
- Gallo, V. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Stevens, C. F. Neurotransmitter release at central synapses. Neuron. 40, 381-388 (2003).
- Mozhayeva, M. G. Development of vesicle pools during maturation of hippocampal synapses. J. Neurosci. 22, 654-665 (2002).
- Cousin, M. A., Evans, G. J. O. Activation of silent and weak synapses by cAMP-dependent protein kinase in cultured cerebellar granule neurons. J. Physiol. 589, 1943-1955 (2011).
- Kim, S. H., Ryan, T. A. Synaptic vesicle recycling at CNS synapses without AP-2. J. Neurosci. 29, 3865-3874 (2009).
- Kim, S. H., Ryan, T. A. Cdk5 serves as a major control point in neurotransmitter release. Neuron. 67, 797-809 (2010).
- Groemer, T. W., Klingauf, J. Synaptic vesicles recycling spontaneously and during activity belong to the same pool. Nat. Neurosci. 10, 145-147 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved