Method Article
תא הדמיה חיה של Bacillus subtilis ו Streptococcus pneumoniae באמצעות מיקרוסקופית אוטומטי זמן לשגות
In This Article
Summary
פרוטוקול זה מספק הליך צעד אחר צעד כדי לפקח על התנהגות תא בודד של חיידקים שונים בתוך זמן באמצעות מיקרוסקופ פלואורסצנטי אוטומטיות זמן לשגות. יתר על כן, אנו מספקים הנחיות כיצד לנתח את תמונות מיקרוסקופ.
Abstract
במהלך השנים האחרונות הפך מדענים מודעים יותר ויותר כי נתונים שהתקבלו בניסויים הממוצע באוכלוסייה חיידקים מבוסס אינם נציג מעמד התנהגות, או הפנוטיפ של תאים בודדים. בעקבות תובנה חדשה זו מספר מחקרים תא בודד עולה בהתמדה (עבור הסקירות האחרונות לראות 1,2,3). עם זאת, רבים של טכניקות תא בודד להחיל אינם מאפשרים מעקב אחר התפתחות והתנהגות של תא אחד בודד מסוימת בזמן (cytometry זרימת למשל או במיקרוסקופ רגיל).
כאן, אנו מספקים תיאור מפורט של שיטה מיקרוסקופית שימוש במחקרים האחרונים מספר 4, 5, 6, 7, אשר מאפשר הקלטה הבאים (הקרינה של) תאים חיידקיים בודדים של Bacillus subtilis ו Streptococcus pneumoniae באמצעות צמיחה וחלוקת במשך דורות רבים. הסרטים וכתוצאה מכך ניתן להשתמש כדי לבנות שושלת עצים פילוגנטי על ידי התחקות בחזרה את ההיסטוריה של תא בודד בתוך אוכלוסיה שמקורם מאב קדמון משותף אחד. זמן לשגות זה מיקרוסקופ פלואורסצנטי השיטה יכולה לשמש לא רק לחקור, צמיחה חלוקה והתמיינות של תאים בודדים, אלא גם לנתח את ההשפעה של ההיסטוריה התא ממוצא על התנהגות סלולרית ספציפית. יתרה מכך, זמן לשגות מיקרוסקופ הוא אידיאלי לבחון ביטוי גנים הדינמיקה לוקליזציה חלבון במהלך מחזור תא החיידק. השיטה מסביר כיצד להכין את תאים חיידקיים ולבנות את השקופית מיקרוסקופ כדי לאפשר את תולדה של תאים בודדים לתוך microcolony. בקיצור, תאים בודדים הם הבחינו על משטח מוצק למחצה המורכב בינוני צמיחה בתוספת agarose שבו הם גדלים ומתחלקים תחת מיקרוסקופ פלואורסצנטי בתוך חדר מבוקר טמפרטורה סביבתיים. תמונות נלכדים במרווחים ספציפיים מנותחים מאוחר יותר בעזרת תוכנות קוד פתוח ImageJ.
Protocol
1. הכנת B. subtilis תרבויות
- תאים לחסן מ -80 ° C 10 מניות זמן לשגות בינוני מ"ל (TLM) מיקרוסקופיה (62 mM K 2 HPO 4, 44mM KH 2 PO 4, 15 מ"מ (NH 4) 2 SO 4, 6.5 סודיום ציטרט מ"מ, 0.8 mM MgSO 4, 0.02% חומצות casamino, 27.8 גלוקוז מ"מ, 0.1 מ"מ L-טריפטופן, pH נקבע ל -7 באמצעות פתרון KOH) בתוספת האנטיביוטיקה, במידת הצורך.
- לגדל את התאים לילה בבקבוק לנער (30 ° C, 225 סל"ד).
- למחרת בבוקר, לדלל את התאים 1:10 במדיום מראש חימם הגדרה כימית (CDM) (62 mM K 2 HPO 4, 44mM KH 2 PO 4, 15 מ"מ (NH 4) 2 SO 4, 6.5 סודיום ציטרט מ"מ, 0.8 mM MgSO 4, 2.2mM גלוקוז, 2.1 L-חומצה גלוטמית mM, 6 מיקרומטר L-טריפטופן, 7.5 מיקרומטר MnCl 2, 0.15 לערבב x מתכת (50x להכין מלאי MT לערבב (נ"צ 8) אשר מכיל: 0.2 M MgCl 2, 70 מ"מ CaCl 2, 5 מ"מ MnCI 2, 0.1 מ"מ ZnCl 2, 0.2 מ"מ תיאמין-hydrochloride, 2 מ"מ HCl, 0.5 mM FeCl 3 (להוסיף האחרונה)) ללא אנטיביוטיקה.
- לגדול ב subtilis התאים לשלב אמצע מעריכי (30 ° C, 225 סל"ד). בדרך כלל, זה לוקח בערך ארבע שעות. חשוב לציין, להכין את השקופית agarose שעה לפני התאים להגיע באמצע שלב מעריכי (ראה סעיף 2).
- מדוד את ספיגת התרבות ב 600nm (600) ו לדלל את התאים משוער של 600 .035 באמצעות CDM. OD זו מבטיחה תאים בודדים עם המרווח המתאימים הבחין בשקופית מיקרוסקופ עבור מיקרוסקופיה זמן לשגות.
2. הכנת המדגם מיקרוסקופ (ראה גם תרשים 2)
שעה אחת לפני תאים להגיע באמצע הצמיחה המעריכית, להכין את השקופית מיקרוסקופ כדלקמן:
- נקה two זכוכית מיקרוסקופ שקופיות (למשל Knittel זכוכית, 7.6 x 2.6 ס"מ) עם 70% אתנול ומים.
- קח את מסגרת הגן (ABgene: 1.7 x 2.8 ס"מ) להסיר בזהירות אחד foils פלסטיק ממסגרת הגן מבלי לגרום פירוק כיסוי הפלסטיק בצד השני של מסגרת הגן.
- צרף את מסגרת הגן באמצע אחד שקופיות הזכוכית על ידי מגע בהנחיית תחילה בצד אחד בלבד, ולאחריו מצורף מודרך מסגרת הגן הנותרים עם ציפורן. למנוע בועות אוויר בזמן מצרף את מסגרת הגן לשקופית זכוכית.
- השתמשו במיקרוגל כדי להמיס 150 מ"ג (1.5%) גבוהה ברזולוציה נמוכה ההיתוך agarose (Sigma) ב 10 מ"ל CDM. Agarose צריך להיות מומס לחלוטין לקבל רקע מינימלי נדרש זמן לשגות ניסויים במיקרוסקופיה. במידת הצורך, להשלים את agarose-CDM עם inducer או תרכובות אחרות בזמן הזה
- העברת 500 μl של חם agarose-CDM באמצע מסגרת הגן. ודא את כל השטח כולל (גבולות) הוא כיסוי מלא.
השלבים הבאים (2.6-2.10) צריך להתבצע במהירות כדי למנוע התייבשות מוגזמת של agarose-CDM. - מניחים את החלק השני על מסגרת זכוכית agarose-CDM הגן מלא. נסו להימנע בועות אוויר. מניחים את השקופיות דחוקה במצב אופקי במשך 45 דקות ב 4 מעלות במקרר כדי לאפשר agarose-CDM לחזק מספיק.
- להחליק בזהירות את החלק העליון של הכוס. השתמש סכין גילוח לחתוך את רצועות רוחב אגר של 5 ~ מ"מ בתוך מסגרת הגן, שבו תאים יהיה גדל. מקסימום של שלוש רצועות יכול לשמש לכל שקופית, מופרדים באמצעות רווח ~ 4 מ"מ מכל צד. רווחים אלה יספקו אוויר אשר חיוני עבור B. subtilis צמיחה. אם ארבעה זנים שונים צריכים להיות אחריו בזמן, שתי רצועות יכול להתבצע ולהיות בחצי לגרום ארבעה ריבועים קטנים. הסר בינוני מוצק שיורית.
- בזהירות להסיר את כיסוי הפלסטיק השני והאחרון ממסגרת הגן לחשוף את הצד הדביק של מסגרת הגן
- טען תאים בודדים (משלב 1.5) על המדיום מוצק מבלי לגעת בו עם קצה pipet. השתמש μl 2.5 עבור כל רצועה, או 1 μl עבור ריבוע קטן. תמיד להתחיל על גבי משטח agarose ולאפשר לנוזל להתפזר באופן שווה על פני שטח שהוקצה הצמיחה על ידי סיבוב להחליק למעלה ולמטה. השקופית מוכן, ברגע הקצוות של נוזל הופכים גלי תנועה של הנוזל אינו נראה לעין כאשר הופכים את השקופיות.
- המקום נקי שקופיות מיקרוסקופ לכסות להחליק (24 x 50 מ"מ) על מסגרת הגן מן הצד האחד אל השני (למנוע בועות אוויר). הבטח מצורף להשלים על ידי הפעלת לחץ על להחליק את מכסה לאורך מסגרת הגן בעזרת הציפורניים. אם להחליק לכסות מושם על התאים מבלי לאפשר להם להתייבש מספיק זמן, תאים נוטים לגדול על גבי אחד את השני במהלך הניסוי. כמו כן להיזהר לא ממתין זמן רב מדי לפני יישום להחליק לכסות, מאז agarose מכן ניתן יהיה יבש מדי.
- טרום חם השקופית עבור h 1 ב 30 ° C. אם את השקופית would ישירות להציב בתא מראש חימם את הסביבה (ראה שלב 3.1) של המיקרוסקופ, את תנודות הטמפרטורה עלולה לגרום לבעיות פוקוס אוטומטי בשעות הראשונות של הניסוי.
3. זמן לשגות מיקרוסקופ פלואורסצנטי (ראה גם איור 3 ו - סרט 1)
- טרום לחמם את החדר סביבתיים בזמן (בידינו לפחות 2h לפני תחילת הניסוי) על מנת למנוע בעיות פוקוס אוטומטי לאחר תחילת הניסוי. הזמן הנדרש תלוי קאמרית הסביבתי בשימוש, כמו גם מערכת חימום מיקרוסקופ.
- בחר את היעד המתאים, מסננים המראה dichroic על פי ניסיוני שלך הגדרת. עבור ניסויים ארוכה לוודא-UV מסנן ממוקמת בין מקור האור לבין המדגם. כמו כן, אם אפשר, לחסום חלק של אור עירור באמצעות מסננים צפיפות ניטרלי כדי למזער את החשיפה.
ציוד הבאים (הניתנים על ידי DeltaVision, בריטניה) שימש במשך זמן לשגות ניסויים במיקרוסקופיה שפורסם דה יונג et al 2010: 5. IX71 מיקרוסקופ (אולימפוס), CoolSNAP HQ2 המצלמה (פרינסטון מכשירים), 300W מקור אור קסנון, 60x בהיר מטרת שדה (1.25 NA), GFP filterset (Chroma, עירור ב ננומטר 470/40, 525/50 פליטת ננומטר), mCherry filterset (Chroma, עירור ב ננומטר 572/35, 632/60 פליטת ננומטר). מיקוד אוטומטי בוצעה באמצעות אור diascopic ושימוש הנוכחי שגרתי פוקוס אוטומטי בתוכנה של DeltaVision Softworx. יצוין, כי כיום יש מספר מערכות פוקוס אוטומטי אחרות, כי הם גם מתאים כמו פוקוס הברורה Zeiss, מערכת פוקוס מושלם ניקון הבקרה מסתגלת לייקה פוקוס.
- תוכנית הניסוי על פי הגדרת הניסוי שלך. רצוי לקבוע את כמות האור הנדרשת מבנים ספציפיים, כמו גם את הגדרות פוקוס אוטומטי עבור זמן לשגות מיקרוסקופים אחרים או חיידקים לפני הניסוי בפועל. פעמים חשיפה קצרים יותר וכמות פחות אור עירור יהיה למזער הלבנת phototoxicity. השתמש אור diascopic עבור שגרת פוקוס אוטומטי.
ההגדרות הבאות שימשו במשך זמן לשגות ניסויים במיקרוסקופיה שפורסם דה יונג et al 2010: 5. תצלומים עבור סרטים צולמו במרווחים של 8 או 12 דקות באמצעות 10% APLLC White LED אור 0.05 החשיפה לתמונות בשדה בהיר 10% קסנון אור וחשיפה של 0.5 גילוי ה-GFP, ו 32% אור קסנון וחשיפה של 0.8 לגילוי mCherry, בהתאמה. נתונים גולמיים אוחסנו באמצעות softWoRx 3.6.0 (Applied Presicion). פוקוס אוטומטי היה מתוכנת עבור 0.06 צעדים מיקרומטר ומגוון הכולל של 1.2 מיקרומטר.
- מניחים את השקף מוכן (סעיף 2) בחדר מחומם מראש הסביבתי של המיקרוסקופ ולנטר את תולדה של תאים בודדים לתוך monolayer microcolony ב 30 ° C.
עצות ספציפיות:
- בחר תאים בודדים נמצאים באמצע לרפד את אגר. הקצוות של אגר משטח להתייבש בקלות רבה יותר. אחסן את עמדת X, Y, Z באמצעות תוכנה של המיקרוסקופ.
- תנועות גדולות של השלב ב X, Y ו-Z אולי כיוון לטרוד את agarose וכתוצאה מכך לעכב את הזיהוי של התאים על ידי שגרת פוקוס אוטומטי. באופן כללי, כדי למזער את X, Y, Z התנועה, אנחנו לא לבחור יותר מ 10 עמדות לכל הניסוי גם אם השקופית מכילה מספר רב של זנים.
- לאחר שנבחר על התא הראשון, רק להתאים את Z-להתמקד עם התוכנה. מנקודה זו, אינם משנים את הפוקוס באופן ידני על הגוף באמצעות מיקרוסקופ "Z-ידית" אלא אם כן זה מקודד דיגיטלית. ודא כי אחרי כל שגרת פוקוס אוטומטי ה-X החדש, Y, Z המיקום מאוחסן על ידי התוכנה.
- בדוק אם הגדרות פוקוס אוטומטי המתאימים הניסוי, לפני תחילת הריצה. השימוש במיקרוסקופ שלב בניגוד עשוי לשפר את שגרת פוקוס אוטומטי לעומת brightfield או באמצעות מיקרוסקופיה DIC, בשל ניגוד משופרת. עם זאת, טבעת שלב שלב לעומת יעדים גורם להם פחות רגישים (כ 10%) באיסוף אור פלואורסצנטי. אז עבור דגימות ניאון חלשה, אובייקטיבי ללא טבעת שלב מתאים יותר.
- בדוק אם התאים שנבחרו הם עדיין בפוקוס כל חצי שעה, עד הניסוי פועל ביציבות. כאשר תאים בשלב זה הם מחוץ לפוקוס, להתאים באופן ידני. בשל שינויים בטמפרטורה, כמו גם דגימות מיובשות גרוע, זה עשוי להיות נחוץ בשעות הראשונות. יתר על כן, בשל ניגוד משופרת, פוקוס אוטומטי עובד טוב יותר כאשר תאים נוספים בתחום התצוגה.
- לאחר הניסוי סיימה, להפריד בין ערוצים שונים של הסרט ובטוחה אותם כקבצים נפרדים (בניגוד כלומר שלב, GFP, mCherry) אם נדרש (חבילות רכישת מסוימים יהיה מקום כל הערוצים בקובץ מוערמים אחד). לפרסום, תמונות ניתן לשפר על ידי deconvolution 2D, אשר במיוחד לנוeful ללימודי לוקליזציה חלבון. Deconvolve את התמונות באמצעות תוכנת מיקרוסקופ שלך או עם חבילת מסחריים כגון הויגנס ( www.svi.nl ).
- ניתוח נתונים באמצעות ImageJ ( http://rsbweb.nih.gov/ij/ ) (להשתמש גלם, קבצי תמונה מעובדת עבור זה) מגרש Microsoft Excel או סיגמא. ערימות יכול למשל יישמרו כפי קובץ ". Avi" הסרט ImageJ. תיאור מפורט של אופן הקרינה של תאים בודדים ניתן למדוד זמן היא כדלקמן.
4. ניתוח נתונים של דינמיקה פעילות באמצעות האמרגן ImageJ
נציין כי אחר חבילות תוכנה טובה זמינים אשר מתמחים בניתוח זמן לשגות תמונות מיקרוסקופיה כגון BHV התוכנה 9, 4, Schnitzcell 10, PSICIC 11, ו-Tracker Microbe 12, אך כאן אנו מתמקדים החבילה ImageJ זמין באופן חופשי.
- הורד ImageJ ( http://rsbweb.nih.gov/ij/ ) ו (במידת הצורך) את התוסף המתאים לפתיחת הקובץ (מוערמים) שלך. למשל, סרטים נרשם באמצעות מיקרוסקופ DeltaVision יכול להיות רק נפתח ImageJ עם תוסף פותחן DeltaVision. העתק את DV-plugin בתיקייה תוסף ImageJ ולהתחיל את התוכנית. שנה את קיבולת הזיכרון לערוך / האפשרות / זיכרון & האשכולות 1250. זה מאפשר עבודה עם קבצים גדולים כגון אלה המתקבלים זמן לשגות סרטים.
- כדי להעריך את ההיסטוריה של תא תא אחד, לפתוח את השלב המקורי בניגוד לסרט של microcolony אחד לגלול את המסגרת האחרונה של עניין בסרט. בחר את "קווי מפולח" כפתור בחירה בתפריט.
- צייר קו על רקע ולחץ על "CTRL" + "T". פעולה זו תפתח את מנהל אזורי של עניין (ROI). (הערך המתאים הקרינה רקע יכול לשמש כדי להפחית באופן ידני את הרקע -.. ראה להלן לחלופין, להשתמש בהווה רקע חיסור שגרתי בתוך ImageJ) גם למתוח קו בתא עניין להוסיף את ההחזר על ההשקעה ROI למנהל. מכיוון שאנו בודקים האמרגן-GFP fusions במחקר זה המקרה ואת ה-GFP היא מתפזרת ברחבי הציטופלסמה, התא כולו צריך ערכי הקרינה דומה עבור כל פיקסל בודד על פני אורך של התא. גלילה מסגרת אחת אחורה בזמן ובחר ROI חדש באותו תא של עניין. שמור את ההחזר על ההשקעה השלישי ממשיך בהליך עד החזר ההשקעה המקבילה המסגרת הראשונה של הסרט נשמר.
שימו לב כי הקרינה של תאים בתה יכול להשתנות במידה רבה לאחר חלוקת התא. או להשתמש לצבוע קרום אשר יכול להיות מיושם יחד עם חלבונים הקרינה המיוצר על ידי תאים (כגון שילוב של הממברנה צבע אדום FM ® 5-95 (Invitrogen) ו-GFP) כדי לחזות היווצרות מחצה. במקרה זה ערוץ הקרינה המתאימים ולא את הסרט בניגוד שלב יש להשתמש כדי לעקוב אחר תאים בזמן. לחלופין, אפשר להישאר בצד הבטוח ידי בחירה של ההחזר על ההשקעה במחצית אחת בלבד של תא. - בתוך מנהל את ההחזר על ההשקעה, לחץ על "שמור". אם הסוף של הקובץ ". ROI", אזי ההחזר על ההשקעה נבחרה ברשימה, ורק זה יישמר. אם הסוף של הקובץ ". Zip", ולאחר מכן להגדיר את כל יישמרו (חובה).
- סגור את הסרט בניגוד שלב ולפתוח הקרינה את הסרט המקורי (GFP למשל). לחץ על "הצג הכל" ו - "מדד" במנהל ההחזר על ההשקעה. חלון חדש יפתח (תוצאות). העתק את התוצאות לגיליון אלקטרוני של Excel ו - להפחית את הקרינה כלומר עבור כל תא יחיד מן הקרינה את הרקע של המדיום. הקרינה נטו וכתוצאה מכך ניתן להתוות נגד הזמן כדי לחשוף את הפעילות האמרגן של התא עניין הזמן.
- לחלופין, הקרינה של כל התאים של microcolony יכול להיות מנותח בשעה מסוימת בזמן נקודה. כדי לעשות זאת לבחור ולשמור של ההחזר על ההשקעה עבור ברקע וכל תא בודד במסגרת אחת כמתואר לעיל, להעתיק את ערכי הקרינה ל-Excel לייצר היסטוגרמות באמצעות הפונקציה "היסטוגרמה" בתוך תפריט "כלים".
- כדי להשיג תמונות מסגרות יחיד עבור פרסום, בחר את המסגרת של עניין, בחר "תמונה" - "לשכפל תמונה" ולשנות את סוג התמונה ל "RGB" או "8-bit" על ידי בחירת "תמונה" - "סוג" - "צבע RGB" או "8 סיביות". שמור את מסגרת משוכפל בשם ". Tiff". התמונות RGB/8-bit ניתן לפתוח על ידי תוכניות ציור קונבנציונליים כגון CorelDraw או Adobe Illustrator. במידת הצורך, התמונות ניתן להתאים באמצעות "תמונה" - "להתאים" - "בהירות / ניגודיות" או "תמונה" - "להתאים" - "חלון / ברמה" ב ImageJ.
5. הפקת סרטים לפרסום עם ImageJ
- פתח את הניגוד שלב המקורי הקרינה את הסרט המתאים (ים) ImageJ כפי שתואר לעיל. בחר בלחצן הבחירה מלבני (1 st משמאל) וצייר ROI מלבן בתוך המסגרת הראשונה בצורה כזאת, כי microcolony בפיתוח מוקף על ידי throu ROIghout הסרט כולו. בחר "תמונה" - "לחתוך" והגרסה בטוח זה קטן יותר של הסרט תחת שם חדש. בחר את ההחזר על ההשקעה באותה דרך מנהל את ההחזר על ההשקעה בסרט הקרינה ולהמשיך כמו קודם.
- כדי לשלב את הסרטים או אופקית או אנכית, בחר "תוסף" - "combiner מחסנית". אם תרצה, חתם זמן ניתן להוסיף דרך "תוסף" - "סטמפר זמן". שמור את המחסנית המשולבת פעם ". DV" או ". Tiff" ופעם ". Avi" או QuickTime הסרט.
אלטרנטיבי עיבודים פרוטוקול Streptococcus pneumoniae (איור 4 סרטים ו 2):
6. הכנת ס pneumoniae תרבויות
- לגדול ס דלקת ריאות תאים (לתמצת זן D39 13, או זן unencapsulated R6 14 כמו תרבויות עומד ב-C + Y בינוני 15 ב 37 ° C עד OD ב 600nm של כ 0.4 הוא הגיע. צנטריפוגה התאים 2 דקות בסל"ד 14000 ו resuspend תא גלולה בהיקף של Aliquot טרי C + Y בינוני המכיל גליצרול 14.5% (V / V), אשר יוביל 600nm של בדיוק 0.4. התאים ולאחסן אותם ב -80 ° C לשימוש עתידי.
- עבור מיקרוסקופיה זמן לשגות, לקחת aliquot ש תרבותי בעבר דלקת ריאות תאים. לחסן 4 מ"ל של טרי C + Y 1:100 בינוני עם תאים מן aliquot -80 מעלות צלזיוס. לגדל את התאים עד שלב אמצע מעריכי כדי OD של 600nm של 0.1-0.2. בדרך כלל, זה לוקח בערך 2 שעות כאשר באמצעות תאים -80 ° C aliquots.
7. הכנת המדגם מיקרוסקופ
- הכן שקופית מיקרוסקופ כפי שתואר לעיל עבור B. subtilis אבל לוודא agarose מכיל קומפלקס C + Y בינוני. מאז ש ' דלקת ריאות היא microaerophile, כיסי אוויר בין רצועות agarose צריך להיות קטן יותר מאשר עבור B. subtilis (~ 1 מ"מ שטח משני הצדדים).
- מדוד את ספיגת התרבות ב 600 ננומטר (600), לדלל את אקספוננציאלית גדל S. pneumoniae תאים כדי משוער של 600 0.05 באמצעות C + בינוני Y ולהשתמש דילול להעמיס את השקופית agarose.
8. זמן לשגות שלב בניגוד מיקרוסקופיה
התאם את ההגדרות עבור מיקרוסקופ ס דלקת ריאות: שלב בניגוד להשתמש במיקרוסקופ מאז ס דלקת ריאות קשה לזהות באמצעות מיקרוסקופ שדה בהיר. המשך הפרוטוקול כפי שתואר עבור B. subtilis (בצע את השלבים 2.9-3.7). S. תאים pneumoniae ניתן לגדל בבית או 30 ° C או 37 ° C (הם גדלים מהר יותר ב 37 ° C).
9. נציג התוצאות:
הניסוי זמן לשגות הקרינה בוצעה בהצלחה, אם החיידק גדל לתוך monolayer microcolony, הנמצא כליל בסוף הניסוי בתוך שדה הראייה (ראה איור 5A-C). אם התאים גדל על גבי אחד את השני, זה לא רק בלתי אפשרי להתחקות באופן מדויק את ההיסטוריה שלהם, אלא גם את רמות הקרינה של תאים חופפות לא ניתן למדוד כראוי. תאים נוטים לגדול על גבי אחד את השני, אם התאים הבחינו לא היו יבשים מספיק (שלב 2.9) או אם הרכב בינוני צריך להיות מותאם כדי להשיג צמיחה איטית יותר. אם microcolony צמחה מתוך השקפה, אז חלוקת אותות הקרינה בתוך המושבה אחד לא ניתן לקבוע. גורם עבור "התנועה microcolony" יכול להיות ייבוש מספיק של תאים הבחין (שלב 2.9), או אם התוכנה לא היה מתוכנת המסלול microcolony במהלך הפיתוח. יתר על כן, חשוב כי תיקוני המקומי של הקרינה גדל אינם מאתרים במדיום כמו זה מטשטש את אותות הקרינה מגיע מתאי (ראה איור 5D-F). בעיות הקשורות רקע יכול לנבוע תרכובות התקשורת, airbubbles או שלא נמס גושים agarose. כדי להמחיש זאת, אנו מציגים באיור. 5F אותות רקע של שקופיות הספציפי הזה כאשר התמונה צולמה באמצעות עירור / פליטה מסננים עבור צבעי ניאון אדום. כפי שראינו, כתמים בהירים autofluorescent נוכחים אשר יכול להפריע הדמיה. כדי למנוע כתמים כאלה, ודא agarose מתמוסס לחלוטין ויש airbubbles לא כאשר הנחת coverslip בשקופית מיקרוסקופ.
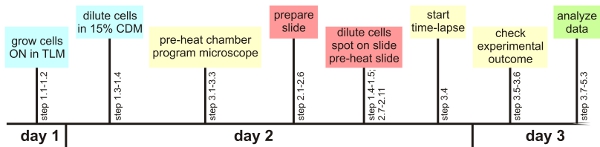
איור 1: סקירה ניסויית

איור 2: הכנת המדגם מיקרוסקופ
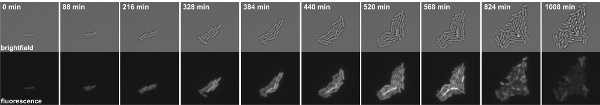
איור 3: זמן לשגות מיקרוסקופ פלואורסצנטי של B. subtilis תאים מחסה היתוך kinB-GFP P. הבזקים לקוחים מתוך סרט 1. לוחות למעלה: שדה בהיר, לוחות התחתונה: ערוץ ה-GFP.
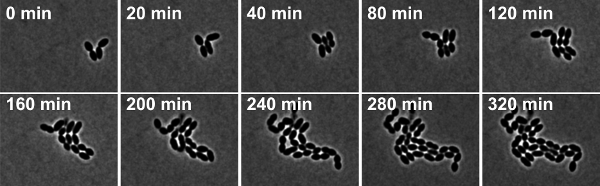
תאנהיור 4: זמן לשגות שלב בניגוד מיקרוסקופיה ש pneumoniae מסוג זן פראי R6. הבזקים לקוחים מתוך סרט 2.
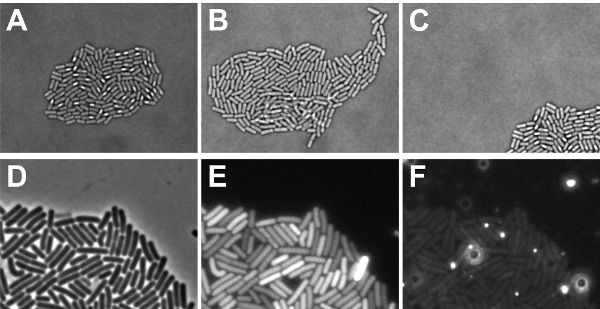
איור 5: איור של (זמן לשגות) תוצאות אפשריות במיקרוסקופ. AC מראה גורמים צריכים להילקח בחשבון על נתונים המתקבלים עם הגדרות אור diascopic. (א) brightfield מיקרוסקופ של monolayer microcolony (תוצאה חיובית) של sporulating B. תאים subtilis (ב) brightfield תמונה של B. subtilis microcolony שבו תאים מסוימים גדל על גבי אחד את השני (תוצאה שלילית) (ג) brightfield תמונה של B. sporulating subtilis microcolony שצמח מתוך בתחום המיקוד (תוצאה שלילית). גורמים DF מראים כי צריך להיחשב עבור נתונים המתקבלים עם הגדרות אור episcopic (ד) בניגוד שלב תמונה של B. subtilis תאים בשלב מעריכי מתואר לדמיין היכן אותות הקרינה ב E ו F מקורן (E) אותות ה-GFP של תאים שמוצג הערה ד כי אותות רקע דומים כל פיקסל (תוצאה חיובית). כמו כן שים לב כי זמן החשיפה עשוי להיות יותר מדי מאז תא אחד מראה אות רווי (תוצאה שלילית) (F) איתותים המתקבלים דרך הערוץ האדום של תאים שמוצג הערה ד כי הרקע מכיל באזורים עם רמות גבוהות פלואורסצנטי אדום (שלילי התוצאה).
1. סרט זמן לשגות מיקרוסקופ פלואורסצנטי של B. subtilis תאים מחסה היתוך kinB-GFP P. הבזקים צולמו במרווחים 8 דקות. משמאל: שדה בהירה, מימין: ערוץ ה-GFP. לחץ כאן כדי לראות את הסרט.
2. סרט זמן לשגות שלב בניגוד מיקרוסקופיה ש pneumoniae מסוג זן פראי R6. הבזקים צולמו 10 דקות במרווחים. לחץ כאן כדי לראות את הסרט.
Discussion
בניגוד אחרים טכניקות רבות תא בודד, בשיטה זמן לשגות מיקרוסקופ פלואורסצנטי המתואר כאן ניתן להשתמש כדי לעקוב אחר ההיסטוריה של תא ספציפי לגבי אבותיה, התנהגותה, אירועים חלוקה. בשילוב עם היזמים היעד או חלבונים שכותרתו fluorescently, מסלול ספציפי ההפעלה התפתחותית ניתן בעקבות בזמן ולוקליזציה חלבון, כמו גם הדינמיקה חלבון יכול להיות פיקוח במהלך התפתחות חיידקים.
כפי שצוין לעיל, מחקרים להתרכז מיני חיידקים שונים ניתן לבצע על ידי התאמת תנאי הגידול בהתאם לדרישות עבור חיידק ספציפי. המגבלות רק נתקלנו קשורות התנאים לצמיחה גודל המדגם. בשל הסביבה אטום, התנאים בינוני לא ניתן לשנות במהלך הניסוי. יתר על כן, לכל היותר ארבעה זנים לכל ניסוי ניתן לפקח ביעילות.
בהתחשב כמה צעדים קריטיים, שיטת הניתוח תא יחיד המתואר כאן יכול בקלות להיות מיושם באמצעות כל מיקרוסקופ אוטומטיות. בחלק הבא, סקירה של השלבים הקריטיים תינתן. מידע מפורט ניתן למצוא את הטקסט העיקרי הכנה כללי:. רצוי לבדוק את הגדרות פוקוס אוטומטי נדרש חיידק ספציפי לפני הניסוי. כמו כן, הגדרות אופטימליות המשוער עבור להדמיה של הקרינה יש לקבוע מראש, אם אפשר. יתר על כן, לאחר שהוכן קו הזמן עוזר לקבל את כל החומר מוכן לשימוש בזמן (לפני ההתחממות קאמרית מיקרוסקופ, תכנות ההגדרות מיקרוסקופ, בהכנת שעה שקופית אחת לפני התאים נמצאים בשלב הצמיחה הרצוי, ראה תרשים 1) . הצמיחה של B. subtilis ב TLM ו CDM: TLM ו CDM מוגדרים כימי התקשורת הרעבה שבו B. subtilis רק גדל לאט. זמן התקופה שבה התאים גדלים בתקשורת עלול להיות ממושך בהתאם לזן הספציפי. הצמיחה האיטי מונע תאים נערמים אחד על השני הכנת המדגם מיקרוסקופ:. בועות אוויר בין מסגרת הגן, את השקופית זכוכית לכסות את הפתק צריך להיות מונע על מנת למנוע ייבוש נרחב של המדיום agarose מבוסס. הוא הדין ממשק בינוני / לכסות את הפתק. זה חיוני כדי לאפשר לתאים יבש מספיק, כדי למנוע שחייה ו / או צמיחה שכבת מרובים זמן לשגות מיקרוסקופ פלואורסצנטי:. טרום ההתחממות של השקופית, כמו גם את חדר הסביבה הוא חיוני כדי למנוע בעיות פוקוס מרכזי. תאים יש לבחור באמצע כרית אגר, שכן אלה יש את הסיכוי הגבוה ביותר להישאר בתחום ולהתמקד במהלך הניסוי (בתנאי המדגם היה יבש מספיק טוב). עד 10 מקומות לכל הניסויים עדיין עובד כמו שצריך. לאחר שנבחר על התא הראשון עניין רק להשתמש בתוכנה כדי לכוון את המיקוד (ראה טקסט לפרטים נוספים). בדוק אם התאים הם עדיין להתמקד במהלך השעות הראשונות של הניסוי ב 30 דקות במרווחים ניתוח:. חשוב לבדוק לפני ניתוח ההליכים הוארכה אם הרקע של המדיום יש ערכים דומים בערוצים פלואורסצנטי. חלקיקי אבק קטנים, רכיבים בינוני, עדשות מלוכלך או גושים זעירים agarose יכול לתרום הקרינה גדל באופן מקומי, מה שהופך את הסרט קשה או בלתי אפשרי לנתח בעיות הירי:. אם התאים לגדול על גבי אחד את השני, זה עלול גם להצביע על כך coverslip היה מצורף מוקדם מדי או כי המדיום אינו מתאים לצמיחה של monolayers microcolony. אם התאים עניין ברציפות למות בטרם עת, ואילו בתאים אחרים בשקופית לחלק בשמחה, אולי כדאי לך לבדוק אם אתה שם את UV-מסנן במצב. זה יכול גם לעזור כדי להקטין את זמן החשיפה או עוצמת האור במהלך הניסויים הארוך.
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
עבודה בקבוצה של JWV נתמך על ידי מארי קירי של האיחוד האירופי Reintegration המלגה, גרנט Sysmo2 (NWO-ALW/ERASysBio), אופק מענק (ZonMW) ועל ידי מלגה VENI (NWO-ALW). הקבוצה של OPK נתמכת על ידי מספר מענקים STW (NWO), SYSMO1 (IGdeJ) ו SYSMO2 מענק, Eurocores ESF SynBio מענק (SynMod) ועל ידי המרכז Kluyver עבור Genomics של תסיסה תעשייתי במכון מובילות המזון והתזונה.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | הערות (אופציונלי) |
|---|---|---|---|
| ג'ין מסגרת | ABgene | AB-0578 | 1.7 x 2.8 ס"מ |
| רזולוציה גבוהה נמוך ההיתוך agarose | סיגמא | A4718 | |
| מכסה גדול להחליק | מספר | 24 x 50 מ"מ | |
| אם רוצים, קרום צבע, למשל FM 5-95 | Invitrogen | T23360 | צבעים קרום אחרים זמינים גם: http://probes.invitrogen.com/media/pis/mp34653.pdf |
| זמן לשגות מיקרוסקופ עם תא סביבתי | מספר | לראות את הפרטים של המכשיר שלנו בסעיפים המתאימים |
References
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev Microbiol. 62, 193-193 (2008).
- Dubnau, D., Losick, R. Bistability in bacteria. Mol Microbiol. 61, 564-564 (2006).
- Locke, J. C., Elowitz, M. B. Using movies to analyse gene circuit dynamics in single cells. Nat. Rev. Microbiol. 7 (5), 383-383 (2009).
- Veening, J. W. Bet-hedging and epigenetic inheritance in bacterial cell development. Proc. Natl. Acad. Sci. U. S. A. 105 (11), 4393-4393 (2008).
- de Jong, I. G., Veening, J. W., Kuipers, O. P. Heterochronic phosphorelay gene expression as a source of heterogeneity in Bacillus subtilis spore formation. J. Bacteriol. 192 (8), 2053-2053 (2010).
- Veening, J. W., Murray, H., Errington, J. A mechanism for cell cycle regulation of sporulation initiation in Bacillus subtilis. Genes Dev. 23 (16), 1959-1959 (2009).
- Eberhardt, A. Cellular localization of choline-utilization proteins in Streptococcus pneumoniae using novel fluorescent reporter systems. Mol Microbiol. 74 (2), 395-395 (2009).
- Vasantha, N., Freese, E. Enzyme changes during Bacillus subtilis sporulation caused by deprivation of guanine nucleotides. J Bacteriol. 144 (3), 1119-1119 (1980).
- Stewart, E. J. Aging and death in an organism that reproduces by morphologically symmetric division. PLoS. Biol. 3, 45-45 (2005).
- Rosenfeld, N. Gene regulation at the single-cell level. Science. 307 (5717), 1962-1962 (2005).
- Guberman, J. M. PSICIC: noise and asymmetry in bacterial division revealed by computational image analysis at sub-pixel resolution. PLoS. Comput. Biol. 4 (11), 1000233-1000233 (2008).
- Montero, L. l. o. p. i. s. . P. Spatial organization of the flow of genetic information in bacteria. Nature. 466, 77-77 (2010).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. J Exp. Med. 79, 137-137 (1944).
- Hoskins, . Genome of the bacterium Streptococcus pneumoniae strain R6. J Bacteriol. 183, 5709-5709 (2001).
- Martin, B. The recA gene of Streptococcus pneumoniae is part of a competence-induced operon and controls lysogenic induction. Mol Microbiol. 15, 367-367 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved