A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
איתור Genogrouping של Noroviruses מ שרפרפים לילדים עד Taqman צעד אחד RT-PCR
In This Article
Summary
צעד אחד RT-PCR assay לגילוי וזיהוי genogroup של מבודד norovirus מ כיסאות ילדים, אשר מנצל primers ו בדיקות TaqMan ספציפיים מסגרת קריאה פתוחה 1 (ORF1)-ORF2 באזור צומת, האזור משומר רוב הגנום norovirus הוא תיאר. לא מסחרי, חסכונית שיטת מיצוי RNA הוא מפורט.
Abstract
Noroviruses (NoVs) הם הגורם העיקרי להתפרצויות של גסטרואנטריטיס חריפה ספורדי ברחבי העולם אצל בני אדם בכל הגילאים. הם גורם חשוב אשפוזים בילדים עם השפעה על בריאות הציבור דומה לזה של Rotavirus. NoVs הם וירוסים RNA של המגוון הגנטי גדולה ויש הופעה רצופה של זנים חדשים. חמש genogroups מוכרים: GI ו GII עם גנוטיפים רבים שלהם תת להיות החשובה ביותר עבור הדבקת בני אדם. עם זאת, האבחנה של שני גנוטיפים נותר בעייתי, עיכוב אבחון וטיפול. 1, 2, 3
להפקת RNA מ דגימות צואה השיטה הנפוצה ביותר היא ערכת QIAmp נגיפי RNA מסחרי Qiagen. שיטה זו משלבת את תכונות הקישור של קרום ג'ל סיליקה, מאגרים השולטים RNases ולספק מחייב אופטימלית של רנ"א את לעמודה יחד עם מהירות של microspin. שיטה זו היא פשוטה, מהירה ואמינה והיא קאר IED מתוך מספר צעדים אשר מפורטים תיאור שמספק היצרן.
Norovirus שנייה רק rotavirus כגורם השכיח ביותר של שלשול. אבחון norovirus צריך להיות זמין כל המחקרים על הפתוגנזה של שלשולים כמו גם התפרצויות או במקרים של שלשול בודדים. כיום לעומת זאת האבחנה norovirus מוגבל רק מרכזים מעטים בשל העדר שיטות פשוטות של האבחנה. זה מעכב את האבחון והטיפול 1, 2, 3. בנוסף, בשל עלויות ההובלה מוסדר של מאגרים מאכל בתוך ובין מדינות להשתמש אלה ערכות מתוצרת מציב בעיות לוגיסטיות. כתוצאה מכך, בפרוטוקול זה נתאר אלטרנטיבה, כלכליים, in-house שיטה המבוססת על בום המקורי et al. שיטה 4 אשר משתמשת במאפייני חומצות גרעין מחייב של חלקיקי סיליקה יחד עם תכונות האנטי nuclease של thiocyanate guanidinium .
"Jove_content"> לאיתור genogrouping (GI ו GII) של מבודד NoVs של דגימות צואה, מספר RT-PCR פרוטוקולים ניצול מטרות שונות פותחו. הקונצנזוס הוא כי RT-PCR באמצעות TaqMan הכימיה תהיה הטכניקה הטובה ביותר לאבחון מולקולרי, משום שהוא משלב רגישות וספציפיות גבוהה, שחזור עם קצב העברת נתונים גבוה וקלות השימוש. כאן אנו מתארים assay מיקוד קריאה פתוחה מסגרת 1 (ORF1)-ORF2 באזור צומת; האזור משומר רוב הגנום לנובמבר ולכן המתאים ביותר לאבחון. עבור ניתוח גנטי נוסף קונבנציונלי RT-PCR, כי מטרות משתנה מאוד N-מסוף פגז מן החלבון העיקרי של capsid (אזור C), תוך שימוש primers המתוארים במקור על ידי Kojima et al. 5 הוא מפורט. רצף של מוצר ה-PCR מ-PCR קונבנציונאלי מאפשרת בידול של גנוטיפים השייכים GI ו genogroups GII.
Protocol
1. צואה דוגמאות
- דגימות צואה יש לאחסן קפוא לשמור על RNA. כדי להפוך את ההשעיה צואה 10%, קחו כ 0.1 גרם של דגימת צואה מופשר ושלמה מ"ל 1 עם PBS.
- Aliquot ב μl 200 כדי למנוע הופעה חוזרת של הקפאה להפשרה. אחסן את aliquots ב -70 ° C.
- להפשיר ו סרכזת aliquots ב ז 4000 10 דקות לפני השימוש ב החילוץ.
2. הכנת חלקיקי סיליקה להפקת עם Guanidine & סיליקה
- ב RT, להשעות את 30 גרם של דו תחמוצת הצורן ולהשלים עם DH 2 O עד 250 מ"ל.
- לאחר 24 שעות של שקיעה, להסיר 215 מ"ל של supernatant ידי שאיבה. הוסף DH 2 O עד 250 מ"ל, ו להשעות סיליקה כדורית ידי רועדת.
- אחרי עוד 24 שעות, להסיר את supernatant על ידי שאיבה, ולהתאים את ה-pH של השעיה סיליקה ל-pH 2.0, באמצעות חומצת מלח (HCl). Aliquot ההשעיה סיליקה ב בוט זכוכיתtles ו החיטוי.
3. הכנת מאגר L6 להפקת עם Guanidine & סיליקה
- ב RT, להכין L6 חיץ ידי המסת 60 גר 'thiocyanate guanidinium (GuSCN) ו -1.3 גרם של טריטון X-100 ב 50 מ"ל של hydrochloride 0.1 טריס M, pH 6.4, ו - 11 מ"ל של EDTA 0.2 מ', 8.0 פתרון ה-pH.
4. הכנת מאגר L2 להפקת עם Guanidine & סיליקה
- ב RT, להכין מאגר L2 ידי המסת 180 גר 'thiocyanate guanidinium (GuSCN) ב 150 מ"ל של hydrochloride 0.1 טריס M, pH 6.4.
5. הפקת סדר
- בשנת מיצוי כל דגימת צואה חיובית לנובמבר, כביקורת חיובית, מים מטופלים DEPC, כביקורת שלילית, יש לכלול.
- בצינור מיקרו צנטריפוגות לערבב את הפעולות הבאות: 1 מ"ל של L6 חיץ, 20 μL של חלקיקי סיליקה, ולהוסיף 200 μL ההשעיה 10% תמצית צואה. מערבולת בקצרה ולהשאיר את RT עבור mi 15n.
- בצנטריפוגה ההשעיה בבית ג'של 6000 על 10 ולשטוף גלולה עם 1ml של חיץ L2 פעמיים, ואחריו שני שוטף עם אתנול 70% ופעם אחת עם אצטון. לייבש גלולה בבלוק חימום יבש על 56 מעלות צלזיוס למשך 5 דקות.
- מימה את הרנ"א של סיליקה כדורית על ידי הוספת 50 μL של RNase ללא DH 2 0. הוסף 1 μL של RNasin, שילוב של צינור דגירה היפוך ועל 56 מעלות צלזיוס במשך 15 דקות.
- סרכזת דקות 3 במלוא המהירות, בצנטריפוגה השולחן, ולאסוף 40 μL של supernatant המכילה רנ"א.
- לכמת את דגימות רנ"א שחולצו באמצעות Nanodrop 2000 ספקטרופוטומטר (Thermo Scientific). לאחר מכן לאחסן ב -70 ° C עד השימוש, עד 6 חודשים. (הערה: דרך טובה יותר לשמור על RNA הוא בסך הכל תמים והפיכתו cDNA).
6. הוצאה אלטרנטיבית שימוש מסחרי רנ"א נגיפי RNA QIAamp Kit
הוראות נוספים נמצאים בחוברת provided עם ערכת QIAGEN. בקצרה ההליך הוא כדלקמן:
- 560 Pipet μL מאגר AVL המכיל את הרנ"א המוביל לתוך צינור 1.5 מ"ל, ולהוסיף 140 μL ההשעיה שרפרף 10%. מערבבים ידי vortexing-הדופק של 15 שניות. על דגירה RT 10 דקות.
- הוספת 560 μL של אתנול (96-100%) המדגם ומערבבים ידי vortexing-הדופק של 15 שניות, אז בקצרה סרכזת.
- החל 630 μL של פתרון זה לעמודה ספין להציב צינור מ"ל 2 אוסף. סרכזת דקות 1 ב 6000 גרם, ולאחר מכן להציב את העמודה ספין לתוך צינור נקי 2 מ"ל.
- לשטוף את העמודה המכילה רנ"א מאוגד עם μL 500 של AW1 חיץ צנטריפוגות ב g 6000 דקות 1. במקום עמודה צינור נקי מ"ל 2 אוסף.
- לשטוף את העמודה עם μL 500 של מאגר AW2 ו צנטריפוגות במלוא המהירות (20,000 או 14,000 סל"ד גרם) 3 דקות.
- ספין במקום עמודה צינור נקי 1.5 מיקרו צנטריפוגות מ"ל, להוסיף מים 40 μL DEPC שטופלו ו elute את RNA במלוא המהירות. חזור עלCE עבור μL 80 הסופי של RNA eluted.
- לכמת את דגימות רנ"א שחולצו באמצעות Nanodrop 2000 ספקטרופוטומטר (Thermo Scientific). לאחר מכן לאחסן ב -70 ° C עד השימוש, עד 6 חודשים. (הערה: דרך טובה יותר לשמור על RNA הוא בסך הכל תמים והפיכתו cDNA).
7. זיהוי של norovirus ב RNA שחולצו על ידי חד פעמית צעד נדל RT-PCR עם בדיקות ספציפיות Taqman
מכשיר StepOnePlus זמן אמת PCR מערכות (Applied Biosystems).
מתודולוגיה
- לנגב לנקות את כל משטחי העבודה, טפטפות, ו צנטריפוגות עם RNase הרחק להסיר כל אפשרות של זיהום RNase.
- Pipet GI נובמבר ו GII ההקרנה אמן מערבב לפי טבלה 1. בדיקות primers ו Taqman מפורטים בטבלה 2.
- 10 aliquot μL של שילוב הורים המתאים צינור כל תגובה.
- הוסף 5 μL של מדגם לא ידוע חיRNA, DEPC שטופלו מים שליטה שלילית או חיובית GII GI בהתאמה מלאה RNA, את בארות התגובה המתאימים. כל הדגימות יש לפעול בשני עותקים. שולטת חיובית ורמה עם ריכוז של 300 מיקרוגרם / μL ו 500 מיקרוגרם / μL בהתאמה סופקו על ידי המעבדה הלאומית Calicivirus המרכז לבקרת מחלות ומניעתן (CDC).
- בצנטריפוגה הצלחת התגובה של 6,000 גרם ל 10 שניות.
- במסך מאפייני הניסוי, להגדיר ובחר סוג של ניסוי לריצה. ודא ריאגנטים TaqMan מוצגים כסוג ריאגנטים, וכי לקריאה Pre-PCR ו הגברה נבחרו.
- הפעלה 15 תגובות μL שימוש בפרופיל תרמית בטבלה 3.
- לנתח את התוצאות.
8. Genotyping של נובמבר GI ו GII באמצעות קונבנציונאלי RT-PCR וסדר
(זה לא מוזכר בסרט הזה כי זה השיטה הנפוצה בשימוש נרחב.)
מכשיר. יישומית Biosystems StepOne ו StepOnePlus בזמן אמת למערכות ה-PCR עם תבנית Quantitec.
מתודולוגיה
- לפני genotyping, genogroup (GI או GII) מהדגימות נקבעים על ידי הקרנת RT-PCR המתוארים לעיל. GI נובמבר RNA חייב להיות מוגבר עם מיקס מאסטר genotyping GI ו 'נובמבר GII RNA עם מיקס מאסטר genotyping GII.
- Pipet GI נובמבר ו GII genotyping אמן מערבב לפי טבלה 4. Primers GI SKF / SKR ו G2 SKF / SKR מפורטים בלוח 5.
- 45 aliquot μL של שילוב שני המתאימה ל -0.2 מ"ל צינורות התגובה.
- הוסף 5 μL מים DEPC שטופלו על צינור כל פקד שלילית, 5 μL מראש הוקרן נובמבר (GI ו / או GII) RNA חיוביות לצינור את התגובה המתאימה.
- לרוץ 50 תגובות μL שימוש בפרופיל תרמית בטבלה 6.
- שלח PCR מוצרי contaiנינג לפחות 100 ng / μL האזור capsid מוגבר כדי Macrogen החברה לטיהור וסדר. (9,700 הגדולה סנקה Hwy. Rockville, MD 20850 ו 10 דולר לכל מדגם רצף).
9. נציג תוצאות
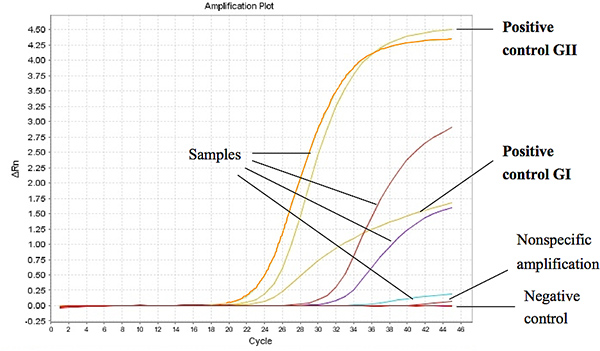
איור 1 מציג תוצאות נציג של Taqman צעד אחד RT-PCR כאשר נעשה שימוש כדי RNA assay שנלקחו דגימות צואה של ילדים שלשולים. מחזור הסף (CT) עבור מדגם חיובית נקבע פחות או שווה ל Ct 37 עבור GI ו-CT 39 עבור GII. את ערכי ה-CT של הבקרות חיוביות נמצאו פחות מ 27 ו - 18 לצומת ORF1-ORF2 עבור GI ו GII, בהתאמה. לחץ כאן כדי להציג דמות גדולה .
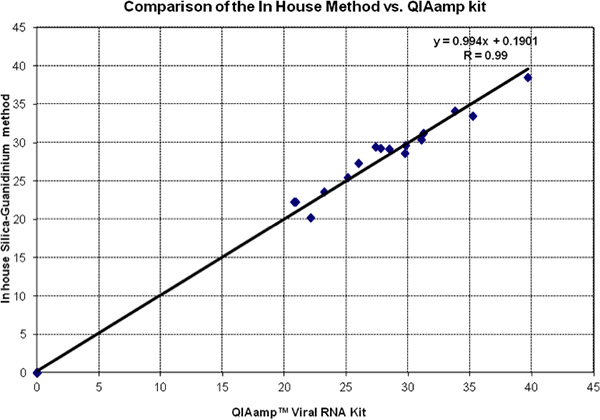
איור 2 מציג השוואה ראש אל ראש ערכים CT של שיטת סיליקה guanidinium ו QiAmp ויראלי ערכת RNA. הנתונים של שני המבחנים נופלים קרוב מאוד לקו השוויון (שיפוע = 1 ו ליירט = 0). זה אושר על ידי ניתוח רגרסיה מקדם המתאם. כל הפקדים שליליות נבדקו ונמצא כי הוא 0 בשתי השיטות.
| מיקס מאסטר | סופי קונצרט כלשהו | נפח (μL) |
| H 2 0 PCR | 2.875 | |
| Quantitect RT-PCR מיקס מאסטר | 1x | 6.250 |
| RT Mix | 1x | 0.125 |
| פריימר 50 מיקרומטר בורג R | 1 מיקרומטר | 0.250 |
| בורג 50 מיקרומטר F פריימר | 1מיקרומטר | 0.250 |
| טבעת 10 מיקרומטר בדיקה | 1 מיקרומטר | 0.125/0.250 * |
| 10.00 |
* 0.250 μL של בדיקה זו נעשה שימוש לצורך בדיקות במערכת העיכול, בעוד 0.125 μL של בדיקה זו נעשה שימוש לצורך בדיקות GII.
1. לוח Qiagen Quantitect מיקס מאסטר להקרנה GI ו GII (טרוחיו et al., 2006). 7
| שם | Geno קבוצה | להשתמש | רצף (5 'ל 3') |
| בורג 1R | GI | צבע יסוד | CTT AGA CGC CAT CAT CAT TYA C |
| בורג 1F | GI | צבע יסוד | CGY TGG ATG CGN TTY CAT GA |
| בורג 2R | GII | צבע יסוד | TCG ACG המרכז לאמנות עכשווית TCT TCA TTC ACA |
| בורג 2F | GII | צבע יסוד | CAR GAR BCN ATG TTY AGR TGG ATG AG |
| טבעת 1A | GI | בדיקה | FAM-AGA TYG CGA TCY CCT GTC CA-BHQ-1 |
| טבעת 1B | GI | בדיקה | FAM-AGA TCG CGG TCT CCT GTC CA-BHQ-1 |
| Ring2-TP | GII | בדיקה | FAM-GAG TGG GGC גת CGC CT-AAT BHQ-1 |
טבלה 2. ראשונה, oligonucleotides בדיקה המשמשים בזמן אמת כמותי RT-PCR עבור genogroups I, II (Kageyama et al.2003). 8
| שלב | טמפרטורה (° C) | זמן (דקות) | |
| 1 | 50 | 30:00 | cDNA סינתזה |
| 2 | 95 | 15:00 | HotStart Taq הפעלת פולימראז |
| 3 | 95 | 00:15 | |
| 60 | 01:00 | 45X מחזורי |
שולחן3. פרופיל תרמי צעד אחד Taqman בזמן אמת RT-PCR (טרוחיו et al., 2006). 7
| מיקס מאסטר | סופי קונצרט כלשהו | נפח (μL) |
| H 2 0 PCR | 29.50 | |
| 5X Qiagen RT-PCR מאגר | 1x | 10.00 |
| 10 mM Mix dNTP | 0.4 מ"מ | 2.00 |
| האנזים Mix | 2.00 | |
| 40 U / μL RNAsin | 20 U / μL | 0.50 |
| 10 מיקרומטר SKF | 0.1 מיקרומטר | 0.50 |
| 10 מיקרומטר SKR | 0.1 מיקרומטר | 0.50 |
| 45.00 |
לוח 4. Qiagen צעד אחד RT-PCR תערובת אב genotyping GI ו GII.
| שם | Geno קבוצה | להשתמש | רצף (5 'ל 3') |
| G1SKF | GI | צבע יסוד | 5'-CCC CTG GAA TTY GTA AAT GA - 3 |
| G1SKR | GI | צבע יסוד | 5'-ACC המרכז לאמנות עכשווית CCA CAR TTR TAC - '3 |
| G2SKF | GII | צבע יסוד | 5'-CNT GGG AGG GCG ATC GCA - 3 |
| G2SKR | GII | צבע יסוד | 5'-CCR CCN GCA TRH CCR TTR ת"א CAT-3 |
Primers לוח 5. המשמש הגברה של אזור C אזור capsid (Kojima et al., 2002). 5
| שלב | טמפרטורה (° C) | זמן (דקות) | |
| 1 | 60 | 30:00 | cDNA סינתזה |
| 2 | 96 | 15:00 | HotStart Taq הפעלת פולימראז |
| 3 | 94 | 00:030 | |
| 52 | 01:00 | 40X מחזורי | |
| 72 | 00:30 | ||
| 4 | 72 | 10:00 | רכוך |
לוח 6. פרופיל תרמי Taqman צעד אחד RT-PCR.
Discussion
שימוש כלכלי in-house שיטה לבידוד חומצות גרעין מ דגימות צואה, נקבל תוצאות שוות כמו המסחרי נגיפי RNA QIAmp ערכת מ Qiagen, ויחד עם TaqMan RT-PCR פותחה במעבדה שלנו אנחנו יכולים לזהות מגוון רחב של נובמבר גנוטיפים השייכים GI ו GII genogroup. פרסום האחרונות של C באזור פרוטוקול דיווחו על שיעורים genotypin...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
המחברים מבקשים להודות Calicivirus המעבדה הלאומית המרכז לבקרת מחלות ומניעתן (CDC) מתנה סוג של כמה תוצאות חיוביות סטנדרטיים ובקרה עבור נובמבר, מעבדות בית הספר לבריאות הציבור באוניברסיטת ג'ונס הופקינס למתן ריאגנטים.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| Guanidine isothiocyanate | Sigma-Adrich | G9277 | |
| טריס HCL | Sigma-Aldrich | T5941 | |
| EDTA | Sigma-Aldrich | E5134 | |
| סיליקה | Sigma-Aldrich | S5631 | |
| טריטון X 100 | BDH כימיקלים | 14530 | |
| Diethylpyrocarbonate | Sigma-Aldrich | D-5758 | |
| QIAamp נגיפי RNA מיני קיט (250) | QIAGEN | 52906 | |
| Quantiטק Probe RT-PCR הערכה (200) | QIAGEN | 204443 | |
| Qiagen אחת RT-PCR שלב קיט (200) | QIAGEN | 210212 | |
| Rnase אינהיביטור 2000 יחידות | A.Biosystems | N808-0119 | 2000 unids / בקבוקון |
| שאינו מקל Rnae ללא Microfuge צינורות | Ambion | AM12450 | |
| Ultrapure agarose 1000 | Invitrogen | 16550-100 |
References
- Medici, M. Molecular epidemiology of Norovirus infections in sporadic cases of viral gastroenteritis among children in Northern Italy. L. Medical Virology. 78, (2006).
- Vidal, R. Novel recombinant Norovirus causing outbreaks of gastroenteritis in Santiago, Chile. J. Clinica Microbiology. 4, (2006).
- Xavier, M. Detection of caliciviruses associated with acute infantile gastroenteritis in Salvador, an urban center in Northeast Brazil. Braz. J. Med. Biol. Res. 42, (2009).
- Boom, R. Rapid and simple method for purification of nucleic acids. J. Clin. Microbiol. 28, 495-503 (1990).
- Kojima, S. Genogroup-specific PCR primers for detection of Norwalk-like viruses. J. Virol. Methods. 100, 107-114 (2002).
- Mattison, K. Multicenter comparison of two norovirus ORF2-based genotyping protocols. J. Clin. Microbiol. 47, 3927-3932 (2009).
- Trujillo, A. A. Use of TaqMan real-time reverse transcription-PCR for rapid detection, quantification, and typing of norovirus. J. Clin. Microbiol. 44, 1405-1412 (2006).
- Kageyama, T. A broadly reactive and highly sensitive assay for Norwalk-like viruses on real-time quantitative RT-PCR. J. Clin. Microbiol. 41, 1548-1557 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved