A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח של נדידת תאים עצביות קרסט טרונק באמצעות Assay השתנה Zigmond הקאמרי
In This Article
Summary
גישה לנתח את ההגירה של תאים (תאי explanted רכס עצביים גזע) הוא תאר. שיטה זו היא זולה, עדינה, ומסוגלת להבחין chemotaxis משני chemokinesis והשפעות אחרות על קוטביות נדידה כגון אלה נגזרים מאינטראקציות תא תא בתוך התרבות העיקרית הגזע עצבי פסגת התא.
Abstract
תאי רכס עצביים (NCCs) הם אוכלוסייה זמנית של תאים הנמצאים בפיתוח חוליות שלהגר מצינור העצבי הגבה (NT) לאחר שעבר 1,2 מעבר אפיתל-mesenchymal. בעקבות EMT, NCCs לנדוד מרחקים גדולים לאורך מסלולים סטריאוטיפיים עד שהם מגיעים ליעדיהם. NCCs להתמיין למגוון רחב של סוגי תאים, כוללים תאי עצב, גליה המלנוציטים, תאי 1-3 chromaffin. היכולת של NCCs להגיע ולהכיר מקומות היעד הנכונים שלהם היא יסוד להיווצרות המתאימה של כל המבנים המכילים תא מטען נגזר NCC-3 מרכיבים. הבהרת מנגנוני ההדרכה לגזע NCC הגירה הייתה אפוא עניין בעל חשיבות רבה. מולקולות רבות שהפגינו להדריך NCC הגירת 4. לדוגמה, NCCs גזע ידוע להיות דחוי על ידי רמזי הדרכה שליליים כגון Semaphorin, Ephrin, וligands חריץ 5-8. עם זאת, לאעד לאחרונה היה לי chemoattractants של NCCs מטען זוהה 9.
גישות קונבנציונליות במבחנה ללימוד התנהגות chemotactic של תאי חסיד עבודה הטובה ביותר עם תאים הנציחו, homogenously מופץ, אך מאתגרים יותר לפנות לתרבויות מסוימות העיקריות בתאי גזע שתחילה חסרות הפצה הומוגני ומהירות להבדיל (כגון NCCs). גישה אחת לומוגני חלוקת NCCs מטען ללימודי chemotaxis היא לבודד NCCs גזע מתרבויות explant NT העיקריות, ואז להרים וreplate להיות כמעט 100% confluent. עם זאת, גישה זו דורשת ציפוי כמויות ניכרות של זמן ומאמץ כדי explant מספיק תאים, היא קשה, ומפיצת NCCs מטען באופן שונה מזו שנמצא בתנאי vivo.
כאן, אנו מדווחים גישה במבחנה כי הוא מסוגל להעריך את התגובות נודדות Chemotaxis ואחרות של NCCs מטען ללא requirinGA חלוקת תא הומוגנית. טכניקה זו מנצלת הדמיה זמן לשגות של ראשוני, ואינה נרתעת NCCs מטען בתוך modified Zigmond קאמרי (קאמרי Zigmond סטנדרטי מתואר במקום אחר 10). על ידי חשיפת NCCs מטען בפריפריה של התרבות לשיפוע chemotactant שניצבת ליווניות הטבעיות חזו, שינויים בקוטביות נודדת הנגרמים על ידי שיפוע chemotactant מיושם ניתן לאתר. טכניקה זו היא זולה, דורשת culturing של רק שני explants NT לטיפול לשכפל, נמנע מהרמת תא קשה (כגון trypsinization), משאיר NCCs מטען בהפצה דומה יותר לתנאי vivo, חותך את כמות הזמן בין explantation וניסויים (שסביר להניח מפחית את הסיכון לבידול), ומאפשר הערכת זמן לשגות של מאפיינים נודדים רבים.
Protocol
1. יום 1: בידוד של צינורות גזע עצביים לתרבות לילה על coverslips
- דגירת ביצי חומוס ל56 שעות ב 38 ° C. הסר את הביצים מדגירה, מרסס אותם במתינות עם אתנול 70%, ולאחר מכן לאפשר להם לייבוש. שובר את הביצים לרווחה אל תוך מגש זכוכית UV-מעוקר.
- לחלץ כל עובר מחלמון הביצה ומניח אותו בחומוס של רינגר. עשה זאת על ידי החיתוך הראשון סביב איי דמה עם מספריים מעוגלים, ולאחר מכן עם מלקחיים בוטים, לאסוף את העובר על ידי קרום extraembryonic ומניח אותו בצלחת פטרי פלסטיק סטרילי המכילה הפתרון של האפרוח רינגר.
- לבודד את תא המטען של כל עובר על ידי זמירה את קרומי extraembryonic עודפים כמו גם רמות ציריות גולגולת, vagal, ועצם העצה באמצעות מחט טונגסטן (1 איור). ראשית, בחר כ 9 עוברים שבין שלבי HH15-17 11. לשלבים HH15 ומעלה, צירי המוח הקדמי ומוח האחוריים יוצרים זווית חדה, ולכן מופיע בראש כדי להטות caudally. בשלב HH17, ניצן הזנב הוא הווה ומטה ventrally אך הוא עדיין לא מכיל somites. עם מחט טונגסטן, לקצץ את קרומי extraembryonic כ 2 מ"מ מהעובר ולנתק את כל רקמות קדמיות לsomite 10 עובריות. כמו כן להסיר את כל הרקמות העובריות caudal החל מרחבי ביותר somite 5 שהוקם זה עתה.
- הנח את הגזעים העובריים המבודדים בDispase (0.24 U / ml DMEM) ו דגירה אותם במשך 15 דקות 1 ש 'ב 37 ° C ו 5% CO 2. ברגע שמתחילים את גזעי דגירה, להתחיל בהכנות 6 coverslips (CS) לexplants NT culturing (1.5-1.8 צעדים).
- שטוף 6 CS באתנול 70% (בדילול במים סטריליים, ultrapure), ולאחר מכן לאפשר להם לייבוש. באמצעות סמן מעבדה, לצייר עיגול במרכזו של כל CS שהוא כ 1 סנטימטר הקוטר (מעגל זה מאוחר לעזור לך לזהות היכן מעייל פיברונקטין יושם). על אותו הפרצוף של כל CS, לכתוב את המילה "להיות" (או איזו מילה או צורה לא סימטרית אחרת) מחוץ למעגל נמשך (זה יעזור you לזהות אם הצד הבולט של CS פונה כלפי מעלה או מטה).
- למקם כל CS ב 40 x 10 מ"מ נפרדים צלחת סטרילית עם המשטח המסומן כלפי מטה ולאפשר את הצלחת לשבת פתוחה מתחת מנורת UV קוטל חידקים למשך 10 דקות.
- החל פיברונקטין μl 60 (FN, 10 מיקרוגרם / המ"ל DMEM) אל פני השטח לא המסומנים של CS תוך הקפדה על כל האזור בתוך עיגול 1 הסנטימטר צופה. הנח את הכלים כדי לדגור על 37 מעלות צלזיוס למשך 30 דקות ולאחר מכן לשאוב פיברונקטין מכל CS בזהירות.
- הוסף 250 בינוניים μl "התרבות" [DMEM עם L-גלוטמין (2 מ"מ), פניצילין (100U/ml), סטרפטומיצין (100 מיקרוגרם / מ"ל), ושל 8% בסרום שור עוברי (FBS)] לאזור FN המצופה של CS. מניח את המנות המכילות כל CS ב 37 ° C ו 5% CO 2 שוב, עד שנוירוטיפיקלים היו מבודדים.
- להעביר את כל גזעי עובר מודגרות לצלחת אחת 5 סנטימטר זכוכית פטרי המכילה L15 בינוני ולהתחיל לנתח את כל NT באמצעות מלקחיים עדינים ומחט טונגסטן (1 איור). גarefully יפרוס לאורך הגבול של NT וsomites עם מחט טונגסטן חדה בעת היותו זהיר שלא לפגוע בNT. זה בדרך כלל קל יותר להתחיל בידוד כל NT מהזנב ביותר סוף תא המטען.
- בחר 6 לנוירוטיפיקלים straightest והארוכים ביותר לתרבות לילה (בין נוירוטיפיקלים בערך 8 ו 15 somites ארוך מומלצים). שימוש בטיפ micropipette דרוך עם מדיום התרבות, תעביר כל אחת מ6 נוירוטיפיקלים לעצמו CS הכין בעבר (משלבים 1.5 עד 1.8). הקפד שהנטורופתי לא יישאר צף על פני השטח. אם NT היא צפה, לטפטף מדיום אליו עד שהיא נקבר באמצעות micropipette.
- הנח בכל צלחת 37 2 הלילה ° C ו 5% CO. להיות זהיר כדי להבטיח לכל NT היא בתוך אזור FN המצופה של CS השייך לו מייד לפני הצבת הצלחת בחממה (באמצעות המעגל נמשך בשלב 1.5 כהפניה). Micropipette יכול לשמש טוב יותר כדי להתאים את המיקום של כל NT במידת צורך.
- מקום ב2 לפחות מ"ל של מדיום התרבות (ללא סרום) לתוך צינור צנטריפוגות סטרילי 15 מ"ל ו דגירת הלילה בשעת 37 ° C ו 5% CO 2. השאר את הכובע מעט פרקתי לאפשר החומציות של המדיום להתאים בין הלילה. טרום דוגר מדיום הוא חשוב כדי למנוע היווצרות בועה בחדר שלך, שעלול לשבש את הקמת שיפוע מולקולרי. בינוני כגון "preincubated" יש להשתמש בכל אמצעים בעתיד. כאשר לא בשימוש, המדיום הזה יש דוגר על 37 ° C.
2. יום 2: טוען הקאמרי modified Zigmond וניתוח זמן לשגות של נדידת תאים
- מתוך 6 נוירוטיפיקלים התרבית, בחר את 3 התרבויות המתאימות ביותר לניתוח. באופן כללי, תרבויות NCC כי יש לפחות אחד קצוות ארוכים וישרים יש לבחור (איור 2A). את 3 התרבויות הטובות ביותר, תשמשנה לטעינה ולסרט 3 תאים שונה Zigmond לאורך היום, כל אחד עם יחס שונה. מתוך 3 תרבויות, לבחור אחד לloadinגרמתי לראשונה לחדר ולהחזיר את השאר לחממה לשימוש מאוחר יותר.
- באמצעות קיסם אוזניים, תחול, גם שכבה דקה של וזלין מקיפה את מאגרי המים והגשר של אחד modified Zigmond קאמרי.
- עם מחט טונגסטן, בעדינות להסיר NT מ CS, תוך השארת NCCs מקיף מצורף אל פני השטח של CS. סמן את הצלחת עם עט לזכור את הכיוון של הקצה הישר של תרבות NCC.
- הנח כמה טיפין של מדיום preincubated אל הגשר. הרם את CS עם מלקחיים עדינים, טיפת קצה CS נגד Kimwipe להסיר ביותר של מדיום התרבות הישן, ואז למקם מייד CS על עדכון Zigmond הקאמרי כך שהקצה הישר של התרבות להצטלם מרוכז על אורכו של הגשר ובערך בניצב לגבול גשר המאגר (האיור 2A, B).
- באמצעות מיקרוסקופ הפוך, להזיז את גבול NCC ישר להיות בצד של הגשר הקרוב ביותר למאגר הדואר שיכיל chemotactant החשד (האיור 2B; לפקדים זה מתאים לאיזה מאגר נטען שני). כמו כן, יותר דק ליישר את הקצה הישר של התרבות להיות ניצב לגבול גשר המאגר.
- בזהירות, אבל בטוח לחץ CS לוזלין הנוכח בחדר Zigmond, כדי לוודא שהוא אטום לחלוטין לקאמרי, ואז למקם וזלין נוסף בשולי CS נוסף כדי להבטיח שהיא תהיה אטומה. עדין להתאים את הזווית של גבול NCC שוב כדי לתקן את כל תנועה בתהליך האיטום.
- טען את המאגר שלא יכיל chemotactant 1 החשד (איור 2 ב '). לעשות זאת על ידי טעינת מזרק 1 מ"ל (25 G x 1.5 פנימה מחט מצורפת) עם בערך 300 בינוניים preincubated μl ולהזריק לתוך המאגר הבינוני עד מלא (בזמן נזהר שלא ליצור כל בועות במאגר). חבר את המאגר בשני הצדדים עם suffכמות icient של וזלין לפני טעינת המאגר הבא.
- חזור על שלב 2.7, אלא שהפעם באמצעות מדיום המכיל preincubated chemotactant המועמד. זה קריטי בעת יצירת שיפוע מולקולרי על פני התרבות תמיד לטעון את המאגר המכיל את המולקולה להיבדק לאחר טעינת המאגר חסר מולקולה הנבדקת.
- הנח הקאמרי Zigmond הטעון ב 37 ° C כדי לדגור על h 1 לפני צילומים. תמונת הגבול הישר של תרבות NCC למשך 3 שעות במרווחי הזמן של 90 בעוד שדוגר על בערך 37 מעלות צלזיוס (האיור 2A, B). לפני יצירה כל סרט, הקפד ליישר את המצלמה כך שהקצה את התמונות כדי לקבל מיושר עם ונוגע בקצה של הגשר שגובל במאגר הטעון האחרון (האיור 2B, פנל העליון; תיבה מקווקות מייצג אידיאלי עמדה להדמיה). זה יהיה להקל על ניתוח מאוחר יותר על ידי תוכנת תקנון הכיווניות של השיפוע המולקולרי יושם והמרחק דואר מהמאגר שצולם בכל סרט הופק.
- עבור פקדים, חזור על שלבים 2.2-2.9 לכל אחד משתי תרבויות NCC האחרות שנבחרו (בשלב 2.1), אבל למלא בכל מאגר עם מדיום מתאים. לסוג אחד של שליטה למלא שני המאגרים עם מדיום preincubated לא מכיל את המולקולה כדי להיבדק. לטיפול ביקורת שני, ראש הגשר עם כמה טיפין של מדיום preincubated מכיל chemotactant החשד לפני הרכבת CS. אז, טען שני המאגרים עם אותו המדיום המכיל chemotactant החשד.
- השתמש ImageJ (NIH) מעקב ידני (rsb.info.nih.gov / ij / תוספים / מסלול / track.html) וChemotaxis וכלי להעברה v1.01 (www.ibidi.de / יישומים / ap_chemo.html) plugins כדי לעקוב אחר ההגירה של NCCs ההיקפי לאורך הגבול הישר של j התרבותust צלם ולנתח את הפרמטרים שונים של מסלולי הנדידה התקבלו (איור 2B-C).
3. נציג תוצאות:
מדגם של מסלולים סלולריים מסרט שבו רב NCCs מטען היה מגיב לchemoattractant מועמד באמצעות טכניקה הנ"ל מוצג (איור 2 ד). רוב התאים בדוגמה זו של תגובה חיובית מוצגים תנועות נטו במעלה שיפוע chemoattractant (כפי שמוצג באדום). נתוני מסלול יכולים לשמש כדי לנתח מאפיינים אחרים של נדידת תאים גם כן.
על מנת להעריך חזותי שיפוע מיושם בmodified Zigmond קאמרי, Alexa פלואוריד 488 IgM המצומד (MW ~ 900 KDA) הוכנס למאגר השני של modified Zigmond קאמרי (בערך 40 מיקרוגרם / המ"ל H 2 O). שיפוע הוקם על ידי 1 ש 'ועדיין קצת נוכחי לאחר 26 שעות, אך הצטמצם מאוד של 50 שעות (3 איור). אם המולקולה להיבדק היא קטנה יותר, ולאחר מכן להחיל השיפוע will לבזות מהר יותר ממה שמוצג.

איור 1. Explantation של נוירוטיפיקלים תא מטען ברמה לculturing הלילה בcoverslips פיברונקטין המצופה. בגלל delaminate NCCs עורק מNT הגבתה הממוקם בסמוך לsomites 8-28, זה קטע של NT מבודד ידי microdissection ולילה על CS פיברונקטין מצופה תרבותי כדי לאפשר הגירה של NCCs מexplant NT. נוירוטיפיקלים מבודדים שבין 8-15 somites ארוך וישר יחסית, הם מתאימים ביותר עבור culturing הלילה כפי שהם נוטים להניב תרבויות NCC בגבולות ישרים יותר. אזורים של הצינור העצבי שמעוררים רמות ציריות אחרות עצביות רכס מוצגים בגופן קטן יותר. s, somite.

איור 2. שיטה להערכת ההגירה של NCCs המטען explantedבאמצעות תא Zigmond modified. () תרבויות NCC מטען המוארכות שהוכנו על ידי culturing הלילה של נוירוטיפיקלים ותרבויות NCC תוצאה עם אחד לפחות גבול ארוך, ישר נבחרו לניסויים. הגבול הישר הארוך ביותר של תרבות שנבחר לאחר מכן מוצב בניצב לגבול גשר המאגר, ולכן במקביל לווקטור של השיפוע מיושם העתיד. (ב ') לאחר שקנס התאמה-העמדה של תרבות NCC בZigmond הקאמרי והאיטום coverslip לתא, התא טעון. כשבדוק chemotaxis, המאגר שלא יכיל chemotactant החשד (-) נטען ראשון ואטום. ואז, המאגר האחר הוא עמוס chemotactant החשד (+) והאטום. NCCs ההיקפי לאורך הגבול שנבחר בעבר אז יכול להיות צלם ומעקב באמצעות תוסף מעקב הידני לImageJ (פנל תחתון). (C) מאפיינים נודדים רבים בתגובהלשיפוע מיושם ניתן להעריך על סמך נתוני מעקב. לדוגמה, מדד chemotaxis ניתן לגזור על ידי חלוקת העקירה של תא לאורך ציר x במרחק הכולל הוא הגר. (ד ') דוגמה לתגובה אטרקטיבית מוצגת על ידי עלילת מסלול תא שנוצרה בתחילה על ידי Chemotaxis וההגירה תוסף כלי לImageJ. נקודת המוצא של כל מסלול מוגדרת למקור (0,0). שים לב כמה יותר תאים נודדים לכיוון מרכז source.The chemoattractant של מסה של כל התאים בעמדתם הסופית (צלב כחול; כל תאי משקל זהים) הוא גם קרוב יותר למקור chemoattractant. NCCs, תאי רכס עצביים; מסלולים אדומים, תאים שנדדו לכיוון המאגר עמוס בחשד chemoattractant; מסלולים שחורים, תאים שנדדו משם; (+), ריכוז גבוה יותר; chemotactant (-), ריכוז chemotactant תחתון.

איור 3. פרופילי אינטנסיביות על הגשר קאמרי Zigmond עדכון בזמנים שונים בעקבות תוספת של הצמוד Alexa פלואוריד 488 IgM. החדר היה עמוס באופן דומה לזה מתואר בפרוטוקול עם החריגים העיקריים שמי preincubated (במקום בינוני preincubated) שמש כדי לדלל את הנוגדן עד 40 מיקרוגרם / מ"ל, וכיסי אוויר קטנים נכחו בקצוות של הגשר (מהפרוסה שבו הפרופילים בעצמה מעל בי נלקחו). בתחילה, לא היה נוכח פני שיפוע ביותר של הגשר. ידי השיפוע 1 חה הוקם ונותר בעינה עד 26 שעות. על ידי 50 שעתי הנוכחות של השיפוע לא הייתה עקבית באזורים שונים של הגשר, וכאשר קיים, תלילות השיפוע צומצמה מאוד. כל הפרופילים שהופקו מפרוסה זהה מעבר לגשר (מגבול אחד גשר למאגר האחר) באמצעות 4.6 AxioVision תוכנה. שים לב שגם בזמן אווירכיסים היו נוכחים, השיפוע לא היה משובש. עצמה גבוהה, גבוהה; נמוכה, עצימות נמוכות; ציר x, מרחק על פני כל רוחבו של הגשר (2 מ"מ); (+), מאגר עמוס Alexa פלואוריד 488 IgM הצמוד; (-), מאגר לא עמוסה הצמוד.
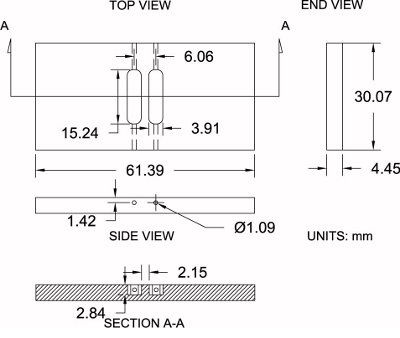
איור 4. המפרטים השתנו Zigmond הקאמריים. המוצגים הם תרשים של modified Zigmond הקאמרי משמש כאן יחד עם מפרטי ממדיה (± 0.2 מ"מ). מדידות יכולות להיות מותאמות באופן מתון על מנת שיתאים להעדפותיו.
פרוטוקול משלים: המצאה של שינוי Zigmond קאמרי
אנא עיין באיור 4 כנקודת התייחסות לפרוטוקול שלהלן:
- לרכוש גיליון "אקריליק המלוטש העבה 3/16 (עובי 4.45 מ"מ בפועל).
- שימוש בטבלה ראה, לחתוך חסר קאמרי גדול מדי לממדים גסים של 33.25 מ"מ x 64.57 מ"מ. זה מאפשר חומר נוסף 3.175 מ"מ לעיבוד שבבי.
- הגדרה הריקה הקאמרי בצבת. עם מכונת טחינה ו6.35 מ"מ (1/4 ") קצת טחנת הסוף, עיבוד שבבי לסיים את הצדדים של התא למידות המדויקות שלהם: 30.07 מ"מ x 61.39 מ"מ.
- מקם את הריק הקאמרי במכונת הטחינה ולאתר את המרכז הריק לאורך שני צירי x ו-y עם מאתר קצה, ואז לאפס את מיקום המרכז.
- לרכוש את גובה התא (ציר Z-) על ידי נגיעה קצת טחנת הסוף למשטח העליון ולאפס את הגובה.
- שימוש קצת טחנת סוף 3.91 מ"מ (0.154 "), קוזז 3.03 המ"מ קצת לאורך ציר X (כיוון חיובי) למאגר הראשון. בגין עיבוד לתוך החדר לעומק של 2.84 מ"מ ואילו נע לאורך ציר y (כיוון חיובי) ל7.62 מ"מ (0.300 ") ולאחר מכן לעבור ל7.62 מ"מ (0.300") בכיוון ההפוך (שלילי) למאגר מלא אורך של 15.24 מ"מ (0.600 "). לקזזקצת ל3.03 מ"מ (0.119 ") לאורך ציר X (כיוון שלילי) ולחזור על אותו התהליך למאגר השני.
- מקם את החדר בקצה שלה ולקדוח חור באמצעות 1.09 מ"מ (0.043 אינץ') מקדח בסיומו של כל מאגר (4 סה"כ) שמחבר את קצו של המאגר לצד של החדר לטעינה בינונית במהלך ניסויים.
- משרה את החדר היטב במים חמים וסבון כדי לסייע להסיר את כל מזהמים כימיים.
- משרים ולשטוף היטב במי החדר מזוקקי פעמים כדי להסיר כל סבון. התאים מוכנים כעת לשימוש כמתואר לעיל.
Discussion
מחקר chemotaxis על NCCs הגזע הוכיח מאתגר עבור סדרה של סיבות. NCCs Trunk מהווה אוכלוסייה הטרוגנית של תאי גזע שתתמיין ואם תרבותי לטווח ארוך, ולכן יש לקבל NCCs הגזע מexplantation העיקרי של NT תא מטען ברמה. שיטות מקובלות ללימוד תגובת chemotactic של אוכלוסיות תאים חולקו homogenously במבחנה קשות לבדו?...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
אנחנו נותנים תודה מיוחדת ללינוי קים, סטיב גוזמן וUjit Satyarthi לסיוע טכני במהלך הפיתוח של שיטה זו. מיירון הות'ורן, ריצ'רד Spengel, ורוברטו רוחאס מכונת התאים משמשים כאן וספקו סיוע טכני נחוץ. יש לציין, רוברטו רוחאס הופק איור 4. אנחנו גם אסירת תודה על העצות היקרות הערך של סקוט פרייזר לקראת הפיתוח של assay chemotaxis לעיל. עבודה זו נתמכה בחלקה על ידי SCORE-5S06GM048680-13-NIH MBRS לMEdB ופרס מהמחלקה לזיהוי הפלילי, תכנית תמיכת תזת בוגר Northridge לCW.
Materials
Denville
| Name | Company | Catalog Number | Comments |
| שם המגיב | חברה | מספר קטלוגים | תגובות (אופציונלי) |
| DMEM | אומגה מדעית | DM-22 | |
| פתרון סטרפטומיצין פניצילין | אומגה מדעית | נ.ב.-20 | ריכוז המניות 100X |
| L-גלוטמין | אומגה מדעית | GS-60 | ריכוז המניות 100X |
| סרום שור עוברי | אומגה מדעית | FB-11 | לוט # 105247 (או אחר שניתן להשוות) |
| שינוי Zigmond קאמרי | תוצרת הבית | N / | נפח מאגר: ~ 160 ea μl; למפרטים נוספים, ראה איור. 4 ופרוטוקול המשלים ייצור |
| צלחת תרבית תאים | T6040 | 40 10 מ"מ x | |
| פיברונקטין | BD | 354008 | מניית 10X prepped על ידי דילול 1 מ"ג FN במיליליטר H 2 O 1 ו המ"ל DMEM 9 |
| Coverslips | דיג | 12-548-B | Precleaned; 22 x 22 מ"מ |
| L15 בינוני | Thermo Scientific | SH30525.02 | |
| וזלין | מנחם | 011110794642 | 100% |
| צינור צנטריפוגה | Biologix | 10-9152 | 15 מ"ל |
| Dispase | מערכות סלולריות | 4Z0-850 | ריכוז המניות 10X |
| מזרק | BD | 309602 | 1 מ"ל |
| מחט | BD | 305127 | 25 G x 1.5 פנימה |
| Alexa פלואוריד 488-IgM | אניnvitrogen | A21042 | מניות הן 2 מ"ג / מ"ל; IgM 7 שומות צבע / שומה |
| מלקחיים מבתרים | FST | שונה. | דומון # 5 או 55; נירוסטה או טיטניום, ישר הטתה |
| מחט טונגסטן | N / | N / | עשה בית; להציב בעל סיכה |
| מלקחי בלאנט | Tiemann | 160-18 | משמש להעברת עוברים לצלצול של מחלמון הביצה |
פרוטוקול משלים: המצאה של שינוי Zigmond קאמרי
אנא עיין באיור 4 כנקודת התייחסות לפרוטוקול שלהלן:
- לרכוש גיליון "אקריליק המלוטש העבה 3/16 (עובי 4.45 מ"מ בפועל).
- שימוש בטבלה ראה, לחתוך חסר קאמרי גדול מדי לממדים הגסים של 33.25 מ"מ x 64.57 מ"מ. זה מאפשר חומר נוסף 3.175 מ"מ לעיבוד שבבי.
- הגדרה הריקה הקאמרי בvise. עם מכונת טחינה ו6.35 מ"מ (1/4 ") קצת טחנת הסוף, עיבוד שבבי לסיים את הצדדים של התא למידות המדויקות שלהם: 30.07 מ"מ x 61.39 מ"מ.
- מקם את הריק הקאמרי במכונת הטחינה ולאתר את המרכז הריק לאורך שני צירי x ו-y עם מאתר קצה, ואז לאפס את מיקום המרכז.
- לרכוש את גובה התא (ציר Z-) על ידי נגיעה קצת טחנת הסוף למשטח העליון ולאפס את הגובה.
- שימוש קצת טחנת סוף 3.91 מ"מ (0.154 "), קוזז 3.03 המ"מ קצת לאורך ציר X (כיוון חיובי) למאגר הראשון. בגין עיבוד לתוך החדר לעומק של 2.84 מ"מ ואילו נע לאורך ציר y ( כיוון חיובי) ל7.62 מ"מ (0.300 ") ולאחר מכן לעבור ל7.62 מ"מ (0.300") בכיוון ההפוך (שלילי) לאורך מאגר מלא של 15.24 מ"מ (0.600 "). לקזז קצת ל3.03 מ"מ (0.119 ") לאורך ציר X (כיוון שלילי) ולחזור על אותו התהליך למאגר השני.
- מקם את החדר בקצה שלהולקדוח חור באמצעות 1.09 מ"מ (0.043 אינץ') מקדח בסיומו של כל מאגר (4 סה"כ) שמחבר את קצו של המאגר לצד של החדר לטעינה בינונית במהלך ניסויים.
- משרה את החדר היטב במים חמים וסבון כדי לסייע להסיר את כל מזהמים כימיים.
- משרים ולשטוף היטב במי החדר מזוקקי פעמים כדי להסיר כל סבון. התאים מוכנים כעת לשימוש כמתואר לעיל.
References
- Le Douarin, N. M. The avian embryo as a model to study the development of the neural crest: a long and still ongoing story. Mechanisms of Development. 121, 1089-1102 (2004).
- Baker, C. V. . Neural Crest and Cranial Ectodermal Placodes. , (2005).
- Gammill, L. S., Roffers-Agarwal, J. Division of labor during trunk neural crest development. Dev. Biol. 344, 555-565 (2010).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Dev. Biol. 344, 566-568 (2010).
- Wang, H. U., Anderson, D. J. Eph family transmembrane ligands can mediate repulsive guidance of trunk neural crest migration and motor axon outgrowth. Neuron. 18, 383-396 (1997).
- Krull, C. E. Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to trunk neural crest migration. Curr. Biol. 7, 571-580 (1997).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development, Cambridge, England. , 133-199 (2006).
- De Bellard, M. E., Rao, Y., Bronner-Fraser, M. Dual function of Slit2 in repulsion and enhanced migration of trunk, but not vagal, neural crest cells. The Journal of cell biology. 162, 269-279 (2003).
- Kasemeier-Kulesa, J. C., McLennan, R., Romine, M. H., Kulesa, P. M., Lefcort, F. CXCR4 controls ventral migration of sympathetic precursor cells. J. Neurosci. 30, 13078-13088 (2010).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chicken embryo. J. Morph. 88, 49-52 (1951).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Davis, E. M., Trinkaus, J. P. Significance of cell-to cell contacts for the directional movement of neural crest cells within a hydrated collagen lattice. Journal of Embryology and Experimental Morphology. 63, 29-51 (1981).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved