A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
RNAi בתיווך ג'ין מציאה ו
In This Article
Summary
בפרוטוקול זה אנו משלבים RNAi בתיווך להשתקת גנים עם In vivo Assay diuresis ללמוד מציאה השפעות של גנים של עניין יש על הפרשת נוזל יתושים.
Abstract
זה פרוטוקול וידאו מדגים טכניקה יעילה מציאה גן מסוים חרק ולנהל המבדק חדשנית למדוד את קצב הפרשת. בשיטה זו ניתן להשתמש כדי להשיג הבנה טובה יותר של תהליך diuresis ב חרקים שימושית במיוחד בחקר diuresis בדם, האכלה פרוקי רגליים כי הם מסוגלים לקחת כמויות עצומות של נוזל הדם בארוחה אחת.
מציאה זו RNAi בתיווך גנים בשילוב עם ב assay diuresis vivo פותחה על ידי המעבדה הנסן כדי לחקור את ההשפעות של מציאה RNAi בתיווך של גנים אקווה פורין על diuresis Aedes יתוש aegypti 1.
הפרוטוקול מוגדר ב-לשני חלקים: ההפגנה הראשונה מדגים כיצד לבנות מכשיר פשוט זריקה יתוש וכיצד להכין ולהזריק dsRNA לתוך בית החזה של יתושים על מציאה RNAi בתיווך גנים. הפגנה 2 מתארת כיצד לזהותוהפרשה שיעורי יתושים באמצעות המבדק ב vivo.
Protocol
חלק א - RNAi בתיווך מציאה גן בוגר Aedes aegypti יתושים. לסקירה הניסוי ראו תרשים 1.
1. dsRNA סינתזה
- לסנתז dsRNAs ספציפיים כנגד הגנים של dsRNAs ריבית ושליטה. הערה: אנו ממליצים primers מתפתחות עבור שברי ה-PCR בטווח של 300 עד 500 זוגות בסיסים הנמצאים "סוף 2 cDNA ספציפי עם רצף פריימר T7 מחובר ב 5 '3 בסוף (5'-TAC ט.א.א. GAC TCA CTA TAG GG-3 "). ייחודה של שברי את חייבת להיות מאושרת על ידי ניתוח BLASTN 3.
- השתמש Ambion Megascript T7 תמלול, תפוקה גבוהה Kit (Ambion, שולחן של ריאגנטים) אשר מנצל T7 רנ"א פולימרז לתגובה שעתוק לסנתז dsRNA. הערה: חומרים כימיים דומים וערכות זמינים במקומות אחרים.
- לטהר dsRNA, להאיץ עם ליתיום כלוריד ביצוע ההוראות עם ערכת Megascript.
- לאחר purificatיון, לפרק את גלולה dsRNA במים סטריליים. על מנת להבטיח צמיגות מתאימה microinjection, ריכוז dsRNA לא יעלה על 2 מיקרוגרם / μl.
2. הזרקת הכנה
- פשוט מיקרו הזרקה ניתן לבנות באמצעות מספריים, צינורות מתכת, מחט, מזרק 1 מ"ל ו 1 מ"ל פלסטיק פיפטה טיפ (ראה איור 2). צינורות יש לחתוך ל ~ 40 ס"מ אורך. לחלופין, מיקרו מזרק אוטומטי יכול לשמש כגון דראמונד Nanojet השנייה 4.
- חותכים את קצה המזרק (רכזת מחט) על סימן 2 בקנה מידה מ"ל ולהסיר את ראש הבוכנה גומי הבוכנה.
- אגרוף החור באמצעות מחט מתכת בראש גומי הבוכנה מקום ראש גומי הבוכנה חזרה לרכזת את המחט.
- מניחים את הרכזת מחט בקצה אחד של צינורות ומקום 1 מפלסטיק מ"ל פיפטה עצה בצד השני, אשר ישמש בתור חתיכת הפה (לחילופין, 10 מ"ל סאיringe ניתן להשתמש כדי לייצר את לחץ האוויר הדרוש להזרקה).
- מכניסים מחט זכוכית נימי חור בראש גומי הבוכנה ולשבור את קצה המחט את כל רוחב מספיק גדול בשביל נוזל לזרום. הערה: גודל אופטימלי של קצה המחט צריכה להיקבע באופן אמפירי - אם הרוחב של מחט גדול מדי זה יגרום טראומה שיעור גבוה לתמותה יתושים, אם רוחב מחט הוא קטן מדי, לא ניתן יהיה לחדור שלד חיצוני יתושים.
- להטביע את מחט הזריקה במדגם dsRNA מוכנה למשוך את המחט אל תוך נוזל דוגמת הזרקת ידי מציצת נוזלים עם חתיכת הפה (או מזרק). הערה: שלב זה הוא זהה עבור כל חומרים כימיים נוזליים כי מוזרקים יתושים, כולל PBS חיץ, אשר משמש בפרוטוקול assay vivo diuresis (ראה להלן).
3. לאסוף הרדימי יתושים
- קולקטיביתטי יתושים עם aspirator מופעל הסוללה לתוך בקבוקון לאוסף. מניחים מכסה על הבקבוקון אוסף ומניחים את הצנצנת על משטח נקי CO 2 להרדים יתושים. הערה: לחלופין יתושים יכול להיות מורדם על הקרח.
4. יתוש הזרקת
- פתח את הבקבוקון איסוף למקם את היתושים ישירות על משטח 2 CO ולחכות עד יתושים מורדמים.
- מחק את כל הזכרים.
- בשורה היתושים בצד, כדי לאפשר גישה נוחה יותר להזרקה.
- תפוס על ידי יתושים ברגליים או כנפיים, כדי למנוע פציעה. אתה יכול גם להשתמש במכחול דק או נוצה לתמרן יתושים.
- כאשר מוכן להזרים יתושים 1, לתמוך בעדינות צד אחד של בית החזה עם מלקחיים את והכנס את קצה המחט אל הצד השני של בית החזה (איור 2). עדיף להזריק לתוך החלק הדק של לציפורן ולהימנע דוחף את המחט אלהו עמוק לתוך בית החזה.
- ברגע שהמחט נמצאת במקום, לפוצץ את הנוזל לתוך יתושים. הסכום המבוקש ניתן לקבוע על ידי ניטור המניסקוס נוזלי מחט. מספר מילימטרים הדרושים עבור נפח מסוים ניתן לקבוע על ידי חישוב נפח הצילינדר של מחט זכוכית נימי (πr 2 ח). כמות אפקטיבית של dsRNA המשמש בדרך כלל להזרקה היא 1 מיקרוגרם.
- פעם אחת את הנוזל מוזרק לתוך יתושים, בזהירות לחזור בו את המחט. אם אגל גדולות נוזלי צורות על החלק החיצוני של בית החזה, היתוש אמור להיות מושלך. לאחר מכן, לחזור על תהליך זה עם היתוש הבא.
5. יתוש שחזור ואחסון
- לאחר ההזרקה, מקם את היתושים במיכל לאחסון. לדוגמה, 1 ליטר מצופה שעווה כוסות קרטון (כוסות מרק) עם כיסוי רשת מאובטחת עם מכסה קרטון. המכסה יש חלק בנוי רשת מכסה להיחשף. לאחר שכל מוsquitoes ממוקמים במכולה, למקם את המיכל בתא מבוקרת לסביבה הדגירה ולספק את היתושים עם מקור המזון, כגון 20% סוכרוז כדורי צמר גפן ספוג מונח על גבי כיסוי רשת. לפני ביצוע של assay diuresis vivo, לשלול את dsRNA-הזריק יתושים של מקור מים במשך 12 שעות לתקנן את מצב הלחות של יתוש זה.
- היעילות של מציאה dsRNA בתיווך הגן יכול להיות משתנה. השתקת הגן יכול להתחיל 1 יום אחרי הזריקה וזה יכול להימשך עד 6 ימים לאחר ההזרקה 4. הזמן האופטימלי כדי להשיג מציאה גן המרבי צריך לקבוע באופן אמפירי את הגן בכל פעם. באופן כללי, אנחנו מחכים 3 ימים לאחר ההזרקה dsRNA לפני שאנו להמשיך.
חלק ב '- ב assay diuresis vivo של מבוגרים Aedes aegypti יתושים
הערה: פרוטוקול פותחה על ידי המחברים ומשמש מציאה RNAi בתיווך של חלבונים אקווה פורין של יתוש הקדחת הצהובה Aedes aegypti 1. כדי למנוע השתנות בין יתושים בודדים, יתושים יש לנתח בקבוצות. מסיבות טכניות, אנו ממליצים על קבוצות של 5 יתושים בכל טיפול - יש כמות מוגבלת של זמן כדי לבצע את המדידה במשקל 1 לפני יתושים להתחיל להפריש שתן לאחר ההזרקה.
6. לאסוף הרדימי יתושים
- לפני אוסף של יתושים, להקליט את משקל בקבוקון אוסף ריק עם מכסה באמצעות איזון דיוק אנליטי. בקבוקון זה ישמש עבור כל המדידות הבאות.
- איסוף 5 נקבות היתושים לתוך בקבוקון אוסף שקל עם aspirator. מניחים את המכסה על הבקבוקון אוסף ולתת לו לשבת על כרית CO 2 למשך מספר שניות על מנת להרדים את היתושים.
7. משקל התחלתי מדידה
- קח לאהוא משקל המדידה הראשונית של 5 יתושים על ידי הנחת בקבוקון המכיל אוסף את היתושים עם כובע על איזון ודיוק.
- לחשב את המשקל של הקבוצה 5 יתושים על ידי לקיחת משקל היתושים ואת בקבוקון אוסף עם כובע ואת הפחתת משקל בקבוקון אוסף ריק עם מכסה.
- פתח את הבקבוקון איסוף למקם את היתושים ישירות על משטח 2 CO לאחר רישום המשקל של היתושים. אם היתושים מתחילים להתעורר במהלך מדידות משקל, קבע את הבקבוקון על משטח CO 2 למשך מספר שניות לפני שפתח את זה ומעמידים את היתושים על כן השיגור.
8. הזרקת הכנה
- הגדר את ההזרקה מיקרו ביצוע ההוראות שניתנו פרוטוקול RNAi בתיווך מציאה גן.
- מכניסים מחט זכוכית נימי ב ההזרקה מיקרו לשבור את קצה המחט את כל רוחב מספיק גדול בשביל liquid לזרום.
- מחט לצלול ב PBS חיץ ולצייר חיץ לתוך מחט הזריקה, כמות רצויה להשתמש בפרוטוקול זה הוא 1.25 μl של PBS על כל יתוש. הערה: סכום זה מחקה את הסכום הממוצע של הפלזמה בדם, כי הוא נלקח על ידי יתושים ממין נקבה 5.
9. יתוש הזרקת
- בשורה היתושים כדי לאפשר גישה קלה יותר עם מזרק מיקרו.
- ברגע שהמחט נמצאת במקום, לפוצץ מאגר PBS אל היתוש.
- פעם אחת את הנוזל מוזרק לתוך יתושים, טיפה עשוי להיווצר על החלק החיצוני של בית החזה. טיפה זו יש להסיר בזהירות לפני לשלב הבא.
- חזור על תהליך זה עם הזרקת יתושים הבא. עם ניסיון, שיעור ההישרדות יתושים יהיה כמעט 100% לאחר ההזרקה.
10. שקילה יתושים
- לאחר ההזרקה, בעדינות למקם את היתושים בבקבוקון אוסףכובע. קח את המדידה במשקל 1 של 5 יתושים על ידי הנחת בקבוקון המכיל אוסף את היתושים עם כובע על איזון ודיוק.
- לחשב את המשקל של הקבוצה 5 יתושים על ידי לקיחת במשקל של יתושים בקבוקון אוסף עם כובע להחסיר את משקל בקבוקון אוסף ריק עם מכסה. הערה: יתושים יתחילו להפריש שתן תוך 2 דקות לאחר הסרת מבלוק 2 CO הרדמה, ולכן חשוב לקחת את המדידה במשקל לפני שהן מתחילות להפריש.
- מניחים יתושים במיכל קטן שבו הם יתחילו להפריש שתן.
11. מדידות משקל השני לאחר
הערה: מדידות משקל של היתושים צריך לקחת 30 דקות intervals, אבל זה יכול להיות מותאם במרווחים קצרים יותר או יותר, בהתאם שיעורי הפרשה.
- אחרי 30 דקות, לאסוף Grouעמ '5 יתושים עם aspirator לתוך בקבוקון אוסף אותו עם כובע. קח מדידת משקל הבא של היתושים על ידי הנחת בקבוקון המכיל אוסף את היתושים עם כובע על איזון ודיוק.
- לאחר המדידה, מקם את היתושים במיכל מחזיק אותו במשך 30 הדקות הבאות.
- חזור על תהליך זה עבור סכום הרצוי של זמן.
12. קביעת שיעור הפרשה יתוש
- הסכום הכולל של הנוזל שהזריקו קבוצה 5 יתושים יכול להיות מחושב על ידי הפחתת משקל ראשוני של היתושים ממשקל מיד לאחר ההזרקה.
- כמות השתן אשר מופרש על ידי קבוצה של יתושים בנקודת זמן מסוימת יכול להיות מחושב על ידי הפחתת משקל ראשוני של היתושים מן המשקל של היתושים בנקודת זמן מסוימת.
- שיעור הפרשת בנקודת זמן מסוימת יכול להיות מחושב על ידי Diviדינג את כמות השתן המופרשת בשלב זה זמן על ידי בסך כולל של מוזרק נוזל (טבלה 1).
13. נציג תוצאות
RNAi בתיווך מציאה גנים ב assay diuresis vivo כבר בשימוש על ידי המעבדה הנסן כדי לחקור את ההשפעות של aquaporins ב diuresis Aedes aegypti יתושים. שלושה aquaporins כי הם לידי ביטוי Aedes aegypti Malpighian tubules הופלו עם השפעה משמעותית על שיעורי והפרשה לעומת שליטה יתושים 1. איור 4 מראה תוצאות נציג של הניסוי שבו assay diuresis נעשה שימוש כדי להשוות בין שיעורי והפרשה Aedes aegypti ו Culex quinquefasciatus בטמפרטורות שונות.
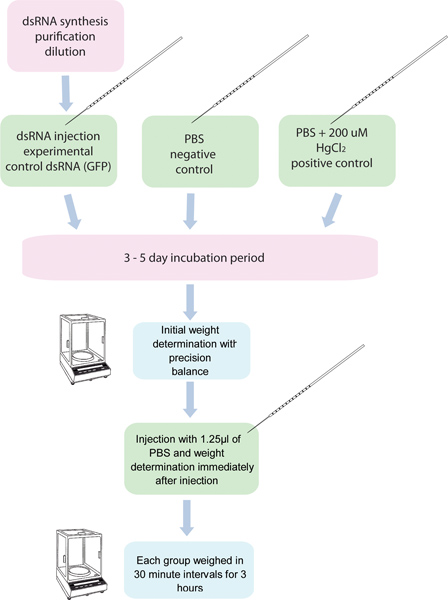
באיור 1. תרשים זרימה של assay RNAi / diuresis. 5 קבוצות של 10 יתושים EAפרק מוזרקים עם dsRNA על גן ספציפי ועוד חמש קבוצות של עשרה יתושים מוזרקים עם שליטה dsRNA. קבוצה אחרת של יתושים מוזרק עם 200 מיקרומטר HgCl 2 ב PBS משמש כביקורת חיובית. יתושים אלה שקל לפני ההזרקה, ולאחר ההזרקה תוך שלושים דקות intervals במשך 3 שעות.
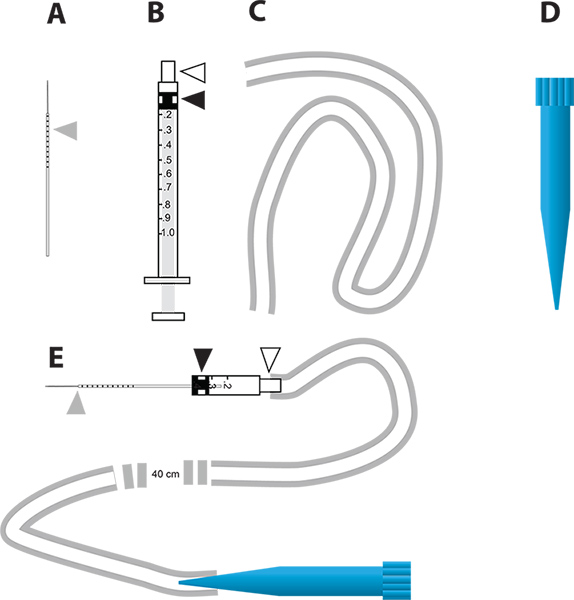
איור 2. מכשיר פשוט הזרקת מיקרו עבור מציאה RNAi בתיווך גנים ב assay diuresis vivo. א המחטים זכוכית נימי משמש להזרקה. משולש אפור מייצג את במרווחים מילימטר המשוכים על המחט כדי לציין את כמות הנוזל מוזרק לתוך יתושים. ב 1 מ"ל במזרק השתמשו כדי לבנות את ההזרקה מיקרו. המשולש הלבן מייצג את הרכזת המחט המשולש השחור מייצג את הבוכנה גומי הראש מחובר הבוכנה של המזרק. ג צינורות נהג לצרף את הפיה אלההזרקה. ד 1 מ"ל עצה הפנויה פיפטה (טיפ כחול) המשמש כשופר של המכשיר microinjection. א המכשיר microinjection המשלבת חלקים לספירה. לחץ כאן כדי להציג דמות גדולה .
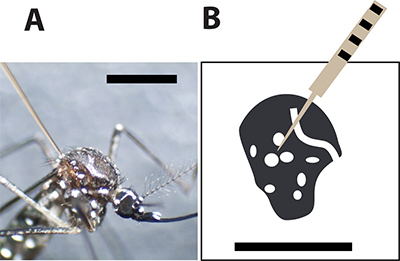
איור 3. יתוש אופטימלית הזרקת באתר. א נקבה Aedes aegypti יתושים מוזרק באמצעות מחט זכוכית נימי בין קשקשים גדולים על החזה. הבר השחור מצביע על 1 מ"מ להשוואה גודל. -B ציור של החזה הנשי יתושים ואת כתמים לבנים מייצגים את הכף לבנות שלד יתושים. מחט הזריקה צריכה פירס יתוש בין הנקודות כדי למזער את שיעור התמותה במהלך ההזרקה.
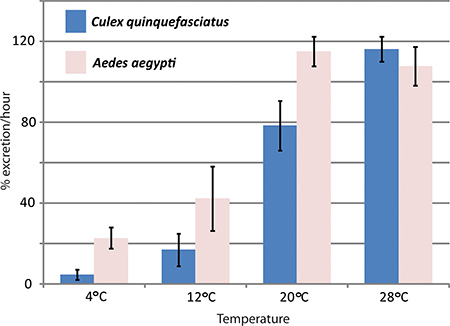
באיור 4. ההשפעות של טמפרהture על Culex quinquefasciatus ו diuresis Aedes aegypti. assay diuresis בוצעה עם שני מינים של יתושים, Aedes aegypti ו Culex quinquefasciatus, בטמפרטורות שונות. שיעור הפרשת במהלך השעה הראשונה לאחר ההזרקה ניתנת אחוזים.
| קבוצה | טרה (ז) | לא מוזרק (ז) | לאחר ההזרקה (ז) | 1h הודעה הזרקה (ז) | המשקל הממוצע (מ"ג) | הסכום הזריק (Μl) | הסכום מופרש (Μl) | % מופרש |
| 1 | 7.5938 | 7.6057 | 7.6104 | 7.6096 | 2.38 | 0.94 | 0.16 | 17.0 |
| 2 | 7.8252 | 7.8349 | 7.8415 | 7.8403 | 1.94 | 1.32 | 0.24 | 18.2 |
| 3 | 7.8896 | 7.9026 | 7.9077 | 7.906 | 2.6 | 1.02 | 0.34 | 33.3 |
1. לוח Aedes aegypti ב assay תוצאות ב vivo diuresis. הנתונים הגולמיים ב assay diuresis vivo הופיע עם Aedes aegypti נקבה יתושים ב 4 ° C.
Discussion
פרוטוקול RNAi משמש פותחה במעבדה של אלכסנדר Raikhel באוניברסיטת קליפורניה בריברסייד 6,7, והוא דומה הפרוטוקול שפורסם על ידי Garver ו Dimopoulos 4. הגישה הניסיונית המוצגת פרוטוקול הווידאו הזאת יכולה לשמש כדי לחקור גנים המעורבים diuresis חרק בסביבה vivo. איברי ההפרשה של חרק?...
Disclosures
אין לנו מה למסור.
Acknowledgements
המחברים מודים ויקטוריה קרפנטר להערות ביקורתיות שלה של פרוטוקול זה.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב או ציוד | חברה | מספר קטלוגי | תגובות |
| MEGAscript T7 ערכת תפוקה גבוהה | Ambion, Inc | AM1334 | |
| PBS חיץ | Sigma-Aldrich | P4417 | |
| צינורות פלסטיק | הספק המקומי | PVC | |
| 1 מ"ל פלסטיק פיפטה עצה | VWR | 83007-376 | כחול עצה |
| 1 מ"ל במזרק | בקטון, דיקינסון החברה | 309602 | |
| מספרים | הספק המקומי | ||
| מחט מתכת | קרוליינה ביולוגיות | 654307 | גודל 5 |
| לטוס כרית | Genesee מדעי | 789060 | |
| סוללות w / אוסף aspirator בקבוקון | UPMA Labs | IPMM 2000 | |
| עצה מלקחיים עדינים | Precision של מכשירים בעולם | 14095 | |
| זכוכית מחטים נימי | Precision של מכשירים בעולם | 1B200-6 | |
| דיסקציה סטריאו מיקרוסקופ | Leica Microsystems | S6D | |
| דיוק אנליטי איזון | Mettler טולדו | AB54S | |
| סוכרוז | Sigma-Aldrich | 84097 | |
| אחד ליטר בשעווה כוסות קרטון מסודרים | הספק המקומי | מרק כוסות שיוצרו | |
| קווי רשת | הספק המקומי | זבוב פלסטיק גזה |
References
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved