A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מכרסמים כירורגיה Stereotaxic ועל צער בעלי חיים שיפורים תוצאה של ההתנהגות Neuroscience
In This Article
Summary
ניתוח Stereotaxic על מכרסמים מאפשר ניהול ממוקד של תרופות או גירוי חשמלי והקלטות ב ער, התנהגות בעלי חיים. במצגת וידאו זה נדגים חידודים פרוצדורליים האחרונות להליך ארוכת זה כי שיעור ההישרדות משופרת בהצלחה ואובדן מופחת לאחר הניתוח המשקל.
Abstract
ניתוח Stereotaxic להשתלה של cannulae לאזורים ספציפיים במוח במשך עשורים רבים הייתה טכניקה ניסויית מוצלחת מאוד לחקור את ההשפעה של הנוירוטרנסמיטר מניפולציות מקומית מסלולי איתות, חיות ער מתנהג. יתר על כן, stereotaxic השתלת אלקטרודות לגירוי אלקטרו לימודי הקלטה כבר סייעה ההבנה הנוכחית שלנו של neuroplasticity ורשתות המוח מתנהג חיות. ידע הולך וגובר לגבי אופטימיזציה של טכניקות ניתוחיות ב 1-4 מכרסמים, מודעות הציבור לגבי בעלי חיים בנושאים הרווחה חקיקה מחמירים (למשל, הוראה 2010 האיחוד האירופי על שימוש בחיות מעבדה 5) תתבקש לנו לחדד אלה פעולות כירורגיות, במיוחד ביחס ליישום נהלים חדשים עבור תוספת חמצן ניטור רציף של חמצון הדם וקצב הלב במהלך הניתוח רמות, כמו גםמציגה פרוטוקול סטנדרטי עבור טיפול לאחר ניתוח. התצפיות שלנו מראות כי שינויים אלה הביאו שיעור ההישרדות המוגברת שיפור במצב הכללי של בעלי החיים לאחר הניתוח (ירידה במשקל למשל פחות חיה יותר פעיל). זו מצגת וידאו יציג את פרוצדורות כללי מעורבים בסוג זה של ניתוח stereotaxic עם תשומת לב מיוחדת מספר שינויים שלנו. נדגים אלה ניתוחים אצל חולדות, אבל ניתן גם לבצע סוג זה של ניתוח בעכברים או בחיות מעבדה קטנות באמצעות מתאמים מיוחדים עבור המנגנון stereotaxic 6.
Protocol
הערה: שיטות חיטוי צריכים להיות מועסקים במהלך ההליך כולו. כל המכשירים והחומרים (כותנה שקצהו מטליות, גזה, וכו ') אשר ישמשו במהלך הניתוח צריך להיות מעוקר על ידי מעוקר. מסכה כירורגית, מצנפת שיער וכפפות סטריליות צריך להיות משוחק. אזור העבודה מנגנון stereotaxic יש לנקות ביסודיות, ולחטא עם פתרון אתנול 70%.
1. טרום ניתוחית נהלים
- הגדרת מנגנון stereotaxic ואת כל החומרים הדרושים. טרום לחמם את כרית החימום.
- מניחים את צינורית התמיכה שלה לבדוק אם היא ישרה.
- הפעל את מערכת הגז - תערובת של אוויר וחמצן הסביבה (30-35% של תזרים בסך הכל צריך להיות חמצן).
- לשקול את העכברוש ולנהל את ההרדמה. אנחנו משתמשים בתערובת של קטמין (37.5 מ"ג / ק"ג) ו dexmedetomidine (0.25 מ"ג / ק"ג) מוזרק מתחת לעור. בפרוטוקולים הרדמה שונים, לראות Flecknell 4 ו Hellebrekers et al. 7.
- אחרי העכברוש איבד את הכרתו, לגלח את אזור הראש הולך מן האוזניים רק בין העיניים עם סכין גילוח חשמלי.
- מניחים את החולדה על כרית חימום, עם האף שלה מול צינורות האוויר. השתמש oximeter על מנת להבטיח כי החולדה יש דם מספקת רמת חמצון (לא צריך טיפה <90%). אנא עקוב אחר הוראות היצרן לשימוש נאות של הציוד.
- החל קרם עיניים (Duratears Z, Alcon) על קרניות הן כדי למנוע התייבשות.
- בדוק רפלקסים של עכברוש (זנב רפלקס או הבוהן קמצוץ רפלקס, כפי שמודגם Walantus et al. 8) על מנת להבטיח כי הוא מורדם כראוי. אם החולדה ממשיכה להראות רפלקסים חזקה, תוספת של הרדמה עלול להיות נחוץ.
- אם לא רפלקס הבוהן קמצוץ מוצג, במקום חולדה במנגנון stereotaxic, להתאים את הסורגים האוזן, כך שזה מראה קריאה שווה משני הצדדים, ומניחים שוב את צינור האוויר מול החיהעל ידי לתקן את זה עם סרגל האף. בדוק שוב אם החולדה מראה חמצון בדם ברמה של 90% ומעלה. אם לא, להתאים גם את צינורות, להביא אותו קרוב יותר אל האף, או להגביר את זרימת החמצן. לנטר את רמת חמצון הדם וקצב הלב במהלך הניתוח.
- לפקח באופן רציף בטמפרטורה של החולדה עם מדחום רקטלי (מחובר מועדף על כרית חימום) ולהקליט את הערכים בתחילת ובסוף הניתוח. התאם את כרית חימום או להשתמש בשמיכה כדי לשמור על טמפרטורת גוף של 37.5-38.5 ° C.
2. כירורגיה
- להזריק משכך כאבים. אנחנו משתמשים ממשל יחיד פרי הניתוח של carprofen (4.0-5.0 מ"ג / ק"ג, תת עורי). עבור פרוטוקולים כאבים שונים, לראות Hellebrekers et al. 7.
- נקו את האזור המגולח של tהוא העור מן המרכז אל ההיקף שיער שלוש פעמים בחומר חיטוי (למשל, chlorhexidine 0.5%) ו מקומי להזריק תערובת של לידוקאין (20 מ"ג / מ"ל) ואדרנלין (5 מ"ג / מ"ל) עבור vasoconstriction הרדמה מקומית (כדי למנוע דימום יתר).
- בצע חתך קדמי, אחורי של כ - 2.5 ס"מ על קו האמצע של הקרקפת, קורה מבין עיניו עד האחורי של האוזניים. השתמש 4-6 מלחציים בולדוג לצבוט את העור כדי לשמור על החתך פתוח. הסר את כל רקמת מקשר עם מרית ו / או כותנה מטליות לנקות את השטח על מנת לחשוף את פני הגולגולת.
- בדוק אם הראש הוא רמה: ראשית, למצוא Lambda והמקום צינורית מדריך בדיוק על מיקום זה, נוגע בגולגולת. הקלט את לתאם dorso-הגחון. בשלב הבא, במקום את הצינורית מדריך בדיוק על גבחת, נוגע בגולגולת, ולהקליט לתאם dorso-הגחון שלה. אלה שתי קואורדינטות צריך להיות זהה. אם ההבדל הוא> 0.3 מ"מ, להתאים את סרגל האף לתקן אותה.
- Mהאייק שני חורים קטנים לתיקון את הברגים בגולגולת באמצעות מקדח יד מעוקרים (אחד כ 5 מ"מ קדמית למיקום צינורית באחת האונות ואת השני 5 מ"מ האחורי למיקום צינורית בחצי הכדור הנגדי). מקום שני ברגים סטרילי לתוך החורים האלה עד שהם מעוגנים היטב, בלי להיות מוכנס כהלכה לתוך הגולגולת.
- עם צינורית מדריך להציב בדיוק גבחת, להקליט את הקואורדינטות קדמית אחורית ו-לרוחב. מיקום נכון של מיקום הצינורית מדריך לכל איזור במוח יכול להיות מחושב על ידי הוספה או הפחתה של גבחת, בעזרת אטלס stereotaxic 9-11.
- מקם את הצינורית מדריך במיקום הנכון, מעט נוגע בגולגולת. הקלט את לתאם dorso-הגחון. עבור מיקום הצינורית הבילטראליים, למצוא הבא למיקום צינורית בחצי הכדור השני, שוב להקליט את לתאם dorso-הגחון. קואורדינטות שניהם צריכים להיות זהים (או שונים <0.3 מ"מ).
- סמן את המיקומים צינורית בגולגולת בעיפרון סטרילית, עם הקודח יד, לעשות את החורים בר, לבדוק את הגודל ואת המיקום הנכון בעזרת המדריך את הצינורית. לאחר החורים נעשים, להשתמש במחט סטרילית בעדינות האגרוף קרומי המוח, כדי לאפשר החדרה של צינורית בלא הפרעה.
- מניחים את צינורית לתוך החור הראשון נמוך זה בזהירות עד שהוא מגיע לתאם הגחון הסופי. הכנת מלט שיניים בנדיבות ולהחיל אותו סביב צינורית אחד או שניהם ברגים כדי לתקן את צינורית. המתן עד הבטון התייבש לחלוטין. לאחר מכן, להסיר בזהירות את התמיכה הצינורית על ידי סיבוב dorso-הגחון כלפי מעלה הבר.
- הנח את השני לתוך צינורית התמיכה עבור למיקום צינורית בחצי הכדור השני. מניחים את צינורית לתוך החור וחזור על השלב הקודם. מכסים את הברגים משטח גדול של cannulas במלט, ולפני בטון יבש, להסיר כל עודף מהעור.
- הזרק חם (~ 37 ° C) מלוחים סטרילית (~ 10 מ"ל / ק"ג, sc) כדי להבטיח להחזרת נוזלים.
- אחרי המלט התייבש לחלוטין, להוציא את צינורית התמיכה ומקום סיכה סטרילי לתוך צינורית כל כדי למנוע חסימה.
- נקו את אזור הפצע עם תמיסת מלח סטרילית תפר הקדמי האחורי של הפצע.
- הסר את החיה מן המנגנון stereotaxic, החלפת צנרת הגז מול האף שלה. המשך לעקוב אחר רמת ריווי חמצן טמפרטורת הגוף.
- אם הרדמה בזריקות עם dexmedetomidine משמש, להזריק atipamezole אנטגוניסט שלה (0.25 מ"ג / ק"ג, sc) ולחכות עד שהחיה מתעוררת (בערך 5 דקות).
- מניחים את חולדה לכלוב ההתאוששות. כדי למנוע היפותרמיה, במקום כלוב באינקובטור ב 28 מעלות צלזיוס או על כרית חימום במקום שבו ניתן לצפות בבעלי חיים למשך שעה אחת לפחות, לפני שחזר אותו לחדר ביבר.
3. לאחר טיפול כירורגי
- במהלך הראשון 4 ימים לאחר הניתוח, לעקוב אחר ההתאוששות של החולדה על ידי שמירה על רישום יומי של משקל ותצפיות אחר בדבר מצבו של בעל החיים ב יומני העבודה במעבדה או "רווחת בעלי החיים יומנים".
- בעלי חיים המראים סימנים גלויים של זיהום מחלה, אובדן את הפצע, משקל גוף או סימנים אחרים של טיפול מיוחד מופחת רווחה חייב לעבור: למשל מנה נוספת של משככי כאבים כדי למזער את הכאב שלאחר הניתוח, תערובת של אבקת מזון ומים בנוסף לרמת האוכל כדי לעורר את התיאבון של החולדה, ו / או הזרקה תת עורית של תמיסת מלח כדי לתמוך להחזרת נוזלים.
- אם החולדה לא מראה שום שיפור לאחר התערבויות אלה, או אובדן של משקל גוף> 15% (לעומת משקל ניתוח מראש), להקריב את חיה עם מנת יתר של חומר הרדמה (הומני נקודת הסיום).
- חולדות בדרך כלל צריך לשחזר לפחות 7 ימים לפני תחילתו של ניסויים התנהגותיים.
4. נציג תוצאות
"jove_content> כדי לקבוע אם שינויים שונים הליך כירורגי שלנו, במיוחד ביחס תוספת חמצן ניטור רציף של החמצון בדם, קצב הלב ואת טמפרטורת הגוף, משופרת ההישרדות של בעלי חיים ושיפור המצב הכללי שלה לאחר הניתוח, השווינו את אי - שיעור הישרדות של 20 קבוצות של בעלי חיים (בהיקף של 20 חולדות כל אחת) כי עבר ניתוח לאחר שביצענו שינויים אלה עם שיעור ההישרדות הלא של 24 קבוצות (20 חולדות כל אחת) פעולה עם הפרוטוקול הסטנדרטי. כפי שמוצג באיור 1 א שיעור ההישרדות הלא צומצם משמעותית במדגם של קבוצות כי הופעל עם פרוטוקול שונה (p <0.05; Mann-Whitney U מבחן, שני זנב). יתר על כן, כפי שמוצג באיור 1b, לאחר ניתוח הרזיה של חולדות פעולה עם פרוטוקול שונה גם הקטינה באופן משמעותי בהשוואה לזו של חולדות פעולה עם ההליך הסטנדרטי (שלאחר הניתוח יום 1: P <0.05; שלאחר הניתוח יום 2: P <0.01; שלאחר הניתוח יום 3: P = 0.17; סטודנט t-בדיקות).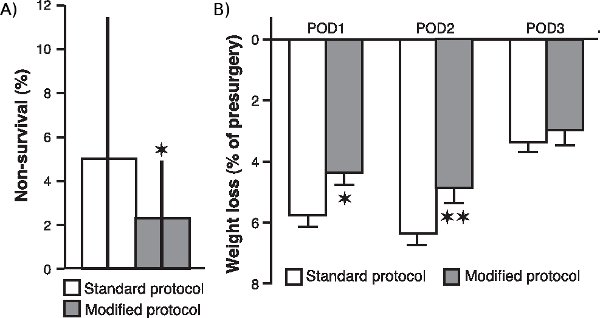
באיור 1. השפעת שינויים כירורגית על שיעור אי - הישרדות לאחר ניתוח הרזיה. (א) ללא שיעור ההישרדות של חולדות פעולה עם פרוטוקול שונה, בהשוואה לזו של חולדות פעולה עם הפרוטוקול הסטנדרטי. שיעור אי - הישרדות (חציון ± interquartile טווחי) היה מחושב כאחוז של חולדות, לכל קבוצה של 20 חולדות, שלא שרד ניתוח. * P <0.05, Mann-Whitney U במבחן דו זנבי (n = 20 המחזורים עבור הפרוטוקול שונה ו 24 המחזורים עבור הפרוטוקול הסטנדרטי). (ב) ירידה במשקל (ממוצע ± SEM כאחוז משקל ניתוח מראש) במהלך הראשון (POD1), השני (POD2) והשלישי (POD3) ביום שלאחר הניתוח. * P <0.05, ** P <0.01, סטודנטים מבחן t (n = 60 בכל קבוצה).
Discussion
המטרה העיקרית של המצגת הווידאו הזאת היא להכיר מדעני מוח התנהגותי עם עקרונות היסוד של הניתוח stereotaxic. חוקרים שכבר נמצאים בביצוע הניתוח stereotaxic עשוי ליהנות גם וידאו ורואים כמה חידודים פרוצדורליים לשימוש במעבדה שלהם. ידע הולך וגובר לגבי אופטימיזציה של טכניקות ניתוחיות
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים מודים לד"ר Gerrits פיטר את הרישומים בשימוש בווידאו.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | ||
| אלכוהול 70% | VWR | ||
| Antisedan (atipamezole) | אוריון | ||
| אטרופין סולפט 0,5 | Pharmachemie BV | ||
| בולדוג עוצר דמום מהדק | Aesculap | ||
| Cannulas | רכיב אספקת ושות | ||
| Chlorhexidine 0.5% | AppepPharma | ||
| אבקת ניקוי | Alconox | ||
| כותנה מקלות | הרטמן BV | ||
| Dexdomitor (dexmedetomidine) | אוריון | ||
| תרגיל | Dremel 8000 | ||
| Duratears Z | אלקון | ||
| Durogrip Naaldvoerder לשוחח 130mm | Aesculap | ||
| Durotip Fijne schaar ret.sp / רחוב 110 מ"מ | Aesculap | ||
| גזה | Medicomp (5x5) | ||
| כרית חימום | הרווארד Apparatus | ||
| סיכות חרקים (stylets) | Entosphinx (צ Republik) | ||
| קטמין 10% (קטמין) | Alfasan | ||
| Micro-הלסטד ישר קצה | Aesculap-הווטרינר | ||
| Molinea | הרטמן BV | ||
| NaCl 0,9% | בקסטר | ||
| מחטים (25 גרם) | Terumo | ||
| Oximeter | עידן מכשירים, Inc | ||
| Pentobarbital | בתי המרקחת של UMCG | ||
| Rimadyl | פייזר | ||
| איזמל להב מס '23 | סוואן מורטון | ||
| Scalpelholder ע"נ. 4 133 מ"מ | Aesculap | ||
| בורג הנהג | חומרה קונבנציונאלי Store | ||
| סימפלקס מהיר (מלט שיניים) | Kemdent | ||
| גולגולת ברגים | רכיב אספקת ושות | ||
| מרית | VWR | ||
| Spongestan מיוחד | ג'ונסון אנד ג'ונסון | ||
| Stereotacts | Kopf מכשירים | ||
| מלקחיים כירורגי 100mm | Aesculap | ||
| תפר חומר Safil 5 / 0 | Aesculap | ||
| מזרק 10 מ"ל | Omnifix | ||
| מזרק 1ml | Terumo | ||
| מזרק 5 מ"ל | Omnifix | ||
| Xylocaine (לידוקאין / אדרנלין) | Astra Zeneca |
References
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress?. Altern. Lab Anim. 33, 119-127 (2005).
- Stokes, E. L., Flecknell, P. A., Richardson, C. A. Reported analgesic and anaesthetic administration to rodents undergoing experimental surgical procedures. Lab Anim. 43, 149-154 (2009).
- Flecknell, P. A. . Laboratory Animal Anaesthesia - A Practical Introduction for Research Workers and Technicians. , (2009).
- . DIRECTIVE 2010/63/EU OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , (2010).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880-e880 (2008).
- Hellebrekers, L. J., Booij, L. H. D. J., Flecknell, P. A., Van Zutphen, L. F. M., Baumans, V., Beynen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. (6), e236-e236 (2007).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1986).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Swanson, L. W. . Brain Maps: Structure of the Rat Brain. , (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved