A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
לדוגמא הכנה של
In This Article
Summary
הפרופיל של metabolomic Mycobacterium tuberculosis נקבע לאחר צמיחה בתרבויות ציר מרק. תנאים יכולים להיות מגוונים כדי לבדוק את ההשפעות של תוספי תזונה, חמצון, וסוכנים נגד שחפת על הפרופיל המטבולי של מיקרואורגניזם זה. נוהל להכנת תמצית היא ישים עבור שניהם 1D 1 H ו2D 1 H- 13 C ניתוחי NMR.
Abstract
Mycobacterium tuberculosis הוא אחד גורמים עיקריים לתמותה בבני אדם בקנה מידה גלובלי. ההופעה של שניהם רבים-(MDR) ונרחבים-(XDR) זנים עמידים לתרופות מאיימת להרוס את תהליך בקרת מחלות נוכחיות. לפיכך, יש צורך דחוף לפתח תרופות וחיסונים שיעילים יותר מאלה הזמינים כיום. הגנום של מ ' שחפת ידועה כבר יותר מ 10 שנים, עדיין קיימים פערים בידע חשוב של תפקוד גן והחיוניות שלנו. מחקרים רבים בשימוש מאז ניתוח ביטוי גנים בשתי רמות transcriptomic וproteomic כדי לקבוע את ההשפעות של תרופות, חמצון, ותנאי גידול על הדפוסים הגלובליים של ביטוי גנים. סופו של דבר, התשובה הסופית של שינויים אלה בא לידי ביטוי בהרכב המטבולי של החיידק כולל כמה אלף כימיקלי משקל מולקולריים קטנים. השוואה בין פרופילים מטבוליים מהסוג פרוע וזנים מוטנטים, גם ללא טיפול או treated עם תרופה מסוימת, יכול למעשה מאפשר זיהוי המטרה, ועלול להוביל להתפתחות של מעכבים חדשים עם פעילות אנטי שחפת. כמו כן, את ההשפעות של שני תנאים או יותר על metabolome יכולות גם להיות מוערכות. תהודה מגנטית גרעינית (NMR) היא טכנולוגיה רבה עצמה המשמשת לזיהוי ולכמת ביניים מטבוליים. בפרוטוקול זה, נהלים להכנתו של מ ' תמציות סלולריות חפת לניתוח metabolomic NMR מתוארות. תרביות תאים גדלות בתנאים מתאימים ו3 בלימה ברמת בטיחות הביולוגית הנדרשת, 1 נקטפו, ונתונים לתמוגה מכאנית תוך שמירה על טמפרטורות נמוכות על מנת למקסם את השימור של מטבוליטים. lysates הסלולרי הם התאוששו, מסוננים מעוקרים, ומאוחסנים בטמפרטורות נמוכות במיוחד. Aliquots מתמציות תאים אלה מצופים באגר 7H9 מידלברוק ליחידות מושבה להרכיב כדי לוודא היעדר תאי קיימא. לאחר חודשים של דגירה ב 37 ° C, אם לא viמושבות מסוגלות הם נצפו, דגימות יוסרו ממתקן הבלימה לעיבוד במורד זרם. תמציות הנן lyophilized, resuspended במאגר deuterated ומוזרק במכשיר NMR, לכידת נתונים ספקטרוסקופיות אז זה נתון לניתוח סטטיסטי. ההליכים המתוארים יכולים להיות מיושמים גם לממד יחיד-(1D) H NMR 1 ודו ממדי 1 (2D) H-13 C ניתוחי NMR. מתודולוגיה זו מספקת זיהוי אמין יותר קטן משקל מולקולרי מטבוליט וניתוחים כמותיים אמינים ורגישים יותר של יצירות מטבוליות תמצית סלולרית מאשר שיטות chromatographic. וריאציות של ההליך מתוארת בעקבות צעד תמוגה התא יכול גם להיות מותאם לניתוח proteomic מקביל.
Protocol
1. טקסט פרוטוקול
פרוטוקול זה מדגיש את ההסתגלות של המתודולוגיה NMR למ ' שחפת (סוכן שלישי כיתה). לכן, biosafety רמה 3 (BSL3) נהלים צריכים להיות מלווה בעת ביצוע מ ' מחקר שחפת במעבדה מוסמכת מדי שנה. חשיפה לאירוסולים מעבדה שנוצרה היא הסיכון החשוב ביותר שנתקל בו כוח אדם שעובד עם מיקרואורגניזמים אלה. ההליכים הבאים מתנהלים במוסד שלנו ווריאציות יכולות להתקיים על בסיס ההמלצות של ועדת הבטיחות הביולוגית המוסדית. אנשים נפוצים ציוד מגן יכללו חליפת Tyvek, כובע נפוח, נעליים, הנשמת N95, הגנה על עין, שרוולים, וזוג כפפות כפול של nitrile. עבודה שיש בי מ ' תרבויות שחפת ו / או מניפולציות עם פתוח מ ' שחפת מכולות מתבצעות בA2 הסוג או ארון בטיחות ביולוגי B2. נייר סופג מכוסה פלסטיק מונח על working פני שטח. כל החומרים / הציוד להיות מסולק או הוסרו מהמתקן חייבים להיות ממוקמים בשתי שקיות Biohazard ולחטא על ידי מעוקר. משטחי עבודה וציוד מנוצל בתוך הארון (FastPrep-24 תמוגה homogenizer, ספקטרופוטומטר, דלי עם קרח, וכו ') יש לחטא לאחר כל ישיבת עבודה עם Amphyl% 1 (tuberculocidal, bactericidal, קוטל פטריות, וvirucidal סוכן). מ' תרבויות שחפת חייבות להיות ממוקמות מתחת לבלימה כפולה לתחבורה לציוד גדול הממוקמים מחוץ לארון הבטיחות הביולוגי כגון מקפיאים, אינקובטורים, צנטריפוגות, ומקררים. צנטריפוגה מתנהלת עם כוסות בטיחות סגורות וצינורות מובילים בורג O-טבעת. לניתוח נוסף, מחוץ למעבדת BSL3, תמציות תא חינם מסוננות דרך מסנן של 0.2 מיקרומטר או חום מיקרואורגניזמים נהרג ב 95 מעלות צלזיוס למשך 15 דקות. 2 דוגמאות מצופות לאמת היעדר יחידות מושבה להרכיב לפני ההסרה מבלימה.
- העברת 110 מ"ל של 7H9 תקשורת מלאה המכילה מידלברוק polysorbate 80 (Tween 80 כדי למנוע יצירת גושים) מרק (MADC-TW) או בינוני מתאימה לבקבוק 250 מ"ל Erlenmeyer. תרבויות שלושה עותקים גדלות באופן שגרתי לכל מצב בעת שימוש C-13 מטבוליטים, ועשר תרבויות זהות גדלות לפרופיל 1D H 1 NMR. לשני תנאים (למשל, עם ובלי תוספת של תרופה), נפח כפול של תרבות ללשכפל ניתן לגדל והתפצלו לשתי תרבויות זהות. כל המתכונים המגיבים ופתרון מסופקים בסוף הפרוטוקול.
- לחסן מרק עם 0.150 מ"ל של מ ' 50% מניות גליצרול חפת (תאפשר להפשיר על קרח). ראה באור 1 להלן.
- בואו לגדול התרבות ב 37 ° C רועד ב 100 סל"ד במשך כ 6 ימים (OD 600 0.6-0.8). ראה באור 2 להלן.
- אם לא ניתן טיפול אנטיביוטי, תוספות או טיפולים אלטרנטיביות אחרים, יש צורך, התרבויות מוכנות לאיסוף. אם טיפולים משמשים, המשךישירות לשלב 5. הסר מדגם 0.5 מ"ל מכל בקבוק, להעביר לצינור microcentrifuge ומקום ב 4 ° C לטיטרציה התרבות ובקרת איכות: בדיקות זיהום, ניתוח פנוטיפית, בדיקות PCR. ראה באור 3 להלן. בשלב זה, המשך לשלב 6.
- הסר צלוחיות מייקרו ולבצע את הטיפול הרצוי (למשל, להוסיף תרופה או מטבוליט). מקום צלוחיות גב במערבב ולדגור לתקופה נוספת (למשל, 6-18 שעות). בסופו של שלב זה, תיקח עוד aliquot מ"ל 1.0 ולקבוע OD 600. הסר מדגם 0.5 מ"ל מכל בקבוק, להעביר לצינור microcentrifuge ומקום ב 4 ° C לטיטרציה התרבות ובקרת איכות.
- תרבויות מקום על קרח למשך 5 דקות. לאחר שלב זה, לצאת מתאים על קרח בכל הפרוטוקול שנותר שלם. תרבויות קציר על ידי צנטריפוגה ב2000 XG ו4 מעלות צלזיוס למשך 15 דקות ב 50 צינורות מ"ל באמצעות צנטריפוגות benchtop. לכל תרבות תדרוש ארבעה צינורות עם 25 מ"ל כל אחת (סך של 100 מ"ל נדרש לקבל אות לרעש הולם עבור 1 2D H-13 C ניסויי NMR, שבו רק 50 מ"ל לתרבות נדרש לניסויי 1D 1 H NMR).
- שטוף את כל תא גלולת שתי פעמים עם DDH 2 O קר כקרח (כ 15 מ"ל בפעם הראשונה ו10 מ"ל הפעם השנייה) על ידי פרמטרי צנטריפוגה שתוארו לעיל. לכביסה השנייה, לשלב את 10 aliquots המ"ל לאותו צינור לפני ספינינג. Resuspend תא הגלול בנפח סופי של 1.0 המ"ל DDH 2 O (צריך להתאים לנפח כדורי תא). אם השעית תא בודדה ללא clumping היא רצויה בשלב זה, תאים ניתן sonicated בקצרה ו / או עברו דרך מחט 27-מד שלוש פעמים. לחלופין, תא הגלולה אפשר להקפיא ב-80 ° C ומאוחסנת עד עיבוד נוסף. במקרה האחרון, כדורים קפואים מופשרים על קרח לפני resuspension. Resuspend את הכדורים הסלולריים בנפח סופי של 1.0 המ"ל DDH 2 O כאמור לעיל.
- Transfer השעית תא המ"ל 1.0 עד 2.0 מיליליטר צינור בורג מכסה המכיל Lysing מטריקס B (0.1 מ"מ תחומי סיליקה). הנח homogenizer FastPrep-24 תמוגה בתוך ארון הבטיחות הביולוגית. שים את הדגימות לבעל המדגם, אבטחת השמירה דברה צלחת על חלק עליון של הצינור. לעבד את הדגימות ל60 שניות בhomogenizer בהגדרת מהירות של 6 מטר / שני.
- לסובב את הדגימות בmicrocentrifuge ב15000 XG ו4 מעלות צלזיוס למשך 10 דקות לפסולת תא גלולה ותאים שלמים.
- הסר מדגם supernatant ועובר דרך מסנן מזרק (0.2 מיקרומטר) לתוך צינור סטרילי. 0.1 מיליליטר צלחת המדגם (או כל חלק נציג של המדגם, כמו למשל 10%) על אגר MADC כדי לוודא שאין תאי קיימא. חוקרים יכולים גם לערוך שלב סינון אחד או יותר ו / או לאמת את הנוכחות של תאי קיימא בתמציות באמצעות נהלי מכתים חי מתים כדי למנוע או לזהות כל חששות biosafety פוטנציאליות. להקפיא דגימות באמבט קרח אתנול יבש לאחסוןב-80 מעלות צלזיוס עד שהם מוכנים לlyophilized ומעובד במתקן לתמ"ג.
- לאחר 2 חודשים, לבדוק צלחות כדי לוודא היעדר יחידות מושבה להרכיב. אם לא CFU של מצוי, ניתן לקחת דגימות ממעבדת BSL3. ניתוח נוסף בוצע במתקן NMR סטנדרטי, אשר בדרך כלל משמש מרובי משתמשים ופועל תחת בלימה אין דרישות ספציפיות.
- Lyophilize את הדגימות ליובש, אז resuspend ב0.7 מ"ל של חיץ והעברה לצינור microcentrifuge NMR. צנטריפוגה ל3 דקות ב13000 x גרם. הסר 0.6 מ"ל והעברה לצינור NMR 5 מ"מ. לחלופין, דגימות lyophilized יכולות תישלחנה למתקן חיצוני כדגימות רגילות שאינן ביולוגיות מסוכנות.
- NMR נתונים נאספים באופן מיידי. למרות כל אמצעי הזהירות, אנזימים פעילים, עדיין עשויים להיות נוכחים והמדגם הוא בדרך כלל לא יציב לפרקי זמן ארוכים. שינויים בספקטרום NMR הם מורגשים כאשר הדגימות נותרות בחוץ בטמפרטורת חדר או ב4 מעלות צלזיוס למשך מ 'בצר מ 1 שבוע. כמו כן, איסוף נתוני תמ"ג הוא נע בין תרבויות שלא טופלו ותרופה שטופלו בו, הם דוגמאות שנבחרו באקראי מכל קטגוריה. הדבר מונע הטיות מיותר כי קטגוריה מסוימת היה עיכוב עוד לפני ספקטרום NMR נאסף. הטיה בנתונים תתרחש אם ספקטרום NMR לכל דגימות שלא טופלו נאספו ראשון, ולאחר מכן על ידי דגימות הסמים שטופלו. אם הדגימות לא מסוגלות להיות מנותח באופן מיידי על ידי תמ"ג, הדגימות צריכות להיות מאוחסנות במיליליטר אפנדורף צינורות 1 ב -80 ° C.
- לאחר שהוא מכניס את הדגימות לBACS-120 מדגם מחליף, כיול מכשיר, הכולל כמה צעדים שיגרתי כגון נעילה, פחית, מנגינה, ואופטימיזציה של ° אורך הפולס 90, נדרש על מנת למקסם את איכות התוצאות. דוגמה אחת משמשת לכיול 90 ° אורך דופק ולכוון את המכשיר לדגימות שנותרו. נעילה, shimming, ואיסוף נתוני תמ"ג לכל מדגם הוא usin האוטומטיגרם ICONNMR וgradshim.
- ספקטרום 1D H 1 NMR הוא נאסף באמצעות רצף דופק zgesgp Bruker עם דיכוי מים באמצעות פיסול עירור. נקודות של 32K נתונים עם רוחב סריקה של 5482.5Hz, 128 סריקות, ו16 סריקות דמה נמצאים בשימוש. 1 ספקטרום 2D H-13 C HSQC נאסף באמצעות רצף דופק hsqcetgp ברוקר. סך של 2048 נקודתי נתונים עם רוחב סריקה של 5000.0 הרץ נאסף לאורך ממד H הישירה 1, ו64 נקודתי נתונים עם רוחב סריקה של 18,864.9 רץ לאורך ממד C העקיף 13. הספקטרום נאסף עם 128 סריקות ו16 סריקות דמה לקבל אות לרעש טובה.
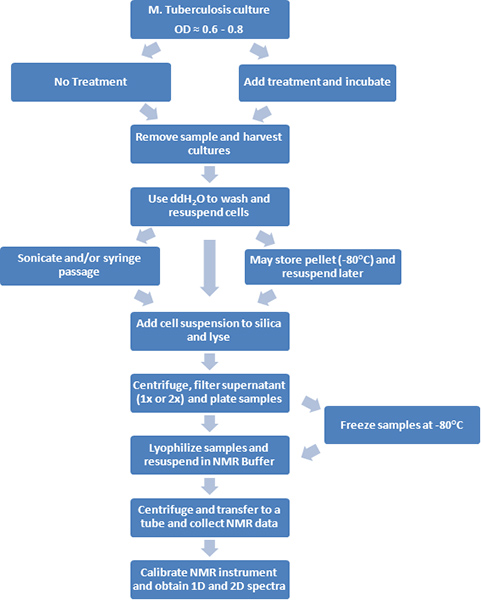
איור 1. תרשים זרימה של הפרוצדורות מתואר.
NMR חיץ
פתרון מלאי חובב פוספט אשלגן 50 מ"מימאה עם TMSP מיקרומטר 50:
- 2.17 הגר 'K 2 HPO 4 (אשלגן פוספט dibasic)
- 1.70 גרם KH 2 PO 4 (אשלגן פוספט monobasic)
- 7.86 מ"ג נתרן-3-Trimethylsilylpropionate (TMSP-2-D ,2,3,3 4 (ד ', 98%))
- מתמוסס ב500 מ"ל של "100%" D 2 O
- הפתרון הסופי צריך להיות ב-pH 7.2 (שלא תוקן)
MADC-TW או MOADC-TW (L 1)
- 4.7 גרם מידלברוק 7H9 מרק בסיס
- 900 המ"ל DDH 2 O
- 2 המ"ל גליצרול
- מערבב את הרכיבים והחיטוי ל25 דקות. נוזל קר לגעת ולהוסיף את הפתרונים הבאים:
- 100 המ"ל ADC עת הכנת OADC MADC או 100 מ"ל בעת הכנת MOADC
- 2.5 מ"ל 20% Tween 80 (לחלופין, 1 מ"ל של Tyloxapol 20% שאינם metabolizable)
- 10 מ"ל 1% cycloheximide
ADC (L 1)
- 20 גרם D (+)-גלוקוז
- 50 גרם שבר BSAV
- 8.5 גרם NaCl
- 800 המ"ל DDH 2 O
- ממס יחד, להתאים את עוצמת קול ל1 ליטר ולחטא עם 0.2 מיקרומטר מסנן. לאחסן ב 4 ° C.
לחלופין, להכין OADC (1 ליטר), מוסיף את כל המרכיבים המפורטים לעיל בתוספת 50 מ"ל של 1% חומצה אולאית (מתכון בהמשך הופך יצווה 250 מ"ל). ממס יחד, להתאים את עוצמת קול ל1 ליטר ולחטא עם 0.2 מיקרומטר מסנן. בקבוק צריך להיות עטוף ברדיד האלומיניום ולאחסן ב 4 ° C.
- חומצה אולאית 2.5 גר '
- 250 המ"ל NaOH 0.2m
- חומצה אולאית הפשרה (מבצר על קירור) על ידי חימום של 55 מעלות צלזיוס למשך 10 דקות ולהוסיף לפתרון וחום NaOH עם הערבוב במשך 60 דקות. חנות בבקבוקי זכוכית סטריליים שהם עטופים ברדיד אלומיניום. בקבוקים חותמים עם parafilm וחנות ב 4 ° C.
אם העדיף, תוכל לרכוש BD BBL מידלברוק ADC המסחרי או OADC עם העשרת catalase.
1% Cycloheximide (100 מ"ל) חזק
- 1 גרם cycloheximide
- 100 המ"ל DDH 2 O
ממס ולחטא עם מסנן 0.2 מיקרומטר. לאחסן ב 4 ° C. זהירות: cycloheximide הוא רעיל כדי לטפל בזהירות מרבית.
20% (v / v) Tween 80 (100 מ"ל)
- 20 המ"ל Tween 80
- 80 המ"ל DDH 2 O
לחלופין, שוקל 20 גרם של Tween 80 (כ 18.9 מ"ל; צפיפות 1.06 גרם / מ"ל), כדי להכין את 20% פתרון w / v. פתרון חום עד 55 מעלות צלזיוס למשך 30 דקות להמסה ולערבב לחלוטין. לעקר נוזלי עם 0.2 מיקרומטר מסנן. אחסן את הפתרון הסופי בטמפרטורת חדר.
20% (v / v) Tyloxapol (100 מ"ל)
- 20 המ"ל Tyloxapol
- 80 המ"ל DDH 2 O
לחלופין, שוקל 20 גרם של Tyloxapol (כ 18.2 מ"ל; צפיפות 1.1 גרם / מ"ל), כדי להכין את 20% פתרון w / v. פתרון חום עד 55 מעלות צלזיוס למשך 30 דקות לdissolve, ולערבב לחלוטין. לעקר נוזלי עם 0.2 מיקרומטר מסנן. אחסן את הפתרון הסופי בטמפרטורת חדר.
שים לב 1: מניות גליצרול של מ ' שחפת מוכנה באמצעות הפרוטוקול הבא.
גרב של מ ' שחפת
- לגדול מ ' שחפת ב50 המ"ל MADC לרוויה (OD 600 = 1.5-2.0) על 37 המעלות צלזיוס בתנאים רועדים (100 סל"ד). בהתאם לעומס, זה ייקח 7-14 ימים.
- ספין דגימות ב2000 XG ב 4 מעלות צלזיוס למשך 15 דקות לתרבות גלולה. הסרת supernatant.
- Resuspend ב 6 מ"ל של גליצרול 50% סטרילי.
- 1.5 מיליליטר aliquot לתוך 4 מבחנות קורנינג קירור ותווית כראוי.
- מייד בקבוקוני הבזק להקפיא אמבטית אתנול / יבשה קרח וחנות ב-80 ° C.
הערה 2: inoculating המתח H37Rv (-80 ° C מניות עד 1.5 שנים) לתוך 70 מ"ל של MADC תקשורת מניבה OD 600 </ תת> של כ -0.6 לאחר 5 ימים של צמיחה על 37 מעלות צלזיוס בתנאים רועדים (100 סל"ד) בInnova 40 אכר.
הערה 3: לבדיקת זיהום התרבות, חוקרים הצליחו לחסן aliquot תרבות על מדיום עשיר סטנדרטי ולאמת היעדר הצמיחה לאחר דגירת הלילה. באופן שגרתי, תרבויות מצופות באגרו MADC להתבונן ולבחון את מורפולוגיה מושבה על ידי מיקרוסקופ שלב ניגוד. אם תרצו, ניתן לאמת תרבויות באמצעות PCR משתמש הוא 6110 פריימרים כמתוארים. 3
2. נציג תוצאות
מדגם שהוא מוכן היטב יניב ספקטרום דומה לזה מתואר באיור 2 NMR. הספקטרום הזה הוא ייצוג של מ ' ברכת שחפת פראית סוג מטבולית. המטבוליטים שזוהו קשורים ישירות או בעקיפין במסלול D-אלאנין. כמו כן, סדר הגודל של עוצמות שיא הוא פרופורציונלי לריכוזי מטבוליט להציגבתמצית התא. לכן שינויים בעוצמות שיא בין תרבויות שלא טופלו, טיפול תרופתי, וזנים מוטנטים יכולים להצביע על הפרעות במטבוליטים ומסלולים מטבוליים. מ ' שחפת 1D H 1 NMR הספקטרום נאסף על ספקטרומטר Bruker Avance 500 MHz מצויד בcryoprobe משולשת תהודה, Z-ציר שיפוע. הספקטרום מכיל CA. 400 פסגות, שממנו היו אפשר לזהות ולכמת 40-50 מטבוליטים, כולל חומצות אמינו, מבשרי נוקליאוטידים, ביניים glycolytic וחומצת לימון. מחליף BACS-120 עם תוכנת דגימת אייקון Bruker שמש כדי להפוך את איסוף נתוני התמ"ג. 1D H 1 NMR הספקטרום נאסף באמצעות פיסול עירור 4 ביעילות להסיר הממס ולשמור על בסיס שטוח, ומבטל כל צורך באוסף בסיסי שעשויה לגרום לממצאים בניתוח שלאחר מכן מנהלת רכיב (PCA) או ניתוח אורתוגונלי החלקי לפחות ריבועי מבחין (OPLS- ד"א). 1ספקטרום ד H 1 NMR נאסף ב 25 ° C עם רוחב ספקטרום של 5482.5 הרץ ונקודתי נתוני 32K. סך של 16 סריקות דמה ו 128 סריקות שמשו כדי להשיג את הספקטרום. תוכנת ACD מעבדות 1D NMR המעבד שמשה לעבד באופן אוטומטי למחצה כל ספקטרום 1D H 1 NMR. הספקטרום היה פורים הפך, בהדרגה, וההפניה לTMSP השיא (0.0 עמודים לדקה). חבילת תוכנת NMRpipe שמשה בנפרד לעבד 2D H 1-13 C NMR הספקטרום ונתחה עם NMRDraw. קובץ נתוני ברוקר FID הוסב ראשון שפורמט קובץ ניתן לזיהוי על ידי NMRpipe ולאחר מכן הקשת הייתה פורה הפכה, השלב תוקן, ואפס מלא. פסגות NMR נצפו בH 1D NMR ספקטרום 1 ו 2D C ספקטרום 1 H-13 NMR מוקצות למטבוליטים ספציפיים באמצעות H 1 ו 13 טולרנסים משמרת כימית C של 0.05 ו 0.50 לדקה, בהתאמה, ומדיסון metabolomics Consortium מסד הנתונים (MMCD ,) 5 BioMagResBank, 6 ומסד Metabolome האנושי. 7 באופן ספציפי, ספקטרום התמ"ג 1D ו 2D הם ידני שיא קטוף בי רשימת השיא של משמרות NMR הכימיים היא לאחר מכן נטענת למאגר Metabolome האנושי. המטבוליטים שזוהו על ידי מסד נתוני Metabolome אדם מוקצים לספקטרום NMR מבוסס על שניהם למקסם את מספר התאמת תהודות NMR ושייך לרשת מטבולים. לכל תרכובת או המטבוליט בדרך כלל יש זוגות CH מרובים ותהודות NMR בהתאם מרובות. לכן, יותר מתהודות NMR אלו שנצפו בספקטרום NMR הניסיוני, כך סביר יותר מטבוליט הוא הווה. באופן דומה, זיהוי מטבוליטים לשייך אותו המסלול מרובים מגביר את הסבירות של מטלות נכונות. נוכחותם של מטבוליטים ומסלולים מטבוליים מאומתת עם אנציקלופדית קיוטו של גנים וגנומים (KEGG) 8 ומאגרי MetaCyc. Mycobacterium smegm 9ATIS הוא מערכת מודל שימושית עבור מ ' שחפת ופתוגנים mycobacterial אחרים. כפי שתואר במקומות אחרים, דגימות של מ ' smegmatis גם יכול להיות משובש על ידי sonication 10.
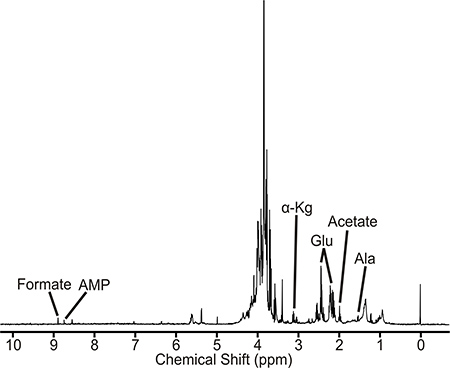
איור 2. 1 ספקטרום תמ"ג 1D H של תמצית תא חפת Mycobacterium. פסגות NMR קשורים מטבוליטים יציגים מסומנות. קיצורים הם כדלקמן: AMP פוספט, אדנוזין מונה; α-ק"ג, α-ketoglutarate; Glu, גלוטמט, ועלא, אלאנין.
Discussion
מספר לא מבוטל של מחקרים נתח את פרופילי transcriptomic וproteomic של מ ' שחפת תחת מגוון במבחנה בתנאי vivo. 11-16 סופו של דבר, שינויים בביטוי גנים ופעילות אנזים יובילו לשינויים בריכוזים של מולקולות קטנות משקל מולקולריות. התיאור המלא של תרכובות אלו מהווה metabolome. לכן, יכו...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
המחברים מבקשים להודות לכל חברי המעבדות של ד"ר Barletta וד"ר פאוורס על הערות תוך פיתוח הפרוטוקול. אנו מודים לנדים אוסטין לדיונים מועילים והגהה של כתב היד. העבודה המתוארת בכתב היד הזה מומנה על ידי מענקי טייס זרעים לכל אחד מחוקרים המפורטים לעיל מאוניברסיטת ביולוגית מרכז חיזור נברסקה לינקולן (הורה המענק # NCRR 2P20RR 017675, ד 'בקר, PI). בנוסף, אנו מבקשים להודות לד"ר אופליה צ'אקון למתן כספים ממענק R21 (1R21AI087561-01A1) לתמיכת המשכורת החלקית של מר Halouska לתקנן שיטות תמ"ג כלול בפרסום זה מחקר ואספקה.
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב / הציוד | חברה | מספר קטלוגים | תגובות |
| העשרת ADC | BD BBL מידלברוק | 212352 | |
| BACS-120 מחליף לדוגמה | ברוקר | ||
| הברוקר Avance NMR | ברוקר | 500 MHz | |
| שור הסרום אלבומין | הפישר סיינטיפיק | BP1600-100 | החלק V |
| סרכזת | Beckman Coulter | אלגרה X-15R | Benchtop |
| צינורות צנטריפוגות | קורנינג | 430291 | פוליפרופילן 50 המ"ל סטרילי |
| בקבוקוני קריוגני | קורנינג | 430488 | פוליפרופילן סטרילי 2.0 מ"ל |
| Cycloheximide | AG מדעית | C-1189 | רעיל |
| D (+) - גלוקוז | Acros | 41095-0010 | |
| אוקסיד דאוטריום | סיגמה אולדריץ | 617385 | |
| Flask Erlenmeyer | VWR | 89095-266 | , בסיס שטוח סטרילי, פוליקרבונט, כובע 0.22 מיקרומטר PTFE קרום פרק |
| Flask ההקפאה פלאש | VWR | 82018-226 | 750 מ"ל |
| הקפא מייבש | VWR | 82019-038 | 4.5 הליטר Benchtop |
| גליצרול | GibcoBRL | 15514-029 | |
| מדגרה | ניו ברונסוויק | Innova 40 | Benchtop ייקר |
| Lysing מטריקס B | Biomedicals MP | 6911-100 | |
| מכונת תמוגה | Biomedicals MP | FastPrep-24 | |
| Microcentrifuge | אפנדורף | 5415D | Benchtop |
| Microcentrifuge | Beckman Coulter | Microfuge 22R | Benchtop |
| מידלברוק 7H9 מרק | Difco | 271310 | |
| NMR צינורות | Norell | ST500-7 | 5mm |
| העשרת OADC | BD BBL מידלברוק | 212351 | |
| חומצה אולאית | סיגמא | O1008 | |
| אשלגן זרח Dibasic | VWR | BDH0266 | |
| אשלגן זרח Monobasic | VWR | BDH0268 | |
| רוטור - Microfuge 22R | Beckman Coulter | F241.5P | אטום ופוליפרופילן |
| רוטור - אלגרה X-15R | Beckman Coulter | SX4750 | עם כיסויים יו מוסמכים |
| כלוריד הנתרן | הפישר סיינטיפיק | S271-3 | |
| נתרן-3-trimethylsilylpropionate-2 ,2,3,3-D4 | קיימברידג' איזוטופ | DLM-48 | |
| ספקטרופוטומטר | Beckman Coulter | DU-530 | |
| Cuvettes ספקטרופוטומטר | עורק חיים | LS-2410 | פוליסטירן מ"ל 1.5, 2 צדדים ברורים |
| מזרק | הקיטון דיקינסון | 309585 | סטרילי, 3 מ"ל luer-Lok |
| מזרק סינון | Nalgene | 190-2520 | יצטט תאית סטרילי 0.2 מיקרומטר |
| Tween 80 | הפישר סיינטיפיק | BP338-500 |
References
- Larsen, M. H., Biermann, K., Tandberg, S., Hsu, T., Jacobs, W. R. Genetic Manipulation of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 2 (2007).
- Larsen, M. H., Biermann, K., Jacobs, W. R. Laboratory Maintenance of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 1 (2007).
- Clarridge, J. E., Shawar, R. M., Shinnick, T. M., Plikaytis, B. B. Large-scale use of polymerase chain reaction for detection of Mycobacterium tuberculosis in a routine mycobacteriology laboratory. J. Clin. Microbiol. 31, 2049-2056 (1993).
- Nguyen, B. D., Meng, X., Donovan, K. J., Shaka, A. J. SOGGY: solvent-optimized double gradient spectroscopy for water suppression. A comparison with some existing techniques. J. Magn. Reson. 184, 263-274 (2007).
- Cui, Q. Metabolite identification via the Madison Metabolomics Consortium Database. Nat. Biotechnol. 26, 162-164 (2008).
- Ulrich, E. L. BioMagResBank. Nucleic Acids Res. 36, 402-408 (2008).
- Wishart, D. S. HMDB: the Human Metabolome Database. Nucleic Acids Res. 35, 521-526 (2007).
- Kanehisa, M. KEGG for linking genomes to life and the environment. Nucleic Acids Res. 36, 480-484 (2008).
- Karp, P. D. Expansion of the BioCyc collection of pathway/genome databases to 160 genomes. Nucleic Acids Res. 33, 6083-6089 (2005).
- Halouska, S. Use of NMR metabolomics to analyze the targets of D-cycloserine in mycobacteria: role of D-alanine racemase. J. Proteome. Res. 6, 4608-4614 (2007).
- Boshoff, H. I. The transcriptional responses of Mycobacterium tuberculosis to inhibitors of metabolism: novel insights into drug mechanisms of action. J. Biol. Chem. 279, 40174-40184 (2004).
- Mehaffy, C. Descriptive proteomic analysis shows protein variability between closely related clinical isolates of Mycobacterium tuberculosis. Proteomics. 10, 1966-1984 (2010).
- Schnappinger, D. Transcriptional Adaptation of Mycobacterium tuberculosis within Macrophages: Insights into the Phagosomal Environment. J. Exp. Med. 198, 693-704 (2003).
- Schnappinger, D., Schoolnik, G. K., Ehrt, S. Expression profiling of host pathogen interactions: how Mycobacterium tuberculosis and the macrophage adapt to one another. Microbes. Infect. 8, 1132-1140 (2006).
- Shui, W. Quantitative proteomic profiling of host-pathogen interactions: the macrophage response to Mycobacterium tuberculosis lipids. J. Proteome. Res. 8, 282-289 (2009).
- Talaat, A. M., Lyons, R., Howard, S. T., Johnston, S. A. The temporal expression profile of Mycobacterium tuberculosis infection in mice. Proc. Natl. Acad. Sci. U.S.A. 101, 4602-4607 (2004).
- Forgue, P. NMR metabolic profiling of Aspergillus nidulans to monitor drug and protein activity. J. Proteome Res. 5, 1916-1923 (2006).
- Goodacre, R., Vaidyanathan, S., Dunn, W. B., Harrigan, G. G., Kell, D. B. Metabolomics by numbers: acquiring and understanding global metabolite data. Trends Biotechnol. 22, 245-252 (2004).
- Shin, J. H. NMR-based Metabolomic Profiling in Mice Infected with Mycobacterium tuberculosis. J. Proteome Res. 10, 2238-2247 (2011).
- Jaki, B. U., Franzblau, S. G., Cho, S. H., Pauli, G. F. Development of an extraction method for mycobacterial metabolome analysis. J. Pharm. Biomed. Anal. 41, 196-200 (2006).
- de Carvalho, L. P. Metabolomics of Mycobacterium tuberculosis reveals compartmentalized co-catabolism of carbon substrates. Chem. Biol. 17, 1122-1131 (2010).
- de Carvalho, L. P. Activity-based metabolomic profiling of enzymatic function: identification of Rv1248c as a mycobacterial 2-hydroxy-3-oxoadipate synthase. Chem. Biol. 17, 323-332 (2010).
- Marrero, J., Rhee, K. Y., Schnappinger, D., Pethe, K., Ehrt, S. Gluconeogenic carbon flow of tricarboxylic acid cycle intermediates is critical for Mycobacterium tuberculosis to establish and maintain infection. Proc. Natl. Acad. Sci. U.S.A. 107, 9819-9824 (2010).
- Tang, Y. J. Central metabolism in Mycobacterium smegmatis during the transition from O2-rich to O2-poor conditions as studied by isotopomer-assisted metabolite analysis. Biotechnol. Lett. 31, 1233-1240 (2009).
- Kweon, O. A polyomic approach to elucidate the fluoranthene-degradative pathway in Mycobacterium vanbaalenii PYR-1. J. Bacteriol. 189, 4635-4647 (2007).
- Hasan, M. R., Rahman, M., Jaques, S., Purwantini, E., Daniels, L. Glucose 6-phosphate accumulation in mycobacteria: implications for a novel F420-dependent anti-oxidant defense system. J. Biol. Chem. 285, 19135-19144 (2010).
- Soga, T. Quantitative metabolome analysis using capillary electrophoresis mass spectrometry. J. Proteome Res. 2, 488-494 (2003).
- Metz, T. O. The future of liquid chromatography-mass spectrometry (LC-MS) in metabolic profiling and metabolomic studies for biomarker discovery. Biomark Med. 1, 159-185 (2007).
- Ludwig, C., Viant, M. R. Two-dimensional J-resolved NMR spectroscopy: review of a key methodology in the metabolomics toolbox. Phytochem. Anal. 21, 22-32 (2010).
- Simpson, R. J., Inglis, J. . Proteins and Proteomics: A Laboratory Manual. , 425-595 (2003).
- Beste, D. J., McFadden, J. System-level strategies for studying the metabolism of Mycobacterium tuberculosis. Mol. Biosyst. 6, 2363-2372 (2010).
- Rhee, K. Y. Central carbon metabolism in Mycobacterium tuberculosis: an unexpected frontier. Trends Microbiol. , (2011).
- Who. Health Organization. Anti-tuberculosis Drug Resistance in the World: Report No. 4. , (2008).
- Jassal, M., Bishai, W. R. Extensively drug-resistant tuberculosis. Lancet Infect Dis. 9, 19-30 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved