A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אינדוקציה של מחלת שתל נגד מארח ו
In This Article
Summary
השתלת מח עצם Murine היא טכניקה בשימוש נרחב ללמוד מנגנונים אימונולוגיים המסדירים את מחלת שתל נגד מארח בבני אדם. היכולת לעקוב אחר דפוסי סחר בתא T In vivo מאפשר ניתוח מפורט של ההתפתחות וההנצחה של תגובות תא T במחלת שתל נגד מארח.
Abstract
מחלת שתל נגד מארח (GVHD) היא המחסום להגבלת השימוש הרחב של השתלת מח עצם כטיפול מרפא למגוון ליקויים המטולוגיות. GVHD נגרם על ידי תאי T alloreactive בשלים הנמצאים במח עצם השתל שהחדירו לתוך הנמען ולגרום ניזק לאיברים מארחים. עם זאת, בעכברים, תאי T יש להוסיף לבידוד מח העצם גורמים GVHD. למרות עבודה מקיפה שנעשתה לאפיין השתלת הודעת T תא תגובות, טכנולוגיית הדמית bioluminescent היא שיטה לא פולשנית כדי לעקוב אחר דפוסי סחר בתאי ה T בגוף חי.
בעקבות קרינה קטלנית, עכברי נמען מושתלים עם תאי מח עצם וsplenocytes מעכברים תורמים. תת תאי T מL2G85.B6 (עכברים הטרנסגניים שconstitutively מבטאים לוציפראז) נכללים בהשתלה. על ידי השתלת תאי T מסוים תת בלבד, אחד הוא מסוגל לעקוב אחר תת תאי T ספציפי בגוף חי,ובהתבסס על המיקום שלהם, לפתח השערות בדבר תפקידו של תת תאי T ספציפי בקידום GVHD בנקודתי זמן שונות. בהשתלת הודעת מרווחים קבועים מראש, עכברי נמען הם צלמו באמצעות מצלמת CCD IVIS Xenogen. עוצמת אור ניתן לכמת באמצעות תוכנת תמונת חיים כדי להפיק תמונה פסאודו צבע המבוססת על עוצמת פוטון (אדום = בעצמה גבוהה, סגולות = עצימות נמוכות).
בין השתלה לאחר 4-7 ימים, עכברי נמען מתחילים להראות סימנים קליניים של GVHD. קוק ואח'. 1 פתח שיטת ניקוד ללכמת את התקדמות מחלה המבוססת על מרקם נמען עכברי פרווה, שלמות עור, פעילות, ירידה במשקל, ויציבה. עכברים הם הבקיעו יומיים, ומורדמים כשהם הופכים לגוססים. עכברים בדרך כלל מטופלות הפכו גוססים השתלת 20-30 ימי הודעה.
מודלים עכבריים הם כלים רבים ערך ללימוד אימונולוגיה של GVHD. סלקטיבי השתלת התאים T מסוים תת אלשפל לזיהוי מדוקדק של התפקידים כל תת מחזות. הלא פולשני מעקב תגובות תא T in vivo מוסיף עוד שכבה של ערך למודלים עכבריים GVHD.
Protocol
1. הקרנה קטלנית
- הנח עד 10 עכברי נמען לכלוב microisolator תואם irradiator לשמש.
- להקרין ב2 מנות שווות מסכמות מינון כולל (מנה כוללת = 9 cGy למקבלי BALB.B). הקרנה שנייה צריכה להיות 3 שעות אחרי הראשון. הזריקה אמורה להתרחש בין 4-6 שעות לאחר הקרנה סופית. עכברים להקרין באו 137 מקור Cs או RS2, 000, irradiator.
- לאחר ההקרנות במינון, עכברי החנות השני בכלוב microisolator עם מי acidified עד למועד השתלה.
2. הכנת Splenocyte
- להרדים את עכבר תורם אחד בהתאם להנחיות מוסדיות. כל תורם בדרך כלל מניב 75x10 6 - 125x10 6 splenocytes. שימוש CD8 ערכות טיהור, כל עכבר בדרך כלל מניב 6x10 6 - 12x10 6 תאי T CD8.
- הסרת הטחול ידי ביצוע 2 2 סנטימטר חתך סנטימטר אנכי הימני של קו האמצע ישירות 1תחת כלוב הצלעות. לחתוך את הפרווה, עור, וקרום בטן.
- הסרת טחול וליצור השעית תא בודדה על ידי הצבת מסך טחול ברשת μl 40 בצלחת פטרי עם 1640 RPMI עם 5% FBS. השתמש בוכנת מזרק כדי להתפרק טחול עד שכל הטחול כבר עבר דרך מחיצת רשת.
- חזור על תהליך זה עבור כל WT וL2G85.B6 תורם. לאסוף את כל השעיות התא הבודדה WT בצינור חרוטים 1-50 מ"ל, ולאסוף את כל L2G85.B6 השעיות התא הבודדות בצינור חרוטי מ"ל נפרד 50.
- צנטריפוגה תאים ב 1200 סל"ד במשך 10 דקות ב 4 ° C. כדורי resuspend ב1640 RPMI עם 5% FBS ותאים לספור.
3. הכנת מח עצם
- הסרת עור מאיבר אחורי אחת של עכבר תורם.
- בזהירות לחתוך כמו רקמת שריר כמה שאפשר מעצם הירך ועצם שוקה / שוקית.
- הסרת גפיים אחוריים על ידי חיתוך עצם ירך משם במפרק הירך. לחתוך כפה אחורית ממש מתחת לצומת שוקה / שוקית. כל קיצוצי העצם צריכים להתבצע באמצעות מספריים חסונים.
- מוציא בזהירות את כל רקמת שריר שנותר. חתוך את השוקית-יחסית מח עצם קטן נמצא בשוקית ולא שווה את המאמץ.
- הנח רגל אחורית ב5% תהליך קר 1640 RPMI FBS וחוזר עם האיבר האחורי השני. כל עכבר אמור להניב בין 20x10 6 - 40x10 6 תאים במח עצם.
4. הסרת מח עצם
- הסרת גפיים אחוריים אחת מתקשורת והמקום בצלחת פטרי גדולה עם כמות קטנה של מדיה קרה (~ 1 מ"ל).
- לחתוך מפרק הברך. שימוש במזרק (נפח מ"ל> 5), מחט תת עורית להכניס לתוך השוקה ומדכא את המזרק עד שכל החומר האדום הוסר מפנים של שוקה. חזור על תהליך עם עצם ירך. השלך עצמות נטולות מח עצם שנותרו. חזור על תהליך עם גפה אחורית שנייה.
- צור השעית תא בודדה על ידי תקשורת pipetting המכיל מח עצם לתוך צלחת פטרי גדולה ובוכנת מזרק שימוש ו40 μl רשת מסך. השעית פיפטה תא בודדה לתוך צינור חרוטים 50 מ"ל ולשמור על קרח.
5. CD3 אזילה
יש מגוון דרכים לפוגעות CD3 + תאים ממח העצם. המעבדה שלנו משתמשת בערכה שנעשתה על ידי Miltenyi BIOTEC (CD3-ביוטין - 130-093-021). לכלות CD3 + תאים ממח העצם בעקבות הפרוטוקול של היצרן. החיץ לערכות Miltenyi להלן ייקרא מאגר MACS (2 mM EDTA, BSA 0.5% ב PBS, 7.2 pH).
- שטוף תאים על ידי צנטריפוגה splenocytes ותאי מח עצם ב 1200 סל"ד במשך 10 דקות ב 4 ° C וספירת תאים.
- הסר את כל supernatant. תאי resuspend מח עצם ב100 μl לכל 10 מיליון תאי מח עצם במאגר המקים.
- המשך עם CD3 דלדול באמצעות מייצר פרוטוקול '.
- שטוף את תאי מוח עצם מדולדל CD3 3 פעמים ב PBS סטרילית. הרוזן CD3 מתרוקן תאי מח עצם וresuspend בנפח מתאים כדי להזריק 10 7 תאים.
תחת = "jove_title"> 6. L2G85.B6 CD8 + טיהור תאי T
יש מגוון של דרכים לטהר CD8 תאי T מL2G85.B6 עכברים. כמו כן, יש כמה דרכים לפוגעות CD8 תאי T מתורמי splenocyte WT. המעבדה שלנו משתמשת בערכות מMiltenyi BIOTEC (CD8 דלדול - 130-049-401, CD8 טיהור - 130-095-236).
- Resuspend WT הגלולה במאגר MACS μl 90 ל10 7 תאים. המשך עם דלדול התא CD8 T לפי מייצר 'פרוטוקול (CD8 דלדול - 130-049-401).
- Resuspend L2G85.B6 הגלולה במאגר MACS μl 40 ל10 7 תאים. המשך עם טיהור התא CD8 T לפי מייצר 'פרוטוקול (CD8 טיהור - 130-095-236).
- לספור כל אוכלוסייה בתא ולשטוף את כל אוכלוסייה 3 פעמים עם PBS סטרילית. Resuspend כל אוכלוסייה בנפח המתאים כדי להזריק 18x10 6 WT (CD8 המדולדל) וsplenocytes 2x10 6 L2G85.B6 המטוהר CD8 תאי T.
7. הכנת הזרקה
- שלב 10 7 CD3 תאי מח עצם מדולדל, 18x10 6 WT (CD8 המדולדל) splenocytes ו2x10 6 L2G85.B6 מטוהרים CD8 תאי T בצינור microcentrifuge. לשטוף עם סטרילי PBS וresuspend ב 300 μl.
- הזרק הכנת תא לוריד הזנב של עכברי נמען. זריקות צריכים להיעשות באמצעות 28 מחטי מד.
- עכברי חנות בכלוב microisolator עם מי acidified. עכברי ציון יומי באמצעות שיטת ניקוד GVHD ניקוד שפותחה על ידי קוק ואח' 1.
8. Bioluminescent הדמיה
- השתלה לאחר שישה ימים, להזריק עכברי נמען עם 4 מ"ג D-luciferin. אפשר 5 דקות לluciferin להגיב בלוציפראז.
- הרדם עכבר בתא isoflurane של imager פליטת האור ומקבלי תמונה למשך 5 דקות עם binning הקטן. פעולה זו תיצור תמונה ברזולוציה גבוהה תוך איסוף כמו אירועים רבים ככל האפשר.
- לנתח נתונים באמצעות חייםתוכנת תמונה. קנה המידה של התמונה פסאודו הצבעים יכול להיות שונה כדי להניב את התוצאות הטובות ביותר. עם זאת, זוהי חובתו של אותו קנה המידה לשימוש בכל ניסויים.
- אזורים של עניין ניתן ליצור באמצעות תוכנת תמונה חייה וemittance אור ניתן לכמת על ידי חישוב הזרם (פוטונים / sec) שנפלט מכל אזור של עניין.
9. נציג תוצאות
כ 7-10 ימים לאחר השתלה, עכברים יתחילו להופיע סימנים קליניים של GVHD. עכברים מופיעים מוזנח בשל חוסר הטיפוח. נמענים גם יתחילו לרדת במשקל בין השתלת הודעה 7-10 ימים. הפעילות והיציבה של עכברי נמען תישארנה נורמלים יחסית עד השתלה לאחר כ 12-14 יום. עשרות GVHD מצטברים בהתמדה להגדיל באמצעות השתלת 1 2-3 שבועות לאחר (איור 1 א). מהלך המחלה משתנה מאוד בין עכברים, אולם מקבלים צריכים אחיד להיכנע לGVHD ידי ד 30-40השתלת ays הודעה (1B איור).
איור 2 מראה עכברי נמען שצפו בי 6 השתלת הודעת ימים. היקף פסיאודו צבעוני מופעים שונים emittance אור בכל הגוף עם עוצמת האור הגבוהה ביותר שנפלטת בטחול והמעיים. הצטברות תאי T CD8 במעיים עולה בקנה אחד עם ממצאים קודמים 6. עכברי נמען ניתן להציב שוב בכלוב microisolator להיות צלמו בנקודת זמן מאוחר יותר או מורדם להדמית vivo לשעבר.
| קריטריונים | כיתה 0 | כיתה 1 | כיתה 2 |
| ירידה במשקל (wkly.) | <10% | > 10% - <25% | > 25% |
| יציבה | נורמלי | Hunching רק במנוחה | Hunching כמה; פוגע movement |
| פעילות | נורמלי | קל עד בינוני ירידה בפעילות | נייח אלא אם מגורה |
| מרקם פרווה | נורמלי | קל עד מתונה פורעת | עלעול קשה / הזנחה עצמית |
| מרקם עור | נורמלי | קנה מידה של כפות / זנב | אזורים בולטים של עור נכרתים |
הטבלה 1. קוק ואח' פתח שיטת ניקוד זה ב -1996 1. עכברים צריכים להיות בקיע מדי יום בכל אחד מהקריטריונים שבצד השמאל. כל עכבר מקבל ציון של 0-2 לכל קריטריון והציון הכולל הוא סכום של כל הציונים הבודדים.

האיור 1. קטלני BALB.B המוקרן הושתלו עם 10 7 עצםתאי מח לבד או עם 18x10 6 splenocytes תא CD8 T המדולדל WT ו2x10 6 המטוהרים L2G85.B6 CD8 תאי T. א) נתוני ציון קליניים של מקבלי מח עצם לבד או עם תאי T CD8 מדולדל splenocytes WT וטהר L2G85.B6 CD8 תאי T. B) נתוני הישרדות של מקבלי מח עצם לבד או עם CD8 תאי T מדולדל splenocytes WT וטהר L2G85.B6 CD8 תאי T. לחץ כאן לצפייה בדמות גדולה.
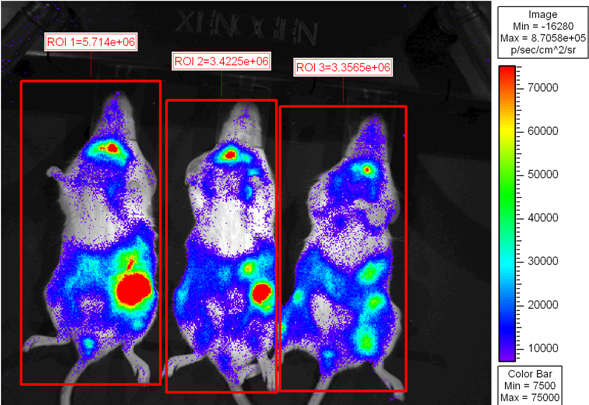
איור 2. עכברי BALB.B קטלני מוקרנים הושתלו עם 10 7 תאי מח עצם לבד או עם 18x10 6 splenocytes תאי T CD8 מדולדל WT ו2x10 6 המטוהרים L2G85.B6 CD8 תאי T. מקבלים הוזרקו 4 מ"ג D-luciferin באמצעות הזרקת intraperitoneal והיו צלמו באמצעות IVIS Xenogen למשך 5 דקות בbinning הקטן. נ.ב.תמונות eudo צבע מוצגות בי סגולים מייצגת עצמה נמוכה ואדום מייצג אזורים בעצמה גבוה של עניין היו סגור מסביב לכל העכבר ושטף כולל (פוטונים / sec) הייתה לכימות.
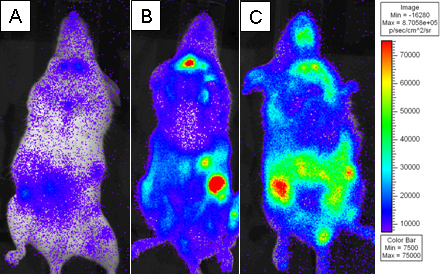
איור 3. עכברי BALB.B קטלני מוקרנים הושתלו עם 10 7 תאי מח עצם לבד או עם 18x10 6 splenocytes תאי T CD8 מדולדל WT ו2x10 6 המטוהרים L2G85.B6 CD8 תאי T. מקבלים הוזרקו 4 מ"ג D-luciferin באמצעות הזרקת intraperitoneal והיו צלמו באמצעות IVIS Xenogen למשך 5 דקות בbinning הקטן. תמונות פסיאודו צבעוניים מוצגות בי סגולים מייצגת עצמה נמוכה ואדום מייצג עצמה גבוהה. מקבלים היו צלמו ב) יום 4, ב ') יום 6, ו-C) העברת הודעה היום 8.
Discussion
הפרוטוקול לגרימת GVHD בעכברים שהוצגו כאן מהווה מודל רלוונטי קליני של GVHD העכברי. הוקם במקור על ידי ברגר ואח'. בשנת 1994, / 6 C57Bl לשילוב מתח BALB.B הוא MHC-תאם, עם תמותת GVHD מתווכת על ידי CD4 CD8 התלוי, גורמי אש T 2, דומים מאוד לתרחיש הקליני השכיח ביותר 3. זה ידוע כי השתלת...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
אנו חייבים תודה לאליס Gaughan ומחמם-ג'ינג וואנג, שמצטיין טכניים תמיכה, הזנה רוחנית ותמיכה מוסרית היו תפקיד מרכזי במחקרים אלו נעים קדימה. מחקרים אלה נתמכו על ידי מענק NIH AI036532 לgah.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגים | תגובות |
| RPMI 1640 | Invitrogen | 12633-012 | |
| עוברי עגל בסרום | Invitrogen | 10439016 | |
| מסננת תא 40 מיקרומטר | BD Biosciences | 352340 | |
| CD3e-ביוטין | Miltenyi יוטק | 130-093-021 | |
| Microbeads אנטי ביוטין | Miltenyi יוטק | 130-091-147 | |
| CD8a microbeads | Miltenyi יוטק | 130-049-401 | נהג לכלות CD8 תאי T מטחול. |
| קוקטייל נוגדן טיהור CD8a | Miltenyi יוטק | 130-095-236 | משמש לטיהורCD8 תאי T מטחול. |
| D-luciferin | Caliper מדעי חיים | 122796 |
References
- Cooke, K. R. An experimental model of idiopathic pneumonia syndrome after bone marrow transplantation: The roles of minor H antigens and endotoxin. Blood. 88, 3230-3239 (1996).
- Berger, M. T cell subsets involved in lethal graft-versus-host disease directed to immunodominant minor histocompatibility antigens. Transplantation. 57, 1095-1102 (1994).
- Nimer, S. D. Selective depletion of CD8+ cells for prevention of graft-versus-host disease after bone marrowtransplantation. A randomized controlled trial. Transplantation. 57, 82-87 (1994).
- Korngold, R., Sprent, J. Surface markers of T cells causing lethal graft-vs-host disease to class I vs class II H-2 differences. Journal of Immunology. 135, 3004-3010 (1985).
- Cao, Y. A. Molecular imaging using labeled donor tissues reveals patterns of engraftment, rejection, and survival in transplantation. Transplantation. 80, 134-139 (2005).
- Asady, R. E. l. TGF-{beta}-dependent CD103 expression by CD8(+) T cells promotes selective destruction of the host intestinal epithelium during graft-versus-host disease. J. Exp. Med. 201, 1647-1657 (2005).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol Rev. 114, 181-217 (1990).
- Karecla, P. I. Recognition of E-cadherin on epithelial cells by the mucosal T cell integrin alpha M290 beta 7 (alpha E beta 7). Eur. J. Immunol. 25, 852-856 (1995).
- Cepek, K. L. Adhesion between epithelial cells and T lymphocytes mediated by E-cadherin and the alpha E beta 7 integrin. Nature. 372, 190-193 (1994).
- Malarkannan, S. The molecular and functional characterization of a dominant minor H antigen, H60. J. Immunol. 161, 3501-3509 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved