A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד והתרבות של תאים עובריים עצביים עכברוש: פרוטוקול מהיר
In This Article
Summary
אנו מתארים מתודולוגיה מהירה לבודד ותרבות נוירונים בהיפוקמפוס ואת קליפת המוח של עוברי מכרסמים. פרוטוקול זה מאפשר לנו לבצע ניסויים שבהם תרבויות עצביים כמעט טהור נדרשים.
Abstract
אנו מתארים שיטה מהירה לנתק ותרבות נוירונים בהיפוקמפוס או קליפת המוח של E15-17 עוברי עכברים. ההליך יכול להיות מיושם בהצלחה את הבידוד של העכבר הנוירונים העיקריים אדם אבות עצביים. נוירונים ניתק נשמרות בינוני סרום ללא עד מספר שבועות. תרבויות אלה יכולים לשמש nucleofection, immunocytochemistry, חומצות גרעין הכנה, כמו גם electrophysiology. תרבויות נוירונים מבוגרים יותר ניתן גם transfected עם שיעור יעיל על ידי התמרה lentiviral ו, פחות יעיל, עם סידן פוספט או שומנים על בסיס שיטות כגון lipofectamine.
Protocol
1. פולי-D-ליזין (PDL): הכנת
- הוסף 5 מ"ל סטרילי DDH 2 O ל 5 מ"ג של PDL להשיג פתרון מלאי של 1 מ"ג / מ"ל.
- מערבבים פתרון המניות על ידי pipetting מספר פעמים.
- להשתמש מיד או לאחסן פולי-D-ליזין פתרון ב 2-8 ° C.
2. פולי-D-ליזין (PDL): תא ציפוי פלסטיק צלחות תרבות
- לדלל את הפתרון המניות PDL עם סטרילית DDH 2 O לריכוז סופי של 10 מיקרוגרם / מ"ל.
- פיפטה פתרון מספיק לתוך צלחת 60 מ"מ כדי לכסות את פני התרבות באזור (3 מ"ל למנה 60 מ"מ).
- לטלטל בעדינות, כדי להבטיח גם ציפוי של משטח התרבות.
- דגירה לוחות מצופים בטמפרטורת החדר (RT) למשך הלילה.
- למחרת, בדרך כלל יום של דיסקציה, להסיר את הפתרון Poly-D-ליזין ידי השאיפה ולשטוף לזמן קצר עם 3 מ"ל של סטרילית DDH 2 א ' חזור על פעולה זו. לאחר שטיפה 2, להסיר במים לחלוטין על ידי שאיפה.
- צלחות ניתן לאחסן 4 ° C עד שלושה שבועות.
3. פולי-D-ליזין (PDL) ו Laminin: הכנת ציפוי של זכוכית דו קאמרית שקופיות
- מערבבים PDL (1 מ"ג / מ"ל) ו laminin (1 מ"ג / מ"ל) מניות פתרונות סטרילית DDH 2 O לריכוז סופי של 10 ו 5 מיקרוגרם / מ"ל, בהתאמה.
- פיפטה פתרון מספיק לתוך הבארות של זכוכית דו קאמרית שקופיות כדי לכסות את פני התרבות באזור (1 מ"ל על כן כל אחד כוס 2 גם 2, חדר שקופיות).
- לטלטל בעדינות, כדי להבטיח גם ציפוי של משטח התרבות.
- דגירה לוחות מצופים ב RT בן לילה.
- ביום הבא, להסיר את הפתרון Poly-D-ליזין, Laminin ציפוי באמצעות השאיפה ולשטוף בקצרה פעמיים עם 1 מ"ל של סטרילית DDH 2 א ' לאחר שטיפה 2, להסיר במים לחלוטין על ידי שאיפה.
- שקופיות קאמרית ניתן לאחסן 4 ° C עד שלושה שבועות.
הערה: כל שקופית תא זכוכית יכול להיות מצופה followinגרם בפרוטוקול זה. אנו משתמשים בדרך כלל את שתי קאמרית שקופיות כי כל שקופית מספק הגדרה השליטה בדיקה ניסיונית (למשל מטופל מול מטופלים, לעומת untransfected transfected).
4. Dissection תרבות עצבי ו
- לחמם את ריאגנטים הבאים אמבט 37 ° C מים:
- TrypLE אקספרס על הבקבוק המקורי שלה 100 מ"ל.
- Neurobasal/B27 בינוני שלם (ראה טבלה אני). נפח חימם תלוי במספר מנות להיות מצופה (למשל 30 מ"ל במשך עשר מנות מצופה 60 מ"מ).
- הוסף 3 מ"ל של תמיסת קר E שינה לארבעה 60 תרבות מנות מ"מ ו 13 מ"ל ל 15 מ"ל BD צינור פוליפרופילן פלקון בהירות גבוהה חרוטית.
- הוסף 25-30 מ"ל של מדיום לנתיחה קר (ראה טבלה II, ד"ר אולימפיה מאוצ'י, תקשורת אישית) לכל אחת משלוש מנות 100 מ"מ תרבות. הצלחות אלה, המכילים כמות גדולה של המדיום, ישמש כדי לשטוף את העוברים מיד אחרי שלהםהסרת מתוך שקי מי השפיר (שלבים 4.7 ו -4.8).
- להרדים חולדה E17 מתוזמן הרה CO 2 על פי מדיניות שירותי בריאות הציבור על טיפול שימוש אנושי של חיות מעבדה ותחת טיפול בבעלי חיים אישרה מוסדית ולהשתמש בפרוטוקול.
- לרסס בבטן התחתונה עם EtOH 70% וחותכים מדיאלית דרך העור והשרירים עם זוג מספריים החושפים את הרחם ואת העובר.
- הסר את כל העוברים ומניחים אותם בצלחת 100 מ"מ סטרילית המכילה עודף בינוני לנתיחה קר (25-30 מ"ל, ראה שלב 4.3).
- גזור עוברים באמצעות מספריים קטנים של שק השפיר ומניחים אותם בצלחת 100 מ"מ 2 המכיל בינוני לנתיחה קר.
- לשטוף את העוברים בטמפרטורת החדר על ידי מנה מטה בעדינות 100 מ"מ במשך 5-10 שניות. לאחר מכן, להעביר את העוברים שטופים לצלחת 100 מ"מ המכיל 3 בינוני לנתח. שתי שוטף במצע עודף בדרך כלל מספיק כדי להסיר את כל עקבות של דם. עם זאת, אם NECessary, לשטוף פעם נוספת באמצעות מאכל טריים 100 מ"מ המכילים 25-30 מ"ל של מדיום לנתיחה קר.
- באמצעות מלקחיים סטראו ועקומים, לחלץ המוח כל העובר של החולדה על ידי תלישת עור הגולגולת. מניחים המוח כולו באחד 60 מ"מ צלחות (בדרך כלל, עם לא יותר מ 5 מוחות לכל מנה) עם הקור שינה א 'שמור את הצלחות על קרח.
- קחו מנה אחת בכל פעם, תחת מיקרוסקופ לנתח, להפריד בין ההמיספרות ולבודד את קליפת המוח הסרת המוח התיכון ואת קרומי המוח.
- אופציונלי: מוח חתך לאורך קו האמצע, לחלץ hippocampi ובצע את ההליך שלהלן כדי לבודד נוירונים בהיפוקמפוס.
- לאסוף את כל קליפת המוח ניתוחים צינור של 15 מ"ל חרוטי ברור המכיל 13 מ"ל של שנת חורף קר א 'השאירו את קליפת המוח על קרח עד שכל והניתוחים הושלמו. בשל גודלם הזעיר, hippocampi גזור ניתן לאסוף בצינור Eppendorf 1.5-מ"ל במקום השפופרת של 15 מ"ל. אם רוצים, על זה צעד אחד או קליפת המוחhippocampi ניתן לשים צלוחית cryotube המכילה 1 מ"ל של שינה E + 2% B27 + גנטמיצין (50 מיקרוגרם / מ"ל) + Fungizone (250 ng / ml) ביחס של 2-4 או 2-4 הקורטקס hippocampi לכל בקבוקון. רקמת המוח ניתן לאחסן 4 ° C בחושך עד שבוע 1 (מאוחר יותר פעמים לא נבדק עדיין). בעת הצורך, להשתמש במלקחיים עדינים להעביר את רקמת המוח צינור המכיל 15 מ"ל שינה E ולאחר מכן בצע את הפרוטוקול שלהלן כדי לבודד את הנוירונים.
- להעביר את הצינור אל מכסה המנוע בתרבית רקמה. אפשר ליישב את קליפת המוח לחלק התחתון של הצינור ואז להסיר בזהירות supernatant.
- הוסף 13 מ"ל של E שינה טרי צינור של 15 מ"ל חרוטי, לאפשר הקורטקס להתיישב בחלק התחתון של הצינור בזהירות להסיר את supernatant. חזור על פעולה זו 2 פעמים, ואחרי הכביסה שעברה, להסיר בזהירות את כל התקשורת.
- Enzymatically לעכל בקורטקס המוח על ידי הוספת 1-2 מ"ל (תלוי במספר של קליפת המוח, להשתמש פחות בידוד hippocampi) של TR חמיםypLE Express. סוגרים את המכסה של הצינור עם Parafilm ולצוף את הצינורית אמבט 37 ° C מים במשך 10 דקות.
- לרסס את הצינור עם אתנול 70% לפני פתיחת המכסה ומוסיפים 10 מ"ל של שינה א 'אפשר ליישב את קליפת המוח בחלק התחתון של הצינור ולהסיר supernatant. חזור על פעולה זו שלוש פעמים כדי לשטוף את TrypLE Express. בשלב האחרון, להסיר בזהירות את כל התקשורת.
- בעדינות triturate (4-5 פעמים) הקורטקס של 2 מ"ל של מדיום Neurobasal/B27 מלאה באמצעות אש זכוכית מלוטשת פסטר (כ 1 מ"מ קוטר). להיזהר כדי למנוע בועות.
- חזור על עוד 4-5 פעמים עם כוס סטרילית פיפטה פסטר קטן יותר בקוטר (כלומר פיפטה כ 1/2-3/4 מ"מ קוטר). אין להשתמש פיפטה פסטר קטן יותר מאשר זה או זה יהרוס את התאים.
- אפשר חתיכות הנותרים של רקמות (בדרך כלל מעט מאוד, אם בכלל) להתיישב.
- מעבירים את ההשעיה העליון מתחיל מתא בודד לצינור 15 מ"ל חדש, והותיר אחריו התיישבו חתיכות של רקמת גוף. פרווהיס לדלל את ההשעיה התא עד 10-12 מ"ל עם מדיום Neurobasal/B27 מלאה.
- מערבבים היטב לדלל תאים עבור מונה על ידי הוספת 10 μl של השעיה תא μl 490 הפתרון ספירת 50x (ראה לוח ג) ב 1.5 מ"ל Eppendorf צינור.
- צלחת התאים על PDL מצופים לוחות בצפיפות של 5.0 x 10 4/2 ס"מ. אם nucleofection יש לבצעם, אנו ממליצים על הציפוי בתאים בריכוז גבוה (8-10 x 10 4 / cm 2).
- בדרך כלל, אנחנו מחלקים 9-10 עוברים בכל ניסוי, כמו בערך 13 x 10 6 נוירונים נגזרות העובר E17 זה. אם עוברים יותר יש צורך, לוודא כי כל התהליך לא נמשך יותר משעתיים.
- אם רוצים, 24 שעות לאחר הבידוד, 10 מיקרומטר של ציטוזין-β-D-arabinofuranoside (AraC) ניתן להוסיף כל מאכל, כדי למנוע התפשטות גליה. עם זאת, שלב זה אינו נחוץ מאחר Neurobasal/B27 בינוני מעכב התפשטות גליה, לפי המלצות היצרן (Invitrogen / Gibco).
- הנוירונים יכול לשמש בניסויים לאחר 4-5 ימים במבחנה, אך הזמן המדויק תלוי בשלב בידול הרצוי. יש לנו נוירונים בתרבית של עד 4 שבועות ללא ירידה משמעותית בהישרדות (איור 1).
- עבור culturing המורחבת, להחליף בינוני culturing כל שבוע עם המדיום Neurobasal/B27 מוכן טרי שלם.
5. נציג תוצאות
נוירונים בתרבית בשקופיות קאמרית זכוכית יכולה להיות נתונה immunocytochemistry. איור 1 מציג תמונה אופיינית של נוירון קורטיקלי קבוע לאחר חמישה ימים של תרבות immunolabeled עם נוגדן אנטי-MAP-2 כדי להראות תהליכים עצביים.
תרשים 2 מציג תמונה מייצגת של תא עצב בהיפוקמפוס חולדה לאחר 3 שבועות בתרבות. מורפולוגיה העצבית של התא הבדיל באופן מלא מסומן על ידי MAP-2 אניmmunolabeling (MAP-2 סמן העצבית, נוגדן חד שבטי העכבר שיבוט AP-20, ג'ין טקס, אירווין, קליפורניה), בעקבות הליך רגיל כפי שתואר קודם 1. התמונות היו דמיינו עם מיקרוסקופ פלואורסצנטי Eclipse E400 Nikon זקוף מצויד EXI אקווה המצלמה (Qimaging), ממונע Z-ציר ולאחר SlideBook5 הרכישה / deconvolution תוכנה (Intelligent הדמיה Innovations, Inc, דנוור, CO). סדרה של תמונות תלת ממדיות של כל תמונה אישית היו deconvoluted לתמונה דו מימדי אחד נפתרה על ידי התאמת אות חתך כדי בעוצמה מקסימלית קרוב להגדיל את הרזולוציה.
איור 3 מציג טוהר תרבויות עצביים. Lysates חלבון התקבלו DIV7 תרבויות חולדה עצביים (ctx) וממנה במקרה של גליובלסטומה האנושי (GBM). כצפוי, lysate העצבית היא חיובית מאוד של חלבון העצבית MAP-2 ו שלילי GFAP סמן astrocytic, בעוד lysate חלבון GBM היא שלילית ואו MAP-2 חיובי עבור GFAP.
למרות בפרוטוקול שלנו אנו עושים שימוש E שינה במשך כמה שנים לנתח ושטיפה בינוני, לאחרונה אנו בחנו שימוש נוסף ומעשי מאוד זה לשמור על רקמות המוח לשימוש נוסף. איור 4 ממחיש כמה ימים במבחנה 5 (DIV5) התרבות של נוירונים בקליפת המוח של עכברים מבודד הקורטקס שמרו על 4 מעלות צלזיוס במשך שבוע אחד שינה E + B27 לאחר דיסקציה המקורי שלהם העובר. נוירונים היו מצופה על זכוכית דו קאמרית השקופית מצופה PDL ו laminin כפי שתואר לעיל. התמונה רכשה היה deconvoluted באמצעות רכישת SlideBook5 / תוכנה deconvolution כמתואר לעיל (איור 2).

באיור 1. התמונה נציג תא עצב בקליפת המוח nucleofected עם pmaxGFP (Amaxa, Lonza, Walkersville, MD) ו immunolabeled עם MAP-2 נוגדנים, באדום. ההגדלה המקורי 100x.
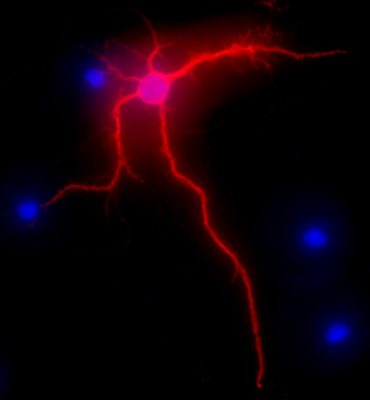
איור 2. תמונת מראה נציג MAP-2 immunolabeling, באדום, של נוירונים בהיפוקמפוס לאחר 3 שבועות בתרבות. מכתים DAPI, בכחול, מראה גרעיני התאים. ההגדלה המקורי 40X.

3. איור המערבי כתם מראה טוהר בתרביות תאים עצביים. 30 מיקרוגרם של נוירונים האדם חולדה lysates GBM, חלבון הופרדו על ידי אלקטרופורזה ו נתון ניתוח כתם המערבי בעקבות הליכים סטנדרטיים 1. Anti-MAP-2 היה ארנב polyclonal מן התא איתות (דאנוורס, MA), אנטי GFAP נוגדן חד שבטי העכבר היה מן Chemicon (Millipore, Billerica, MA), ועכבר חד שבטי נגד GRB2 נוגדנים היה ממעבדות BD התמרה ( ד"ר ניצוצות). GRB2 שימש בקרת הטעינה.

באיור 4. נציג תמונות של ימים במבחנה 5 (DIV5) נוירונים בקליפת המוח של עכברים המתקבלים קליפת המוח שנותרו שינה E + B27 על 4 מעלות צלזיוס למשך שבוע לאחר הניתוח שלהם. א) שלב ניגודיות של נוירונים בתרבית על משטח הזכוכית של שתי קאמרית שקופיות. ההגדלה המקורי 20X. ב) immunofluorescence מראה ביטוי של MAP-2 בתהליכים עצביים, בירוק, התרבות היה שלילי GFAP סמן astrocytic. מכתים DAPI, בכחול, מצביע על גרעין התא. ההגדלה המקורי 40X.
Discussion
שיטת לנתיחה והתרבות של נוירונים בהיפוקמפוס של חולדות ועל קליפת המוח המתואר כאן מאפשר ביצוע ניסויים באמצעות תרביות נוירונים טהורים כמעט שגודלו בינוני הגדרה כימית (איור 3). אף על פי פרוטוקולים של נוירונים culturing טהורים כמעט בסרום ללא מדיה תוארו בעבר 2,3,4, י...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
אנו מודים jonna אליס לסיוע המערכת. הפרויקט המתואר נתמך על ידי מספר פרס R01MH079751 (PI: פ Peruzzi) מהמכון הלאומי לבריאות הנפש. התוכן הוא באחריות הבלעדית של הכותבים ולא בהכרח מייצגים את הדעות הרשמיות של המכון הלאומי לבריאות הנפש או מכוני הבריאות הלאומיים.
Materials
| Name | Company | Catalog Number | Comments |
| מגיב | ריכוז | ||
| Neurobasal | 98% | ||
| B27 | 2% | ||
| Glutamax | 0.5 מ"מ |
לוח ט Neurobasal/B27 שלם בינוני.
| מגיב | ריכוז |
| גלוקוז | 16 מ"מ |
| סוכרוז | 22 מ"מ |
| HEPES | 10 mM |
| NaCl | 160 מ"מ |
| KCl | 5 מ"מ |
| Na 2 HPO 4 | 1 mM |
| KH 2 PO 2 | 0.22 mM |
| גנטמיצין | 50 מיקרוגרם / מ"ל |
| Fungizone | 250 ng / mL |
| ה-pH | 7.4 |
| Osmolarity | 320-330 mOsm |
לוח ב. דיסקציה בינוני.
| מגיב | נפח (μl) |
| Neurobasal/B27 שלם בינוני | 240 |
| Trypan כתם כחול 0.4% | 250 |
| סך הכל | 490 |
לוח ג. 50x ספירת פתרון.
| מגיב | חברה | החתול. מספר |
| שינה E | Brainbits | 767171 |
| Neurobasal | Gibco, Invitrogen | 21103-049 |
| B27 | Gibco, Invitrogen | 17504-044 |
| Fungizone | Gibco, Invitrogen | 15290-018 |
| גנטמיצין סולפט | סיגמא אולדריץ' | G1264 |
| Glutamax 200 מ"מ | Gibco, Invitrogen | 35050 |
| TrypLE Express W / O פנול אדום | Gibco, Invitrogen | 12604 |
| ציטוסין-β-D-arabinofuranoside hydrochloride | סיגמא אולדריץ' | C6645 |
| פולי-D-ליזין | סיגמא אולדריץ' | P6407 |
| Laminin 1 מ"ג / מ"ל | Millipore | CC095 |
| HEPES | סיגמא אולדריץ' | H3375 |
| Trypan כתם כחול 0.4% | Gibco, Invitrogen | 15250 |
לוח ד. חומרים כימיים מסוימים.
| ציוד | חברה | החתול. מספר |
| סטריאו מיקרוסקופ | אולימפוס | SZ61 |
| מלקחיים גדולים | FST | 11022-14 |
| בסדר שקצהו מלקחיים | מוריה | MC40B |
| מיקרו בסדר שקצהו מלקחיים | מוריה | MC31 |
| חדות כתער מספריים | Roboz | RS-6820 |
| מספריים המבתרים מיקרו | FST | 91460-11 |
| מיקרו הביתור מספריים עקומים | FST | 14067-11 |
| זכוכית 2-קאמרית שקופיות | Lab-Tek | 154461 |
| 60 מנות מ"מ | BD פלקון | 353002 |
| 100 מנות מ"מ | קורנינג | 430167 |
| 15 מ"ל צינורות | BD פלקון | 352099 |
| 1.5 מ"ל cryo-צינור בקבוקון | Nunc | 375353 |
לוח ו 'ספציפית ציוד.
References
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. . Culturing nerve cells. , (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved