A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפקה של וקטורים lentiviral עבור תאים Transducing ממערכת העצבים המרכזית
In This Article
Summary
בפרוטוקול זה אנו מתארים, ייצור טיהור טיטרציה של וקטורים lentiviral. אנו מספקים דוגמה משלוח וקטור בתיווך lentiviral הגן בנוירונים בתרבית ו האסטרוציטים ראשוניים. השיטות שלנו עשוי לחול גם על סוגי תאים אחרים במבחנה ו In vivo.
Abstract
Efficient gene delivery in the central nervous system (CNS) is important in studying gene functions, modeling neurological diseases and developing therapeutic approaches. Lentiviral vectors are attractive tools in transduction of neurons and other cell types in CNS as they transduce both dividing and non-dividing cells, support sustained expression of transgenes, and have relatively large packaging capacity and low toxicity 1-3. Lentiviral vectors have been successfully used in transducing many neural cell types in vitro 4-6 and in animals 7-10.
Great efforts have been made to develop lentiviral vectors with improved biosafety and efficiency for gene delivery. The current third generation replication-defective and self-inactivating (SIN) lentiviral vectors are depicted in Figure 1. The required elements for vector packaging are split into four plasmids. In the lentiviral transfer plasmid, the U3 region in the 5' long terminal repeat (LTR) is replaced with a strong promoter from another virus. This modification allows the transcription of the vector sequence independent of HIV-1 Tat protein that is normally required for HIV gene expression 11. The packaging signal (Ψ) is essential for encapsidation and the Rev-responsive element (RRE) is required for producing high titer vectors. The central polypurine tract (cPPT) is important for nuclear import of the vector DNA, a feature required for transducing non-dividing cells 12. In the 3' LTR, the cis-regulatory sequences are completely removed from the U3 region. This deletion is copied to 5' LTR after reverse transcription, resulting in transcriptional inactivation of both LTRs. Plasmid pMDLg/pRRE contains HIV-1 gag/pol genes, which provide structural proteins and reverse transcriptase. pRSV-Rev encodes Rev which binds to the RRE for efficient RNA export from the nucleus. pCMV-G encodes the vesicular stomatitis virus glycoprotein (VSV-G) that replaces HIV-1 Env. VSV-G expands the tropism of the vectors and allows concentration via ultracentrifugation 13. All the genes encoding the accessory proteins, including Vif, Vpr, Vpu, and Nef are excluded in the packaging system. The production and manipulation of lentiviral vectors should be carried out according to NIH guidelines for research involving recombinant DNA (http://oba.od.nih.gov/oba/rac/Guidelines/NIH_Guidelines.pdf). An approval from individual Institutional Biological and Chemical Safety Committee may be required before using lentiviral vectors. Lentiviral vectors are commonly produced by cotransfection of 293T cells with lentiviral transfer plasmid and the helper plasmids encoding the proteins required for vector packaging. Many lentiviral transfer plasmids and helper plasmids can be obtained from Addgene, a non-profit plasmid repository (http://www.addgene.org/). Some stable packaging cell lines have been developed, but these systems provide less flexibility and their packaging efficiency generally declines over time 14, 15. Commercially available transfection kits may support high efficiency of transfection 16, but they can be very expensive for large scale vector preparations. Calcium phosphate precipitation methods provide highly efficient transfection of 293T cells and thus provide a reliable and cost effective approach for lentiviral vector production.
In this protocol, we produce lentiviral vectors by cotransfection of 293T cells with four plasmids based on the calcium phosphate precipitation principle, followed by purification and concentration with ultracentrifugation through a 20% sucrose cushion. The vector titers are determined by fluorescence- activated cell sorting (FACS) analysis or by real time qPCR. The production and titration of lentiviral vectors in this protocol can be finished with 9 days. We provide an example of transducing these vectors into murine neocortical cultures containing both neurons and astrocytes. We demonstrate that lentiviral vectors support high efficiency of transduction and cell type-specific gene expression in primary cultured cells from CNS.
Protocol
1. אריזות של וקטורים lentiviral
וקטורים lentiviral המיוצרים על ידי cotransfection של וקטור העברת lentiviral ו פלסמידים אחרים הנדרשים האריזה לתוך התאים 293T בשיטה סידן פוספט transfection. אנו משתמשים 10 100 מ"מ בתרבית רקמה מנות בפרוטוקול זה. זה יכול להיות scaled למעלה או למטה בהתאם יישומים. קו תא 293T נשמרים שונה Dulbecco של הנשרים בינוני (DMEM) עם גלוקוז גבוה (4,500 מ"ג / ל '), השלימו עם סרום 10% שור עוברית (FBS), 100 יחידות / מ"ל פניצילין, 100 מיקרוגרם / מ"ל סטרפטומיצין ב 37 ° C חממה עם 5% CO 2.
- 293T זרעים תאים בכל מפגש 30-40% עד 10 100 מ"מ תרבות מנות רקמות (3 x 10 6 תאים / צלחת) ב בינוני התרבות. להחזיר את התאים חממה.
- לאחר 20-24 שעות תרבות, לבדוק את צפיפות התאים. התאים צריך להיות בערך 80% המפגש בזמן transfection.
- הכן צינורית 50 מ"ל. הוסף 4.4 מ"ל TE79/10 (1 mM TrisHCl, 0.1 מ"מEDTA, pH 7.9) פחות נפח כולל של DNA פלסמיד הבאה. להוסיף 100 מיקרוגרם העברת lentiviral פלסמיד (איור 1), 58 מיקרוגרם pMDLg / pRRE, 31 מיקרוגרם pCMV-G, 25 מיקרוגרם pRSV-Rev, 600 μl 2M CaCl 2. מערבבים בעדינות.
- הכן עוד צינור 50 מ"ל. הוסף 5 מ"ל 2x בהרוורד (0.05 HEPES M, 0.28 M NaCl, 1.5 מ"מ Na 2 HPO 4, pH 7.12).
- קח את ה-DNA-CaCl 2 תערובת של 10 מ"ל פיפטה ולהוסיף צינור המכיל 2 x בהרוורד, dropwise תוך vortexing צינור.
- שמור על תגובה משקעים בטמפרטורת החדר (RT) למשך 30 דקות.
- להסיר את הכלים מן התרבות בחממה. מערבבים את התגובה משקעים היטב על ידי vortexing. הוסף 1 מ"ל של השעיה על כל 100 מ"מ המכילים תאים צלחת. ההשעיה יש להוסיף לאט, תוך dropwise בעדינות מתערבל בינוני בצלחת. להחזיר את הכלים ולעזוב את החממה H 5.
- הסר בינוני מתרבות. הוסף 6 מ"ל תרבות טרי בינוני המכיל 6 נתרן mM butyrate על כל מאכל. להחזיר את התרבויות כדי חממה. לאחר לילה תרבות, אם יש כתב ניאון לבנות, לבדוק ביטוי גנים כתב תחת מיקרוסקופ פלואורסצנטי. בדרך כלל, מעל 80% של התאים לבטא את הגן הכתב אם הוא מונע על ידי האמרגן נמצא בכל מקום (למשל האמרגן CMV).
- יומיים (40-44 שעות) לאחר transfection, לאסוף supernatant מ -10 מנות לתוך צינורות 2 50 מ"ל (כ - 30 מ"ל כל הצינור). להקפיא את supernatant ב -80 ° C או במקפיא עבור לשלב הבא.
2. ריכוז וטיהור של הווקטורים
- בצנטריפוגה אסף טרי או מופשר supernatant ב 900 גרם (כ סל"ד 2000) במשך 10 דקות כדי להסיר כל פסולת תא supernatant.
- צרף מזרק של 60 מ"ל ל-מסנן 0.2 מיקרומטר מזרק SFCA. העברת supernatant מהצינור 50 מ"ל ל המזרק. סנן supernatant לתוך צינור צנטריפוגות polyallomer.
- קחו 5 מ"ל סוכרוז 20% (שהוכנה PBS) בתוך פיפטה של 5 מ"ל. להכניספיפטה אל החלק התחתון של הצינור צנטריפוגה המכילה supernatant. לאט לאט להוסיף את הפתרון סוכרוז תחת supernatant וקטור. חזור על שלבים אלה עבור supernatant מהצינור אחר.
- בצנטריפוגה supernatant ב 11000 סל"ד ו - 4 מעלות צלזיוס למשך 4 שעות עם הרוטור SW28 הנדנדה Beckman.
- הסר את supernatant. הוסף 150 μl לקטוז 4% (להכין PBS) על צינור כל צנטריפוגות. Resuspend את כדורי.
- להעביר את וקטור מרוכז מכל צינורות צנטריפוגות כדי צינור 1.5 מ"ל. השאירו את הצינור על קרח במשך 15 דקות.
- מערבבים את ההשעיה על ידי וקטור pipetting. להסתובב עם microcentrifuge במלוא המהירות (כ 16000 ז) דקות 1.
- העברת supernatant לצינור 1.5 מ"ל חדשה. מחלקים את המדגם הסופי ל -20 aliquots μl ומאחסנים אותם במקפיא -80 ° C.
3. טיטרציה של הווקטורים
- זרע 5 X 10 4 / היטב HT1080 תאים בצלחת 12-היטב בינוני 1 DMEM מ"ל השלימו עם FBS 10%.
- לאחר overnigתרבות HT, לספור תאים מאחד וציון מספר התא.
- לעשות 5 פי דילול סדרתי (01:05, 1: 25, 1:125, 1:625 ו) של וקטור מרוכז עם המדיום לתרבות. הוסף אני μl של וקטור כל בדילול מלא לבארות נפרדים. דוגמאות ניתן לשכפל להגדיל את הדיוק.
- הוסף 1 μl 4 מ"ג / מ"ל Polybrene (Hexadimethrine ברומיד) ב וקטור המכיל כל טוב, אל גם בלי וקטור. מערבבים בעדינות את ידי רועדת בצלחת. חזור אל חממה H 48.
- הסר בינוני מבארות תרבית תאים. לשטוף היטב עם כל PBS. הוסף 250 μl 1x trypsine-EDTA הפתרון התאים. כאשר תאים מנותקים (3-5 דקות), להוסיף 1 מ"ל התרבות בינוני. Resuspend את התאים על ידי pipetting. להעביר את ההשעיה התא 1.5 צינורות צנטריפוגות מ"ל.
- סרכזת ב 900 גרם של 6 דקות. עבור וקטורים עם הגן כתב ניאון (למשל GFP), עבור לשלב 3.7 לניתוח FACS. עבור וקטורים ללא כתב, עבור לשלב 3.8 עבור QPCR בזמן אמת.
- עבור וקטורים המכילים fluoהגן כתב rescent, הסר supernatant ו resuspend גלולה עם 300 μl של פורמלדהיד 3.7% ב PBS. לקבוע את אחוז התאים הכתב חיוביות בניתוח FACS. Titer יהיה מיוצג כיחידות התמרה למיליליטר מרוכזת וקטור (TU / ml).
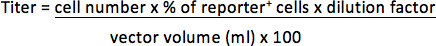
לדוגמה, אם 1 x 10 5 תאים היה transduced עם μl 1/25 (0.04 μl) וקטור תאים 30% הם עיתונאי חיובי, titer יהיה:
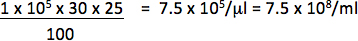
השתמש רק דילולים נופלים במערכת יחסים לינארית בין אחוז התאים החיוביים כמות וקטור הוסיף לחשב titer. Titer הסופי צריך להיות הממוצע של המתקבלים titers transductions של לפחות 2 כמויות שונות של וקטור.
- עבור וקטורים ללאהגן הכתב ניאון, לחלץ הדנ"א הגנומי של HT1080 תאים באמצעות QIAamp DNA מיני קיט (Qiagen) לפי הפרוטוקול של היצרן. להגביר את רצף וקטור ב-DNA גנומי באמצעות ABI Prism 7000 זיהוי רצף System (Applied Biosystems) עם פריימרים (באזור ה-HIV-1 PBS / psi 17) 5'-CCGTTGTCAGGCAACGTG-3 'ו 5'-AGCTGACAGGTGGTGGCAAT-3', ו TaqMan בדיקה 5 "-FAM-AGCTCTCTCGACGCAGGACTCGGC-טמרה-3". הגן אלבומין כי הוא גן עותק יחיד בגנום (2 עותקים / תא) היה מוגבר גם primers 5'-TGAAACATACGTTCCCAAAGAGTTT-3 "ו 5'-CTCTCCTTCTCAGAAAGTGTGCATAT-3", ו החללית 5'-FAM-TGCTGAAACATTCACCTTCCATGCAGA-טמרה-3 "כמו שליטה פנימי. לקבוע את המספרים עותק של וקטור ואלבומין ידי PCR בצלחת 96-גם על פי הוראה של ייצור עם התוכנית הבאה: 50 מעלות צלזיוס למשך 2 דקות, 95 מעלות צלזיוס במשך 10 דקות, ו 35 מחזורים של 95 מעלות צלזיוס למשך 15 שניות ו 60 מעלות צלזיוס למשך 2 דקות. פי עשרה דילולים סדרתי של פלסמידים של ריכוז ידוע (המיוצג כעותקמספר) המכיל את רצפי תבנית צריך גם להיות מוגבר כדי ליצור עקומת תקן כימות של דגימות לא ידועות. Titer יהיה מיוצג כיחידות אינטגרציה למיליליטר מרוכזת וקטור (IU / ml).
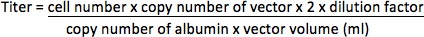
4. התמרה של תרבויות הניאוקורטקס
תרבויות הניאוקורטקס המכילים שני נוירונים גליה מוכנים מן הקורטקס העכבר באמצעות הליך דו שלבי ציפוי כפי שתואר קודם 18. Neocortices שהתקבלו בעכברים העובר על ההריון 14-16 ימים הם מצופה על monolayer גליה הקימה בעבר MEM השלימו עם 10% FBS, גלוקוז 20 מ"מ ו 2 מ"מ גלוטמין צלחת 24 גם בתרבית רקמה.
- לאחר 5 ימים במבחנה, מוסיפים 10 מיקרומטר ציטוסין arabinoside (ערה, ג) ב neocתרבות ortical לעכב שאינם העצבית חלוקת התא. המשך התרבות תאים של 2 ימים.
- בינוני התרבות חם 37 ° C אמבט מים למשך 5-10 דקות. החלף ערה-C המכיל בינוני עם בינוני תרבות טרי (500 μl / טוב).
- הוסף וקטור עם הרצוי משרד הפנים (ריבוי של זיהום, היחס בין מספר החלקיקים וקטור למספר תאים היעד) לתרבות. המשך התרבות עבור H 24. אנו משתמשים משרד הפנים של 1-10 (בדרך כלל 5) בתרבויות קורטיקליים ראשוניים.
- החלף בינוני עם התרבות בינוני טרי. המשך התרבות. אם יש גן הכתב מבנה וקטור, לבדוק תאים תחת מיקרוסקופ פלואורסצנטי 2 ימים לאחר התמרה. ביטוי גנים הכתב יהיה גלוי בנוירונים 2-7 לאחר התמרה, בהתאם לעיצוב וקטור והמנה בשימוש.
5. נציג תוצאות
את titers של וקטורים lentiviral מיוצר עם מגוון זה פרוטוקול 8 10 -10 10 IU / mL, whicH מתאימים התמרה של מגוון רחב של סוגי תאים מתוך מערכת העצבים המרכזית הן במבחנה in vivo. טבלה 1, איור 2 מראה תוצאה נציג באמצעות וקטורים המיוצרים על ידי פרוטוקול זה. אנחנו transduced תרבויות שבמוח Murine עם וקטורים lentiviral המבטאים ירוק ניאון חלבון (GFP) הנשלטת על ידי היזם (SYN) synapsin או גליה fibrillary חומצי (GFAP) האמרגן חלבון. שבעה ימים לאחר התמרה, ביצענו immunostaining לנוירונים התווית לבין האסטרוציטים עם נוגדנים נגד NeuN ואנטי GFAP, בהתאמה. כפי שמוצג בטבלה 1, איור. 2 א, אחרי התמרה עם וקטור נושא את האמרגן synapsin, מעל 90% של נוירונים (תאים NeuN +) אקספרס GFP ולא האסטרוציטים (GFAP + תאים) להביע את הגן הזה כתב. כאשר היזם GFAP משמש מבנה וקטור (איור 2 ב), כ -80% האסטרוציטים (GFAP + תאים) הבעהשל ה-GFP, כל + תאים GFP הם האסטרוציטים כפי שאישרה colocalization עם GFAP והיעדר ביטוי GFP בתאים NeuN, שכותרתו. תוצאות אלו מראות כי וקטורים lentiviral יעילים מאוד כדי לספק transgenes לתאים של מערכת העצבים המרכזית של התא ספציפי ביטוי גנים יכולה להיות מושגת כאשר היזמים המתאימים משמשים.
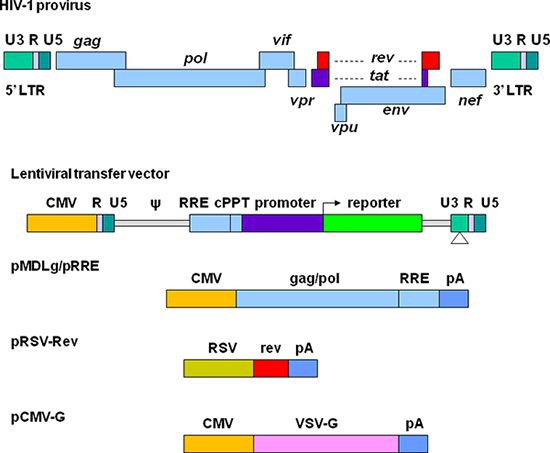
באיור 1. ייצוג סכמטי של HIV מבוססות וקטורים lentiviral ואת פלסמידים אריזה. Provirus-1-HIV מוצג בחלק העליון. גורמים לייצור וקטור מופרדים לארבע פלסמידים שונים. העברת lentiviral הפלסמיד מכיל LTR היברידית '5 שבו האזור U3 מוחלף ציטומגלווירוס (CMV) האמרגן, האות אריזה (ψ), רצף RRE, מערכת polypurine המרכזית (cPPT), הגן של עניין (לדוגמה: כתב ניאון) יחד עם האמרגן של בחירה, LTR '3 שבורצפים רגולטוריים חבר העמים יוסרו לחלוטין מאזור U3. pMDLg / pRRE מכיל איסור פרסום וגנים pol ורצף RRE מ-HIV-1 בשליטת היזם CMV. pRSV-Rev מכיל את רצף הקידוד של Rev מונע על ידי האמרגן RSV. pCMV-G מכיל את הגן VSV-G חלבון בשליטת היזם CMV. הרשות מציינת את האות polyadenylation מן הגן β-גלובין האדם.
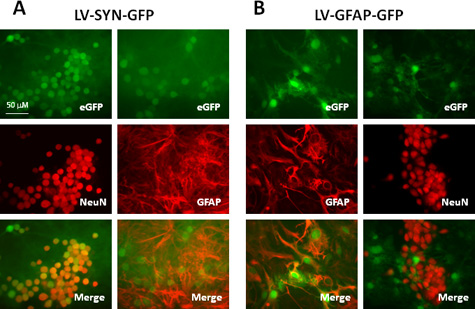
איור 2. הביטוי של גנים הכתב בתרבות העכבר הניאוקורטקס מעורבת transduced עם וקטורים lentiviral שנשאו סוג ספציפי מקדמי סלולריים. התרבויות היו transduced עם LV-SYN-GFP () או LV-GFAP-GFP וקטורים (ב) משרד הפנים של 5. שבעה ימים לאחר התמרה, התאים היו immunostained עם נוגדנים נגד NeuN או נגד GFAP. לוחות העליונות להראות GFP הקרינה, לוחות הביניים מראים immunostaining לוחות נמוכות מתמזגים תמונות (GFP: ירוק NeuN או GFAP: אדום).
| וקטור | GFP + תאים נוירונים | GFP + ב האסטרוציטים |
| LV-SYN-GFP | 92.2 ± 7.3 | 0 |
| LV-GFAP-GFP | 0 | 78.3 ± 11.5 |
טבלה 1. השוואה בין ביטוי של GFP בתרבויות שבמוח Murine transduced עם וקטורים lentiviral נושאים שונים כמה יזמים.
תרבויות כמה שבמוח Murine (5 X 10 5/24 טוב גם צלחת) היו transduced עם LV-SYN-GFP או LV-GFAP-GFP על משרד הפנים 5. שבעה ימים לאחר התמרה, תרבויות קובעו immunostained עבור NeuN או GFAP. מספר התאים ה-GFP ו NeuN / GFAP המבטאים נמנו תמונות 10 שדות בכל תנאי הניסוי. הערכים מייצגים את האחוז של נוירונים (תאים NeuN +) אוהאסטרוציטים (GFAP + תאים), אשר הביע את הגן כתב ה-GFP. הערכים המוצגים הם ממוצעים ± סטיית תקן של שלושה ניסויים בלתי תלויים.
Access restricted. Please log in or start a trial to view this content.
Discussion
בפרוטוקול זה, הראינו את הייצור של וקטורים lentiviral ויישום של וקטורים אלה בתרבויות המוח. הראינו יעיל תא סוג ספציפי התמרה עם וקטורים המיוצרים בשיטות אלה. כאשר היזם synapsin משמש, ביטוי של GFP הוא בהחלט נוירון מסוים. כאשר היזם GFAP משמש, ביטוי של GFP הוא אך ורק האסטרוציטים. אם לא ביטו?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
עבודה זו נתמכה על ידי המוח NIH תכנית אב Core מענק (p30 NS057105, BJS) כדי אוניברסיטת וושינגטון, תוכנית פרויקט גרנט NS032636 (BJS) ועל ידי מרכז התקווה הפרעות נוירולוגיות.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
| DMEM | Sigma-Aldrich | D5796 | |
| MEM | Invitrogen | 11090-081 | |
| בסרום שור עוברית | Hyclone | SV3001403 | |
| PBS | Mediatech | 21-040-CM | |
| טריפסין-EDTA | Sigma-Aldrich | T3924 | |
| סודיום בוטיראט | Sigma-Aldrich | B5887 | |
| Hexadimethrine ברומיד (Polybrene) | Sigma-Aldrich | H9268 | |
| 293T תאים | ATCC | CRL-11268 | |
| HT1080 תאים | ATCC | CCL-121 | |
| פלקון 100 x 20 מ"מ רקמת תרבותה מנה | BD Biosciences | 353003 | |
| 1 x 3 ½ בצינור צנטריפוגות polyallomoer | Beckman Coulter- | 326823 | |
| 0.2 מיקרון המסנן המזרק | קורנינג | 431219 | |
| QIAamp DNA מיני קיט | Qiagen | 51304 |
References
- Naldini, L. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272, 263-267 (1996).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J. Virol. 72, 9873-9880 (1998).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nat. Rev. Neurosci. 4, 353-364 (2003).
- Gascon, S., Paez-Gomez, J. A., Diaz-Guerra, M., Scheiffele, P., Scholl, F. G. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. J. Neurosci. Methods. 168, 104-1012 (2008).
- Hioki, H. Efficient gene transduction of neurons by lentivirus with enhanced neuron-specific promoters. Gene Ther. 14, 872-882 (2007).
- Li, M. Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells. J. Neurosci. Methods. 189, 56-64 (2010).
- Naldini, L., Blomer, U., Gage, F. H., Trono, D., Verma, I. M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. U.S.A. 93, 11382-11388 (1996).
- Blomer, U. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. J. Virol. 71, 6641-6649 (1997).
- Consiglio, A. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc. Natl. Acad. Sci. U.S.A. 101, 14835-14840 (2004).
- Jakobsson, J., Ericson, C., Jansson, M., Bjork, E., Lundberg, C. Targeted transgene expression in rat brain using lentiviral vectors. J. Neurosci. Res. 73, 876-885 (2003).
- Arya, S. K., Guo, C., Josephs, S. F., Wong-Staal, F. Trans-activator gene of human T-lymphotropic virus type III (HTLV-III). Science. 229, 69-73 (1985).
- Sirven, A. The human immunodeficiency virus type-1 central DNA flap is a crucial determinant for lentiviral vector nuclear import and gene transduction of human hematopoietic stem cells. Blood. 96, 4103-4110 (2000).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8033-8037 (1993).
- Farson, D. A new-generation stable inducible packaging cell line for lentiviral vectors. Hum. Gene Ther. 12, 981-997 (2001).
- Broussau, S. Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol. Ther. 16, 500-507 (2008).
- Wang, X., McManus, M. Lentivirus production. J. Vis. Exp. (32), e1499(2009).
- Sastry, L., Johnson, T., Hobson, M. J., Smucker, B., Cornetta, K. Titering lentiviral vectors: comparison of DNA, RNA and marker expression methods. Gene Ther. 9, 1155-1162 (2002).
- Snider, B. J., Lobner, D., Yamada, K. A., Choi, D. W. Conditioning heat stress reduces excitotoxic and apoptotic components of oxygen-glucose deprivation-induced neuronal death in vitro. J. Neurochem. 70, 120-129 (1998).
- Mazarakis, N. D. Rabies virus glycoprotein pseudotyping of lentiviral vectors enables retrograde axonal transport and access to the nervous system after peripheral delivery. Hum. Mol. Genet. 10, 2109-2121 (2001).
- Kato, S. Neuron-specific gene transfer through retrograde transport of lentiviral vector pseudotyped with a novel type of fusion envelope glycoprotein. Hum. Gene Ther. 22, 1511-1523 (2011).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Kutner, R. H., Puthli, S., Marino, M. P., Reiser, J. Simplified production and concentration of HIV-1-based lentiviral vectors using HYPERFlask vessels and anion exchange membrane chromatography. BMC Biotechnol. 9, 10(2009).
- Laughlin, M. A., Chang, G. Y., Oakes, J. W., Gonzalez-Scarano, F., Pomerantz, R. J. Sodium butyrate stimulation of HIV-1 gene expression: a novel mechanism of induction independent of NF-kappa B. J Acquir Immune Defic Syndr Hum Retrovirol. 9, 332-339 (1995).
- Gasmi, M. Requirements for efficient production and transduction of human immunodeficiency virus type 1-based vectors. J. Virol. 73, 1828-1834 (1999).
- Palsson, B., Andreadis, S. The physico-chemical factors that govern retrovirus-mediated gene transfer. Exp. Hematol. 25, 94-102 (1997).
- Lizee, G. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum. Gene Ther. 14, 497-507 (2003).
- Lee, J. K., Chung, J., McAlpine, F. E., Tansey, M. G. Regulator of G-Protein Signaling-10 Negatively Regulates NF-{kappa}B in Microglia and Neuroprotects Dopaminergic Neurons in Hemiparkinsonian Rats. J. Neurosci. 31, 11879-11888 (2011).
- Shevtsova, Z., Malik, J. M., Michel, U., Bahr, M., Kugler, S. Promoters and serotypes: targeting of adeno-associated virus vectors for gene transfer in the rat central nervous system in vitro and in vivo. Exp. Physiol. 90, 53-59 (2005).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved