A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הקלטה אופטית של פעילות עצבית suprathreshold עם רזולוצית תא בודד ויחיד ספייק
In This Article
Summary
הבנת התפקוד של מערכת העצבים מרכזי החוליות דורשת הקלטות מנוירונים רבים בגלל תפקוד קליפת המוח מתעורר ברמה של אוכלוסיות של נוירונים. כאן אנו מתארים שיטה אופטית להקלטת פעילות עצבית suprathreshold עם רזולוצית תא בודד ויחיד ספייק, התלבטה סריקה בגישה אקראית. זה מסמל שיטה רשום סומטיות קרינת סיד מעד 100 נוירונים עם רזולוציה גבוהה זמנית. אלגוריתם מקסימאלי סבירות deconvolves הפעילות העצבית suprathreshold הבסיסית מאותות סיד הקרינה סומטיות. שיטה זו אמינה מזהה קוצים עם איתור יעיל גבוהים ושיעור נמוך של תוצאות חיוביות שגויות ויכולה לשמש כדי לחקור אוכלוסיות עצביות במבחנה ו In vivo.
Abstract
איתות של מידע במערכת העצבים מרכזי החוליות לעתים קרובות מבוצעת על ידי אוכלוסיות של תאי עצב ולא נוירונים בודדים. גם התפשטות של פעילות spiking suprathreshold כרוכת אוכלוסיות של נוירונים. מחקרים אמפיריים העוסקים בתפקוד של קליפת המוח באופן ישיר ובכך מחייבים הקלטות מאוכלוסיות של נוירונים עם רזולוציה גבוהה. כאן אנו מתארים שיטה אופטית ואלגוריתם deconvolution להקליט פעילות עצבית מהמרחק של עד 100 נוירונים עם החלטה אחת תא וחד ספייק. שיטה זו מסתמכת על גילוי של העליות החולפות בריכוז הסידן תוך תאי הגופני קשור עם קוצי חשמל suprathreshold (פוטנציאל פעולה) בנוירונים בקליפת המוח. רזולוציה גבוהה זמנית של ההקלטות האופטיות מושגת על ידי טכניקת סריקה מהירה בגישה אקראית באמצעות deflectors acousto אופטי (AODs) 1. עירור שני פוטונים של התוצאות בסידן רגיש צבע ברזולוציה מרחבית גבוהה בtis המוח האטוםלתבוע 2. שיקום של קוצים מהקלטות סיד הקרינה מושג על ידי שיטה מקסימלי סבירות. הקלטות אלקטרו אופטיות ובו זמנית מצביעות על כך שהשיטה שלנו אמינה מזהה קוצים (> 97% איתור יעיל ספייק), יש שיעור נמוך של זיהוי חיובי כוזב ספייק (<0.003 קוצים / ים), ודיוק גבוה זמני (כ 3 ms) 3. שיטה זו של זיהוי אופטית ספייק ניתן להשתמש כדי להקליט את הפעילות עצבית במבחנה בחיות מורדמות in vivo 3,4.
Protocol
1. התקנה אופטית (איור 1)
- עבור עירור שני פוטוני מערכת ליזר פעם אינפרא אדומה עם פולסים femtosecond משמשת. הספק ליזר גבוה (במקרים מסוימים> 2W באורך גל nm 890) נדרש כדי לקזז את ההפסדים הגדולים שהונהגו על ידי הרכיבים האופטיים של המערכת.
- מערכת המורכבת משתי prechirper מנסרות מקנה פיזור מהירות חבורה שלילית (GVD) על גבי פעימות ליזר לפני את deflectors acousto האופטי (AODs) כדי לפצות על הפיזור הזמני הוצג על ידי 1 AODs.
- שתי AODs עם פתחים גדולים (10 מ"מ למטרת טבילה במי 40X עם NA 0.8) להסיט את קרן הליזר בשני ממדים.
- סריג עקיף רעיוני עם 100 מטעים / מ"מ ממוקם 13 סנטימטרים מאחורי AODs לפצות את הפיזור המרחבי הוצג על ידי AODs בעת שימוש בפעימות ליזר קצרות.
- קרן הליזר מכוונת עם שני טלסקופי ממסר ליציאת המצלמה של microsco זקוףpe.
- אירוס ממוקם במרווחי זמן קבועים ליישור של הרכיבים האופטיים.
- Beamsplitter Dichroic מול אובייקטיבי משדר את אור אינפרא אדום לעירור את הדגימה ומשקפת את אור פלואורסצנטי מדגימה על גלאי.
- הגלאי וEpi transfluorescence (photomultipliers, PMTs) לאסוף אות פלואורסצנציה דרך אובייקטיבי ו-- אם קיימים - דרך הקבל.
- מסנני זכוכית צבעוניים (BG-39, 3-5 מ"מ) ממוקמים בחזית של הגלאי כדי למנוע אור עירור מגיע לגלאים.
- זוויות סטיית AOD נשלטות על ידי מחשב שמצויד דיגיטלי אנלוגי ממיר לוח (156.25 קצב שעון קילוהרץ), אשר בתורו מניע מתנדים מתח מבוקרים.
- האות מphotomultipliers מועברת דרך מסנן Butterworth נמוך לעבור (תדר חתך של kHz 100) ועל ידי דיגיטציה אנלוגי דיגיטלי בממיר (156.25 קצב שעון קילוהרץ) לפני שמאוחסן במחשב לניתוח.
- יישור ורעש חשמלי נבדקים על ידי הקלטת חלוקת אותות קרינה עם ובלי אור ליזר, ברווח נמוך וגבוה של photomultipliers, כמו גם עם ובלי חיווי. הסורק בצורה נכונה הוא התקנה והמוגן כאשר הרוחב של ההתפלגות את אותות הקרינה ברווח גבוה ועם מחוון הוא הרבה יותר גדול מאשר הרוחב של ההפצות האחרות של אותות קרינה (איור 2).
2. פרוצדורות
- סריקה התלבטה גישה אקראית מסתמכת על גילוי של גידול התאי בסידן. מספר גדול של תאי עצב יכול להיות מוכתם באמצעות הזרקת בולוס של טופס אסתר של מחוון סיד (למשל אורגון גרין 488 Bapta-1 בבוקר) לרקמות עצביות 5.
- כמה מקומות מכל נוירון סומה נרשמים, כל אחד לזמן קצר ("היסוסים", 4 מקומות, 6.4 μs עבור כל מיקום = 25.6 μs זמן הקלטה לדוארach נוירון בכל מחזור, איור. 3C). כדי לבחור נוירונים עניין מסגרת מלאה בהיקף של 256x256 פיקסלים נרכשה (איור 3 א). המרכז של כל נוירון סומא שיירשם נבחר באופן ידני בתמונה זו. תוכנות שליטה אוטומטית מוסיפות שלוש נקודות במרחק 2 מיקרומטר סביב המרכז הזה.
- בכל מחזור, אות פלואורסצנציה נרשמת מכל אחד מתאי העצב 40 (איור 3). תהליך זה חוזר על עצמו לכל משך הקלטה אחד (הקלטת 5 2 = 3255 מחזורים, מחזור 1 = 1.536 ms).
3. כלי תוכנה באינטרנט כדי למקסם את יעילות איתור ספייק
- איתור ספייק מאותות סיד סומטיות קרינה מסתמך על אות לרעש יחס גבוה (S / N) של אותות סיד הקרינה סומטיות. גבוה S / N יכול להיות מושגת על ידי הגדלת עוצמת גירוי. עוצמת עירור, לעומת זאת, ניתן להגדיל רק לגבול מסוים בגלל ניזקי שמש. איתור ספייק הוא גבוה בתוך windo קטן מאודw של עוצמות עירור היחיד שבו אותות קרינה יש S / N אבל גבוה רק מעט מאוד ניזקי שמש הוא ציין 3. על מנת להבטיח שאת האותות המוקלטים נמצאים בחלון של זיהוי ספייק גבוה במהלך הקלטות אנו עוקבים אחר שיעור פוטון (ראה משוואה 3.2) וירידה של הבסיס פלואורסצנטי באמצעות ניתוח באינטרנט.
- שיעור פוטון משוער לנוירון מחושב מחלון זמן קצר (100-200 ms) של רעש תחילת מחקר. מספר הפוטונים (N λ) ופוטון שיעור (λ = N λ / Δt) מחושב מערכי הקרינה על ידי התאמת החלוקה (σ) של שינויי קרינה יחסיים עם המשוואה הבאה:
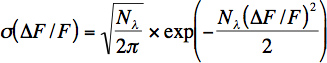
משוואה זו מייצגת את התפלגות פואסון לרעש יריית פוטון עם שינוי של משתנה לשינוי פלואורסצנטי יחסית: ΔF / F = (G * N λ (t)-G * N & לםBDA;, 0) / G * N λ, 0 כאשר G מציין את הרווח המצטבר של מכפיל וכל הרכיבים האלקטרוניים האחרים. שים לב שמשוואה זו אינה קובעת נכון המספר של פוטונים שזוהו בהקלטות עבור vivo כי יש מקורות אחרים של רעש (ממצא תנועה), בנוסף לרעש יריית פוטון. עם זאת משוואה זו היא שימושית עבור vivo בהקלטות כדי לאמוד את הרעש.
- Baseline פלואורסצנטי מחושב מאותו חלון הזמן וזמם כפונקציה של זמן או ניסויים. הירידה הממוצעת של בסיס נשמרת מתחת 0.0002 / s על ידי התאמת כוח הליזר כי גילוי ספייק מהירות יורד כאשר עולים על מגבלה זו.
- כל 10-20 דקות את עמדות somata נוירון מאומתות על ידי רכישת תמונה מלאת מסגרת שוב. במידת צורך, מקומות הקלטה מותאמים. מיקומים יכולים להיות מותאמים לכל הנוירונים בפעם אחת, או לנוירונים בודדים.
4. Reconstruction של תזמוני ספייק מאותות קרינה (deconvolution)
- את אותות קרינה הנובעים מפעילות עצבית לעתים קרובות summate בזמן בגלל הדעיכה של עוברי הסידן היא ארוכה (כמה מאה האלפיות שניים). שיטת deconvolution משחזרת תזמוני ספייק וספייק מאותות קרינה.
- כדי לקבוע את רכבת ספייק הסבירה ביותר העומדת בבסיס אות פלואורסצנציה המוקלטת, מודלים שונים בהשוואה. כאן נקט באלגוריתם גנטי כדי לקבוע את המודל - ולכן רכבת ספייק ותזמוני ספייק - עם הסיכוי המרבי.
- באוכלוסיות הומוגניות של נוירונים, ספייק עורר אות הסידן יכולה להשתנות בין הנוירונים. לניתוח ללא השגחה של ערכות נתונים שתוכננו אלגוריתם שלוקח בחשבון את השונות של אות סיד ספייק עורר-מתא העצב לתא עצב.
- כדי להימנע ממספר גדול של תגליות חיוביות כוזבות הוא שימושי כדי להצר את המשרעת המותרת והדעיכה המתמדת של מ 'אודל של אות סיד ספייק עורר-. ההתפלגות המשותפת של הזמן משרעת ודעיכה המתמיד של הארעיים סיד עוררו חד ספייק נרשמת בקבוצה נפרדת של ניסויים מאותו הסוג של תאי עצב באותם תנאי ניסוי באמצעות הקלטות אלקטרו אופטיות ובו זמנית.
- כדי להסביר שינויים בסיסיים איטיים וכדי לצמצם עלויות חישוביים deconvolving, הקלטות ארוכות יותר מחולקות למספר עקבות קצרות יותר של 1-5 שניות.
- לכל נוירון וכל הקלטה, אלגוריתם deconvolution עשוי לבחון מספר רב של דגמים (עד 1,000,000 דגמים שונים או יותר). כדי לזרז את deconvolution, ניסוי אחד deconvolved על עד 10 מחשבים שונים במקביל.
- לאחר deconvolution, ספייק הנתונים נותחו ובחן. היסטוגרמה peri-גירוי זמן, הסתברות ספייק, וקצב ירי (ספייק הממוצע לתאי עצב) מחושבות באופן אוטומטי.
5.נציג תוצאות
צירים מוצלחים ספייק גילוי על יחס אות לרעש גבוה של אותות סידן נרשמו הקרינה סומטיות. כל שעליך לעשות שימוש בשיעורים גבוהים (עירור כוח הליזר גבוה) יכול לגרום להשפעות שליליות של photoeffects בחומר ביולוגי (ניזקי שמש). בניזקי שמש סריקת מיזוג צבעים בגישה אקראית מתבטא כירידה בפלואורסצנטי תחילת המחקר ומפחית את אותות ספייק עוררו-הסיד פלואורסצנטי. הירידה באות ספייק עורר-יכולה לגרום במהירות בכישלון לזהות קוצים. יש רק חלון קטן מאוד של עוצמת עירור שבם זיהוי ספייק מאותות קרינה הוא גבוה. בסופו של דבר הגבוה יותר חלון זה מוגבל על ידי ניזקי שמש, בקצה התחתון את אותות הקרינה יש יחס נמוך בין אות לרעש. לנוירונים בקליפת מוח בפרוסות חריפות שאנו משתמשים בכוח הליזר וכתוצאה מכך שיעורי פוטון של כ 400,000-1,500,000 פוטון / s בעת הקלטה בכ 100 מיקרומטר מתחת לפני שטח פרוסה. בעת שימוש גבוהמחוון זיקה - כאן אורגון גרין 488 BAPTA - 1 - אותות זה מספיק כדי לזהות קוצים בודדים. איור. 3E מראה דוגמה של אות פלואורסצנציה נרשמה בשיעור נמוך מאוד עירור, דוגמה אחת של הקלטה בתוך חלון זיהוי, ואחד בקצב עירור גבוה מאוד.
בהשוואה לשיטות אחרות כדי לתעד פעילות עצבית עם רזולוצית תא בודד ויחיד ספייק, התלבט סריקה בגישה אקראית ניתן להקליט ממספר גדול יותר של תאי עצב מאותה האוכלוסייה, מקומית והוא פחות פולשנית לדוגמה בהשוואה להקלטות tetrode / multielectrode . סריקה לכן מיזוג צבעים בגישה אקראית ניתן להשתמש כדי להקליט את הפעילות עצבית מתא עצב רב למדוד מידע הדדי אותת על ידי פעילות suprathreshold 6 (איור 4 א), שינויים בפעילות עצבית באוכלוסייה של נוירונים בקליפת המוח (פלסטיות), והתפשטות של פעילות suprathreshold דרך אוכלוסיות של נוירונים 14 (איור 4 ב)
alt = src "איור 1" = "/ files/ftp_upload/4052/4052fig1.jpg" />
איור 1. עיצוב אופטי של התקנת גישת סריקת מיזוג צבעים האקראית.
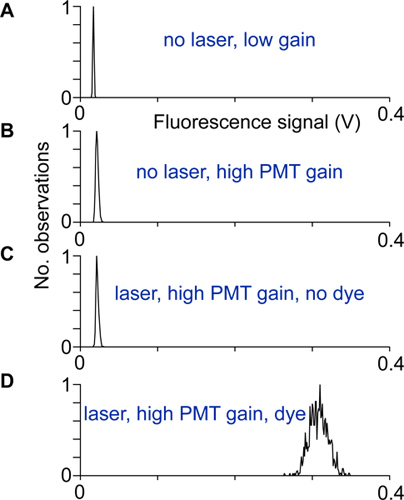
איור 2 יישור ובדיקה:. הפצות של אותות קרינה שנרשמו בתנאים שונים. א) לא אור ליזר ורווח מכפיל נמוך, ב ') ברווח גבוה יותר PMT, אבל אין אור ליזר, החלוקה הוא רחב יותר בגלל זרם חושך מכפיל. ג) עם הליזר ובנרשם ברווח PMT גבוה. הבדל בין ההפצות במוצגות בB והפצה זה היה מציין כי אור העירור מגיע לגלאי PMT. ד) חלוקת אותות קרינה נרשמה ברווח גבוה מנוירון somata. אם אין מקור רעש אחר תורם, חלוקה זו נובעת מרעש יריית פוטון יחיד.
. Jpg "/>
איור 3 תמונה) מלאת מסגרת פלואורסצנטי כדי לאתר ולבחור את עמדות somata נוירון, B) נתיב הסריקה של מחזור אחד, C) איור של עיקרון dithering;. בכל soma (העיגול) מספר מקומות נרשמים לפני שעבר לקרן הבאה סומה, ד) איור של הפלט של 2 D / A ערוצים. לכל נוירון סומה, אות פלואורסצנציה נרשמת מגיל 4 נקודות שונות בכל סומה (S1-S4). המיקום של כל נקודת נתונה על ידי X ומיקום Y. X ו-y העמדות לכל מקומות ובכל נוירונים נשלחים לממיר דיגיטלי לאנלוגי באופן רציף. בעוד שהקרן עברה בין somata 2 נוירון, אין אות נרכשה (ריק). ה) דוגמאות לאותות קרינה. שים לב שכל דוגמה מראה תגובה לאחת ספייק (כפי שנמדד עם הקלטת אלקטרו תא מצורף).
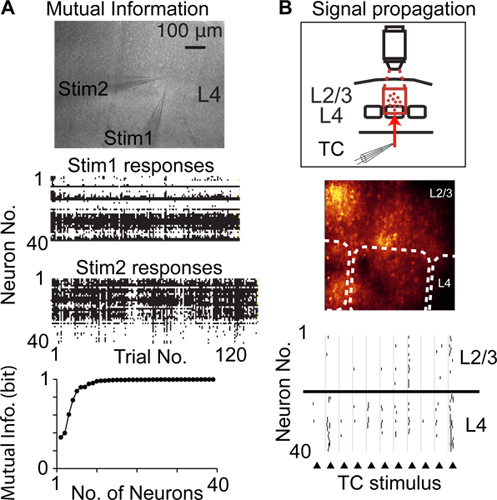
איור 4. לימוד קורטיפונקצית קלוריות באמצעות סריקת מיזוג צבעי גישה אקראית. א) מדידת מידע הדדי אותת על ידי אוכלוסיות של נוירונים. תמונה עליונה מציגה photomicrograph של פרוסת מוח חריפה ושתי pipettes גירוי שהונח באותה העמודה קליפת המוח בשכבה 4 (L4). גרפי מרכז להראות תגובות עצביות לכל חזרה על גירוי. גרף תחתון מציג המידע ההדדי של שאנון אותת על ידי האוכלוסייה נרשמה בתאי עצב. ב) ריבוי מדידת פעילות suprathreshold spiking (ריבוי אות) בין אוכלוסיות של נוירונים בקליפת המוח. גרף עליון מציג עיצוב ניסיוני, תמונה מראה תמונת מרכז פלואורסצנטי, קווים מקווקווים מציינים גבולות חבית, גרף תחתון מציג קוצים אותרו בתגובה לגירוי חשמלי של סיבי thalamocortical (משולשים).
Discussion
סריקה התלבטה בגישה אקראית בעקיפין מזהה פעילות suprathreshold spiking מהעליות בסיד סומטי תאי מקושר עם כל עלייה בsomata נוירון. העליות בסידן התאי מזוהות על ידי צבעי סיד ניאון. המגבלות של סריקת מיזוג צבעי גישה האקראית עולות במידה רבה משל יחס אות לרעש המוגבל של אותות קרינת סידן. יחס א?...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
אנו מודים לד"ר רנדי Chitwood לקראו את כתב היד קשה. עבודה זו נתמכה על ידי קרן וייטהול ומענקי פ אלפרד סלואן הקרן לHJK.
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב | חברה | מספר קטלוגים | תגובות (אופציונלי) |
| רכיבים אופטיים מפורטים בצו, החלו מהליזר | |||
| טיטאן: ספיר ליזר | קוהירנט בע"מ | זיקית Ultra 2 | הספק גבוה מומלץ (> 2W במהירות של 900 ננומטר) |
| עדשת achromatic f = 30 מ"מ | מעבדות Thor | AC254-030-B | ציפוי נגד השתקפויות (AR) 650-1050 ננומטר |
| עדשת achromatic f = 100 מ"מ | מעבדות Thor | AC254-100-B | AR 650-1050 ננומטר |
| עדשת f = 75 מ"מ | מעבדות Thor | LA1608-B | AR 650-1050 ננומטר |
| עדשה 175 מ"מ f = | מעבדות Thor | LA1229-B | AR 650-1050 ננומטר |
| עדשת achromatic f = 300 מ"מ | מעבדות Thor | AC254-300-B | AR 650-1050 ננומטר |
| עדשת achromatic f = 100 מ"מ | מעבדות Thor | AC254-100-B | AR 650-1050 ננומטר |
| עדשת achromatic f = 100 מ"מ | מעבדות Thor | AC254-100-B | AR 650-1050 ננומטר |
| deflectors Acousto אופטי | Intraaction קורפ | ATD 6510CD2 | |
| סריג עקיף רפלקטיבית | ניופורט | 53-011R | 100 חריצים / מ"מ לAODs עם רוחב פס MHz 65 וזווית סריקה של 45 mrad |
| 21.6 מ"מ רוסטר מנסרות | מבדה המחקר אופטיקה בע"מ | IBP21.6SF10 | |
| זכוכית צבעונית | שוט | BG-39 | |
| מראה Dichroic | Chroma הטכנולוגיה קורפ | Z532RDC | |
| מודולים מכפילים | Hamamatsu | H9305-03 | |
| DAC-ADC לוח | מכשירים הלאומיים | PCI-6115 | |
| אורגון גרין 488 Bapta-01:00 | Invitrogen | O-6807 |
References
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved