A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קצב העברת נתונים גבוה תא יחיד ו מרובה תאים מיקרו אנקפסולציה
In This Article
Summary
שילוב הדור monodisperse טיפה עם סידור אינרציה של תאים וחלקיקים, אנו מתארים שיטה כדי לתמצת המספר הרצוי של תאים או חלקיקים בטיפה אחת בשיעורים kHz. אנחנו מדגימים את יעילות פעמיים העולה על אלו של אנקפסולציה לא מסודרת עבור טיפות יחיד ו פעמיים החלקיקים.
Abstract
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
Protocol
הפרוטוקולים בסעיף זה מתארים את החומרים והציוד מנוצל במיוחד על מנת לקבל את תוצאות הניסויים שהוצגו. שימו לב ספקים חלופיים כימיקלים וציוד עשוי להיות מנוצל.
1. המכשיר ייצור ליתוגרפיה Soft
תקן טכניקות ליתוגרפיה רך, 21 במספר אשר הוצגו במאמרים קודמים יופיטר, 22 שימשו ליצירת polydimethylsiloxane (PDMS) רשתות מלוכדות microchannel מצעים זכוכית. מלבד ייצור העתק עובש על ידי אמן photolithography SU-8, התהליכים ניתן לבצע מחוץ לחדר נקי או מכסה המנוע נקי, עם זאת, אבק וחלקיקים עדיין צריך להיות ממוזער כדי להשיג תוצאות עקביות.
- עיצוב דפוס ערוץ מיקרו כפי שמוצג באיור 1 ב-AutoCAD (Autodesk Inc). מעסיקים יצרנית צד שלישי (Fineline הדמיה בע"מ) להדפיס ברזולוציה גבוהה (50,000 dpi) טרנסparency המסכה על הסרט מיילר או קוורץ שבו ערוצי שקופים על רקע כהה.
- צור סיליקון SU-8 עבור דפוס מאסטר photoresist העתק. בקיצור, ספין SU-8 2050 (MicroChem) photoresist שלילית עם סל"ד מומלץ של היצרן על coater ספין כדי ליצור שכבה עבה על 52 מיקרומטר כמה 7.5 ס"מ נקיים או 10 פרוסות סיליקון ס"מ. לאחר לאפות רך, EDGE הסרת חרוז, חשיפה UV דרך מסכה של איש קשר, שלאחר החשיפה לאפות, פיתוח, וחשיפה המבול, למדוד את עובי שכבת בפועל של 8-SU באמצעות profilometer Dektak (Veeco). סרט עובש אמן על החלק התחתון של התבשיל 4 "או 5" פטרי להתכונן דפוס העתק PDMS.
- מערבבים PDMS בסיס אלסטומר עם סוכן אלסטומר ריפוי (Dow Corning) ב 10:01 בסיס יחס W / ל לסוכן ריפוי. יוצקים גם מעורב מבשר PDMS על המאסטר סיליקון כדי ליצור שכבה 2-3 מ"מ עובי הסופי. תערובת של בסיס 20 גרם אלסטומר עם סוכן גרם 2 ריפוי מספיק כדי לכסות 4 "פני קוטר.
- מניחים את master עובש PDMS ב תא ייבוש ואקום (Jencons) לדה גז PDMS דפוקה. באמצעות ווסת לחץ (קול בן הזוג), לאט לאט להפחית את מד תא לחץ של 0 "כספית ל -27" כספית מעל 20 דקות, כדי למנוע עודף קצף. השאירו המכשיר בתא ואקום ב -27 "כספית במשך 30 דקות או עד בועות אוויר להיעלם.
- לשחרר ואקום ולעבור עובש אב PDMS ל 65 מעלות צלזיוס בתנור (Thermo Scientific) לתקופה של ארבע שעות. המכשיר ניתן להשאיר בתנור למשך הלילה כדי לשפר ריפוי.
- הסר את ההתקן מהתנור להתקרר. חותכים בזהירות סביב PDMS רקיק עגול בעזרת סכין דיוק לקלף את PDMS. לחתוך את קווי המתאר מכשיר כפי שמוצג באיור 1 עם אזמל.
- פונץ fluidic יציאות (3 לכל מכשיר) בשלוש אזורים עגולים שמוצג באיור 1 באמצעות אגרוף ביופסיה. עבור התקן זה, השתמש 0.75 מ"מ קוטר חיצוני אגרוף (האריס).
- לדבוק נייר דבק לצד בדוגמת של PDMS וקליפת להסיר כלאבק. כחלופה עלות חיסכון, אך מעשית מנגנוני פלזמה קונבנציונאלי חמצן, 21,22 פלזמה לטפל בצד בדוגמת של PDMS ו 3 נקי "x 1" מיקרוסקופ שקופיות הזכוכית באמצעות יד שנערך במעבדה קורונה treater (אלקטרו טכני מוצרים בע"מ .). 23 שים לב, כי למכשיר יש להשתמש במנדף או מאוורר היטב בשטח עקב הפרשות האוזון, וכל שעונים וטלפונים סלולריים יש לשמור לפחות עשרה מטרים. התאמת הפרשות קורונה להשיג קורונה יציב עם מינימלי מעוררת. לאט לאט לנופף האלקטרודה על 1/4 "מעל פני השטח כל אחד במשך כ 20 שניות ואז מיד להחזיר את המשטחים שטופלו במגע ליצור קשר קבוע וחזק לפני משטחי PDMS לחזור למצב הטבעי שלהם.
- מניחים את המכשיר על צלחת מתכת, ומכניסים לתנור קר, להגדיר את התנור ל 120 מעלות, ואופים במשך הלילה כדי להשלים מליטה לחזור PDMS למצב הידרופובי המקורי. 24 במהלך האפייה זה חום גבוה, לאהוא משטח הזכוכית של הערוץ יהיה גם שניתנו הידרופובי בשל בתצהיר של שכבת הידרופובי דקה על זכוכית. לחלופין, ציפוי הידרופובי כגון Aquapel (PPG Industries) ניתן להזריק לתוך השקעים fluidic באמצעות מזרק 1 מ"ל ומחט המזרק. 12 בזהירות אך בתקיפות להזריק Aquapel ואחריו טיהור אוויר לתוך השקעים fluidic בלי לשבור את PDMS לכוס בונד . באגרסיביות לחזור על טיהור אוויר בכל יציאות כניסת ו לשקע תוך מוחה את כל Aquapel עודף על מנת למנוע כל פיקדונות שעלולים לסתום את הערוצים על גבי ייבוש.
2. לדוגמא הכנת
- להכין תרבית תאים בהתאם לנהלים שנקבעו עבור סוג שבחרת התא. עבור מכשיר מסוים נעשה שימוש במחקר זה, 8-15 חלקיקים מיקרומטר או תאים צריך במידה מספקת להורות אנקפסולציה. סוגי תאים קטנים יותר או גדול יותר עשויים לדרוש שינוי הממדים של ערוץ התמקדות להשיג עמ 'Re הולם. עבור ליתוצאות ההפגנה thod המוצג במאמר זה, קלקר 9.9 מיקרומטר microspheres (G1000, Thermo Scientific) מנוצלים כמו המחליפים סלולריים.
- מכינים את החלקיק מימית או ההשעיה התא באמצעות ערבוב עדין. בעת שימוש תאים או חלקיקי פוליסטירן, שליטה וריכוז חיוני (ראה איור 4) כדי להשיג אנקפסולציה הורה אידיאלי. שימוש בנתונים הקודמים 12 כמדריך, לחשב את התא הרצוי או ריכוז החלקיקים מבוסס על המרווח הרכבת הורה וגודל מיקרו ערוצים כמו: תא אחד או החלקיקים הצפויים לכל אורך המרווח פעמים רכבת התמקדות חתך באזור הערוץ. אם ריכוז המניות (1% w / w) אינה מספקת, להגביר את הריכוז (כאן 1.5% w / w) על ידי בעדינות צנטריפוגה מדגם המניות, הסרת נוזל supernatant, מחדש השעיית חלקיקים על ידי מערבולת ערבוב, או ערבוב עדין בעת השימוש בתאים. הכן נפח מספיק כדי להסביר את עוצמת אוסף הרצוי במשך זמן ריצה הקשורים FLow כוונון.
- שני תאים וחלקיקים פוליסטירן יש משקל סגולי גדול מ 1. אמנם לא הפגינו פרוטוקול זה, לטווח הארוך ניסויים שנמשכו בסדר גודל של דקות ארוכות עד שעות, הציפה להתאים את הפתרון על ידי הוספת המומס כגון CaCl 2 עבור חלקיקים או OptiPrep (Sigma-Aldrich) של תאים.
- הכן מדגם 10 מ"ל של שלב fluorocarbon רציפה הנפט על ידי ערבוב שמן fluorocarbon FC-40 (3M) ו-PEG PFPE לחסום פעילי שטח קופולימר 25 (2.5% w / w) (RainDance טכנולוגיות) בצינור צנטריפוגות 15 מ"ל. לחלופין, שמן מינרלי אור (כימיקלים PTI התהליך) יכול להיות מנוצל עם פעילי שטח 90 ABIL-EM (2.5% w / w) (Evonik גולדשמידט Corporation).
3. ניסויי ההתקנה
- כוח על מיקרוסקופ אופטי הפוכה (Axio אובזרוור, Zeiss) ואת המצלמה במהירות גבוהה (פנטום V310, Vision Research). להתמקד ולבדוק את הערוצים עבור כפכפים ופסולת באופן ידני על ידי הזזת המכשיר אובאמצעות מיקרוסקופ ממונע הבמה. פסולת כמה קטן יכול להיות דחף החוצה כאשר נוזל זורם. עבור פסולת גדולה או כפכפים ברורות, בחר ערוץ אחר במכשיר כמו פסולת בערוץ התמקדות יכול לפגוע משמעותית באיכות ההזמנה. שים לב, כפכפים לעתים קרובות ניתן להסיר תחת זרם על ידי לחיצה היטב על פני השטח PDMS מעל האזור הפגוע עם פינצטה קהים.
- חותכים שלושה אורכי צינורות PVC (0.01 "ID/0.03" OD, Tygon) עבור כניסת מימית, כניסת שמן, וכן עודפים אמולסיה. כדי למזער את נפח מת, לחתוך מספיק צינורות להגיע מן משאבות מזרק לשלב את המיקרוסקופ. לחתוך קצוות צינורות בזווית של 45 מעלות כדי להקל על הכניסה לתוך יציאות fluidic.
- להשתמש בפינצטה ללחוץ להתאים צינור מסתיים לתוך השקעים fluidic אגרוף בשלב 1 ולאחר מכן הקש להכיל שני 30 בוטה, קצה מד חלד מזרק מחטים פלדה (SmallParts) את הקצוות החופשיים של מימית המתאימה ואת כניסת צינורות נפט (אין צורך דבק) . מניחים את צינורות מוצא אל R פסולתeservoir. צינור זה יהיה מאוחר יותר נכנסו למאגר אוסף.
- העבר את המכשיר צינורות המצורפת לשלב את המיקרוסקופ, ליישר, ולהתמקד זרבובית את המכשיר באמצעות המטרה זמין (20x שימש לצורך ניסוי זה). כוונן עבור K hler תאורה והגדרות מיקרוסקופ אחרים כנדרש הקלטה אופטימלית.
- מלא את המזרק 1 מ"ל (BD) עם שלב היטב מעורבת מימית ו מזרק 3 מ"ל (BD) עם פתרון הנפט בשלב מוכן בשלב 2. שים לב כי כל מזרקים של כל אמצעי אחסון ניתן להשתמש ויש שנבחרו בקפידה בהתאם לרוץ פעמים הרצויים וצמצום pulsatility כלשהו. הטה 1 המזרק במאונך קפיצי לעבור בועות אוויר לשקע את המזרק. לאט לאט לדכא את הבוכנה עד כדי לדחוף את האוויר עד קצה המזרק. מחזיק את המזרק במאונך, לחבר את המזרקים כדי מחט המזרק בהתאמה המצורפת למכשיר כבר בשלב 3.3. לדכא את הבוכנה של חיל האוויר באמצעות מחט המזרק נפח הנוזל הוא מת עד עמ 'ushed דרך צינורות כמעט למכשיר. מאובטח לעלות את המזרק משאבת מזרק (Nexus 3000, Chemyx) ועוסקים גוש הבוכנה. חזור על קשרים מזרק 2 ו הר משאבת מזרק 2.
- הפעל את המשאבה בכל מזרק התוכנית באמצעות פרוטוקולים היצרן של המשאבה. הגדר את ספיקות הראשונים ש שמן = 50 μL / דקה ו-Q aq = 5 μL / דקה לשלב את השמן בשלב מימית, בהתאמה. התחל את המשאבות.
- חכו נוזל זה להיכנס למכשיר ולמלא את הערוצים, דוחף את האוויר המת הנותרים. זה עשוי להימשך מספר דקות. אם יש כמות גדולה של אוויר בצינור היניקה, להגדיל באופן זמני את כל קצב הזרימה עד האוויר מסולק. לא להגדיל את ספיקות גבוהות, כך הלחץ גדול להופיע בערוץ, שעלול לכישלון PDMS אל הכוס בונד.
- באמצעות ספיקות ראשוניים, לצפות את היווצרות טיפות בכל נחיר (תוצאות המוצג כאן: 20x magnification, מסגרת הדולר 21005 תמונות בשניה, חשיפה 3 μs). להפחית את השדה במצלמה מבט אל הנחיר רק כדי למקסם את המסגרת הדולר ולצמצם את דרישות הזיכרון אם אפשר. לכידת וידאו מדגם ולוודא כי קצב הדגימה הוא מספיק כדי למנוע aliasing.
- כדי למנוע הטיסות הללו (ראה איור 2), להתחיל עם ספיקה נמוכה מימיות. לאט לאט להגביר את קצב זרימת מימית לקיים סדר חלקיקים בערוץ פתרון ארוך מימית כמו עליית קצב הזרימה.
- אם ריכוז החלקיקים היא נמוכה מכדי לספק רכבות עם מספר קטן יחסית של חלקיקים "נעדר" מדגם לא ציפה בהתאמה, פיזית להטות את משאבת מזרק לכיוון מוצא את המזרק על מנת לספק ליישוב הדרגתית של חלקיקים לכיוון מוצא את המזרק. שיטה זו באה לידי ביטוי בפרוטוקול וידאו. מדי פעם לסובב את המזרק לאורך הציר שלה עשוי גם להפחית התיישבות בלתי רצויה.
- לאחר סידור הולם מתרחשת, להתאים את קצב זרימת הנפט לכוון את תדר הדורגודל הטיפות. היקף הירידה הממוצע יכול להיות מחושב לפי שער זרימת מימית חלקי התדר ירידה הדור כפי שנמדד על ידי לכידת וידאו. חוזרת לשנות את שתי ספיקות להשיג שיעורי אנקפסולציה הרצויות ואמצעי אחסון ירידה.
- אנקפסולציה הורה יציב פעם הוא אישר, להעביר את צינור מוצא מן המאגר פסולת אל תוך המאגר אוסף או להאכיל אותו למכשיר אחר לבדיקה שלאחר מכן.
- קבע את זמן איסוף מבוסס על המספר הרצוי של טיפות ותדירות הדור מחושב.
- להקליט את החלק היחסי של טיפות המכילות 0, 1, 2, ..., N חלקיקים לכמת את היעילות באמצעות בין אם הדור ירידה בתוצאות וידאו או pipetting מדגם של תחליב נאסף לבדיקה.
4. נציג תוצאות
תוצאות מוצגים בו גם להשיג שליטה יחיד החלקיקים ומבוקר פעמיים החלקיקים אנקפסולציה (איור 3). על ידי חיתוך קצב הזרימה FC-40 שמן 1/2, חד החלקיקים אנקפסולציה הופך שני החלקיקים אנקפסולציה. לעומת זאת, נוכל הגדילו את קצב הזרימה מימית כדי לספק חלקיקים זרבובית מהר יותר, אבל אנחנו גם לא הגדילו את הסיכון המתפרצת של הנחל מימית. היסטוגרמות באיור 3 מציגים את מספר השבר של חלקיקים בכל ירידה של שני המקרים, יחד עם ההשוואות פואסון לסטטיסטיקה. טיפות מדי פעם עם אפס חלקיקים הם בעיקר בשל חלקיקים "חסרים" ב הרכבות שהוזמנו, ואילו במקרים בהם ישנם חלקיקים כמוס יותר מאשר התוצאה הרצויה מן המקומיים ריכוזים גבוהים של חלקיקים וחלקיקים שלעתים נודדים לעבר אחד משני תפקידים התמקדות אנכיים. שים לב, הציפה התאמה כמתואר בסעיף 2 לא נוצל. במקום זאת, משאבת מזרק היה מוטה באופן פיזי כדי לאפשר יישוב של חלקיקים לכיוון מוצא את המזרק, מה שמוביל לריכוז גבוה של חלקיקים בזמן הריצה.
class = "jove_content"> ריצה הניסוי מדגים את הצורך חלקיק נכונה ריכוזי תאים מוצגת באיור 4. ללא הזמנה מלאה, קבוצות מקומיות של הסדר חלקיקים כמוסות, אבל טיפות רבות ללא חלקיקים. ההיסטוגרמה מראה את היעילות אנקפסולציה ירד אנקפסולציה 2 הרצויה החלקיקים.
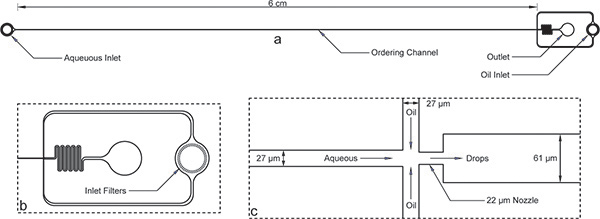
באיור 1. מכשיר Encapsulation. א) המכשיר כולל עם פתחי הכניסה, לשקע, ואת ערוץ הזמנת רב. גובה המכשיר הוא 52 מיקרומטר ורוחב הערוץ מזמין הוא 27 מיקרומטר. ב) גם מימית וגם פתחי הכניסה הנפט מסננים פסולת גדולות עם פערים בסדר גודל של רוחב הערוץ מזמין עבור תצוגה מוגדלת של כניסת שמן. ג) צפה זרבובית מוגדלת מראה רוחבי שווה של ערוץ 27 מיקרומטר עבור ערוצי מימית, שמן, ואחריו התכווצות זרבובית של 22 מיקרומטר והרחבת הפתאומית לערוץ רחב יותר מיקרומטר 61.שים לב, את מידותיו של המכשיר המוצג כאן אומתו באמצעות profilometer לאחר microfabrication ו שונה במקצת את ממדי נומינליים על המסכה. התמונה האמיתית של הערוץ מזמין ו זרבובית זמינים באינטרנט כמו איור משלימה 1 . קובץ AutoCAD המסכה יש גם כלל באינטרנט כתוספת כתב היד הזה.

איור 2. Hysteresis של נוטף המעבר המתפרצת באמצעות מכשיר רחב יותר (80 מיקרומטר רחב x 22 מיקרומטר גבוהה). א) בקצב FC-40 זרם בלתי פוסק (ש שמן = 45 μL / min), יצירת ירידה מתמדת מתרחשת kHz 10 באמצעות שיעור מימית זרימת ש aq = 8 μL / דקה. כמו קצב זרימת מימית הוא גדל לאט עד 10 & MU, L / min, המתפרצת של זרם נוזל מימי מופעל. ב) כאשר קצב זרימת מוחזר μL 8 / דקה הטיסות הללו ממשיך. שים לב, היווצרות ירידה קבועה ניתן הוקמה מחדש על ידי לחיצה קצרה הפסקה משאבת זרימה מימית (להשהות 1 2 אופייני).
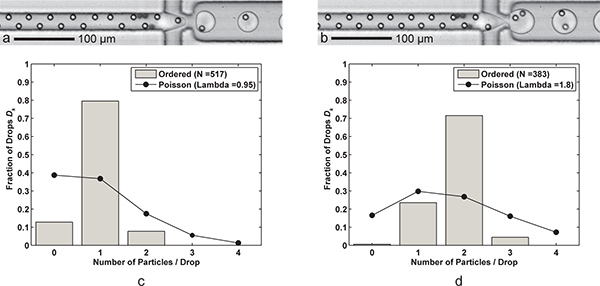
איור 3. אנקפסולציה יחיד ו פעמיים החלקיקים. היווצרות) Drop עם תא אחד לכל ירידה (Q שמן = 60 μL / דק ', ש aq = 9 μL / min) עם שיעור ירידה של הדור kHz 6.1, גודל ירידה ממוצעת של 24.4 PL, וכמה מתא בודד יעילות לכידת D k = 79.5% ו P K = 83.7% (λ = 0.95) עבור גודל מדגם של n = 517 טיפות ד ו n p = 491 חלקיקים. ב) היווצרות Drop עם שני תאים לכל ירידה מושגת רק על ידי צמצום FC-40 קצב הזרימה נפט ל -30 ש μ L / min. גדולים יותר (39.8 את PL) נוצרות טיפות בשיעור של 3.8 kHz ביעילות 2 תאים לכידת D k = 71.5% ו P K = 79.5% (λ = 1.80) עבור גודל מדגם של n D = 383 טיפות ו-N p = 689 חלקיקים. CD) שתי היסטוגרמות להשוות את אנקפסולציה ירידה החלקיקים יעילות D K של אנקפסולציה יחיד ו פעמיים החלקיקים הורה עם Poisson לסטטיסטיקה (אנקפסולציה אקראית). שים לב שעבור המקרים, מרווח בין החלקיקים לכיוון הזרימה היא כ 17-18 מיקרומטר עבור חלקיקים, הורה באופן מלא לסירוגין. קטעי וידאו משלימים מראה גם אנקפסולציה יחיד ו פעמיים החלקיקים זמינים באופן מקוון. לחץ כאן כדי להציג סרט תוספת 3 א . לחץ כאן כדי להציג סרט תוספת 3 ב .
התחת = "jove_content"> 
ריכוז איור 4. מאוד משפיע על יעילות אנקפסולציה.) כמו ירידה הריכוז, סידור מלא אינו מתרחש, ובכך "חורים" של הרכבות לצאת, לצאת כמה טיפות עם פחות מ חלקיקים צפויים. ב) ההיסטוגרמה מראה את יעילות ירידה ( D k = 55.9%, P k = 70.9%) אנקפסולציה של שני החלקיקים בשל הערך הנמוך של λ = 1.57 שם יש כמעט אותו מספר חלקיק יחיד טיפות כמו שיש פעמיים החלקיקים טיפות. התוצאה היא דמות שמן ש = 30 μL / דקה ו-Q aq = 9 μL / דקה, תנאי הזרימה זהה איור 3 ב. וידאו משלים נציג זמין באינטרנט. לחץ כאן כדי להציג סרט משלימה 4 .
Discussion
למרות תארים גבוהים יחסית של ההזמנה, לא טיפות כל יכיל את מספר נכון של חלקיקים או תאים. יעילות Encapsulation יכול להיות מחושב על פי מספר התאים או חלקיקים שהפכו הגלום טיפות עם תפוסה הרצוי חלקי המספר הכולל שלהם. נתונים אלה גלם ניתן להשיג גם מן האלגוריתם וידאו אוטומטית במהירות גב...
Disclosures
י"א הוא ממציא על הפטנט תלויה ועומדת מבוסס על טכנולוגיה מנוצל כתב היד הזה.
Acknowledgements
אנו מודים RainDance טכנולוגיות למדגם של פעילי שטח PFPE-PEG שימוש במחקר זה, ואנו מודים משאבים BioMEMS מרכז (מהמט טונר, מנהל) על תבנית סיליקון פרוסות סיליקון המשמשת ליצירת העתקים PDMS הערוץ.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| AutoCAD | Autodesk | ||
| שקיפות מסכה | Fineline הדמיה בע"מ | ||
| SU-8 photoresist | MicroChem | 2050 | |
| Dektak Profilometer | Veeco | ||
| צלחת פטרי | BD פלקון | 351058 | |
| PDMS סיליקון ערכת אלסטומר | Dow Corning קורפ | Sylgard 184, מספר חומרים (240) 4019862 | |
| אבק תא ייבוש | Jencons | 250-030 | |
| משאבת ואקום | אלקטל טכנולוגיה אבק | 2010 C2 | |
| אבק הרגולטור | קולמן בן הזוג | EW-00910-10 | |
| תנור | Thermo Scientific | לינדברג כחול M, OV800F | |
| ביופסיה, 0.75 מ"מ | האריס | Uni-Core 15072 | |
| המעבדה קורונה Treater | אלקטרו טכני מוצרים בע"מ | BD-20AC, מק"ט 12051A | |
| שקופיות הזכוכית | חותם זהב | 3010 | |
| Aquapel | PPG Industries | אסטרטגיה אלטרנטיבית | |
| פוליסטירן microspheres, 9.9 מיקרומטר | Thermo | G1000 | |
| OptiPrep | Sigma-Aldrich | D1556 | לא הפגינו |
| Luer-Lok מזרקים | BD | 1 מ"ל: 309628 3 מ"ל: 309585 | |
| FC-40 fluorocarbon שמן | 3M בע"מ | סיגמא אולדריץ', F9755 | |
| PFPE-PEG Fluorosurfactant | RainDance טכנולוגיות | ||
| אור שמן מינרלי | PTI כימיקלים בתהליך | 08042-47-5 | אסטרטגיה אלטרנטיבית |
| שמן מינרלי פעילי שטח | Evonik גולדשמידט Corporation | ABIL EM 90 | אסטרטגיה אלטרנטיבית |
| Tygon צינורות PVC | SmallParts | TGY-010 | |
| 30 Luer-Lok מד מחט מזרק, 1/2 " | SmallParts | לא זמיןE-301PL-C | |
| הפוך מיקרוסקופ | Carl Zeiss הדמיה | Axio Observer.Z1 | |
| במהירות גבוהה מצלמה | Vision Research | פנטום V310 | |
| מזרק משאבות (2) | Chemyx בע"מ | Nexus 3000 | |
| שמן סיליקון | Dow Corning | 200 נוזל, 10 CST | אופציונלי עבור אחסון אמולסיה |
References
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved