A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דימום דוגמנות intracerebral בעכברים: הזרקה של דם או השתלת collagenase קטריאלי
In This Article
Summary
מודלים של בעלי חיים רלוונטיים קליני של דימום intracerebral (ICH) על מנת להרחיב את הידע של שבץ המדמם שלנו ולבחון אסטרטגיות טיפוליות חדשניות. במחקר זה, אנו מתארים ולהעריך את שני מודלי ICH המיישמים זריקות חד צדדיות של כל אחד דם אוטולוגית או collagenase חיידקים לגרעיני בסיס (קורפוס סטריאטום) של עכברים.
Abstract
דימום intracerebral ספונטני (ICH) מגדיר מחל נוירולוגית שעלולה לסכן חיים, שמהווה 10-15% מכלל האשפוזים הקשורים לאירוע מוחי ושאין עבורם טיפולים יעילים זמינים עד היום 1,2. בגלל חוסר האחידות של ICH בבני אדם, מודלים פרה שונים יש צורך ביסודיות לחקור אסטרטגיות טיפוליות פוטנציאליות 3. ICH הניסויי מושרה נפוץ במכרסמים בזריקת intraparenchymal של או דם אוטולוגית או collagenase חיידקי 4. המודל המתאים נבחר מבוסס על הפתופיזיולוגיה של אינדוקצית דימום והתקדמות פציעה. מודל הזרקת הדם מחק דימום במהירות מתקדמת. לחלופין, collagenase חיידקי enzymatically משבש lamina הבסיס של נימים במוח, וגורם לדימום פעיל המתפתח בדרך כלל במשך מספר שעות 5. בצקת perihematomal תוצאתי וגירעונות neurofunctional ניתן לכמת הלוך ושובמ 'שני מודלים. במחקר זה, שתארנו והערכתי מודל שונה כפול הזרקה של הדם כל אוטולוגית 6, כמו גם מודל הזרקת ICH של collagenase חיידקי 7, אשר שניהם היעד לגרעיני הבסיס (קורפוס סטריאטום) של עכברי זכרי CD-1. חוקרים העריכו את גירעונות neurofunctional ובצקת מוחית בגיל 24 ולאחר 72 hr אינדוקצית ICH. הזרקת Intrastriatal דם אוטולוגית (30 μl) או collagenase חיידקים (0.075U) גרמה לגירעונות לשעתק neurofunctional בעכברים ובצקת מוח גדלה באופן משמעותי בגיל 24 ו 72 שעות לאחר ניתוח (p <0.05). לסיכום, שני הדגמים להניב אוטמי hemorrhagic עקביים ומייצגים שיטות בסיסיות למחקר קליני ICH.
Protocol
כל ההליכים בוצעו בעמידה במדריך NIH לטיפול ושימוש בחיות מעבדה ואושרו על ידי הטיפול בבעלי החיים ושימוש בועדת אוניברסיטת לומה לינדה.
1. הכנות Presurgical
טכניקות Aseptic מומלצות לכל הניתוחים. לחטא את מנגנון stereotactic ולהכין כלים כירורגיים סטריליים לפני הניתוח. ללבוש ציוד מגן אישי (PPE) במהלך כל הטיפול של בעלי החיים. השתמש בכרית חימום במהלך ניתוח כדי לשמור על טמפרטורת הגוף הפיזיולוגית של בעל החיים.
- שוקל עכבר הישן השבוע 8-12 שימוש בסולם חית קורה משולש.
- קטמין שיתוף להזריק (100 מ"ג / ק"ג) וxylazine (10 מ"ג / ק"ג) intraperitoneally לאחר מכן לאפשר ל7-10 דקות ההרדמה תיכנס לתוקף (מוניטור להרגעה מספקת).
- הנח את העכבר על גבי שמיכת תרמית ולגלח את הקרקפת.
- החל משחת עיניים לשני העיניים.
- Secureדרכי נשימה, בעדינות להזיז את הלשון באופן רוחבי, ולאבטח את ראשו של העכבר בזהירות על מנגנון stereotactic. הערה: הראש חייב להיות מאובטח בצורה אופקית לבסיס של מסגרת stereotactic.
- לחטא את אזור הניתוח עם פולידין ולשטוף עם אתנול 70%. חזור לסירוגין יישומים של פולידין ו70% אתנול בהיקף כולל של שלוש פעמים. applicators כותנה בקצוות יכול לשמש למטרה זו.
2. דגם הזרקת דם
- עושה חתך 1 סנטימטר ארוך קו אמצע של הקרקפת עם להב # 10 אזמל.
- השתמש applicators כותנה בקצוות, כדי להסיר את הרקמות הרכות המכסות את הגולגולת, במטרה לחשוף את נקודת החיתוך בניצב של תפר העטרה וsagittal (גבחת).
- הר המילטון המזרק (250 μl) על משאבת ההזרקה, וstereotaxically לכוון את המחט (26 מד) על גבחת.
- בשלב בא, להתאים את זרועות הפעלת Stereotactic כדי למקם את מחט 0.2 מ"מ קדמי ו 2מ"מ רוחבי לצד ימין. בקואורדינטות האלה עושים חור קטן בגולגולת זמזום טורדני, באמצעות מקדח מהירות משתנה עם מקדח 1 מ"מ.
- להשעות את זנבו של בעל החיים ולחטא פני השטח שלו נמוכים יותר עם 70% אתנול.
- לנקב את העורק המרכזי הזנב עם מחט סטרילית (26 מד למשל) ולאסוף את הדם העורקי לתוך צינור נימי unheparinized.
- להעביר את הדם במהירות מצינור הנימים לתוך חבית הזכוכית של מזרק המילטון, ואז להכניס את הבוכנה.
- חבר מחדש את μl או יותר עכשיו 30 מתוך דם עורקים מכיל מזרק המילטון על משאבת ההזרקה ולהכניס את המחט (עם הקצה המשופע שלה פונה תפר sagittal) דרך חור הצרימה, רק עד שפוע הוא כבר לא נראה לעין.
- מנקודה זו מראש 3 מ"מ מחט ventrally ולהזריק 5 μl דם עצמי בשיעור של 2 μl / דקה.
- לאחר השלים מראש הזריקה הראשונה 0.7 מ"מ המחט נוסף בעומק.
- חכה5 דקות לאחר מכן להזרים 25 μl דם לסטריאטום הנכון.
- עם השלמת הזריקה השנייה, השאר את המחט בתפקיד במשך 10 דקות נוספות, לפני שהוצאת אותה בשיעור של 1 מ"מ / דקה.
- לאטום את החור בשעוות Burr עצם ולתפור את העור.
- לשיכוך כאבים לאחר ניתוח מזריק 0.05 מ"ג / ק"ג של עצירות תת עורי בנוזלים מראש חממו (מלח רגיל).
3. דגם הזרקת collagenase
- בעקבות הכנות presurgical, חזור על שלבי 1-4 כמתואר בדגם הזרקת הדם.
- מלא המילטון המזרק (10 μl) עם 0.075U של חיידקים (clostridial) collagenase VII-S מומס ב0.5 μl של תמיסת מלח. למנוע היווצרות של בועות אוויר.
- חבר מחדש את מזרק המילטון על משאבת ההזרקה ולהכניס את המחט (26 מד), דרך חור הצרימה, רק עד שפוע הוא כבר לא נראה לעין.
- לקדם את מחט 3.7 מ"מ ventrally ולהזריק 0.075U של collagenasen בסטריאטום הנכון בשיעור של 2 μl / דקה.
- עם השלמת הזריקה, להשאיר את המחט בתפקיד במשך 10 דקות נוספות, לפני שהוצאת אותה בשיעור של 1 מ"מ / דקה.
- לאטום את החור בשעוות Burr עצם ולתפור את העור.
- הזרק 0.05 מ"ג / ק"ג של עצירות תת עורי בנוזלים מראש חממו שלאחר ניתוח.
4. מבצע שאם
- בעקבות הכנות presurgical, חזור על שלבי 1-4 כמתואר בדגם הזרקת הדם.
- הכנס את המחט (26 מד) 3.7 מ"מ ventrally דרך חור הגרון. המחט צריכה להישאר בתפקיד למשך 10 דקות, לפני שנסוג בקצב של 1 מ"מ / דקה.
- לאטום את החור בשעוות Burr עצם ולתפור את העור.
- הזרק 0.05 מ"ג / ק"ג של עצירות תת עורי בנוזלים מראש חממו שלאחר ניתוח.
5. נציג תוצאות
דימום intrastriatal ניסויי מעורר מורפולוגי כגם שינויים התנהגותיים במכרסמים. שינויים אלה יכולים להיות מוערכים על מנת להבטיח ביצוע נאות של ההליך, או כדי לחקור את ההשפעות של טיפולים פוטנציאליים. יצירה לדמם באזור מוח ממוקד (למשל גרעיני בסיס) היא חיונית ביותר לגישה לשחזור, ויכולה להיות מאומתת על חלקי מוח ברוטו או היסטולוגיה צבעוניים (איור 1-2). פגיעה בתוצאות גרעיני הבסיס בגירעונות חושיים, שניתן לכמת באמצעות התנהגותיות שונות. תוצאות הבדיקה הראו כי תור הפינה, לאחר ICH הניסיוני הימני צדדי, עכברים הפכו באופן משמעותי ולעתים קרובות יותר ipsilaterally הרחק מהצד הנגדי הלקוי (משמאל), מאחיזת עיני חיות פעלה בשעות 24 ו 72 לאחר ניתוח (איור 3). יתר על כן, היכולת כראוי למקום (משמאל) forelimb הלקוי על פני שטח, בעקבות גירוי vibrissae, הוערכה באמצעות מבחן הצבת forelimb. בשעות 24 ו 72 לאחר ניתוח, תת עכבריםjected לICH הימני צדדי הראה מיקומי אופן משמעותי פחות מאשר חיות פעלו מזויפות. מדידה של בצקת מוחית לעתים קרובות מועסקת כדי לכמת את מידת פגיעה מוחית לאחר ICH הניסיוני. זריקות intracerebral דם אוטולוגית (30 μl) או collagenase חיידקים (0.075 U) הובילו לעלייה משמעותית של תכולת מים בקליפת מוח ipsilateral והגרעינים הבזליים ב24 (איור 4) ועד 72 שעות (תרשים 4 ב ') לאחר ניתוח ( בהשוואה לדמה). תוצאות בדיקות ההתנהגות (איור 3) והיקף הבצקת במוח (איור 4) הראו שאין הבדל בין הדם ודגמי הזרקת collagenase בהיקפים שניתנו.
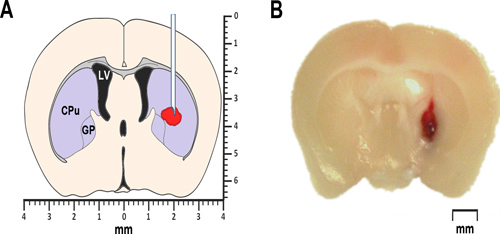
איור 1. ICH דוגמנות בעכברים. () סכמטית המופשט של 0.2 מ"מ עטרת מוח סעיף קדמי של גבחת ממחישה את יחסי הציבורoposed מיקום דם עצמי או הזרקת collagenase. את החדר לרוחב מסומן LV. מעבד עומד על caudate-putamen, חלק מהסטריאטום, ורופא המשפחה מזהה pallidus הגלובוס. שניהם, כמו גם סטריאטום pallidus הגלובוס שייך לקבוצה של גרעינים תת קליפת מוח, הידוע גם בגרעיני בסיס. (ב) photomicrograph נציג קדמי עטרת מוח סעיף 0.2mm של גבחת, שהושג ב24 שעות לאחר ההזרקה של דם כל intrastriatal עצמי.
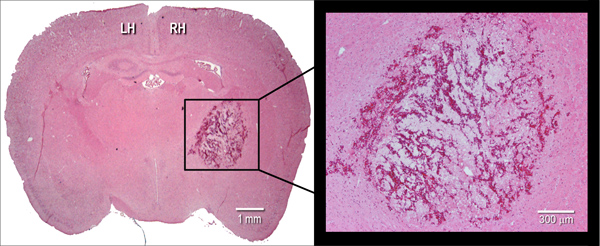
איור 2. ביטוי היסטולוגית של שטף הדם. הנציג hematoxylin וeosin (H & E) cryosection עטרה המוכתמת (10 מיקרומטר) של מוח עכבר, הממחיש את גודל שטף דם ב24 שעות לאחר הזרקת intrastriatal של collagenase חיידקים (0.075 U). LH = שמאל אונה, RH = אונה ימנית.
< img alt = src "איור 3" = "/ files/ftp_upload/4289/4289fig3.jpg" />
איור 3. הערכות Neurofunctional לאחר ICH ניסוי בעכברים. הזרקת Intrastriatal דם אוטולוגית (30 μl) או collagenase חיידקים (0.075 U) גרמו לגירעונות neurofunctional לשעתק. () עכברים לאחר ICH הניסיוני הראו סיבובים משמעותיים נכונים יותר מחיות המופעלות מזויפות בשעות 24 ו 72 לאחר ניתוח. (ב) יכולת הצבת רגל הקדמית של הגפה השמאלית נפגעה לאחר ICH בשעות 24 ו 72 לאחר ניתוח. ערכים באו לידי ביטוי כממוצע ± SEM ונתחו עם ניתוח Kruskal-ואליס דרך אחת של שונות בסולם הדרגות, ואחריו את השיטה לתלמיד ניומן-Keuls. ערך של AP <0.05 נחשב משמעותי מבחינה סטטיסטית, n = 6-12 לכל קבוצה, * p <0.05 בהשוואה לדמה. לחץ כאן לצפייה בדמות גדולה.
igure 4 "src =" / files/ftp_upload/4289/4289fig4.jpg "/>
איור 4. הערכת תכולת מי מוח לאחר ICH ניסוי בעכברים. הזרקת intracerebral דם אוטולוגית (30 μl) או collagenase חיידקים (0.075 U) הוביל לעלייה משמעותית של תכולת מים בקליפת מוח ipsilateral והגרעינים הבזליים ב24 (א) ו 72 שעות (ב) לאחר ICH-אינדוקציה. ערכים באו לידי ביטוי כממוצע ± SEM ונתחו עם ניתוח דרך אחת שונה, ואחריו אד העברת מבחן Tukey. ערך של AP <0.05 נחשב משמעותי מבחינה סטטיסטית, n = 6-10 לכל קבוצה, * p <0.05 בהשוואה לדמה. לחץ כאן לצפייה בדמות גדולה.
Discussion
מודלים של בעלי חיים של דימום intracerebral (ICH) יתרמו רבים להבנה מתקדמת של הפתופיזיולוגיה של המחלה, ומשמשים בדרך כלל כדי לפתח ולהעריך אסטרטגיות טיפוליות חדשניות בהגדרה קלינית. זריקות Intraparenchymal דם אוטולוגית או collagenase חיידקים הן שיטות מבוססות היטב כדי ליצור ICH במכרסמים. שני הש?...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
מחקר זה מומן בחלקו על ידי מענק NIH RO1NS053407 לJH ג'אנג. ברצוננו להודות למר דיימון Klebe על תרומתו היקרה.
Materials
| Name | Company | Catalog Number | Comments |
| חומר | חברה | מספר קטלוגים | הערה |
| מסגרת ראש Stereotactic | Stoelting ושות | 51600 | |
| משאבת המזרק Nanomite | הרווארד Apparatus | PY2 70-2217 | |
| המילטון מזרק | חברת המילטון | 1725RN (250 μl) 1701 RN (10 μl) | מחט מד 26 עבור 250 μl ו10 מזרקי μl. |
| Microdrill | כלי מדע פיין | 18000-17 | |
| Microdrill Burr | כלי מדע פיין | 19007-09 | קוטר 0.9 מ"מ |
| Collagenase סוג VII-S | סיגמה אולדריץ | C2399 | |
| Microhematocrit צינורות נימים | הפישר סיינטיפיק | 22-362-574 | unheparinized |
| שעוות עצם | Ethicon | W31 | |
| תפר | Ethicon | 1676G | |
| קטמין | תרופות JHP | 42023-115-10 | Ketalar |
| Xylazine | מעבדות LLOYD | 139-236 | AnaSed |
References
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved