A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בelectroporation אובו של פלסמידים מירנה מבוססים ברכבת התחתית הפיתוח העצבי והערכת פנוטיפים ידי הזרקת DiI בהכנות-ספר פתוח
In This Article
Summary
שיטה שבאמצעותה ביטוי גנים בצינור העצבי יכול להיות downregulated באופן ספציפי לסוג תא, מעקב מתוארת. אנחנו מדגימים איך באוב Electroporation של פלסמידים microRNA מבוססים שיעוררו התערבות RNA spatiotemporally מבוקרת יכול לשמש כדי לחקור הדרכת האקסון commissural בצינור העצבי פיתוח.
Abstract
dI1 נוירונים Commissural נחקרו רב על מנת להבהיר את המנגנונים בבסיס הדרכת האקסון במהלך 1,2 פיתוח. נוירונים אלה ממוקמים בחוט השדרה הגבה ולשלוח האקסונים שלהם לאורך מסלולים סטריאוטיפיים. אקסונים Commissural תחילה להקרין כלפי ventrally ולאחר מכן מעבר לfloorplate. אחרי שחצה את קו האמצע, אקסונים אלה לעשות תפנית חדה ומקורית פרויקט longitudinally לכיוון המוח. כל אחד משלב אלה מוסדר על ידי הפעילות המתואמת של רמזי הדרכה אטרקטיביות ודוחים. הפרשנות הנכונה של הרמזים הללו היא חיונית להדרכה של אקסונים לאורך המסלול המתוחם שלהם. לפיכך, התרומה הפיזיולוגית של מולקולה מסוימת להדרכת האקסון commissural הוא נחקר באופן אידיאלי בהקשר של החיים בהתהוותו. בהתאם לכך, מציאת גן בvivo חייבת להיות נשלטה במדויק כדי להבדיל פעילויות הדרכת האקסון של גנים שעשויים לשחק בזהירות מרובהתפקידים במהלך פיתוח.
כאן, אנו מתארים שיטה למציאת ביטוי גנים בצינור העצבי העוף באופן ספציפי לסוג תא, למעקב. אנו משתמשים בוקטורי פלסמיד רומן 3 מטפחים יזמי תאים ספציפיים לסוג / משפרים המניעים את הביטוי של סמן חלבון פלואורסצנטי, ואחרי ישירות על ידי תמליל miR30-RNAi 4 (הממוקם בתוך-UTR 3'של קידוד cDNA חלבון פלואורסצנטי) ( איור 1). כאשר electroporated לתוך הצינור העצבי פיתוח, הווקטורים האלה לעורר downregulation היעיל של ביטוי גנים ולבטא חלבוני סמני ניאון בוהקים כדי לאפשר מעקב ישיר של התאים חווים מציאה 3. ערבוב וקטורי RNAi שונים לפני electroporation מאפשר מציאה סימולטנית של שניים או יותר גנים באזורים עצמאיים של חוט השדרה. זה מאפשר אינטראקציות תאיות ומולקולריות מורכבות לבחינה במהלך פיתוח, באופן שהוא מהיר, שלimple, מדויק וזול. בשילוב עם DiI איתור של מסלולי האקסון commissural בהכנות של ספרים פתוחים 5, שיטה זו היא כלי שימושי עבור במחקרי vivo של מנגנונים התאיים ומולקולריים של צמיחת האקסון commissural והדרכה. בעיקרון, כל אמרגן / משפר יכול לשמש, באופן פוטנציאלי ביצוע הטכניקה מתאימה יותר נרחבת במחקרי vivo של תפקוד גן במהלך 6 פיתוח.
סרטון זה מדגים ראשון כיצד לטפל וביצים של חלונות, ההזרקה של פלסמידים DNA לתוך הצינור העצבי והליך electroporation. כדי לחקור הדרכת האקסון commissural, חוט השדרה הוא להסיר את העובר כהכנת ספר פתוח, קבוע, והוזרק לי DiI לאפשר מסלולי האקסון לנודעו עקבותיו. חוט השדרה הוא רכוב בין coverslips ודמיין באמצעות מיקרוסקופ confocal.
Protocol
1. הכנה של ה-DNA פלסמיד RNAi להשתקת גן ספציפית לסוג התא
פלסמידים (איור 1) מסונתזים באמצעות טכניקות סטנדרטיות מולקולריות שיבוט, כפי שתוארו בפירוט בעבר 3,4.
1.1 שיבוט לווקטורים: עיצוב oligonucelotide
- אנו משתמשים באותם oligonucleotides האוניברסלי ופרוטוקולי שיבוט המתוארים במידע על המוצר מסופק עם וקטור pRFPRNAiC 4 (ארון-Genomics).
- לשיבוט לאתר החד הראשון:
פריימר '5 HP1:
5'-GGCGGGGCTAGCTGGAGAAGATGCCTTCCGGAGAGGTGCTGCTGAGCG
פריימר '3 HP1:
5'-GGGTGGACGCGTAAGAGGGGAAGAAAGCTTCTAACCCCGCTATTCACCACCACTAGGCA - לשיבוט לאתר הסיכה השני:
5 'HP2 פריימר:
5'-GGCGGGACGCGTGCTGTGAAGATCCGAAGATGCCTTGCGCTGGTTCCTCCGTGAGCG
פריימר '3 HP2: - 5'-CGCCGCGCATGCACCAAGCAGAGCAGCCTGAAGACCAGTAGGCA
- לשיבוט לאתר החד הראשון:
- אנו משתמשים Finder של Genscript siRNA היעד לבחור רצפי יעד גן ספציפיים: https://www.genscript.com/ssl-bin/app/rnai.
- Primers עבור שיבוט מירנה גן ספציפית לאתר החד הראשון:
דוגמה להשתקת GFP מוצגת להלן.
רצף יעד (22nt): 5'-GGCACAAGCTGGAGTACAACTA
GFP קדימה HP1 = 59mer 
GFP הפוך HP1 = 58mer 
יש רצפים נפוצים בoligos אלה שמהווים חלק מרצפי מירנה האיגוף (עוף ספציפי), ורצפי לולאה / גזע נפוצים (מהאדם miRNA30). את רצפי יעד גנים הספציפיים בקו תחתונים. שים לב שיש בבוקרismatch בבסיס 5 'של הגדיל קדימה (מוצג באותיות מודגשות; G → בדוגמה זו) לחקות את חוסר ההתאמה הטבעי בmiRNA30 בעמדה זו.
- Primers עבור שיבוט מירנה גן ספציפית לאתר הסיכה 2:
דוגמה להשתקה LacZ מוצגת להלן.
רצף יעד (22nt): 5'-CGCGCTGTATCGCTGGATCAAA
LacZ קדימה HP2: 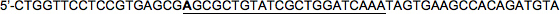
LacZ ההפוך HP2: 
שים לב ששוב, בסיס 5 'של רצף היעד בגדיל קדימה השתנה (מוצג באותיות מודגשות; C → בדוגמה זו) כך שהוא חוסר התאמת רצף antisense, מחק miRNA30.
1.2 תגובה וSubcloning PCR
- את oligos גן הספציפי הואעורך יחד עם oligos האוניברסלי בתגובת PCR ליצור סיכת miRNA30 הדמוית עם עוף מירנה רצפי איגוף.
| שיבוט לאתר חד הראשון: 1 μl - 10 ng פריימר קדימה GFP HP1 100 ng 5 'פריימר HP1 - 1 μl פריימר 100 ng '3 HP1 - 1 μl 1 dNTPs μl (10 מ"מ) חיץ 5 μl 10x pfu תגובה פולימראז 1 μl pfu דנ"א (Promega) 39 מי μl PCR-Grade | או | שיבוט לאתר סיכה שני: 1 μl - 10 ng פריימר קדימה LacZ HP2 100 ng 5 'פריימר HP2 - 1 μl פריימר 100 ng 3 'HP2 - μl 1 1 dNTPs μl (10 מ"מ) חיץ 5 μl 10x pfu תגובה פולימראז 1 μl pfu דנ"א (Promega) 39 מי μl PCR-Grade |
מחזורים:
| 94 מעלות צלזיוס | 94 מעלות צלזיוס | 55 ° C | 72 ° C | 72 ° C | 4 מעלות צלזיוס |
| 1 דקות | 30 שניות | 30 שניות | 1 דקות | 9 דקות | להחזיק |
| 30 מחזורים | |||||
- לטהר את מוצר PCR, לעכל עם אנזימי הגבלה וsubclone לוקטור:
- אתר חד ראשון: השימוש NheI וMluI
- אתר סיכה שני: השימוש MluI וSphI
- עקוב טכניקות מקובלות לטרנספורמציה של תאים חיידקיים מוסמכים. תאי פלייט על אגר LB (המכיל אמפיצילין) ו-DNA הבציר ב midipreparation פלסמיד (למשל Nucleobond Xtra Midi הערכה, Machery-נגל).
- להשעות DNA פלסמיד המרוכזבסטרילי DDH 2 0, ריכוז מודד לפי ספקטרופוטומטר ולאחסן ב -20 ° C.
1.3 פלסמידים מירנה רצף
בתנאים סטנדרטיים תגובת הרצף לעתים נכשלה בשל מבנה משני חזק של הסיכות. כדי לשפר את זה 7:
- בצע את התגובה ברצף 10 mM טריס-Cl עם 0.01 mM EDTA (pH 8.0) במקום מים. זה מגדיל מרות של DNA supercoiled לssDNA, שהוא יותר נוח לסידור.
- הוסף צעד denaturation חום (98 מעלות צלזיוס, 5 דקות) לפני הרצף. זה ממיר DNA פלסמיד supercoiled לssDNA.
2. Electroporation
טיפול ביצה 2.1
- מניח את הביצים לתוך סט חממה ל38.5 ° C ו ~ 45% לחות.
- לדגור על הביצים עד שהעוברים הגיעו לשלב הרצוי של פיתוח. ללמוד הדרכת האקסון של עצב commissural, אנו typically electroporate עוברים כאשר הם הגיעו למבורגר ושלב המילטון (HH) 17-18 (לאחר כ 3 ימי דגירה) 8. עם זאת, הזרקה וelectroporation צריכים להיעשות לפני החלבון של עניין צבר, כדי להפוך את המציאה יעילה.
- הסר את הביצים מהחממה ולשים אותם בעמדה יציבה אופקית למשך 20 דקות, כדי למקם את העובר על גבי החלמון בצד העליון של הביצה. להחזיר את הביצים לאינקובטור בתקופה זו.
2.2 הכנת ריאגנטים וציוד
- הכן נאגר מלוח פוספט (PBS) ולעקר ידי מעוקר או עובר דרך הפתרון של 0.2 מיקרומטר מסנן.
- הפוך micropipettes זכוכית על ידי משייכת נימים (עולם מכשירי דיוק 1B120F-4; 1.2 / 0.68 OD / מזהה (מ"מ)) במכשיר מושך מתאים (למשל Narishige PC-10). לשבור את קצה micropipette להשיג קוטר קצה ~ 5 מיקרומטר, ולחבר אותו לחתיכת צינור עםהקוטר המתאים.
- הר האלקטרודות הפלטינה (0.5 סנטימטרים) בתקיפות במסגרת מוחזקת ביד, עם מרחק בין האלקטרודה של 0.5 סנטימטר. חבור את האלקטרודות לגל מרובע פעימות גנרטור (BTX-ECM 830).
- הגדר את מחולל פעימות עם את הפרמטרים הבאים:
- לelectroporation חד צדדי: מתח: 25 V, מספר הפעימות: 5, אורכו של דופק: 50 אלפיות שני, interpulse מרווח: 1 שניות
- לelectroporation דו צדדי: מתח: 18 V, מספר הפעימות: 5, אורכו של דופק: 50 אלפית שני, interpulse מרווח: 1 שניות
- הכן את מזרק עם מחט 18 G, אזמל, בקבוק זילוף של אתנול 70% וקלטת.
- ממס שעוות פרפין בכוס על צלחת חימום ב 80 ° C.
2.3 חלונאות
- נגב את הביצים באמצעות רקמה הספוגה באתנול 70%.
- הנח רצועה של סרט לאורך הציר הארוך של הביצה.
- לעשות שני חורים קטנים בקליפת הביצה באמצעות אזמל, האחד בהקצה הקהה של הביצה והשני בפינה של האזור שיש בחלונות.
- שימוש במזרק, להסיר כ. 3 מ"ל של חלבון מכל ביצה על ידי החדרת המחט בזווית של 45 מעלות לתוך החור בקצה הקהה של הביצה. זהירות להימנע מהפגיעה בחלמון.
- חותך חלון לתוך קליפת הביצה באמצעות מספריים קטנים, שנערכו בצורה אופקית כדי למנוע ניזק לעובר. במידת צורך, את עמדתו של העובר ניתן לאמת ומסומן בעיפרון על ידי החזקת אור חזק נגד הקצה הקהה של הביצה. חלון של 1.5 עד 2 סנטימטר מרובע הוא שימושי עבור רוב היישומים.
- לאטום את החור בקצה הקהה של הביצה וכל סדקים בקליפת הביצה עם שעוות פרפין מומסות, הוחל עם מברשת.
- לאטום את החלון בעזרת נייר דבק שקוף (למשל סרט הדבקה).
- להחזיר את הביצה לאינקובטור.
2.4 electroporation
- הכן את הכלים סטריליים ולנגב את אזור העבודה עם אתנול 70%.
- הכן אותיפתרון njection. ריכוז ה-DNA המתאים צריך להיקבע על ידי המשתמש וישתנה בהתאם ל/ אמרגן משפר להשתמש בכונן ביטוי. כמדריך, אנו משתמשים בדרך כלל 0.2-2.0 מיקרוגרם / μl (ראה דיון). בסך של 20 μl, תערובת ההזרקה צריכה להכיל:
| DNA פלסמיד RNAi (בH 2 0) | X μl |
| 20x PBS | μl 1 |
| 0.4% trypan כחול | 2 μl |
| סטרילי DDH 2 0, לנפח סופי של | 20 μl |
השתמש שאיבה עדינה כדי לטעון את תערובת ה-DNA לתוך כוס microcapillary מחובר לצינור.
- הסר את הסרט מביצת חלונות ולביים את העובר על פי המבורגר והמילטון 8.
- השתמש במלקחיים ומספריים האביב להסיר בזהירות extraeקרומי mbryonic ממחצית הזנב של העובר. הממברנות ניתן להרים בקלות מהעובר באזור שבו ורידי vitelline שמאל ימין והגדול להיכנס לתא המטען. בעדינות לקרוע או לחתוך את הקרומים ולמשוך אותם לכיוון הזנב. במידת צורך, העובר יכול להיות טוב יותר דמיין ידי הזרקת תמיסה של דיו הודו או ירוק מהיר בין דיסק עוברי וחלמון ביצה, כפי שמוצג בוידאו על ידי Boulland ועמיתים 9.
- להזריק את פתרון ה-DNA לתוך התעלה המרכזית של הצינור העצבי, בדיוק מעל hindlimbs. לשלוט בעוצמת קול הזריקה דרך פה. הצבע הכחול צריך להתפשט מקצה הזנב עד אל החדר של המוח המתפתח.
- הוסף כמה טיפין של PBS סטרילי בראשו של העובר.
- הנח את האלקטרודות המקבילה לציר קדמי-האחורי של העובר. הימנע מלגעת בעובר או כלי דם.
- החזק את האלקטרודות יציבה, וelectroporate.
- מוציא בזהירות את האלקטרודות ולשטוף אותם עםמים סטריליים כדי להסיר חלבונים מפוגלים מחלבון ביצה.
- לelectroporation דו צדדי, לעבור את הקוטביות של אלקטרודות, למקם את האלקטרודות המקבילה לעובר ולחזור electroporation. שטוף את האלקטרודות במים סטריליים.
- זרוק כמה PBS סטרילי יותר על העובר. Reseal הביצה עם קלטת ולהחזיר אותו לחממה עד לשלב ההתפתחותי הרצוי הוא הגיע. איטום נכון הוא חיוני כדי למנוע התייבשות של העובר.
3. הכנות חוט שדרה
3.1 Dissection של עוברים
- בHH25-26 (5 ימים של דגירה), הוצא את העובר מהביצה באמצעות מלקחיים או כפית קטנה. למקם אותו בPBS בצלחת פטרי מצופית בסיליקון (אלסטומר Sylgard).
- הסר את קרומי extraembryonic ולהניח את העובר על הגב שלו. לייצב אותה על הצלחת ידי מצמיד אותו בצוואר והזנב (באמצעות סיכות חרקים 0.20 מ"מ), עם הים עדיןtretching.
- עוברים שלמים (לחתך מאוחר יותר) יכולים להיות קבועים כאן, על ידי החלפת PBS עם paraformaldehyde 4% (PFA) ודוגר לשעה 1 בטמפרטורת חדר. כדי לעשות את הכנות של ספרים פתוחים, ממשיך פרוטוקול עם רקמה מבולבלת כפי שיתואר להלן.
3.2 בידוד של חוט שדרה מעוברים
- הצמד את הגפיים, להבטיח כי את הסיכות מוכנסות בזווית מהעובר, כך שהם לא מפריעים לנתיחה. העובר צריך להיות מואר מלמטה כדי לאפשר צפיפות רקמה להיתפס בשלבים הבאים.
- הסר את הלב והאיברים פנימיים תוך שימוש במספרי האביב ומגרד בעדינות עם מלקחיים. החוליות מפולחות וחוט שדרה צריכות להיות גלויים אם כל האיברים הוסרו לחלוטין.
- בעזרת מספרי האביב, לעשות חתך רדוד דרך החוליות שמעל חוט השדרה באזור הצוואר. סובב 180 מעלות העובר ולגרום 2 קצריםחתכים אורכיים באמצעות חוליות משני צדי עמוד השדרה, מהצוואר לכיוון הזנב. השתמש במלקחיים כדי להרים את הכיסוי של חוליות מחוט השדרה, ולקלף את הרקמה (המכיל את כל החוליות) ברצועה אחת לכיוון הזנב.
- עדינות למתוח ולהצמיד מחדש את העובר דרך הזנב וגפיים.
- השתמש במייקרו אזמל דק (למשל Grieshaber 68101) או מחט טונגסטן לחתך את קרומי המוח מונחים על חוט השדרה. חפש קו כהה וצפוף של רקמה בין הצינור העצבי וגרעיני השורש הגבו. כוון את זווית ההארה, במידת צורך. בעדינות לחתוך longitudinally לאורך הקו הזה בכל צד של עמוד השדרה, מהצוואר ועד הזנב. קרומי המוח צריכים להיפרד מחוט השדרה עקב מתיחה העדינה של העובר המוצמד.
- חותך את חוט השדרה ברמה של ניצן הכנף והזנב לניצן הגפה, ולהרים את חוט השדרה כולו החוצה של העובר במקורי חלק אחת הזנב תנועה, באמצעות מלקחיים. חוט השדרה המבודד צריך להיות כל זמן שקוע בPBS במהלך שלב זה. אל תרים אותו מהצלחת.
3.3 קיבוע של ספרים פתוחים
- מורח את חוט השדרה המבודד על מרית ולהעביר אותו לצלחת פטרי סיליקון מרופדת חדשה המכילה 4% paraformaldehyde ב PBS.
- לייצר הכנה שטוח הר על ידי מצמיד זהירות את חוט השדרה בשש עמדות (rostrally, מדיאלית וcaudally בכל צד, באמצעות סיכות חרקים 0.10 מ"מ). אנו קוראים לכל הכנה של 'דגל' קטן המזהה את העובר, אלא גם מציין את הקצה הקדמי של הכנת הספר פתוח.
- דגירה בטמפרטורת חדר למשך 30 דקות עד 1 שעה. ספרים פתוחים לא צריכים להיות יותר מדי קבועים וזה מקטין את היעילות של DiI דיפוזיה 10 ומגדיל את הרקע.
- הזהירות לשפוך את 4% PFA ולהחליף אותו עם PBS. שמור את הכלים ב 4 ° C עד מוכן להזרקה עם DiI או הר.
- הקפד על פתיחה בספרים תחת miscroscopy פלואורסצנטי ובחר בצד המתאים של הספר פתוח להזריק עם DiI.
- הכן המהיר DiI (5 מ"ג / מ"ל באתנול) ולצייר את הפתרון לmicropipette זכוכית מחוברת לצינורות פלסטיק. לשבור את סוף micropipette כדק ככל האפשר כדי להשיג קצה קוטר קטן מאוד. הכנס את המחט לתוך צלחת של PBS ולבדוק שDiI לא ידלוף מהמחט. אם הדלפות DiI, קוטר המחט גדול מדי. במקרה זה, להכין מחט חדשה.
- להאיר את הכנות ספר פתוח מלמטה. חפש פס אורכים צפופים יותר של רקמה, הממוקם כ 1/5 מרוחב hemibook מהקצה הלטרלי של ההכנה. זה מתאים לגופי התא של הנוירונים commissural, הנמצאים רק גחון לצלחת הגג. מתחיל בקצה אחד של הספר הפתוח, להכניס את מחט הזכוכית לתוך הרקמה, וכפי שאני המחטשל מכונס, מתנפח בכמות קטנה של DiI באמצעות פיפטה פה.
- לעבוד במהירות, מה שהופך כמה זריקות לאורכו של הספר הפתוח במרווחים קבועים של כ 0.5 מ"מ. אם המחט הופכת סתומה, נקה אותו בזהירות עם מלקחיים. אם הקצה הופך גדול מדי (והדלפות DiI), להחליף את המחט.
- לאחר שהשלמת את כל ספר פתוח, השתמש פיפטה העברה למצוץ משם ולזרוק את החריגה, דלף DiI. אם לא יעשה זאת תגרום רקע גבוה.
- השאר את ההכנות לכשלושה ימים ב 4 ° C כדי לאפשר DiI להתפשט לאורך האקסונים.
3.5 הרכבה עבור הדמיה
- השתמש במזרק עם מחט 18 G להפיץ גבול דק ורצוף של שמן ואקום (למשל Dow Corning # 976V) בקצוות של 24 מ"מ coverslip הזכוכית x 24 מ"מ. הוסף כמה טיפין של PBS סטרילי לטוב. שים לב שהרכבה בינונית המכיל גליצרול עם n-gallate propyl לא יכול להיות שותףmpatible עם 11 DiI. כמו כן, גריז ואקום של צמיגות נמוכה עשוי לערבב עם PBS והתוצאה ברקע גבוה.
- הסר את הסיכות מהספר הפתוח ולהעביר אותו לטיפת PBS. לטבול את הספר פתוח ולמקם אותו באמצע הבאר.
- מניח בעדינות עוד 24 מ"מ x 24 מ"מ coverslip על גבי, ולוודא את הספר הפתוח נשאר פתוח. במידת צורך, coverslip ניתן להסיר, וספר הפתוח מיקומו. לחץ בעדינות מסביב לקצוות של ההכנה ליצור חותם שלם של גריז. PBS העודף סחט במהלך שלב זה. הימנע מבועות אוויר.
- שמור את ההכנות בחושך ב 4 ° C עד מוכן לבדיקה ותיעוד על ידי מיקרוסקופ פלואורסצנטי. זה צריך להיעשות בזריזות (תוך שבוע), על מנת להבטיח כי ההכנות לא תתייבשנה.
4. נציג תוצאות
Electroporation וביטוי של פלסמידים
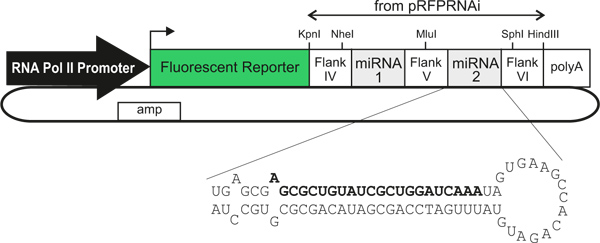
תחתתנאים המתוארים לעיל, פלורסנט חלבון צריך להיות ברור לזיהוי בסוג התא המתאים ללא צורך בהגברה נוספת של האות על ידי תיוג נוגדן. החלבון פלואורסצנטי צריך להתגלות רק בסוג / של התא הרצוי. דוגמאות מייצגות של תכשירים העוסקים בספרים פתוחים וחתכים של עוברי electroporated עם פלסמידים השונים מוצגות באיור 2.
יעילות של miRNAs המלאכותי
miRNAs המלאכותי נגד גן רומן של הריבית ראשונה חייב להיות מוקרן ליעילות ולהשפעות סגוליות של מציאתם. אנו מוצאים כי מבני β-יקטינו אמרגן מונחים, electroporated ברמה של 0.25 מיקרוגרם / μl, מתאימים לזה 3. מציאת in vivo יכולה להיבדק על ידי אימונוהיסטוכימיה או כלאה באתר.
DiI תיוג
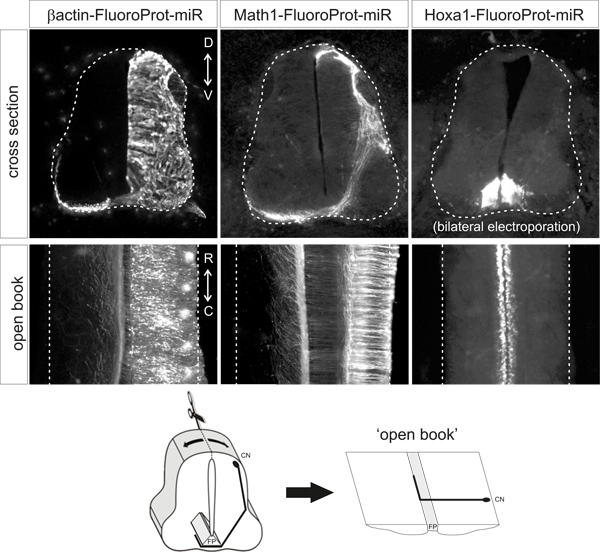
ממוקדים כראוי זריקות DiI לעוברי wildtypeאמור להניב יותר מ 80% מאתרי הזרקה עם מסלולים אידיאליים, ארכיטיפיים 3, כפי שמוצג באיור 3. בעלי חיים לשונות חיים צריכים להיות נמוכים.
איור 1. סכמטי כוללני של וקטורי פלסמיד מירנה מביע-. השימוש במקדמים שונים RNA פולימראז II / משפרים מאפשר ביטוי תא מסוג מסוים. תאי transfected ניתנות לזיהוי על ידי הביטוי של כתב ניאון שמקושר ישירות (בתוך תמליל יחיד) לmiRNAs המלאכותי אחד או שתיים, שמתנגש במורד ביטוי גנים. טקסט מודגש מציין גדיל התחושה של מירנה המלאכותית נגד LacZ, כפי שמתואר בטקסט.
איור 2. נציג דוגמאות of דפוסי ביטוי חלבון פלואורסצנטי הושגו בעקבות electroporation של וקטורי פלסמיד שצוינו. חתכים וספרים פתוחים הם מHH25-26 עוברי העופות שelectroporated בHH18. אמרגן β-תקטין מניע ביטוי בכל מקום, Math1 משפר מניע ביטוי בdI1 נוירונים וHoxa1 משפר מניע ביטוי במיוחד בצלחת הרצפה. CN, commissural נוירון; FP, צלחת רצפה.
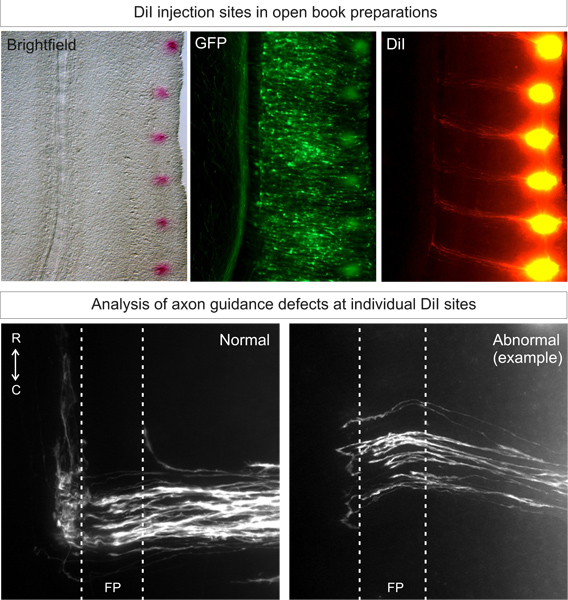
איור 3. יישום וניתוח של אתרי הזרקה DiI בהכנות ספר פתוחות. DiI צריך להיות מוזרק בדפוס punctate, קרוב לשולים לרוחב של הספר הפתוח, בצד electroporated (מזוהה על ידי ביטוי החלבון פלואורסצנטי). לאחר 3 ימים של דיפוזיה, מסלולי האקסון commissural צריכים להיות מסוגלים להיות דמיינו תחת מיקרוסקופ פלואורסצנטי. מסלולי האקסון נורמלים יגדלו לכיוון הרצפה עממאוחר, לחצות את צלחת רצפה ואחר כך תהפוך לגדול rostrally. פנוטיפים חריגים הנובעים מדפיקת גן למטה ניתן להשוות למסלול ארכיטיפי זה. בדוגמא, חלק דוכן האקסונים בצלחת הרצפה או לקבל החלטות שגויות מפנה בצד הנגדי.
Discussion
אסטרטגיה זו פשוטה, וקטור מבוססת מלאכותית מירנה ביטוי יכולה לשמש לביטוי גני מציאת אנדוגני בצינור העצבי העוף. כלים אלה תפקודיים להציע השתקת גנים מרובות, שליטה זמנית וספציפי תא מסוג, כדי להקל על ההבהרה של מסלולי התפתחות מורכבים. בפרט, אנו הוכחנו את התועלת של פלסמידים אל?...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה במעבדה של ES נתמכת על ידי הקרן הלאומית למדע השויצרית. ברצוננו להודות לד"ר Beat קונץ לקבלת סיוע בצילומים.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגים | |
| 0.5 מ"מ זכוכית נימים | מכשירי Precision העולם | 1B120F-4 | |
| זכוכית מחט חולץ | Narishige | מחשב-10 | |
| Electroporator | BTX | ECM 830 | |
| אלסטומר סיליקון Sylgard | מכשירי Precision העולם | SYLG184 | |
| תיל טונגסטן, 0.075 מ"מ | מכשירי Precision העולם | TGW0325 | |
| סיכות חרקים, 0.20 מ"מ | כלי מדע פיין | 26002-20 | |
| סיכות חרקים, 0.10 מ"מ | כלי מדע פיין | 26002-10 | |
| מספרי האביב | מדע פיין כדיOLS | 15003-08 | |
| דומון # 5 מלקחיים | כלי מדע פיין | 11252-20 | |
| דומון # 55 מלקחיים | כלי מדע פיין | 11255-20 | |
| מהר DiI | בדיקות מולקולריות | D-7756 | |
| מיקרוסקופי פלורסנט | אולימפוס | SZX12, BX51 |
References
- Chédotal, A. Further tales of the midline. Current Opinion in Neurobiology. 21, 68-75 (2011).
- Avraham, O., Hadas, Y., Vald, L., Zisman, S., Schejter, A., Visel, A., Klar, A. Transcriptional control of axonal guidance and sorting in dorsal interneurons by the Lim-HD proteins Lhx9 and Lhx1. Neural Development. 4, 21 (2009).
- Wilson, N. H., Stoeckli, E. T. Cell type specific, traceable gene silencing for functional gene analysis during vertebrate neural development. Nucleic Acids Research. 39, e133 (2011).
- Das, R. M., van Hateren, N. J., Howell, G. R., Farrell, E. R., Bangs, F. K., Porteous, V. C. A robust system for RNA interference in the chicken using a modified microRNA operon. Developmental Biology. 294, 554-563 (2006).
- Perrin, F. E., Stoeckli, E. T. Use of lipophilic dyes in studies of axonal pathfinding in vivo. Microscopy Research and Technique. 48, 25-31 (2000).
- Timmer, J., Johnson, J., Niswander, L. The use of in ovo electroporation for the rapid analysis of neural-specific murine enhancers. Genesis. 29, 123-132 (2001).
- Kieleczawa, J. Simple modifications of the standard DNA sequencing protocol allow for sequencing through siRNA hairpins and other repeats. Journal of Biomolecular Techniques. 16, 220-223 (2005).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88, 49-92 (1951).
- Boulland, J., Halasi, G., Kasumacic, N., Glover, J. C. Xenotransplantation of Human Stem Cells into the Chicken Embryo. J. Vis. Exp. (41), e2071 (2010).
- Kim, B. G., Dai, H. -. N., McAtee, M., Vicini, S., Bregman, B. S. Labeling of dendritic spines with the carbocyanine dye DiI for confocal microscopic imaging in lightly fixed cortical slices. Journal of Neuroscience Methods. 162, 237-243 (2007).
- Murphy, M. C., Fox, E. A. Anterograde tracing method using DiI to label vagal innervation of the embryonic and early postnatal mouse gastrointestinal tract. Journal of Neuroscience Methods. 163, 213-225 (2007).
- Helms, A. W., Abney, A. L., Ben-Arie, N., Zoghbi, H. Y., Johnson, J. E. Autoregulation and multiple enhancers control Math1 expression in the developing nervous system. Development. 127, 1185-1196 (2000).
- Li, X., Lufkin, T. Cre recombinase expression in the floorplate, notochord and gut epithelium in transgenic embryos driven by the Hoxa-1 enhancer III. Genesis. 26, 121-122 (2000).
- Mauti, O., Baeriswyl, T., Stoeckli, E. T. G. e. n. e. Silencing by Injection and Electroporation of dsRNA in Avian Embryos. Cold Spring Harbor Protocols. , (2008).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Developmental Dynamics. 229, 433-439 (2004).
- Cullen, B. R. Enhancing and confirming the specificity of RNAi experiments. Nature Methods. 3, 677-681 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved