A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השרשה של סיבים אופטיות לגירוי Optogenetic כרוני של רקמת המוח
In This Article
Summary
הפיתוח של optogenetics מספק כעת את האמצעים בדיוק כדי לעורר נוירונים ומעגלים מוגדרים גנטי, שני במבחנה ו In vivo. כאן אנו מתארים את ההרכבה וההשתלה של סיבים אופטיים לphotostimulation הכרוני של רקמת מוח.
Abstract
דפוסי הבהרה של קישוריות עצבית כבר אתגר למדעי המוח קליניים ובסיסיים. אלקטרופיזיולוגיה כבר את תקן הזהב לניתוח דפוסים של קישוריות הסינפטית, אבל הקלטות אלקטרו לזווג יכולות להיות גם מסורבלות וניסוי מגביל. הפיתוח של optogenetics הציג שיטה אלגנטית כדי לעורר נוירונים ומעגלים, הוא ב1 מבחנת in vivo 2,3. על ידי ניצול פעילות תא ספציפית אמרגן סוג לנהוג ביטוי אופסין באוכלוסיות עצביות נפרדות, ניתן לעורר דווקא תת עצבי מוגדר גנטי במעגלים שונים 4-6. שיטות שתוארו היטב כדי לעורר נוירונים, כולל גירוי חשמלי ו / או מניפולציות תרופתיות, לעתים קרובות ללא הבחנת תאי סוג, פולשני, ויכולות להזיק לרקמות מסביב. מגבלות אלה עלולות לשנות את התפקוד נורמלי הסינפטי ו / או התנהגות מעגל. בנוסף, בשללאופי של המניפולציה, השיטות קיימות הן לעתים קרובות חריפות וסופנים. Optogenetics מקנה את היכולת לעורר נוירונים בצורה יחסית לא מזיקה, ובנוירונים ממוקדים מבחינה גנטית. רוב המחקרים שכלל בoptogenetics vivo כרגע להשתמש סיב אופטי מודרך דרך צינורית 6,7 מושתל, אולם מגבלות של שיטה זו כוללות רקמות פגועות מוח עם כניסה חוזרת של סיב אופטי, ושבירת פוטנציאל של הסיבים בתוך הצינורית. בהתחשב בתחום המתפתח של optogenetics, שיטה אמינה יותר לגירוי כרוני יש צורך להקל על מחקרים ארוכי טווח עם ניזק לרקמות ביטחונות מינימאליים. כאן אנו מספקים הפרוטוקול השונה שלנו כמאמר וידאו כדי להשלים את השיטה המתוארת ביעילות ובאלגנטיות בספרטה et al. 8 עבור הייצור של שתל סיבים אופטיים וקיבועו הקבוע על הגולגולת של עכברים מורדמים, כמו גם את ההרכבה של סיבמצמד אופטי חיבור השתל למקור אור. השתל, מחובר עם סיבים אופטיים לליזר מצב מוצק, מאפשר שיטה יעילה כרוני לphotostimulate מעגלים עצביים פונקציונליים עם ניזק לרקמות פחות 9 באמצעות חבלים, קטנים, נתיקים. קיבוע קבוע של שתלי הסיבים האופטיים מספק עקבי, לטווח ארוך במחקרי vivo optogenetic של מעגלים עצביים בעכברים, ערים מתנהגים 10 עם ניזק לרקמות מינימאלי.
Protocol
* כל החומרים יחד עם יצרנים ו / או ספקים המפורטים להלן הפרוטוקול.
1. הרכבה של שתל
- הכן תערובת של אפוקסי סיבים האופטיים חום ניתן לריפוי על ידי הוספת 100 מ"ג של מקשה ל1 גרם של שרף.
- מדוד וחתכת כ 35 מ"מ של סיבים אופטיים 125 מיקרומטר עם ליבת 100 מיקרומטר ידי ניקוד אותו עם סופר קרביד טריז קצה. מקם את ניצבת הסופר לסיבים האופטיים והניקוד בתנועה אחת, חד כיווני. חיתוך הסיבים לחלוטין יפגע בליבת הסיב.
- הכנס LC קרמיקת כפת מתכת עם 127 מיקרומטר קדח בסגן, צד קמור מופנה כלפי מטה.
- הכנס את הסיב האופטי לתוך טבעת חזוק. הסיב האופטי צריך להחליק בצורה חלקה ושולי יבלוט מעבר לסוף הקמור של כובעון המתכת (האיור 1 א).
- החל טיפה אחת של אפוקסי סיבים האופטיים חום לריפוי לסוף והחום השטוח עם אקדח חום עד אפוקסי הופך לשחור. אפוקסי צריךלמלא את טבעת חזוק כפי שהוא מתחמם ולפני ריפוי. אפוקסי צריך לרפא בתוך ~ 1 דקות של יישום חום קבוע.
- נקה את איפוקסי צדי טבעת חזוק, כפי שיקשה התממשקות עם המצמד.
- פולני הסוף הקמור של טבעת חזוק באמצעות דיסק LC סיב אופטי ליטוש (FOPD) על יריעות אלומיניום תחמוצת ליטוש על משטח הליטוש (האיור 1b). הפוך דפוסי סיבוב מעגליים ולהבריק בארבע כיתות על פי הסדר הבא: 5, 3, חצץ 1 0.3 מיקרומטר.
- חותך את הסיבים האופטיים בסוף השטוח לאורך כזה שהיא יהיה ממוקדת באזור של ריבית המתאים. האורך ניתן לקבוע באמצעות אטלס stereotaxic.
- בדוק את השתל על ידי חיבורו לליזר דרך כבל המצמד המתואר להלן. הסוף המלוטש של השתל מוכנס לתוך השרוול של המצמד וצריך ליצור קשר ישיר עם טבעת חזוק יריב. השתל צריך להיות מסוגל לשמור על 10 mW של תפוקת אור, נמדד בקצה של הדואר סיבי שתל. שתל רע יהיה מוקד חלש ליד קצה הסיב האופטי.
- אחסן את השתלים המוגמרים (האיור 1 ג) בקצף עד לשימוש.
2. הרכבה של כבל מצמד סיבים אופטי
- הכן תערובת של אפוקסי סיבים האופטיים חום לריפוי כאמור לעיל.
- למדוד ולחתוך אורך מתאים של סיבים אופטיים 220 מיקרומטר עם ליבת 200 מיקרומטר ידי ניקוד אותו עם סופר קרביד טריז קצה. אורכו של הסיב צריך לאפשר את העכבר כדי לנוע בחופשיות סביב הדיור, אך לא לאפשר את העכבר כדי ללעוס דרך הסיב.
- הכנס את הסיבים האופטיים לאורכו של צינור מזלוג מעט ארוך יותר מאורך הסיבים האופטי. הצינורות צריכים קוטר פנימי מעט גדול יותר מהסיבים האופטיים.
- רצועה ~ 25mm בקצה אחד של הסיב האופטי והכניסו אותו לסוף המתכת של MM FC Multimode כפת מתכת אסיפה עם 230 מיקרומטר נשא עד שייעצר. הסיב האופטי צריך לבלוט באמצעות ferruסוף le (איור 2 א).
- לאבטח את החיבור עם cyanoacrylate (דבק סופר) בסוף המתכת. כיסוי החיבור עם אתחול מחבר וללטש סוף טבעת חזוק עם FC FOPD. הפוך דפוסי סיבוב מעגליים ופולנים בארבע כיתות, לפי הסדר הבא: 5, 3, 1, 0.3 מיקרומטר חצץ (האיור 2b).
- להתפשט ולהכניס את הקצה השני של הסיב האופטי לתוך LC קרמיקת כובעון מתכת (230 מיקרומטר id המשעמם) עם סוף דיסטלי הקמור. תחול ירידה של אפוקסי עד הסוף והחום השטוח עד שנרפא.
- פולני הסוף הקמור של טבעת חזוק באמצעות FC FOPD על גיליונות ליטוש תחמוצת אלומיניום כפי שתואר לעיל.
- הסט שרוול טבעת חזוק LC על הקצה הקמור של טבעת חזוק עד נקודת האמצע של השרוול.
- מקום חום לכווץ צינורות מעל צינורות מזלוג והשרוול וחום לאבטח ולהגן על החיבור (איור 2 ג).
- בדוק את המצמד על ידי חיבורו למקור הליזר ומדידת outp האורut דרך המצמד עם ספקטרופוטומטר. אובדן האור בין פלט הליזר ופלט המצמד נמדד לא יעלה על 30%.
3. השרשת כירורגים
* מדובר בהליך טיפים בלבד. מכשירים הם סטרילי אבל כפפות לא צריכות להיות בגלל מניפולציה מתמדת בין המכשירים והציוד.
- הרדם עכבר עם תערובת intraperitoneal הזרקת קטמין / Xylazine 100 ו 10 מ"ג / קילו בהתאמה באמצעות מחט 30-מד.
- גילוח הקרקפת עם קוצץ. נגב את הקרקפת עם אלכוהול רפואי 70% ואחריו Betasept לנגב (4% פתרון chlorhexidine) עבור 2 דקות, חוזר פעם אחת.
- הנח את העכבר באסדת sterotaxic ולאבטח את הראש, להבטיח כי הגולגולת היא רמה. החל משחת עיניים לעיניים, כדי למנוע יובש וכאב שלאחר ניתוח. לשמור על הרדמה באמצעות% volatized isoflurane (1-3 המדולל בחמצן בהתאם למצב הפיזיולוגי של mouse, שצריך להיות במעקב רציף על ידי תגובה לקמצוץ זנב).
- עושה חתך בקו האמצע של הקרקפת, וחושף את הגולגולת ממסלולי העיניים למבדה. לדחוף הצידה רקמות חיבור במידת צורך.
- השתמש במהדק Serafin להחזיק לאחור את העור ולשמור על גישה לגולגולת (איור 3 א).
- לחרוט תבנית משובצת לאורך פני השטח של הגולגולת עם מכוש שיניים. שטוף את הלכלוך משם עם מי מלח סטרילית. להתייבש היטב.
- החל מי חמצן (3%) לגולגולת החשופה עם קיסם אוזניים ל~ 2-3 שניות כדי ליצור micropores. לשטוף מספר פעמים ויבשות ביסודיות. לחלופין, ניתן עוגנים מוברגים לגולגולת, כמתואר בספרטה et al. (2012).
- שוב, לחרוט תבנית משובצת לאורך הגולגולת עם מכוש שיניים ולשטוף את הלכלוך עם מי מלח. להתייבש היטב.
- שימוש בכלי סיבובי, להפוך את הקוץ קטן חור craniotomy (<1 מ"מ קוטר) עם מקדח סטרילי(Autoclaved) מעל האזור של עניין, נקבע על ידי אטלס stereotaxic המכויל לגבחת ומבדה. היזהר שלא לשבור את הדורה או לפגוע בכל רקמה. לשטוף לכלוך ויבש ביסודיות.
- הכנס את טבעת חזוק הסיבים האופטית (שתל) לתוך מחזיק החללית ולהתחבר לזרוע stereotaxic.
- מקם את השתל במקום ישירות מעל האזור של עניין באמצעות זרוע stereotaxic (איור 3 ב). אם החדרת הסיב האופטי ברקמת המוח, סיבים יש לקדם לאט בקצב של ~ 2 מ"מ / דקה. טבעת חזוק צריכה לנוח על הגולגולת שנותרה.
- הכן תערובת של מלט שיניים. התערובת צריכה להיות מספיק צמיגות נמוכה בקלות להחיל על פני הגולגולת. התערובת תהיה שמישה עבור 2-4 דקות.
- באמצעות קיסם סטרילי, תחול, גם שכבה דקה של מלט שיניים על פני גולגולת ועל החלק התחתון של השתל. שכבת הבסיס של מלט שיניים צריכה לכסות את פני שטח כל כך הרבה על הגולגולת כאפשרי. אל תתנה מלט השיניים באים במגע עם העור של העכבר. זה יוביל לקושי מוגבר בתפירה, כמו גם גירוי לעכבר. אם מלט השיניים אינו בא במגע עם העור, לאפשר לו להתייבש חלקית באופן שכל השכבה של מלט ניתן התקלפה לפני ההגדרה.
- לאפשר לו להתייבש לחלוטין.
- תחול אפילו שכבות של בטון שיניים ליצירת גבעה קטנה מעל הגולגולת וסביב השתל, המאפשר לכל שכבה להתייבש לחלוטין (איור 3 ג). השאר ~ 3-5 מ"מ מהקצה הקמור של טבעת חזוק נקיה של מלט, כדי לאפשר חיבור חלק, ללא הפרעות.
- לתפור את הקרקפת על תלולית בטון שיניים וסביב השתל באמצעות תפרים סטריליים, שימוש יחיד משי קלועים (6-0) עם C22 מחט. הסר לאחר 7 ימים. אופציונלי: בונד וטרינר שימוש למחייבים נוסף לאחר תפירה. הקפד להשתמש בונד וטרינר מינימאלי. עודף יכול לגרום לניזק בעור חמור עקב גירוד.
- Immediately לאחר ניתוח, עכבר צריך להיות מוזרק מתחת לעור עם Ketprophen (5 מ"ג / ק"ג) כדי להקטין כאב שלאחר ניתוח. זה צריך להיות חזר 24 שעות מאוחר יותר. החל משככי כאבים אקטואליים (Bupivicaine) ואנטיביוטיקה (כוהל) לעור ונתפר מסביב לבסיס של השתל.
- הנח את העכבר בכלוב מעל שמיכת חימום להתאוששות מן ההרדמה. הנח את העכבר בכלוב התאוששות סטרילי, לאחר ניתוח. כלובי ההתאוששות לא צריכים להכיל כל מצעים כדי לשמור על טמפרטורה ולמנוע חנק. העכבר ניתן להחזירו לכלוב המקורי או כלוב פעם ערה חדש.
הרכבה נכונה של שתל הסיבים האופטיים ותוצאות מצמד באובדן פוטון מינימאלי בין מקור האור וסופו של הסיב האופטי באזור של עניין. סיבים אופטיים מלוטש היטב צריך להעביר אור במדים, קונצנטרי העיגול (איור 2 ד). עם השתלה ותפירה זהירות, לא גורם לגירוי השתל גלוי להעכבר ויכול להישאר במקום למחקרים ארוכי טווח (איור 3D,> 1 חודש, תצפיות שלא פורסמו) ללא כל שפלה משמעותית של הסיבים האופטיים או כמות האור המועבר. השתלה או תפירה לא נכונה יכולה לגרום לגירוי ויכולה לגרום לעכבר מגרד את הקרקפת שלה, וחושפת את שיני מלט, או שבירה של טבעת חזוק מבטון השיניים בגלל מניפולציה מתמשכת. תרשים סכמטי של המערכת המורכבת שניתן לראות באיור 4.

איור 1. עצרת של סיבים אופטיים להשתלה. () הסיב האופטי מוכנס לתוך טבעת חזוק, שולי בולטת מעבר לקצה הקמור שצוין על ידי ראש החץ. (ב) הסוף הקמור של כובעון המתכת מלוטש באמצעות FOPD בכיתות בהדרגה מעודנות יותר של גיליונות ליטוש. (ג) opt הסיבים המושתל המוגמרIC. לחץ כאן לצפייה בדמות גדולה.

איור 2. עצרת של מצמד סיבים אופטיים המשמש לקשור את המפרק הסיבובי הסיבים האופטי לשתל. (א) דבק סיבים אופטי דרך הרכבת טבעת חזוק. (ב) צד טבעת חזוק של ההרכבה מוכנס לתוך הכיתות בהדרגה העדינה FOPD ומלוטשות באמצעות נייר ליטוש. (ג) שרוול טבעת חזוק מצויד מעל טבעת חזוק ומאובטח עם צינורות חום פסיכולוג. (ד) מצמד הסיבים האופטיים סיים צריך לייצר אור קונצנטרי עם אובדן פוטון מינימאלי.

איור 3. השתלת כירורגים בסיבים האופטיים. (א) את כל פני השטח של craniuמ 'חשוף ורקמות חיבור אינה מסומנות. (ב) שתל הסיבים האופטי מוחזק בעמדה עם זרוע stereotaxic. (ג) מלט שיניים מיושם תיקון שתל הסיבים האופטי לגולגולת. (ד)> 1 חודש לאחר השתלה, העור נרפא סביב השתל ואין סימנים של גירוי.
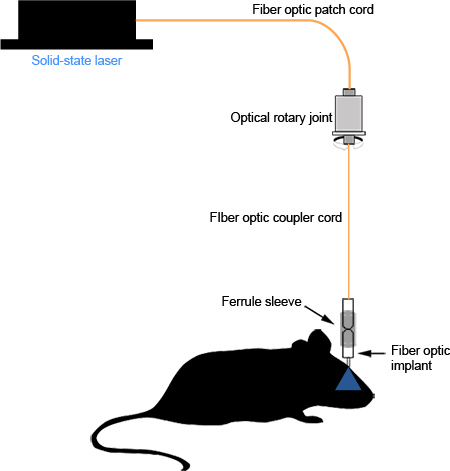
איור 4. תרשים סכמטי של המערכת התפקודית
Access restricted. Please log in or start a trial to view this content.
Discussion
Optogenetics היא טכניקה חדשה ורבת עצמה המאפשרת שליטה חסרת תקדים על תת עצבי ספציפיים. זו יכולה להיות מנוצלת כדי להשפיע על מסלולים עצביים עם דיוק האנטומי וזמני, תוך הימנעות מתא מהסוג חסר הבחנה ואפקטים פולשניים של גירוי חשמלי באמצעות אלקטרודה. השרשה של סיבים אופטיים מאפשרת ל?...
Access restricted. Please log in or start a trial to view this content.
Acknowledgements
ברצוננו להכיר בכך שהטכניקה זו תוארה לראשונה על ידי ספרטה et al., 2012 והותאמה בקלות לשימוש במעבדה שלנו.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב או הציוד | חברה | קטלוג # | תגובות |
| שרוול LC כובעון מתכת | מוצרי סיבי דיוק (PFP) | SM-CS125S | מזהה מ"מ 1.25 |
| FC MM מחבר מראש התאסף | PFP | MM-CON2004-2300 | 230 מיקרומטר כפת מתכת |
| מילר FOPD-LC דיסק | PFP | M1-80754 | לLC ferrules |
| צינורות מזלוג | PFP | FF9-250 | 900 מיקרומטר od, שם מיקרומטר 250 |
| MM LC סטיק כפת מתכת 1.25 מ"מ | PFP | MM-FER2007C-1270 | זיהוי מיקרומטר 127 Bore |
| MM LC סטיק כפת מתכת 1.25 מ"מ | PFP | MM-FER2007C-2300 | 230 מיקרומטרזיהוי Bore |
| אפוקסי חום לריפוי, מקשה ושרף | PFP | ET-353ND-16OZ | |
| FC / PC וSC / מחשב דיסק ליטוש מחבר | ThorLabs | D50-FC | לFC ferrules |
| כוח אופטי דיגיטלי ומד אנרגיה | ThorLabs | PM100D | ספקטרופוטומטר |
| הפוליש Pad | ThorLabs | NRS913 | 9 "x 13" 50 מד קשיות |
| תחמוצת אלומיניום מלחך פחים (פוליש): 0.3, 1, 3, 5 גריסי מיקרומטר | ThorLabs | LFG03P, LFG1P, LFG3P, LFG5P | |
| סיבי Multimode חיפוי קשיחים סטנדרטיים | ThorLabs | BFL37-200 | OH נמוך, Core מיקרומטר 200, 0.37 NA |
| כלי עקירת סיבים | ThorLabs | T10S13 | לבוש / Coב: מיקרומטר 200/300 מיקרומטר |
| סיבי סיליקה / אופטיים סיליקה | טכנולוגיות Polymicro | FVP100110125 | הגבוה OH, UV משופר, 0.22 NA |
| 1x1 משותף רוטרי fiberoptic | עדשות דוריים | FRJ_FC-FC | |
| מונה fiberoptic Patchcord | עדשות דוריים | MFP_200/230/900-0.37_2m_FC-FC | |
| מחמם לכווץ צינורות, סנטימטר 1/8 | בעלות הברית אלקטרוניקה | 689-0267 | |
| אקדח חום | בעלות הברית אלקטרוניקה | 972-6966 | 250 ואט; 750-800 ° F |
| הכותנה הטתה applicators | הפוריטנית רפואית מוצרי חברה | 806-ב"ש | |
| דבק רקמות VetBond | הפישר סיינטיפיק | 19-027136 | |
| אקריליק בסיס התותב פלאש | ייטס Motloid | ColdPourPowder + liq | |
| בון מיניאטורות מספרי איריס | Miltex Integra | 18-1392 | 3-1/2 "(8.9cm), ישר, להבי 15 מ"מ |
| ג'ונס הופקינס בולדוג קלאמפ | Miltex Integra | 7-290 | 1-1/2 "(3.8 סנטימטרים), התעקל |
| MEGA-מומנט חשמלי מעבדת מוטור | וקטור | EL-S | |
| פנתר burs-Ball # 1 | קלרקסון מעבדה | 77.1006 | |
| ויולט בלו ליזר מערכת | CrystaLaser | CK473-050-O | אורך גל: 473 ננומטר |
| ספק כוח הליזר | CrystaLaser | CL-2005 | |
| דומון # 2 מלקחי Laminectomy | Fהגדרות משיווק מדעים | 11223-20 | |
| בדיקה | כלי מדע פיין | 10140-02 | |
| 5 "מלקחי סטרייט | Excelta | 35-PH | |
| מלחציים עם בסיס משוקלל | Altex אלקטרוניקה | PAN381 |
References
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neuronal activity. Nat Neurosci. 8, 1263-1268 (2005).
- Arenkiel, B. R. In Vivo Light-Induced Activation of Neural Circuitry in Trangenic Mice Expressing Channelrhodopsin-2. Neuron. 54, 205-218 (2007).
- Gradinaru, V. Molecular and cellular approaches for diversifying and extending optogenetics. Cell. 141, 165-16 (2010).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetic and imaging technologies for circuit based neuroanatomy. Nature. 461, 900-907 (2009).
- Zhang, F. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat. Protoc. 5, 439-456 (2010).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450, 420-424 (2007).
- Sparta, D. R. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocols. 7, 12-23 (2012).
- Stuber, G. D. Excitatory transmission from the amygdala to nucleus accumbens facilitates reward seeking. Nature. 475, 377-380 (2011).
- Liu, X. Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature. 484, 381-385 (2012).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved