A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בדיקת רגישות אנטיביוטית הנגרמת על ידי מתח על שבב
In This Article
Summary
פיתחנו פלטפורמה מיקרופלואידית לבדיקות רגישות לאנטיביוטיקה במהירות. נוזל מועבר במהירויות גבוהות על חיידקים משותקים בתחתית ערוץ מיקרופלואידי. בנוכחות מתח ואנטיביוטיקה, זנים רגישים של חיידקים מתים במהירות. עם זאת, חיידקים עמידים יכולים לשרוד את התנאים מלחיצים אלה.
Abstract
פיתחנו שיטה מיקרופלואידית מהירה לבדיקות רגישות לאנטיביוטיקה בסביבה מבוססת מתח. נוזל מועבר במהירויות גבוהות על חיידקים משותקים בתחתית ערוץ מיקרופלואידי. בנוכחות מתח ואנטיביוטיקה, זנים רגישים של חיידקים מתים במהירות. עם זאת, חיידקים עמידים לשרוד אלה תנאים מלחיצים. ההשערה מאחורי שיטה זו היא חדשה: הפעלת מתח של מסלולים ביוכימיים, שהם מטרות של אנטיביוטיקה, יכול להאיץ בדיקות רגישות לאנטיביוטיקה. בהשוואה לשיטות סטנדרטיות לבדיקת רגישות לאנטיביוטיקה, הצעד המגביל את הקצב - צמיחת חיידקים - מושמט במהלך יישום אנטיביוטי. היישום הטכני של השיטה הוא בשילוב של טכניקות סטנדרטיות וגישות חדשניות. החלקים הסטנדרטיים של השיטה כוללים פרוטוקולי תרבות חיידקים, הגדרת ערוצים מיקרופלואידיים בפולידימתילסילוקסן (PDMS), ניטור כדאיות התא עם פלואורסצנטיות ועיבוד תמונת אצווה לספירת חיידקים. חלקים חדשניים של השיטה נמצאים בשימוש בזרימת מדיה תרבותית ליישום מתח מכני, שימוש באנזימים לנזק אך לא להרוג את החיידקים, ושימוש במצעים microarray עבור התקשרות חיידקית. הפלטפורמה המפותחת יכולה לשמש בפיתוח ובדיקות של תרופות אנטיביוטיות ולא אנטיביוטיות. בהשוואה לניסויים הסטנדרטיים בהשעיית חיידקים, ניתן להדליק ולכבות את השפעת התרופה שוב ושוב על פני תקופות זמן מבוקרות. התבוננות חוזרת ונשנית באותה אוכלוסיית חיידקים אפשרית במהלך אותו ניסוי.
Introduction
עליית ההתנגדות החיידקית מגבירה את הצורך בבדיקות רגישות אנטיביוטיות מבוססות פנוטיפ מהירות על מנת להגן על התרופות שלנו של המוצא האחרון. בדיקות רגישות סטנדרטיות מבוססות על עיכוב גדילה חיידקית בנוכחות אנטיביוטיקה שלוקח כמה (8-24) שעות כדי להשלים. פיתחנו בדיקת רגישות אנטיביוטית חדשנית על פלטפורמה מיקרופלואידית המסתמכת על הפעלת מתח של מסלולים ביוסינתטיים כדי להאיץ את פעולת האנטיביוטיקה.
בדיקות רגישות לאנטיביוטיקה בקנה מידה microfluidic לשאת את היתרון של שימוש יעיל מדגם, שכן הם דורשים מספר קטן של חיידקים. בנוסף, התקנים microfluidic ניתן multiplexed על מנת לבדוק דגימות מרובות בתנאים מרובים1,2. לאחרונה, מספר שיטות microfluidic עבור בדיקות רגישות לאנטיביוטיקה דווחו3-9. בשיטות אלה, חיידקים גדלים בתוך טיפות ננו ופיקוליטר3,7, בנפח המלא של הערוץ המיקרופלואידי4-6,8, או כמו חיידקים בודדים מקומיים חשמלית על פני השטח התחתון שלהערוץ 9. למרות בדיקות אלה מתבצעות בערוצים microfluidic, כולם לפקח על צמיחה מיקרוביאלית בנוכחות והיעדר אנטיביוטיקה דומה לשיטות מסורתיות. מדידות צמיחה מתבצעות באמצעות צפיפות אופטית, צבעים רגישים ל- pH או תמונות ניגודיות או פלואורסצנטיות בהירות של שדה/פאזה. למרות שחלק מבדיקות אלה מהירות יותר משיטות מסורתיות, כל אחת מהן מזהה באופן פסיבי עמידות לאנטיביוטיקה. במילים אחרות, שיטות אלה עדיין דורשות מהמשתמש לחכות לצמיחת חיידקים כמו הקריאה הסופית.
לעומת זאת, פיתחנו שיטה המשתמשת בשילוב של גזירה ומתח אנזימטי כדי להפעיל מסלולים ביוכימיים רגישים לאנטיביוטיקה10. קריאת תיגר על החיידקים הדגיש עם אנטיביוטיקה אלה יוצרת בדיקת רגישות מהירה יותר. חיידקים עמידים לאנטיביוטיקה מסוגלים לעמוד בתנאים מלחיצים. חיידקים רגישים, לעומת זאת, נהרגים במהירות על ידי הלחצים המשולבים. אחוז המוות של תאים לאחר שעה אחת, הנמדד על ידי מיקרוסקופיה באמצעות כתם תא מת פלואורסצנטי, מגדיר את הפנוטיפ של החיידקים (עמיד לעומת רגיש).
ליישום מוצלח של השיטה שלנו, חיידקים חייבים להיות משותקים על המשטח התחתון של הערוץ המיקרופלואידי. בדרך זו, חיידקים יכולים להיות נתונים ללחצים שונים ובמקביל להדמית תחת מיקרוסקופ במישור אחד. שקופית זכוכית מיקרוסקופ מצופה משמשת לשיתוק חיידקים. השקופית היא precoated על ידי היצרן עם קבוצות אפוקסיד עבור מחייב חלבון לא ספציפי. הכריכה הלא ספציפית של אפוקסידים אלה לחלבוני פני השטח החיידקיים מחברת את החיידקים למשטח השקופית.
זנים נבדקים בתנאים זהים (גזירה + מתח אנזימטי) בהיעדר (שליטה) ונוכחות (ניסוי) של אנטיביוטיקה. תמונות מיקרוסקופ של ניגודיות פאזה ופלואורסצנטיות של כל ערוץ נלקחות באופן אוטומטי כל שתי דקות למשך שעה אחת. כינויי התנגדות נעשים לאחר מכן על ידי השוואת אחוז החיידקים המתים בערוץ הניסוי לאלה הנמצאים בערוץ הבקרה. לאחר שעה אחת, מדגם עם אחוז מוות של תא גדול מ -1% נחשב רגיש, בעוד פחות מ 0.5% מוות מעיד על התנגדות. אחוזים הנכללים בין שני ניתוקים אלה נחשבים לא מוגדרים ויש לבדוק שוב את המדגם.
ערוצים מיקרופלואידיים מוגדרים ב- PDMS, שהוא חומר המועדף על מכשירים מיקרופלואידיים11. PDMS שקוף אופטית במגוון רחב של אורכי גל, תואמים ביולוגית, אינרטיים, חדירים לגזים ויש לו חדירות נמוכה לנוזלים; לכן הוא מתאים היטב לניסויים אלה.
מתח מכני/גזירה נוצר על ידי זרימת מדיית טמפרטורת החדר על פני החיידקים משותקים. (הערה: התחממות המדיה ל 37 °C (69 °F) אין השפעה משמעותית על תוצאת התסעפות.) משאבות מזרק אוטומטיות מאלצות מדיה (המכילה כתם תא מת +/- אנטיביוטי, כמו גם גורמי לחץ אנזימטיים אופציונליים) דרך הערוצים המיקרופלואידיים (200 מיקרומטר x 400 מיקרומטר) בקצב זרימה של 1 מ"ל / דקה כדי לתת 6.25 kPa של כוח גזירה או קצב גזירה של 6,000 שניות-1. שיעור זה שווה או עולה על הלחצים גזירה שנחקרו בעבר על Staphylococci.
האנזים, lysostaphin, נבחר לניסויים ראשוניים כי זה גורם נזק ישיר לקיר התא סטפילוקוקוס. הריכוז של lysostaphin (0.7 ng/ml) הספיק כדי לגרום נזק לקיר התא החיידקי, אך לא מספיק כדי לגרום למוות של תאים חיידקיים ללא אנטיביוטיקה במסגרת הזמן של הניסוי. Lysostaphin אינו נדרש לייעוד הנכון של רגישות חיידקית אבל זה להגדיל את התוצאה, המוביל מוות תאי מוגבר זנים רגישים. לעומת זאת, לחץ גזירה הוא קריטי לתפקוד מבחנים. כאשר זני סטפילוקוקוס אוראוס רגישים למתיצילין מטופלים בליזוזאפין ובאוקסצילין בהעדר זרימה, לא נרשם מוות תאי במהלך הניסוי.
הכדאיות של התא מנוטרת עם כתם תא מת פלואורסצנטי12. בחירת הצבע התבססה על יכולתו להכתים באופן סלקטיבי רק תאים פגומים, על אי-ציותו לתאים חיים ועל פלואורסצנטיות הרקע הנמוכה שלו, שאפשרה את הוספתו הישירה למדיית התאים ללא צעדים נוספים. הבחירה של ריכוז צבע פלואורסצנטי של 0.25 מיקרומטר הייתה להשיג רמות אות מקובלות במהלך זמן חשיפה של 1.6 שניות לאור עירור פלואורסצנטי.
הבטא-לקטם, אוקסצילין, שימש במחקרים הראשוניים שלנו. מינים עמידים בפני מתיצילין S. aureus (MRSA) עמידים בפני אוקסצילין ולא יראו מוות תאי ניכר במסגרת הזמן של הניסוי. הריכוז של 50 מיקרוגרם / מיליליטר נקבע במחקרים הראשוניים. ריכוזים נמוכים יותר של אנטיביוטיקה נתנו פחות הפרדה בין זנים עמידים רגישים, בעוד ריכוזים גבוהים יותר לא גרמו להבדל ניכר בתוצאות הניסוי.
דיווחנו בעבר על פיתוח מוצלח של בדיקה המשלבת לחצים מכניים ואנזימטיים המשפיעים ישירות על דופן התא החיידקי13 עם אנטיביוטיקה המעכבת את הביוסינתזה של דופן התא14,15. ניסויים אלה הוכחת העיקרון בוצעו על פאנל של MRSA ומתיצילין רגיש S. aureus (MSSA). עם זאת, עם הבחירה של פרמטרים ניסיוניים נאותים, השיטה שלנו צריכה להיות ישימה על מינים מרובים של חיידקים ומחלקות מרובות של אנטיביוטיקה.
Protocol
1. הפוך את שכבת PDMS (איור 1)
- מערבבים במרץ PDMS וסוכן ריפוי ביחס של 10:1. כדי להסיר בועות, degas את התערובת צמיג בתא ואקום במשך 1 שעה בטמפרטורת החדר.
- בקנה מידה, יוצקים את PDMS לאט על תבנית האלומיניום. יוצקים מהמרכז ושומרים על התבנית מאוזנת. הקפד להשאיר את הפינים חשופים. להפסיק לשפוך פעם אחת משקל היעד מושגת.
התבנית שלנו דורשת 4 גרם של PDMS ו 0.4 גרם של ריאגנט ריפוי. - מיישרים את התבנית בתוך תנור, ומרפאים ב-37 מעלות צלזיוס למשך הלילה.
זמני ריפוי חלופיים הם 2 שעות ב 60 מעלות צלזיוס או 1 שעה ב 90 מעלות צלזיוס. - לנתח את שכבת PDMS נרפא לאורך קצה התבנית בזהירות לקלף אותו משטח עובש עם זוג מלקחיים. נקה את משטח התבנית עם 70% אתנול וקצה Q.
2. להרכיב את תא הזרימה לפי איור 2
הרכבה סטנדרטית של PDMS עם מגלשות זכוכית נעשית באמצעות טיפול בפלזמת חמצן בשני המשטחים, המבטיח חיבור ללא דליפה בין PDMS ומגלשת זכוכית מיקרוסקופ. בפרוטוקול שהוצג, טיפול הפלזמה יהרוס את הציפוי הכימי במגלשת הזכוכית. לכן המגלשה אטומה בלחץ ולא פלזמה מטופלת.
- מניחים את חלון הזכוכית בכיס תא הזרימה.
- הנח שקופית זכוכית מצופה מעל חלון הזכוכית בתוך הכיס של תא הזרימה כאשר הצד הפעיל למעלה, והנח את שכבת ה- PDMS עם ערוצים הפונים כלפי מטה מעליה. מקם את שקופית ה- PDMS באופן כזה שכניסות הערוצים יתיישרו עם חורי הכניסה בלוח המתכת. בעדינות לדחוף את האוויר מתוך בין השכבות.
- הפוך את מכלול שקופית הזכוכית/PDMS כך שה- PDMS יפונה לחלון הזכוכית. חפף את כניסות ערוץ PDMS עם חורי הכניסה בלוח המתכת.
- מניחים את לוחית הלחץ למעלה ומהדקים את הברגים.
- הנח את תא הזרימה המורכב מתחת למיקרוסקופ. הגדר את הגדלת המיקרוסקופ ל- 60X ויישר מראש את מיקומי הערוצים.
3. הכן חיידקי שלב יומן
- יום לפני הניסוי: לחסן 50 מ"ל של מרק מולר הינטון המכיל 2% NaCl (MH2) עם מושבת חיידקים. לנער ב 250 סל"ד לילה ב 37 מעלות צלזיוס.
זן חיידקי אחד או שניים ניתן ללמוד בניסוי אחד עבור ההגדרה המתוארת. - לפני הניסוי: מערבבים 50 מיקרוליטר של תרבות חיידקים לילה לתוך 50 מ"ל של מדיה MH2. לנער ב 250 סל"ד במשך 3 שעות ב 37 מעלות צלזיוס כדי להבטיח את החיידקים נמצאים בשלב יומן.
4. לחמם את רכיבי הפתרון הניסיוני לפחות 10 דקות לפני שהם נדרשים
- להפשיר את הצבע הפלואורסצנטי (5 מ"מ מלאי) ו lysostaphin (10 מיקרוגרם / מיליליטר מלאי) בטמפרטורת החדר.
- מחממים את אבקת האוקסצילין לטמפרטורת החדר.
5. להכין ולטעון את ההשעיה החיידקית
- לאחר סיום תת-תרבות של 3 שעות: יש ליטול 10 מ"ל של תרבות חיידקים וצנטריפוגה ב-1,650 x גרם למשך 2 דקות.
- הסר את החיידקים supernatant ו resuspend ב 1 מ"ל של מדיה MH2 טרי.
- חבר אורך קצר של צינורות למזרק מנעול Luer 1 מ"ל. לשטוף את צינורות המזרק עם 1 מ"ל של מדיה. השאירו קצת מדיה בצינורות כדי למנוע בועות אוויר בעת ציור ההשעיה חיידקי.
- טען 0.7 מ"ל של חיידקים מסוג 1 לתוך המזרק. למלא שני ערוצים של תא הזרימה עם סוג חיידקים 1. צפה עבור הנוזל להופיע בצד השני של הערוץ לאחר ca. 150 μl.
השקיפות של הערוץ משתנה כפי שהוא מלא חיידקים. - אם אתם מתנסים בסוגי חיידקים מרובים, חזרו על הליך הטעינה של חיידקים מסוג 2 לשני הערוצים הנותרים של תא הזרימה.
- מניחים את תא הזרימה בתוך האינקובטור ב 37 מעלות צלזיוס במשך 45 דקות כדי לאפשר התיישבות חיידקית והחזקה למשטח השקופית.
6. להכין ולטעון את הפתרונות הניסיוניים
- הכן 140 μl של 0.5 מ"מ פתרון צבע פלואורסצנטי על ידי ערבוב 14 μl של מלאי צבע פלואורסצנטי (5 mM) ו 126 μl של מדיה MH2.
- לדלל 10 מ"ג של אוקסצילין ב 40 מ"ל של מדיה MH2 כדי לקבל ריכוז סופי של 250 מיקרוגרם / מ"ל oxacillin.
- הכן 130 מ"ל של פתרון בקרה עם ריכוזים סופיים של 0.25 μM צבע פלואורסצנטי ו 0.7 ng/ml של lysostaphin. כדי לעשות זאת, לערבב 65 μl של צבע פלואורסצנטי (0.5 מ"מ), 9.12 μl של מלאי lysostaphin (10 מיקרוגרם / מיליליטר) ו 130 מ"ל של מדיה MH2.
- הכן 130 מ"ל של פתרון אנטיביוטי עם ריכוזים סופיים של צבע פלואורסצנטי 0.25 מיקרומטר, 0.7 ng/ml של lysostaphin, ו 50 מיקרוגרם / מיליליטר אוקסצילין. כדי לעשות זאת, לערבב 65 μl של צבע פלואורסצנטי (0.5 מ"מ), 9.12 μl של מלאי lysostaphin (10 מיקרוגרם / מיליליטר), 26 מ"ל של אוקסצילין (250 מיקרוגרם / מיליליטר) ו 104 מ"ל של מדיה MH2.
- ממלאים שני מזרקים 60 מ"ל עם פתרון בקרה ושני מזרקים 60 מ"ל עם פתרון אנטיביוטי. שמור על פתרונות עטופים בנייר אלומיניום כדי למנוע השפלה הנגרמת על ידי אור של ריאגנטים.
למלא יתר על הים את המזרקים כדי להסביר את ההפסד עקב שטיפה של צינורות. - הסר בועות אוויר מהמזרקים על-ידי החלקה. חבר ומלא צינורות קלט לקצה עם הפתרון הניסיוני.
- הר מזרקים על המשאבה. מקם תחילה את המזרק עם הנפח הקטן ביותר ולאחר מכן נעל את מיקום הבוכנה. להתאים את שאר המזרקים על המשאבה, לסחוט את הבוכנות שלהם לפי הצורך.
- הגדר את מהירות המשאבה ל 1 מיליליטר / דקה ואת נפח המשאבה ל 60 מ"ל. לעשות סומק עם המשאבה עד זרם קבוע של נוזל נראה מכל המזרקים.
7. הגדרת תא הזרימה מתחת למיקרוסקופ
- הסירו את תא הזרימה מהצנטריפוגה והרכיבו אותו על במת המיקרוסקופ (איור 3).
- חבר צינורות קלט/פלט לכל אחד מתעלות תא הזרימה (פלט קלט/פלט אחד לערוץ).
איסוף פלט לארבעה גורמים מכילים שונים מאפשר מדידה של אמצעי אחסון בודדים של פלט ערוץ.
8. הפעל את הניסוי בן 60 הדקות
- בדוק את העמדות החתונות מראש משלב 2.5. אם שדה התצוגה של המיקרוסקופ אינו ממורכז בערוץ ו/או נמצא מחוץ למוקד, התאם את ההגדרות ושמור את המיקומים החדשים.
התמקדות מדויקת לא יכולה להיות אפשרית לפני תחילת הזרימה בשל הצפיפות הגבוהה של חיידקים טעונים. - הגדר את זמן הרכישה של ניגודיות הפאזה ל- 10 msec ואת זמן רכישת הפלואורסצנטיות ל- 1,600 msec.
- השג תמונות ניגודיות פאזה ופלואורסצנטיות עבור כל מיקום לפני התחלת הזרימה.
זה נותן הערכה איכותית של צפיפות החיידקים הטעונים. - התחל את זרימת הנוזלים ומיד לבדוק כי המיקרוסקופ מתמקד בתחתית הערוצים.
- קח תמונות ניגודיות פאזה ופלואורסצנטיות של אזורי היעד בתוך הדקה הראשונה של הזרימה.
- רכוש תמונות כל 2 דקות לאחר קבוצת התמונות הראשונה עד שתתרחש זרימה של 60 דקות. התמקד מחדש לפי הצורך.
9. לחטא את תא הזרימה
- הפוך פתרון אקונומיקה 10% ב כיף (100 מ"ל). ממלאים 4 x 20 מ"ל מזרקים עם 10 מ"ל של התערובת. לרוקן את המזרקים ולחבר אותם לתא הזרימה.
זה ייקח ~ 1-2 דקות עבור הערוצים כדי להיות ברור של חיידקים. - הגדר את מהירות המשאבה ל 1 מיליליטר / דקה ואת נפח המשאבה ל 3 מ"ל. לרוץ במשך 3 דקות.
- מלאו 4 x 60 מ"ל מזרקים עם 60 מ"ל של מים DI. לרוקן את המזרקים ולחבר אותם לתא הזרימה.
- הגדר את מהירות המשאבה ל 1 מיליליטר / דקה ואת נפח המשאבה ל 30 מ"ל. לרוץ במשך 30 דקות.
- לפקח על ניקוי הערוצים מתחת למיקרוסקופ.
- לפרק את תא הזרימה. בטל את שקופית האפוקסי הנמצאת בשימוש. משרים את רכיבי תא הזרימה במים DI במשך 20 דקות.
10. לנתח תמונות וליצור נתונים
- ספור את מספר החיידקים בכל תמונה.
תוכנת הגישה הפתוחה, CellProfiler משמשת לביצוע עיבוד תמונתאצווה 16. חלוקה לרמות גבוהה של רוטינות CellProfiler מסוכמת בטבלה 1. מספר החיידקים הנמצאים בתמונת ניגודיות הפאזה (Np)נותן את ספירת החיידקים הכוללת. מספר החיידקים הנראים בתמונת הפלואורסצנטיות (Nf)נותן את מספר החיידקים המתים. - לחשב את אחוז התמותה של תאי חיידקים מנורמלים כפונקציה של זמן.
- יבא Nf ו- Np עבור תמונות בודדות לתוכנת ניתוח הנתונים.
- לחשב את השבר של חיידקים מתים בכל ערוץ בנקודת זמן ספציפית שניתנה על ידי השבר (Nf / Np) ב t = T.
- הפחת את שבר החיידקים המתים הנמצאים בתחילת הניסוי (t = 1 min) הן עבור הבקרה והן עבור ערוצי הניסוי.
- הפחת את השבר של חיידקים מתים הנמצאים בערוץ הבקרה מזה שנמצא בערוץ הניסוי בכל נקודת זמן עם המשוואה הבאה:
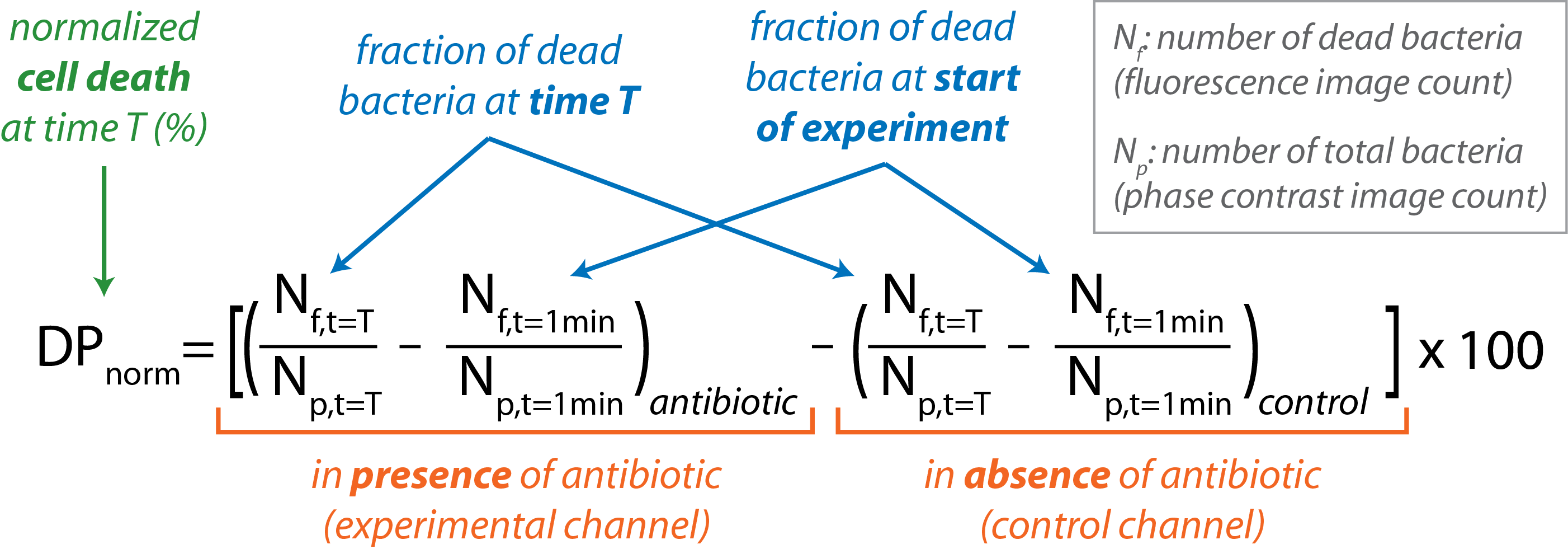
- גרף DP נורמה לעומת t במהלך הניסוי.
שים לב כי מדגם עם אחוז מוות של תא גדול מ 1% נחשב רגישים, בעוד פחות מ 0.5% מוות מעיד על התנגדות. אחוזים הנכללים בין שני ניתוקים אלה נחשבים לא מוגדרים ויש לבדוק שוב את המדגם. - השתמש בגיליון אלקטרוני כדי לסכם ולנתח תוצאות מניסויים שונים.
תוצאות
הנתונים המוצגים באיור 4 מראים את התגובה של זן סטפילוקוקוס אוראוס רגיש לאורך זמן בערוץ מיקרופלואידי המכיל אנטיביוטיקה. תמונות ניגודיות פאזה שנרכשו בשעה ובסוף הניסוי של שעה מוצגות באיורים 4A ו- B. הנתונים המנותחים של שעה מוצגים באיור 4C כאשר החיי...
Discussion
הפרוטוקול שהוצג אומת ואופטימיזציה בסדרה של ניסויים עם זני סטפילוקוקוס אוראוס רגישים למתיצילין ועמידים במתיצילין10. לכן, פרוטוקול זה ללא שינוי צריך להיות ישים ישירות זנים אחרים של S. aureus ואנטיביוטיקה אחרים עם מנגנונים של פעולה המשפיעים על ביוסינתזה של דופן התא החיידקי. סוגי...
Disclosures
השיטה המיקרופלואידית תלויה ועומדת: סאוור-באדג' A, שרון א', קלצ'ניקוב ז, וירז H, ממציאים; שיטה ומכשיר לגילוי מהיר של עמידות לאנטיביוטיקה חיידקית/פטנט רגישות PCT/US10/33523.
Acknowledgements
אנו מודים למהנדסים ולסטודנטים במרכז פראונהופר לחדשנות בייצור. על העזרה בתכנון, עיבוד שבבי ואוטומציה של מערכת הניסוי, אנו מודים לאנדריאס פרינסן, הולגר וירז, דאג פוס, דיוויד צ'ארגין וד"ר סודונג שו. אנו מודים לג'וליה קקארץ, מלאני צימרמן, ניקו קרצמר, טים גאמבל, ג'וש ויאנואבה, מינורי שימיזו וקטרז'ינה קוליגה על העזרה בבדיקת פרוטוקולים ניסיוניים ואיסוף נתונים. אנו מכירים בד"ר אן א. קרפנטר ומארק-אנתוני בריי מפלטפורמת ההדמיה במכון ברוד של הרווארד ו-MIT לעזרה בפיתוח שגרת ניתוח התמונה ב- CellProfiler. הפרויקט המתואר נתמך בחלקו על ידי פרסים R21AI079474 ו 1R01AI101446 מהמכון הלאומי לאלרגיה ומחלות זיהומיות. התוכן הוא באחריות המחברים בלבד ואינו מייצג בהכרח את השקפותיו הרשמיות של המכון הלאומי לאלרגיה ומחלות זיהומיות או המכונים הלאומיים לבריאות. הפרויקט נתמך גם על ידי פראונהופר ארה"ב.
Materials
| Name | Company | Catalog Number | Comments |
| SYTOX Green | Invitrogen Corporation | S7020 | Dead cell fluorescence stain |
| Bovine Serum Albumin (BSA) | Sigma Aldrich, Inc | A9418-5G | Used for lysostaphin storage |
| Sodium Acetate | Sigma Aldrich, Inc | S8750-500G | Used for lysostaphin storage |
| Lysostaphin | Cell Sciences | CRL309A | Arrives as 1 mg solid. For storage: Dissolve in 20 mM sodium acetate. Mix with BSA solution to final concentration of 1% BSA and 100 µg/ml lysostaphin for storage |
| Oxacillin salt | Sigma Aldrich, Inc | 28221-1G | Antibiotic |
| Mueller Hinton Broth | Fisher Scientific | DF0757-17-6 | |
| Sodium chloride | Sigma Aldrixh | S3014-500G | 2% added to Mueller-Hilton broth prior to autoclaving |
| 1 ml, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 14-823-2F | |
| 2 oz, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 309653 - 60 mL | Overfill to ~65 ml |
| Microscope | |||
| Inverted Fluoresccence Microscope Olympus IX-70 | Cambridge Scientific | 9349 | |
| 60X, Fluorescence/Phase contrast objective | Olympus Corp. | LCPlan F1 60x/0.70 Ph2 | |
| Retiga 12-bit monochrome CCD camera | QImaging | RET-4000R-F-M-12-C | |
| Microscope automation | |||
| Shutters phase contrast/fluorescence | PRIOR Scientific | H204/H202 | |
| X/Y Stage | PRIOR Scientific | H107AENN | |
| Focus motor | PRIOR Scientific | H122 | |
| Joystick for XYZ control | PRIOR Scientific | CS152EF | |
| Proscan Controller | PRIOR Scientific | H3-XY2 | |
| Image Acquisition Software | Fraunhofer CMI | ||
| Flow Cell Assembly and PDMS | |||
| Flow Cell | BU Scientific Instruments Facility/Fraunhofer CMI | 3333-1044 | Engineering drawings were produced by Fraunhofer CMI |
| Glass window | Fraunhofer CMI | 3333-1054 | Glass window was cut to the proper size at Fraunhofer CMI |
| BOROFLOAT Window 50 mm x 50 mm | Edmund Optics Inc. | NT48-543 | |
| Sealing plate | BU Scientific Instruments Facility | 3333-1045 | |
| Epoxide glass slide | Arrayit Corporation | SuperEpoxy 2 | |
| PDMS master | Fraunhofer CMI | 3333-1053 | Master machined in aluminum or brass with UPM-0005 (ultrapresicion fly-cutting machine) |
| PDMS slide design | Fraunhofer CMI | 3333-1053 | |
| Tubing | |||
| Nut, Super flangeless Tinytight, headless, 1/16 in, PEEK, green | IDEX Health Science | M-644-03 | Flow cell inputs/outputs are tapped for this ferrule |
| Ferrule, Tinytight, 1/16 in, 6-40, .030 in TH, PEEK w/ SS lock ring, black | IDEX Health Science | M-657 | |
| Nut, Super flangeless Tinytight, headless, 1/16-1/32 in, 1/4-28, PEEK, natural | IDEX Health Science | P-255 | |
| Ferrule, Super Falngeless, 1/16 in, Tefzel (ETFE), yellow | IDEX Health Science | P-259 | Fits Luer-lock adapter |
| Tubing, Teflon FEP, .030 in x 1/16 in x 20 ft, green | IDEX Health Science | 1520G | |
| Adapter, quick connect female Luer to female 1/4-28, PEEK, red | IDEX Health Science | P-658 |
References
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic systems for pathogen sensing: a review. Sensors. 9, 4804-4823 (2009).
- Yager, P., et al. Microfluidic diagnostic technologies for global public health. Nature. 442, 412-418 (2006).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab Chip. 8, 1265-1272 (2008).
- Cao, J., et al. Uncovering toxicological complexity by multi-dimensional screenings in microsegmented flow: modulation of antibiotic interference by nanoparticles. Lab Chip. 12, 474-484 (2012).
- Chen, C. H., et al. Antimicrobial susceptibility testing using high surface-to-volume ratio microchannels. Anal. Chem. 82, 1012-1019 (2010).
- Churski, K., et al. Rapid screening of antibiotic toxicity in an automated microdroplet system. Lab Chip. 12, 1629-1637 (2012).
- Eun, Y. J., Utada, A. S., Copeland, M. F., Takeuchi, S., Weibel, D. B. Encapsulating bacteria in agarose microparticles using microfluidics for high-throughput cell analysis and isolation. ACS Chem. Biol. 6, 260-266 (2011).
- Kim, K. P., et al. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device. Lab Chip. 10, 3296-3299 (2010).
- Peitz, I., van Leeuwen, R. Single-cell bacteria growth monitoring by automated DEP-facilitated image analysis. Lab Chip. 10, 2944-2951 (2010).
- Kalashnikov, M., Lee, J. C., Campbell, J., Sharon, A., Sauer-Budge, A. F. A microfluidic platform for rapid, stress-induced antibiotic susceptibility testing of Staphylococcus aureus. Lab Chip. 12, 4523-4532 (2012).
- McDonald, J. C., Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc. Chem. Res. 35, 491-499 (2002).
- Roth, B. L., Poot, M., Yue, S. T., Millard, P. J. Bacterial viability and antibiotic susceptibility testing with SYTOX green nucleic acid stain. Appl. Environ. Microbiol. 63, 2421-2431 (1997).
- Francius, G., Domenech, O., Mingeot-Leclercq, M. P., Dufrene, Y. F. Direct observation of Staphylococcus aureus cell wall digestion by lysostaphin. J. Bacteriol. 190, 7904-7909 (2008).
- Jordan, S., Hutchings, M. I., Mascher, T. Cell envelope stress response in Gram-positive bacteria. FEMS Microbiol. Rev. 32, 107-146 (2008).
- Koch, A. L. Bacterial wall as target for attack: past, present, and future research. Clin. Microbiol. Rev. 16, 673-687 (2003).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: from targets to networks. Nat. Rev. Microbiol. 8, 423-435 (2010).
- Kohanski, M. A., Dwyer, D. J., Hayete, B., Lawrence, C. A., Collins, J. J. A common mechanism of cellular death induced by bactericidal antibiotics. Cell. 130, 797-810 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved