A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שינויי קונפורמציה Submillisecond בחלבונים נפתר על ידי photothermal Beam הסטה
In This Article
Summary
כאן אנו מדווחים יישום של טכניקת הסטת קרן photothermal בשילוב עם תרכובת בכלוב סידן, DM-nitrophen, לעקוב אחר דינמיקת המיקרו והאלפית שנייה והאנרגטיקה של שינויים מבניים הקשורים לעמותת סידן לחיישן סידן עצבי, אלמנט רגולטורים במורד אנטגוניסט מודולטור .
Abstract
סטיה קרן photothermal יחד עם calorimetry תמונה אקוסטי ותרמי צורמת שייכת למשפחה של שיטות photothermal שלפקח בזמן פרופיל הנפח ואנתלפיה שינויי אור הנגרמים שינויי קונפורמציה בחלבונים במייקרו לאלפית שני בזמן קשקשים שאינם נגישים באמצעות מסורתית תחנה תזרים מכשירים. בנוסף, מאז שינויים הכוללים בנפח ו / או אנתלפיה הם חקרו, ניתן ליישם את הטכניקות הללו לחלבונים וBiomacromolecules האחרים שחסרים fluorophore ואו תווית chromophore. כדי לעקוב אחר דינמיקה ואנרגטיקה של שינויים מבניים הקשורים Ca 2 + מחייב מתמרים סידן, סידן חיישנים עצביים כגון, תרכובת סידן בכלוב, DM-nitrophen, הוא מועסק צילום הדק עלייה מהיר (τ <20 μsec) בסידן חופשי שינויי ריכוז והנפח הקשורים ואנתלפיה הם חקרו באמצעות טכניקת סטיה קרן photothermal.
Introduction
שיטות צילום תרמי כגון calorimetry photoacoustic, סטיה קרן photothermal (PDB), וצורם חולפים בשילוב עם עירור לייזר שבריר שנייה מייצגות חלופה רבת עוצמה ל חולפת spectroscopies האופטי ללימודים של ביניים קצרים 1,2 זמן נפתר. בניגוד לשיטות אופטיות, כגון קליטה חולפת וספקטרוסקופיה IR, העוקב אחר הפרופיל של שינויי קליטה בכרומופור שמסביב הזמן; טכניקות photothermal לזהות בזמן התלות של שינויי חום / נפח ולכן הם כלים רבי ערך לחקר פרופילים של אופטי זמן תהליכים "שקטים". עד כה, calorimetry photoacoustic והצורם חולפים כבר מיושמים בהצלחה ללמוד דינמיקה קונפורמציה של תהליכים הנגרם תמונה כוללים הגירת יגנד דו אטומית בglobins 3,4, אינטראקציות יגנד עם חלבון חיישן חמצן FixL 5, אלקטרון ופרוטון בתחבורת heme-נחושת oxidases 6nd photosystem השני, כמו גם צילום isomerization ברודופסין 7 ודינמיקת קונפורמציה בCryptochrome 8.
כדי להרחיב את היישום של טכניקות photothermal למערכות ביולוגיות שחסרות chromophore ו / או fluorophore פנימי, טכניקת PBD הייתה בשילוב עם השימוש במתחם בכלוב לצילום הדק עלייה בריכוז ליגנד / מצע בתוך כמה מיקרו או מהיר יותר, בהתאם במתחם בכלוב. גישה זו מאפשרת ניטור של דינמיקה ואנרגטיקה של שינויים מבניים הקשורים ליגנד / המצע מחייב את חלבונים שחסרים fluorophore או כרומופור פנימי ובזמן בקנה מידה שאינם נגישים על ידי עצירת זרימת מכשירים מסחריים. הנה יישום של PBD כדי לפקח על התרמודינאמיקה של מתחם הכלוב, Ca 2 + DM-nitrophen, צילום מחשוף כמו גם קינטיקה לCa 2 + עמותה לתחום בטרמינל C-של חיישן סידן העצבי דאוןזרם התקינה האלמנט אנטגוניסט מודולטור (חלום) מוצג. Ca 2 + הוא מCa-שוחררה תמונה 2 + DM-nitrophen בתוך 10 μsec וrebinds לכלוב unphotolysed עם קבוע של ~ 300 μsec זמן. מצד השני, בנוכחות apoDREAM הקינטית נוספת המתרחש בזמן בקנה המידה אלפית השנייה הוא ציין ומשקף את יגנד מחייב את החלבון. היישום של PBD לחקור מעברי קונפורמציה במערכות ביולוגיות היה מוגבל בדרך כלשהי בשל קשיי אינסטרומנטלי; יישור למשל מפרך של החללית וקרן משאבה כדי להשיג אות PBD חזקה ושחזור. עם זאת, עיצוב מוקפד של הגדרת מכשור, שליטה מדויקת של הטמפרטורה, ויישור זהיר של קרן הבדיקה ומשאבה מספקים אות PBD עקבית ויציבה, המאפשרת ניטור של זמן נפתר שינויי אנתלפיה ועוצמת קול ברחב זמן בקנה מידה מ10 μsec כ 200 לאלפיות שניים. בנוסף, modifications של ההליך ניסיוני כדי להבטיח זיהוי של עקבות מדגם והתייחסות בטמפרטורה זהה, הרכב חיץ, אורינטצית תא אופטי, כוח הלייזר, וכו 'מפחית באופן משמעותי את השגיאה הניסיונית בכמויות תגובה נמדדו וenthalpies.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכנות לדוגמא
- לבצע את הכנת מדגם וכל מניפולציות המדגם בחדר חשוך כדי למנוע משחררות רפרוף לא רצוי.
- Solubilize DM-nitrophen ((1 - (2-ניטרו-4 ,5-dimethoxyphenyl) - N, N, N ', N'-tetrakis [מתיל (Oxy-קרבוניל)] -1,2-ethanediamine) ב50 HEPES מ"מ חיץ, 100 מ"מ KCl, pH 7.0 לריכוז סופי של 400 מיקרומטר (ε 350nm = 4330 M -1 cm -1 9).
- להוסיף CaCl 2 מפתרון מניות 0.1 M כדי להשיג יחס רצוי של [Ca 2 +]: [DM-nitrophen]. לחלבונים עם ד K עבור Ca 2 + עמותה גדולה מ10 מיקרומטר, היחס של [Ca 2 +]: [DM-nitrophen] של 1:1 עדיף למנוע מחייב של 2 + Ca-שוחרר תמונה לDM-nitrophen שברחה מכלוב . ואכן, שוקל את ערך ד K עבור DM-nitrophen להיות 10 ננומטר והריכוז הכולל של DM-nitrophen וCa 2 + להיות 400 מ"מ, ~ 90% סידן חלבון מחייביםעם ד K = 10 מיקרומטר יהיה בapoform. מצד השני, למחקר של Ca 2 + מחייב את חלבונים עם ד K <10 מיקרומטר, עדיף להקטין את [Ca 2 +]: היחס [DM-nitrophen] ל0.95 למנוע Ca 2 + complexation עם APO- חלבון לפני צילום דיסוציאציה הכלוב.
- Solubilize מתחם ההתייחסות, K 3 [Fe (III) (CN) 6] או Na 2 4 CRO, באותו חיץ כלמדגם.
2. הגדרת הניסוי
- התצורה הניסיונית הבסיסית מוצגת באיור 2.
- השתמש חור סיכה (P 2) כדי להתאים את הקוטר של קרן הבדיקה (פלט 632 ננומטר של לייזר הוא Ne-, כוח לייזר 5 mW ~) 1 מ"מ ולהפיץ את קרן הבדיקה דרך מרכז תא יוצב בטמפרטורה בשליטת בעל תא באמצעות מראה M 1.
- להשתמש במראה (ז 2) מאחורי המדגם כדי למרכז את קרן הבדיקהבמרכזו של גלאי רגיש עמדה.
- תתמקד קרן הבדיקה במרכז של הגלאי בצורה כזאת, כי ההבדל במתח בין שתי דיודות העליונה ושתי דיודות תחתונה, כמו גם ההבדל במתח בין שתי דיודות בצד השמאל וימין של הגלאי הוא אפס.
- בהמשך לכך, לעצב את קוטר של קרן המשאבה, פלט 355 ננומטר של ממותג Q Nd: YAG לייזר, FWHM 5 NSEC) באמצעות חריר 3 מ"מ (P 1) ממוקם בין שתי מראות לייזר 355 ננומטר.
- Copropagate קרן המשאבה דרך מרכז קובט כפי שמודגם באיור 2. חשוב ששני קרני הלייזר מופצות דרך מרכז התא האופטי באופן כמעט colinear להשיג זווית סטיה מדידה ובכך גבוהה המשרעת של אות PBD. תחת תנאי ניסוי, את הזווית של צומת האלומות ובדיקת המשאבה היא פחות מ 15 °.
- השתמש במתחם התייחסות ליישר את החללית ומשאבהקרן להשגת אות PBD משביעה רצון, כלומר יחס טוב S / N ומשרעת PBD יציב על סקלות זמן ארוכים יותר (~ 100 אלפיות שנייה).
- להתאים את המיקום של קרן המשאבה ביחס לקרן הבדיקה על ידי התאמה הדרגתית של 355 מראות לייזר ננומטר.
- מדוד את המשרעת של אות ייחוס PBD כהבדל בין שתי דיודות העליונה והתחתונה על הגלאי רגיש העמדה. אות PBD צריכה להפגין גידול מהיר במשרעת בזמן בקנה מידה מהירה (<10 μsec) ולהישאר יציבה ב100 זמנים אלפיות שניים כפי שמודגמת באיור 3. הזריקה לשונות נורו של משרעת PDB היא בתוך 5% של משרעת האות ושחזור האות מושפע בעיקר מתנודות.
- בדוק את הליניאריות במשרעת אות PBD ביחס לאנרגיית החום המשתחררת על ידי מדידת התלות ליניארית של אות PBD על כוח לייזר עירור ועל מספר אינשטיין נספגה, E= (1-10-), שבו תואם את ספיגת ההתייחסות בגל העירור.
- שמור את כוח הלייזר מתחת כ -1,000 μJ וספיגה של מתחם מדגם / התייחסות בגל העירור פחות מ 0.5 כדי למנוע ספיגת multiphoton וירידה של כוח קרן משאבה, בהתאמה, ולהבטיח ליניאריות של אות PBD.
3. מדידות PBD
- התחל עם המדידה של עקבות PBD להתייחסות. מניחים את הפתרון של מתחם ההתייחסות בתא קוורץ x 0.5 סנטימטר 1.0 סנטימטר x 1.0 סנטימטר או 1.0 סנטימטר ולמקם את התא בבעל הטמפרטורה מבוקרת. שני אורכי הנתיב לספק משרעת PBD דומה.
- לזהות את אות PBD ההתייחסות כפונקציה של טמפרטורה בטווח הטמפרטורות 16-35 ° C עם תוספת הטמפרטורה של 3 מעלות צלזיוס
- על כל שינוי בטמפרטורה, לבדוק את המיקום של קרן הבדיקה בגלאי רגיש העמדה מחדשלהתאים את המיקום למרכז של הגלאי במידת צורך.
- בדוק את הליניאריות של אות PBD כפונקציה של טווח [(dn / dt) ρ P / C] לפי משוואה 2.
- מניחים את פתרון המדגם באותו התא אופטי כמו למתחם התייחסות שמירה על אותו הכיוון של התא האופטי כמו למדידת ההתייחסות.
- זיהוי מדגם עקבות PBD באותו טווח הטמפרטורות כמו להתייחסות ולבדוק את הליניאריות של משרעת PBD המדגם ביחס ל[ (dn / dt) ρ P / C] הטווח.
4. ניתוח נתונים
סדר הגודל של הסטייה הוא ביחס ישר לשינוי הנפח עקב חימום המדגם (ΔV ה) ושינוי nonthermal נפח (nonth ΔV) לפי משוואת 1: 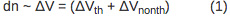
המשרעת של המדגם (S) והתייחסות (r) אות PBD ניתן לתאר באמצעות משוואות 2 ו -3, בהתאמה. 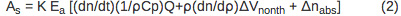
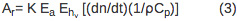
אות PBD עומד ביחס ישר לפרמטר תגובת מכשיר (K) ומספר אינשטיין נספג (E). הקדנציה הראשונה במשוואה 2, (dn / dt) (עמ '1/ρC) Q, תואמת את שינוי האות עקב החום המשתחרר לממס. Dn / dt הטווח מייצג את שינוי הטמפרטורה תלויה באינדקס שבירה, ρ הוא הצפיפות של הממס, עמ 'C הוא קיבול החום. כל הפרמטרים ידועים למים מזוקקים וניתן לקבוע לפתרון חיץ על ידי השוואת אותות PBD למתחם ההתייחסות במים מזוקקים ובמאגר מתאים. Q הוא כמות returne החוםד לממס. טווח ρ (DN / ד ρ) הוא יחידה קבועה פחות שהוא טמפרטורה עצמאית בטווח טמפרטורות 10-40 ° C 10. טווח רירי בטן Δn מתאים לשינוי באינדקס השבירה בשל נוכחותם של מיני קליטה בפתרון וזה זניח אם אורך הגל של קרן הבדיקה מוסט ביחס לספקטרום הספיגה של מינים כלשהו בפתרון. האות הנובעת ממתחם ההתייחסות (r) באה לידי ביטוי על ידי משוואה 3 בי ν h E הוא אנרגיית הפוטון באורך גל העירור, ν h E = 80.5 קלוריות / mol ל355 עירור ננומטר.
- קח את המשרעת של אות PBD ההתייחסות כהפרש בין pretrigger ואות PBD הודעה הדק כפי שמודגם באיור 3. באופן דומה, לקבוע את המשרעת של הצום (s מהירה) ושלב איטי (s איטית) של אות PBD המדגם.
- לחסל את פרמטר תגובת המכשיר, K, בהיקף של המשרעת של אות PBD המדגם על ידי משרעת של אות PBD להתייחסות. היחס של אות הדגימה לאות ההתייחסות נותן משוואה 4 ויכול להיות כפי שנכתב:

- שימוש במשוואה זו, לקבוע את החום המשתחרר לפתרון (Q) והשינוי בנפח nonthermal (nonth ΔV) הקשורים לתגובה ביוזמת תמונה מהמדרון וליירט, בהתאמה, של חלקה [(s / R) E ν h] טווח לעומת [טווח תלוי טמפרטורה (dn / dt) (1/ρCp)].
- כדי לקבוע את עוצמת תגובה ושינוי באנתלפיה למהירה ותהליך האיטי, קנה מידה של הנפח שנצפה ושינוי באנתלפיה לתשואת הקוונטים המתאים בהתאם למשוואות 5-7.
 "משוואה 5"
"משוואה 5" 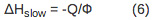
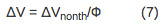
לתהליך רב שלבי עם קינטיקה המתרחשת בזמן בקנה המידה בין 10 μsec ~ 200 אלפיות שני, ניתן לקבוע את עוצמת הקול ושינויי אנתלפיה הקשורים לשלביה השונים של התגובה. אמפליטודות והגלגולים לצעדים הבודדים מנותחים על ידי התאמת הנתונים לפונקצית F (t) שמתאר את הפרופיל של הנפח ושינויי אנתלפיה הזמן.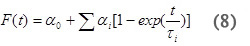
שבו α 0 מתאים לים מהיר וα i מתאימה לים איטי לכל תהליך אישי וτ אני נמצא בחיים של צעדי תגובה הבודדים. מטמפרטורת התלות של קבוע קצב עבורr תהליכים בודדים (k i = 1 / τ) i הפרמטרים אנתלפיה ההפעלה ואנטרופיה ניתן בקלות לקבוע באמצעות עלילות איירינג.
Access restricted. Please log in or start a trial to view this content.
תוצאות
דוגמא מייצגת של PBD עקבות לCa 2 + תמונה שחרור מCa 2 + DM-nitrophen מוצגת באיור 3. השלב המהיר מתאים לצילום המחשוף של Ca 2 + DM-nitrophen וCa 2 + שחרור, ואילו השלב האיטי משקף Ca 2 + מחייבים לכלוב nonphotolysed. העלילה של המדגם משרעת PBD לשלב המהיר ואיטי בקנה מידה למש?...
Access restricted. Please log in or start a trial to view this content.
Discussion
העיקרון הפיזי מאחורי שיטות photothermal הוא שמולקולת צילום מתרגש מתפוגגת אנרגיה עודפת באמצעות הרפיה רטט למצב הקרקע, וכתוצאה מחימום תרמית של 1,12 ממס שמסביב. לממסים, כגון מים, זה מייצר התרחבות מהירה נפח (ΔV ה). מולקולות נרגשת מדינה עשויות גם לעבור תהליכי פוטו כי תוצ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדע (MCB 1,021,831, JM) וי & E. ביו רפואית תכנית המחקר (פלורידה מחלקת בריאות, JM).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1-(4,5-Dimethoxy-2-Nitrophenyl)-1,2-Diaminoethane-N,N,N',N'-Tetraacetic Acid | Life Technologies | D-6814 | DM-nitrophen, cage calcium compound, keep stock solutions in dark to prevent photodissociation |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid, N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid) | Sigma Adrich | 0909C | HEPES buffer |
| Potassium ferricyanide (III) | Sigma Aldrich | 702587 | reference compound for PBD measurements |
| Sodium chromate | Sigma Aldrich | 307831 | reference compound for PBD measurements |
| He-Ne Laser Diode 5 mW 635 nm | Edmund Optics | 54-179 | use as a probe beam for PBD measurements |
| Oscilloscope, | LeCroy | Wave Surfer 42Xs | 400 MHz bandwith |
| Nd:YAG laser | Continuum | ML II | pump beam for PBD measurements |
| M355; Nd:YAG laser mirror | Edmund Optics | 47-324 | laser mirror for 355 nm laser line |
| M1 and M2; Laser diode mirror | Edmund Optics | 43-532 | visilbe laser flat mirror, wavelength range 300-700 nm |
| P1 and P2; Iris Diaphragm | Edmund Optics | 62-649 | pin hole to shape the probe and pum beams |
| L1; bi-convex lens | Thorlabs | LB1844 | a lens to focus the probe beam at the detector, EFL 50 mm, wavelength range 350-2,000 nm |
| DM, dichroic mirror | Thorlabs | DMLP505 | a longpass dichroic mirror with a cutoff wavelength of 505 nm |
| F1; Edge filter | Andower | 500FH90-25 | a long pass filter with a cutoff wavelength of 500 nm |
| Temperature-controlled cuvette holder | Quantum Northwest | FLASH 300 |
References
- Gensch, T., Viappiani, C. Time-resolved photothermal methods: accessing time-resolved thermodynamics of photoinduced processes in chemistry and biology. Photochem. Photobiol. Sci. 2, 699-721 (2003).
- Larsen, R. W., Mikšovská, J. Time resolved thermodynamics of ligand binding to heme proteins. Coord. Chem. Rev. 251 (9-10), 1101-1127 (2007).
- Westrick, J. A., Peters, K. S. A photoacoustic calorimetric study of horse myoglobin. Bioph. Chem. 37 (1-3), 73-79 (1990).
- Belogortseva, N., Rubio, M., Terrell, W., Miksovska, J. The contribution of heme propionate groups to the conformational dynamics associated with CO photodissociation from horse heart myoglobin. J. Inorg. Biochem. 101 (7), 977-986 (2007).
- Mikšovská, J., Suquet, C., Satterlee, J. D., Larsen, R. W. Characterization of Conformational Changes Coupled to Ligand Photodissociation from the Heme Binding Domain of FixL. Biochemistry. 44 (30), 10028-10036 (2005).
- Miksovska, J., Gennis, R. B., Larsen, R. W. Photothermal studies of CO photodissociation from mixed valence Escherichia coli cytochrome bo3. FEBS Lett. 579 (14), 3014-3018 (2005).
- Losi, A., Michler, I., Gärtner, W., Braslavsky, S. E. Time-resolved Thermodynamic Changes Photoinduced in 5,12-trans-locked Bacteriorhodopsin. Evidence that Retinal Isomerization is Required for Protein Activation. Photochem. Photobiol. 72, 590-597 (2000).
- Kondoh, M., et al. Light-Induced Conformational Changes in Full-Length Arabidopsis thaliana Cryptochrome. J. Mol. Biol. 413 (1), 128-137 (2011).
- Kaplan, J. H., Ellis-Davies, G. C. Photolabile chelators for the rapid photorelease of divalent cations. Proc. Natl. Acad. Sci. U.S.A. 85 (17), 6571-6575 (1988).
- Eisenberg, H. Equation for the Refractive Index of Water. J. Chem. Phys. 43 (11), 3887-3892 (1965).
- Ellis-Davies, G. C., Kaplan, J. H., Barsotti, R. J. Laser photolysis of caged calcium: rates of calcium release by nitrophenyl-EGTA and DM-nitrophen. Biophys. J. 70, 1006-1016 (1996).
- Miksovska, J., Larsen, R. W. Structure-function relationships in metalloproteins. Methods Enzymol. 360, 302-329 (2003).
- Miksovska, J., Norstrom, J., Larsen, R. W. Thermodynamic profiles for CO photodissociation from heme model compounds: effect of proximal ligands. Inorg. Chem. 44 (4), 1006-1014 (2005).
- Dhulipala, G., Rubio, M., Michael, K., Miksovska, J. Thermodynamic profile for urea photo-release from a N-(2-nitrobenzyl) caged urea compound. Photochem. Photobiol. Sci. 8, 1157-1163 (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved