Method Article
לדמיין אינטראקציות החלבון-DNA בתאים חיידקיים בשידור חי באמצעות מעקב מולקולה בודדת photoactivated
In This Article
Summary
מיקרוסקופיה photoactivated הלוקליזציה (PALM) בשילוב עם מעקב מולקולה בודדת מאפשרת התבוננות ישירה וכימות של אינטראקציות החלבון-DNA בתאי חיידקי Escherichia חיים.
Abstract
אינטראקציות החלבון-DNA הן בלב של תהליכים תאיים רבים יסודיים. לדוגמא, שכפול הדנ"א, השעתוק, ותיקון, והארגון של כרומוזום נשלטים על ידי חלבוני קושרי DNA שמזהים מבני DNA ספציפיים או רצפים. בניסויים במבחנה סייעו לייצר מודלים מפורטים עבור הפונקציה של סוגים רבים של חלבוני ה-DNA מחייבת, ובכל זאת , המנגנונים של תהליכים אלה והארגון שלהם בסביבה המורכבת של התא החי המדויקים יישארו הרבה פחות מובן. לאחרונה הציגו שיטה לכימות פעילות ה-DNA-תיקון בתאי חיידקי Escherichia חיים באמצעות photoactivated לוקליזציה מיקרוסקופית (PALM) בשילוב עם מעקב מולקולה בודדת. הגישה הכללית שלנו מזהה אירועים-DNA מחייבת פרט על ידי השינוי בניידות של חלבון יחיד על קשר עם כרומוזום. את החלק היחסי של מולקולות מאוגדים מספק מדד כמוני ישיר לפעולת החלבוןivity ושפע של מצעים או אתרי קישור ברמת התא הבודד. כאן, אנו מתארים את הרעיון של השיטה ונדגים הכנת מדגם, רכישת נתונים, ונהלי ניתוח נתונים.
Introduction
פרוטוקול זה מתאר מדידה הישירה של אינטראקציות החלבון-DNA בתאים חי Escherichia coli. הטכניקה מנצלת את השינוי במקדם הדיפוזיה של חלבון יחיד שכותרתו fluorescently כפי שהוא קושר את כרומוזום (איור 1). כדי להדגים את השיטה שאנו משתמשים DNA פולימרז (Pol1), חלבון קושר DNA טיפוסי שממלא את פערי דנ"א בשכפול גדיל מפגר ומסלולי תיקון כריתת 1.
כניסתו של מיקרוסקופ פלואורסצנטי רזולוציה סופר מאפשרת הדמיה של מבנים מולקולריים בתאים עם רזולוציה ננומטר. Photoactivated לוקליזציה מיקרוסקופית (PALM) מעסיק חלבוני ניאון שיכול להיות מופעל ממדינה חשוכה ראשונית למצב ניאון (איור 2). רק קבוצת משנה של כל המולקולות שכותרתו מופעלת בכל עת כדי לקבוע את עמדותיהם באופן רציף, באופן בלתי תלוי tהוא בסך הכל ריכוז של מולקולות שכותרתו במדגם 2. דיוק הלוקליזציה לכל מולקולה בעיקר תלוי בגודל של פונקצית התפשטות נקודת הניאון (כוחות הביטחון הפלסטיניים), מספר הפוטונים שנאספו, ואות רקע 3. יישומים של שיטה זו רבים להתמקד בויזואליזציה המשופרת של מבנים הסלולר. ההבנה שניתן לשלב PALM עם מולקולה בודדת מעקב 4 נפתחו אפיקים חדשים לעקוב באופן ישיר את התנועה של מספרים שרירותיים של חלבונים שכותרתו בתאים חיים. רגישות מוגברת והחלטה זמנית של מיקרוסקופים הקרינה מאפשרים כעת מעקב של חלבוני ניאון לשדר אחת בציטופלסמה חיידקי 5.
כאן, אנחנו מעסיקים PAmCherry, חלבון פלואורסצנטי מהונדס שאופן בלתי הפיך ממיר ממדינת nonfluorescent ראשונית למצב ניאון על הקרנה עם 405 ננומטר אור 6. fluorophores PAmCherry הופעל יכול להיות תמונהד על ידי עירור ב 561 ננומטר ולעקוב אחריו במשך כמה מסגרות עד photobleaching. אנחנו מדגימים את יכולתה של השיטה לזיהוי אירועים-DNA מחייבת חולפים של חלבונים בודדים באמצעות שילוב של Pol1 וPAmCherry. טיפול בתאים עם methanesulfonate מתיל (MMS) גורם נזק מתילציה דנ"א שהפך למצעי DNA ומרווחים על ידי אנזימים לתיקון בסיס כריתה. השיטה שלנו מראה ברורה מחייבת של מולקולות Pol1 אחת בתגובה לנזק MMS 7.
Protocol
1. תרבית תאים
השתמש בצינורות תרבות סטרילי וטיפים פיפטה. E. זן חיידק AB1157 פולה-PAmCherry נושא היתוך PAmCherry טרמינל C-של Pol1. ההיתוך הוכנס במיקום כרומוזומלי האם על ידי החלפת גני wild-type באמצעות רקומבינציה מבדה אדומה כפי שמתואר בDatsenko et al. 8 הפונקציונליות של חלבון ההיתוך אושר כלהישפט על ידי שיעורי צמיחה סלולריים ורגישות לתיל סוכן ה-DNA נזק methanesulfonate (MMS). ניתן למצוא מידע נוסף על הבנייה של מתח התא בUphoff et al. 7, Datsenko et al. 8, ו רייס-למוט et al. תרביות תאים 9 גדלים במדיום מינימאלי M9 להפחית autofluorescence ולהימנע חלקיקי רקע על שקופיות מיקרוסקופ. לחלופין, בינוני מוגדרת עשירים בחומרים מזינים יכול לשמש 10.
- רצף ה AB115 זן חיידק7 פולה-PAmCherry ממניות גליצרול קפוא על צלחת מרק לוריא (LB) agarose עם אנטיביוטיקה סלקטיבית (כאן, 25 מיקרוגרם / מיליליטר kanamycin) ולדגור על 37 מעלות צלזיוס למשך לילה.
- לחסן תרבות 5 מיליליטר LB ממושבת תא בודד ולגדול על 37 מעלות צלזיוס רועד ב220 סל"ד במשך 3 שעות.
- לדלל את התרבות 1:10,000 לתוך 5 מיליליטר מדיום מינימאלי (בינוני M9, חומצות אמינו MEM + פרולין, ויטמיני MEM, גליצרול 0.2%) ו לדגור על 37 ° C הרועד בסל"ד 220 לילה.
- למחרת בבוקר, מודד את הצפיפות האופטית (OD) באמצעות ספקטרופוטומטר ולדלל את התרבות ב5 מיליליטר מדיום מינימאלי טרי לOD 0.025. לגדול במשך השעה 2 ב 37 מעלות צלזיוס רועד ב220 סל"ד לתחילת שלב מעריכי (OD 0.1).
- להתרכז 1 מיליליטר של תאים בצינור 1.5 מיליליטר microcentrifuge ידי צנטריפוגה ב2,300 XG במשך 5 דקות. הסר את supernatant ו resuspend התא גלולה ב 20 בינוני שיורי μl ומערבולת.
2. שקופיות מיקרוסקופ preparatיון
- הכן את פתרון agarose נמוך הקרינה 1.5% ב DH 2 O. השתמש במיקרוגל כדי להמס agarose עד הפתרון הוא ברור. מערבבים 500 μl של פתרון agarose נמס עם 500 μl של מדיום מינימאלי 2x בעדינות על ידי pipetting למעלה ולמטה כמה פעמים.
- מורחים את פתרון agarose באופן שווה על מרכז coverslip מיקרוסקופ (אין עובי 1.5). זה חייב להיעשות במהירות לפני agarose מתקרר, הימנעות בועות.
- שטח את הכרית עם coverslip שני (אין עובי 1.5). כדי להסיר חלקיקי ניאון רקע, coverslips נשרפו בעבר בתנור ב500 מעלות צלזיוס במשך שעה 1. coverslips נשרף יכול להיות מאוחסן במשך שבועות בטמפרטורת חדר מכוסים בנייר אלומיניום.
- עבור ניסויי נזק לדנ"א, להכין כרית agarose המכילה 100 מ"מ-MMS. בצע את ההליך בשלבי 2.1-2.3, אבל להוסיף 8.3 MMS μl 500 μl של מדיום M9 לפני הערבוב עם 500 μl של agarose 1.5% מומסים, לריכוז סופי של 100 מ"מ Mטרשת נפוצה. (Caution! MMS הוא רעיל וmutagenic ויש לטפל בם עם כפפות, מסכה, משקפי מגן, ומעייל מעבדה).
- הסר את השקופית העליונה מהפנקס ולהוסיף 1 μl של השעיה תא מרוכזת על הכרית. לשתק את התאים על ידי כיסוי הכרית עם coverslip שאינו בשימוש שרפה (אין עובי 1.5, מפרט מטרת מיקרוסקופ התאמה) ועל ידי לחיצה בעדינות רבה בשקופית. תאים צריכים להיות צילמו בתוך 45 דקות של חוסר תנועה לפני מתייבש כרית agarose. כדי למנוע התייבשות במהלך ניסויים ארוכים יותר, יכולה להיות אטומות רפידות agarose באמצעות אטמי סיליקון.
- בניסויים ה-DNA נזק, דגירה תאים משותקים על כרית agarose המכילה 100 מ"מ MMS עבור 20 דקות במכל humidified בטמפרטורת חדר לפני ההדמיה.
3. הכנה מיקרוסקופית רכישת נתונים
PALM מסתמך על זיהוי והאיתור מדויק של חלבוני ניאון אחד. הרגישות והיישור אופטימלי שלהמיקרוסקופ הוא קריטי לאיכות נתונים. מיקרוסקופים הקרינה מולקולה בודדת בדרך כלל להעסיק השתקפות סה"כ פנימית תאורה (TIR) כדי לשפר את יחס אות לרעש על ידי fluorophores המרגש רק בתוך קטע דק מעל פני השטח coverslip. הנה, הדמיה בתוך E. coli דורש תאורה מאוד נוטה 11, אשר יכול להיות מושגת על ידי מיקרוסקופ TIRF מעט להקטין את הזווית של אור העירור. ההדמיה PAmCherry נוספת דורשת לייזר photoactivation 405 ננומטר וליזר עירור 561 ננומטר. פליטת הקרינה נרשמת על אלקטרון הכפלת CCD מצלמה (EMCCD) בהגדלה וכתוצאה מכך אורך פיקסל של 114.5 ננומטר / פיקסל. לדיוק לוקליזציה אופטימלי, גודל פיקסל צריך כ להתאים את רוחב סטיית התקן של כוחות הביטחון הפלסטיניים על מנת להבטיח דגימה מספיק בלי להפיץ את האות על פיקסלים רבים מדי. איור 3 מראה סכמטי של התקנת PALM מינימאלית. סרט 1נותן רושם של תהליך בניית מיקרוסקופ העידו, ראה Uphoff אח' 7 לתיאור מפורט של המכשיר..
- ביצוע יישור מיקרוסקופ שיגרתי. מדוד את ננומטר 405 ו561 עוצמות לייזר גל רציף ננומטר מול אובייקטיבי. התאם את עוצמת 561 ננומטר ל3.5 mW (~ 400 W / 2 סנטימטר) ו405 עוצמת ננומטר עד 10 μW (~ 1 W / 2 סנטימטר). השתמש בגלגל משתנה ברציפות ניטראלית צפיפות מסנן המאפשר התאמה הדרגתית של 405 עוצמת ננומטר 0-10 μW. כבה את תאורת הלייזר עד לתחילת הניסוי.
- מניחים את המדגם על הבמה מיקרוסקופ ולהביא את התאים לתוך להתמקד במצב מועבר אור מיקרוסקופית (איור 4 א). רווח המצלמה EMCCD צריך להיות כבוי כדי למנוע נזק למצלמה על ידי חשיפת יתר.
- הגדר FOV קצוץ כדי להקטין את גודל הנתונים ולהגדיל את מהירות קריאה מתוך מצלמה.
- כסה המדגם מן האור וswit הסביבהch על רווח המצלמה EMCCD.
- הגדר את קצב הפריימים ל15.26 msec / מסגרת (כולל 0.26 זמן קריאת נתוני מצלמה אלפיות שני). ראה "עוצמות זמן חשיפה ועירור" בסעיף הדיון.
- להציג את נתוני מצלמה כדי לבדוק את אות רקע הכהה (איור 4).
- הפעל את לייזר 561 ננומטר ולבדוק את אות רקע עירור (איור 4C).
- הפעל את לייזר 405 ננומטר עבור photoactivation של חלבוני היתוך Pol1-PAmCherry ולהגביר את עוצמת הקרינה עד PSFs יופיע.
- התאם את הזווית של קרן העירור להאיר סעיף דק בלבד של המדגם הקרוב אל פני השטח coverslip.
- לשם כך, קרן הלייזר ממוקדת למישור המוקד האחורי של מטרת 100X NA 1.4 (איור 3). תרגום העדשה מתמקדת בניצב לקרן מעביר את המוקד מהמרכז של המטרה לגרום לקרן כדי לצאת האובייקטיבי תחת זווית.
- Aiמ 'למקסם את עוצמת הקרינה ולמזער את אות הרקע. שימו לב שעירור TIR קפדן הוא אופטימלי לfluorophores תמונה בתוך של פני השטח coverslip 100 ננומטר, לעומת זאת, מחייב חלבוני DNA הדמיה קשורים לE. coli nucleoid דורש תאורה עמוקה יותר עד 0.8 מיקרומטר.
4. רכישת נתונים
כאן אנו מתארים פרוטוקול הכללי לרכישת סרט PALM. אותו הנוהל חל הדמיה חלבוני היתוך Pol1-PAmCherry בא ניזוק coli תאים ותחת טיפול נזק לדנ"א רציף עם MMS. יישום השיטה לחלבוני היתוך של מספר משקל או עותק מולקולרי שונה לכל תא ידרוש הגדרות רכישה שונות (ראה סעיף דיון).
- מצא את השדה חדש של ראייה (FOV) של תאים במצב מיקרוסקופ אור מועבר ולמקד את התמונה. קח את תמונת מצב מצלמה כדי להקליט (איור 4 א) קווי המתאר תא.
- כסה את הדגימה מאור הסביבה ולעבור על רווח המצלמה EMCCD.
- הפעל את לייזר 561 ננומטר ולהלבין את autofluorescence הסלולרי וכתמי רקע על coverslip לכמה שניות לפני שמתחיל רכישת נתונים. לתאים גדלו וצלם במדיום M9 ושימוש שרפה coverslips יש בדרך כלל רקע הקרינה קטן מאוד, עם זאת, prebleaching יכול להיות שימושי עבור תאי הדמיה במדיום גידול עשיר כגון LB. שים לב שהתאורה חזקה היא רעילה לתאים כך prebleaching צריך להישמר עד למינימום.
- הפעל את הרכישה של סרט PALM תחת עירור 561 ננומטר רציף ב15.26 msec / מסגרת.
- הפעל את לייזר 405 ננומטר ולהגדיל בהדרגה את האינטנסיביות במהלך הסרט, והגיע עד W 1/2 סנטימטר. הימנע 405 עוצמות ננומטר גבוהות יותר שגורמות autofluorescence הסלולרי. שים לב לצפיפות של מולקולות ניאון - חשוב לשמור על שיעורי הפעלה נמוכים כדי כך שהם בבירור PSFsמבודד בכל מסגרת (איורים 4D-F).
- הקלט 10,000 מסגרות / סרט (תלוי במספר המולקולות להיות צילמו לכל תא); סרט אחד בדרך כלל לוקח 2-3 דקות ודורש 0.5-1 GB של שטח דיסק קשיח בהתאם לגודל של שדה הראייה.
- חזור על תהליך הרכישה לFOV מרובה. שים לב שכל שדה ראייה יכולה להיות צילם רק פעם אחת בגלל fluorophores PAmCherry לקבל photoactivated ומולבן באופן בלתי הפיך.
5. ניתוח נתונים
מסגרת ניתוח נתונים אוטומטית וחזקה היא חיונית לביצועים ויעילים של השיטה. אנו משתמשים בתוכנה מותאמת אישית שנכתבה ב-Matlab.
- לבצע את ניתוח הלוקליזציה באמצעות אלגוריתמים שתוארו בקרוקר ואח'. 12, הולדן ואח'. 13, HoldenI et al. 14, וWieser et al. 15 PSFs מזוהה ראשון בתמונה מסוננת להקה עוברת משתמש בקרנל גאוס עם 7 פיקסלהקוטר של (איור 5 א). עמדות מועמד מתאימות לPSFs עם עוצמות פיקסל שיא מעל 4.5 פעמים סטיית התקן של אות הרקע (איור 5). פיקסל הבהיר באופן מקומי לכוחות הביטחון הפלסטיניים מועמד משמש כניחוש ראשוני להתאמת פונקצית גאוס סגלגלה (איור 5 ג). פרמטרים בכושר חינם הם: מיקום ה-x, y-מיקום, x-רוחב, y-רוחב, זווית סיבוב, משרעת, ורקע קיזוז. מסכת גאוס הסגלגל מהווה מולקולה בזמן החשיפה, המטשטש ומעווה את כוחות הביטחון הפלסטיניים.
- עלילה (x, y) מגויר כתוצאה מכל המסגרות של סרט PALM על גבי התמונה במיקרוסקופ אור מועברת מאותו שדה הראייה. מגויר של Pol1-PAmCherry אמור להופיע בתוך שטח E. המרכזי תאי coli (איור 6 א). אם מגוירים רבים מופיעים מחוץ לתאים, סף הלוקליזציה נקבע נמוך מדי או המדגם הכיל חלקיקי ניאון רקע.
- לניתוח מעקב אוטומטי, יישום MATLAB של האלגוריתם המתואר בקרוקר ואח'. 12 יכולים לשמש (ראה "ניתוח דיפוזיה" בסעיף הדיון). עמדות המופיעות במסגרות הבאות בתוך חלון מעקב הגדרת משתמש מחוברות ליצירת מסלול. במקרה שמגויר מרובים להתרחש באותו החלון, מסלולים מוקצים באופן ייחודי על ידי מזעור הסכום של אורכי צעד. לדיון מפורט של השיקולים השונים בעת חישוב מקדמי דיפוזיה מנתוני מעקב חלקיק יחיד, ראה Wieser et al. 15
- האלגוריתם משתמש בפרמטר זיכרון לתת דין וחשבון למצמוץ חולף או מגויר החמיץ במהלך מסלול. כאן, אנו מגדירים את פרמטר הזיכרון למסגרת 1; ערכים גבוהים יותר יכולים לשמש למעקב אחר fluorophores עם מדינות חשוכות חיים ארוכות.
- בחר חלון מעקב מתאים המבוסס על מדרגות הכיול הבאות. לPol1, אנו משתמשים 0.57 מיקרומטר (5 פיקסלים).
- הפעל את אלגוריתם המעקב לטווח של מעקב חלון פרמטרים. לחשב את מספר מסלולים שנמדדו לכל תא כפונקציה של חלון המעקב כדי לזהות את חלון המעקב הקטן ביותר האפשרי שלא לפצל מסלולים (איור 6).
- עלילה מסלולי כתוצאה מכך על התמונה במיקרוסקופ אור מועברת מאותו שדה הראייה כדי להמחיש את הפריסה המרחבית של תנועת מולקולה בתוך תאים. מסלולי Pol1 צריכים להציג דיפוזיה מוגבלת בתוך תאים בודדים (איורים 6C-D).
- אם חלק קטן משירים מופיע לחצות בין תאים זה מצביע על כך שמולקולות נפרדות בטעות קשורה כי חלון המעקב נבחר גדול ו / או שיעור photoactivation היה גבוה מדי (איור 6E) מדי.
- מגרש את ההתפלגות המצטברת של אורכי הצעד בין מגויר רצוף (איור 6F). העקומה עולה ומרווה בצורה חלקה עבור Windows מעקב גדולה מספיקאבל מראה קצה חיתוך אם החלון נבחר קטן מדי.
- כדי לנתח את מאפייני הדיפוזיה של Pol1, לחשב את התזוזה הממוצעת בריבוע (MSD) בין מגויר ברציפות עבור כל מסלול עם סך של צעדי N):
MSD = 1 / (N-1) Σ i = 1 N-1 (X i +1 - x i) 2 + (y i +1 - i y) 2.
כולל מסלולים עם לפחות 4 שלבים (N ≥ 5 מגוירים) רק כדי להפחית את אי הוודאות הסטטיסטית בערכי MSD. - עלילה עקומה של ערכי MSD על פני טווח של פעמים בפיגור על ידי חישוב התקות על מסגרות מרובות (איור 6G). הצורה של עקומת MSD יכול לעזור לסווג את התנועה הנצפית המולקולרית (איור 6 שעות).
- לחשב את * D מקדם הדיפוזיה הברורה לכל מסלול מMSD:
D * = MSD / (4 Δt) - σ loc 2 / Δt.
T השניERM מתקן לשגיאת הלוקליזציה נאמדה (כאן, loc σ = ננומטר 40 וΔt = 15.26 אלפיות שני, ראה Wieser et al. 15). - עלילה היסטוגרמה של הערכים * D נמדדו מכל המסלולים ב( איור 7 א) FOV.
- לזהות מולקולות Pol1 בודדות המופיעות חייבת כרומוזום המבוסס על נמדד D * הערך לכל מסלול. להפריד בין האוכלוסיות של כבול (החלוקה חדה מרוכזת ב D * ~ 0 מיקרומטר 2 / sec) ומולקולות לשדר באופן חופשי (הפצה רחבה מרוכזת ב D * ~ 0.9 מיקרומטר 2 / sec) על ידי קביעת סף D * <0.15 מיקרומטר 2 / שניות ( ברים אדומים ב7A דמויות ו7D).
- לבצע לוקליזציה, מעקב, וניתוח דיפוזיה לPol1 בתאים שלא נפגעו (איורים 7 א-C) ובתאים תחת טיפול-DNA נזק עם MMS (איורים 7D-E). את החלק היחסי של מסלולים כרוכים מספק מדד כמוני ישיר של DNפעילות תיקון Pol1 in vivo.
תוצאות
הרעיון של מולקולה בודדת photoactivated מעקב כדי לחקור אינטראקציות-DNA חלבון in vivo מודגם באיור 1. חלבוני היתוך PAmCherry מזוהים בE. החי coli תאים באופן רציף על ידי photoactivating מולקולות בודדות stochastically עם ננומטר אור 405 בתדר של מולקולה פחות מאחוז אחד לכל תא בכל פעם. מולקולות הופעל הם צילמו תחת עירור ננומטר הרציף 561. תנועה מולקולרית בתא יכולה להיות במעקב על ידי חיבור מגויר סמוך בסדרה של מסגרות עד photobleaching בלתי הפיך. בגלל דיפוזיה של חלבוני ה-DNA מחייבת מואטת על כריכת כרומוזום, מקדם הדיפוזיה לכאורה D * המתקבל למסלול ישירות מדווח על אינטראקציות החלבון-DNA בודדים.
איור 2 מדגים photoactivation של חלבוני היתוך Pol1-PAmCherry בא 'בשידור חי תאי coli. השפעת עוצמת 405 ננומטר on הצפיפות של מולקולות ניאון שניתן לראות באיור 4. שים לב שהצפיפות אינה נקבעה אך ורק על ידי עוצמת 405 ננומטר אלא גם במספר המולקולות שאינן זמינים עבור הפעלה; הבריכה של מולקולות הנותרות יאזל במהלך סרט PALM.
ניתוח לוקליזציה מתבצע לכל מסגרת של סרט PALM כפי שמודגם באיור 5. מדדנו את רמת דיוק הלוקליזציה באמצעות מולקולות נייחות בתאים קבועים או מולקולות מאוגדות בתאים חיים. הגדרות הרכישה שלנו נתנו דיוק לוקליזציה של loc = 40 ננומטר σ, בהסכם עם התחזית התיאורטית 3.
מגוירי Pol1 וכתוצאה מכך לכבוש את האזור המרכזי של התא (איור 6 א), באופן רחב משחזר ארגון המרחבי של א ' coli nucleoid 7. רוב Pol1 עוקב בתאי ניזוק להציג difהיתוך כפי שמוצג באיור 6 ג. תא טיפוסי מכיל כמה מאה מסלולים Pol1 (איור 6 ד '), עולים בקנה אחד עם מספר העותק של כ 400 מולקולות Pol1 לE. . תא coli 1 נתוני 6B ו6E-F לספק הדרכה בבחירת חלון מעקב פרמטר מתאים - אם חלון המעקב הוא גדול מדי, מולקולות שונות נוטה יותר להיות בטעות קשורה למסלול, אם חלון המעקב הוא קטן מדי, מסלולים בצעדים ארוכים יותר יהיה מפוצל. עקומת MSD לPol1 עולה באופן ליניארי לפעמים בפיגור קצר ומרווה בזמנים השהיה ארוכות יותר בשל תא כליאה (איור 6G). סוגים שונים של תנועה מולקולרית יכולים להיות מזוהים על ידי ניתוח MSD. תנועת בימוי נותנת עקומת parabolic; תנועה הבראונית מאופיינת בקו ישר; עקומת הדיפוזיה מוגבלת מגיעה לרמה; קיזוז של עקומת MSD עבור חלקיקים נייחים מייצגת את lחוסר ודאות ocalization (איור 6 שעות). ניתן למצוא מידע נוסף על טיפים למעקב ופתרון בעיות חלקיק יחיד בArnauld et al. 16
אנחנו מוחלים בעבר את השיטה כדי למדוד את פעילות ה-DNA-תיקון Pol1 בתגובה לנזקי DNA אקסוגני אלקילציה 7. D היסטוגרמה * של Pol1 עוקבת בתאי ניזוק מראה אוכלוסייה דומיננטית של לשדר מולקולות (איורים 7 א-C). חלק קטן של מולקולות Pol1 כפותות .2.7% הוא סביר מעורב בשכפול גדיל מפגר ותיקון של נזק לדנ"א אנדוגני. תחת נזק מ"מ MMS רציף 100, האוכלוסייה של מסלולים עם D * ~ 0 מיקרומטר עליות 2 / sec ל13.8% (איור 7D). מסלולים אלה מייצגים מולקולות Pol1 בודדות ביצוע סינתזת תיקון דנ"א כדי למלא פערי נוקלאוטיד יחיד כחלק ממסלול תיקון בסיס כריתה. עמדותיהם של מסלולים כרוכים מראות את מיקומם של הפרטנזק לדנ"א ותיקון אתרים (איור 7E-F).
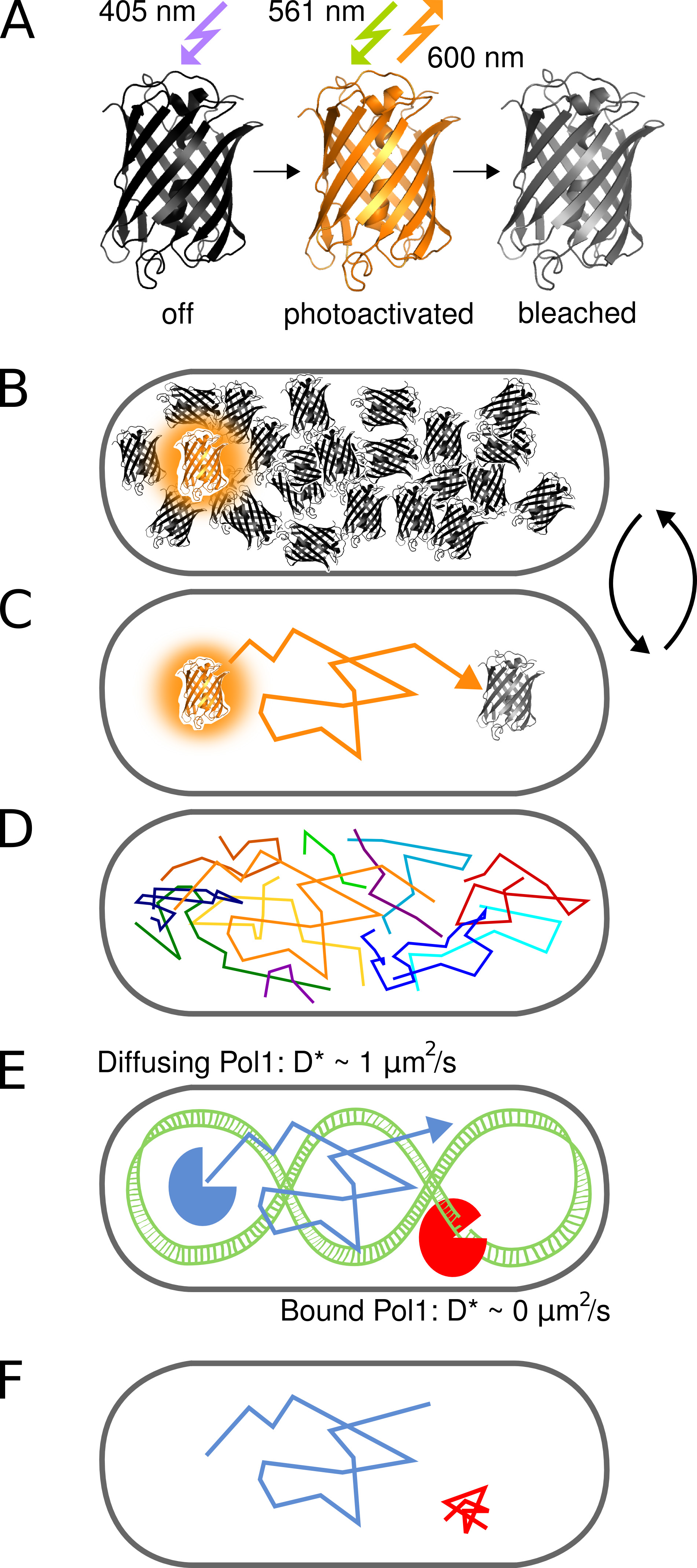
איור 1. ייצוג גרפי של השיטה. () PAmCherry החלבון פלואורסצנטי ניתן photoactivated ממדינת nonfluorescent ראשוני על הקרנה עם 405 ננומטר אור. המדינה בהירה היא נרגשת ב561 ננומטר ופולטת הקרינה סביב 600 ננומטר עד מלביני fluorophore באופן בלתי הפיך. (ב) שליטה על שיעור photoactivation מאפשרת הדמיה רק חלבון יחיד הופעל stochastically היתוך PAmCherry לכל תא בכל עת תוך הבריכה הגדולה באופן שרירותי של מולקולות שעדיין לא הופעלו או כבר מולבנת נותר במצב חשוך. (ג) עמדתה של מולקולת הניאון נקבעה ממרכז כוחות הביטחון הפלסטיניים וTR המבודדיםacked במשך כמה מסגרות עד photobleaching. מסלולים (ד ') של מולקולות רבות נרשמים באופן רציף. (EF) האינטראקציה של חלבון קושר DNA עם רצף יעד כרומוזומליות או מבנה עוצרת את תנועת diffusive האקראית. מולקולות מאוגדים ולא מאוגדים נבדלות במקדם דיפוזיה לכאורה D * חולץ משירים בודדים. את החלק יחסי של מולקולות מאוגדים וכתוצאה מכך נותן מדד כמוני לפעילות של חלבון ה-DNA מחייבת in vivo. לחץ כאן לצפייה בתמונה גדולה יותר.
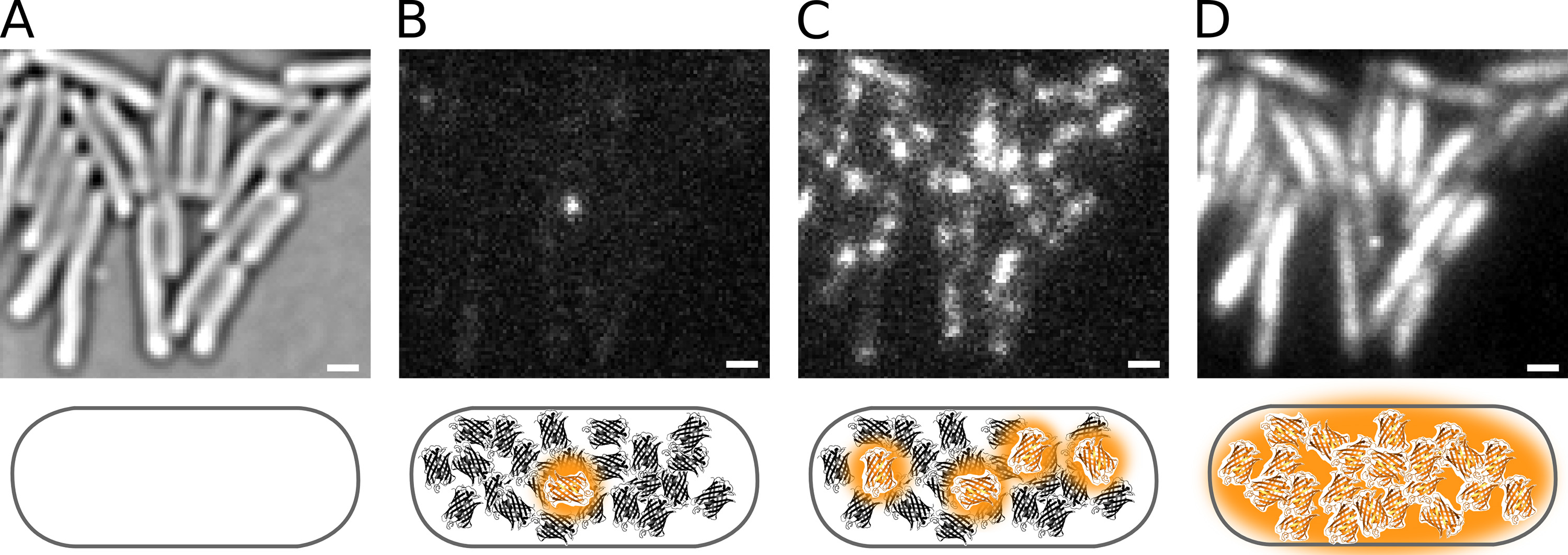
איור 2. Photoactivation של Pol1-PAmCherry בא 'בשידור חי תאי coli. ברים סולם: 1 מיקרומטר. שרטוטים מוצגים מתחת לכל פנל. ( א) מועבר בתמונת מיקרוסקופ אור של תאים משותקים על כרית agarose. (ב) Phototactivating fluorophore PAmCherry אחת בתא אחד. (ג) שיעור photoactivation גבוה יותר מגדיל את מספר מולקולות ניאון. הקרינה המשולבת PAmCherry מסרט PALM (ד '). לחץ כאן לצפייה בתמונה גדולה יותר.
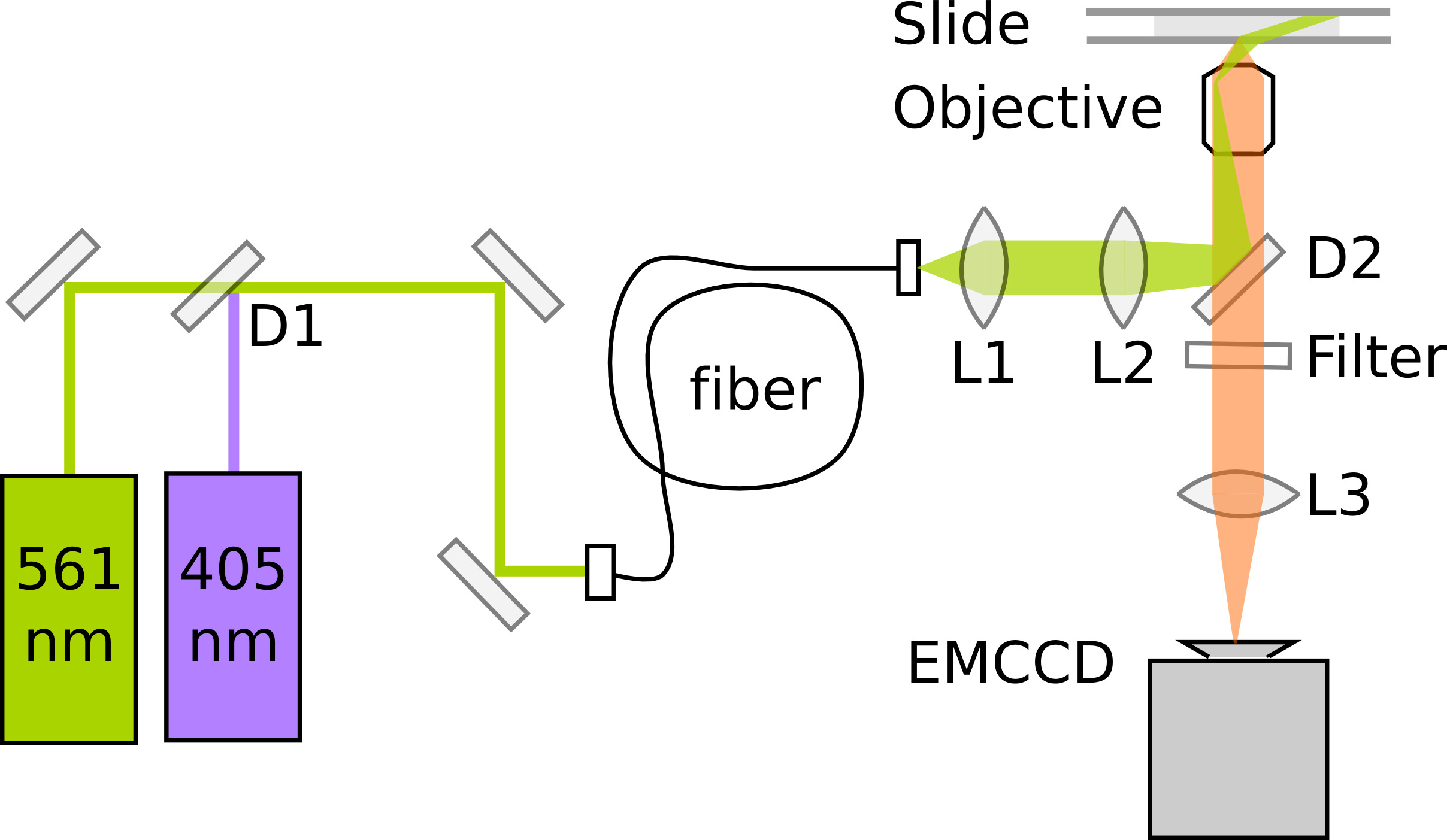
איור 3. תרשים סכמטי של הרשת PALM מינימאלית לחלבוני photoactivating והיתוך PAmCherry ההדמיה D1:. מראה Dichroic (למשל 550 ארוך לעבור ננומטר). D2: מראה Dichroic (למשל 570 ארוך לעבור ננומטר). L1: עדשת collimating. L2: עדשת TIR. L3: עדשת צינור.1177/51177fig3highres.jpg "target =" _blank "> לחץ כאן לצפייה בתמונה גדולה יותר.

איור 4. נציג תמונות מסרט PALM עם 15.26 msec / מסגרת סולם ברים:. 1 מיקרומטר. (א) המועברים בתמונת אור של תאים משותקים על כרית agarose. (ב) תמונת רקע כהה שנמדדה על המצלמה EMCCD עם הלייזרים כבויה. תמונה (C) עירור רקע תחת עירור 561 ננומטר רציף לפני photoactivation. עוצמת ננומטר (DF) מוגבר 405 מובילה לשיעורים גבוהים יותר של photoactivation PAmCherry, צילמו תחת עירור ננומטר הרציף 561. האזורים התאגרפו מוצגים מוגדל להלן. (ד ') בעצימות נמוכה ננומטר 405 פעילים (<μW 1) מעט מאוד מולקולות ניאון לFOV. (ה) בינונית 405תוצאות photoactivation עוצמת ננומטר (~ 2 μW) בצפיפות כוחות הביטחון הפלסטיניים טובה ללוקליזציה ומעקב וניתוח. העצמה גבוהה 405 ננומטר (~ 10 μW) (F) מפעיל מולקולה יותר מאחד ניאון בחלק מהתאים, אשר מטשטשת לוקליזציה ומעקב וניתוח. לחץ כאן לצפייה בתמונה גדולה יותר.

איור 5. איור של ניתוח הלוקליזציה. ברים סולם: 1 מיקרומטר () סינון הלהקה עובר מסיר רעש פיקסל מזויף ומשטח הדרגתיים בעוצמה על פני שדה הראייה.. (ב) PSFs מועמד מזוהה בתמונה המסוננת בהתבסס על סף המוגדרים על ידי משתמש, כי הוא נבחר כדי למזער לתגליות שליליות חיוביות ושקר שקר. Threshold תואם את עוצמת המינימום של פיקסל מועמד מחולקת בסטיית תקן הרקע (יחס אות לרעש, יחס אות לרעש). פיקסל המקומי הבהיר שעובר את הסף משמש כניחוש ראשוני לוקליזציה (צלב כתום) לשני ממדים בכושר גאוס סגלגל (C). סולם ברים: 0.5 מיקרומטר. לוקליזציה וכתוצאה מכך הרזולוציה סופר (צלב כחול) יש דיוק ממוצע של loc σ = 40 ננומטר. לחץ כאן לצפייה בתמונה גדולה יותר.
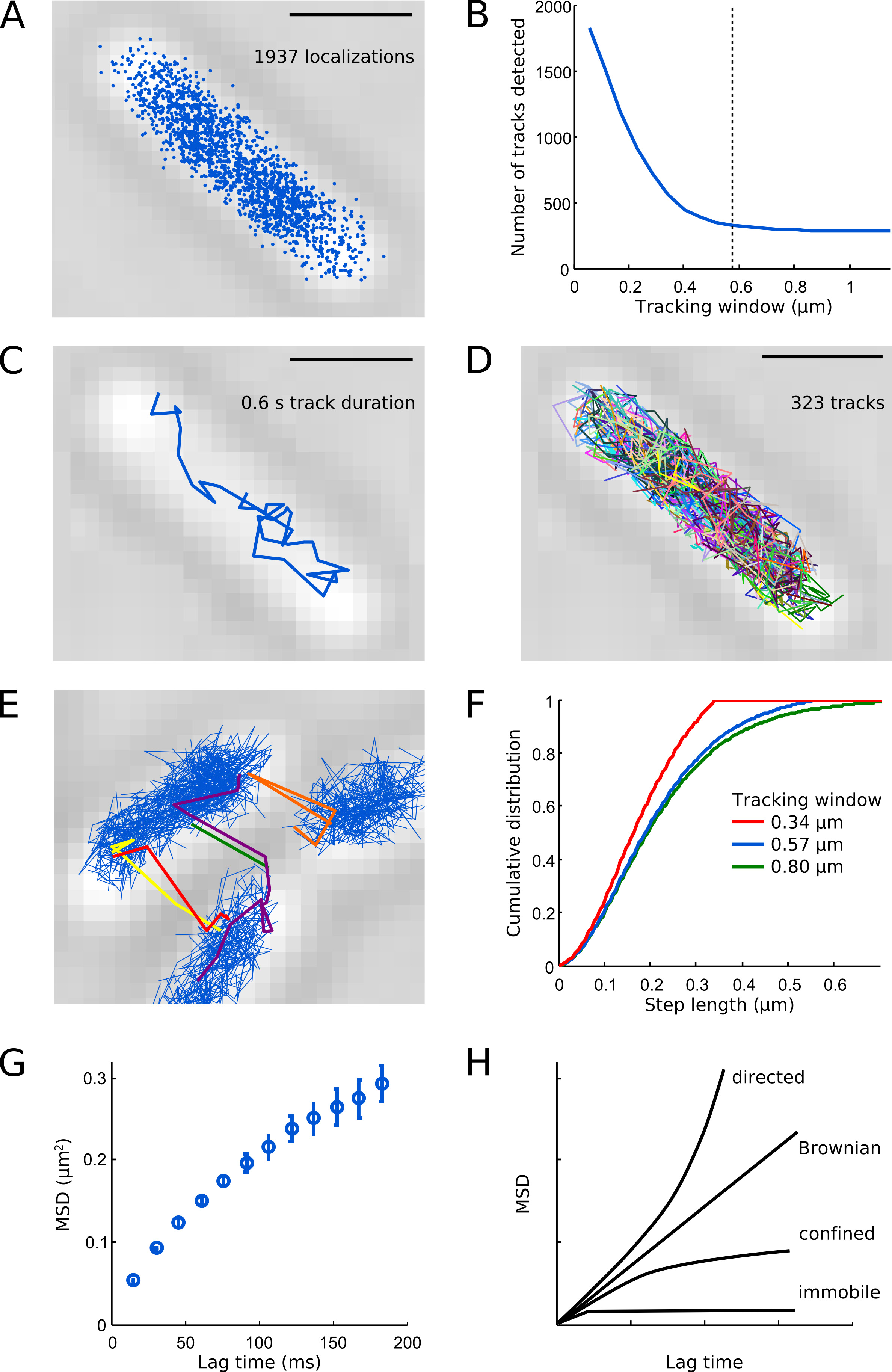
.. איור 6 איור של ניתוח מעקב סולם ברים: 1 מיקרומטר. (א) כל הגרסות המגוירות המזוהה של Pol1-PAmCherry בתא ירושלים. (ב) מספר המסלולים לזהותאד בתא, למשל כפונקציה של חלון המעקב. חלונות מעקב קטנים לפצל מסלולי מולקולה, מה שמוביל לartifactual מספר גבוה של מסלולים. הקו המקווקו מציין הבחירה שלנו לפרמטר חלון מעקב (0.57 מיקרומטר, 5 פיקסלים) - זה נותן פשרה טובה בין איתור ההתפלגות המלאה של צעדים ושמירה על המסלולים של מולקולות שונות בשלמותה. (ג) אחר דוגמא של מולקולת Pol1-PAmCherry אחת. (ד) כל המסלולים נמדדו מוצגים בצבעים אקראיים. ממצאי מעקב (ה) אם חלון המעקב נבחר גדול מדי (כאן 0.8 מיקרומטר, 7 פיקסלים) או הצפיפות של PSFs לכל מסגרת היא גבוהים מדי. (F) התפלגויות מצטברת של אורכי צעד לחלונות מעקב: 0.34 מיקרומטר (3 פיקסלים, קו אדום), 0.57 מיקרומטר (5 פיקסלים, קו כחול), ו0.80 מיקרומטר (7 פיקסלים, קו ירוק). שימו לב ש0.34 מיקרומטר חלון המעקב חותך את צעדים ארוכים יותר מ0.34 מיקרומטר אשר באופן ברורחותך את ההתפלגות המלאה של צעדים. חלון המעקב 0.57 מיקרומטר מזהה כמעט אותה ההתפלגות של צעדים כפי שעושה 0.80 מיקרומטר חלון המעקב. עקומה (G) MSD מציגה דיפוזיה מוגבלת של Pol1. עקומות (H) סכמטי MSD לתנועה מכוונת, תנועה בראונית, דיפוזיה מוגבלת, וחלקיקים נייחים. לחצו כאן לצפייה בתמונה גדולה יותר.
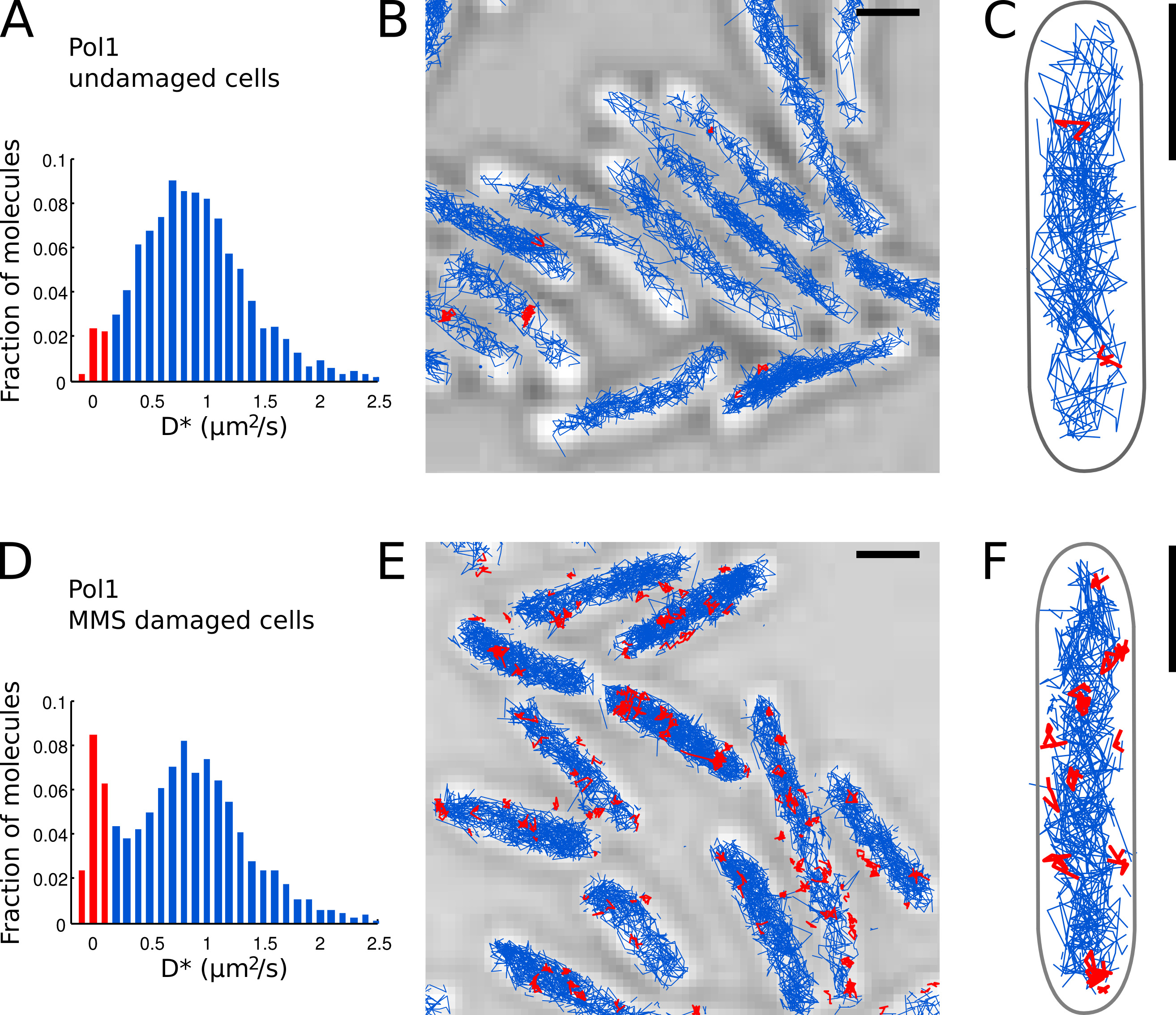
איור 7. מדידה ישירה של פעילות תיקון DNA של Pol1 בא 'בשידור חי . Coli תאי סולם ברים: 1 מיקרומטר. (א) היסטוגרמה של * D מקדם הדיפוזיה לכאורה לכל המסלולים של 4 או יותר שלבים בFOV של תאים שלא נפגעו (N = 4,162 שירים). האוכלוסייה של מולקולות מסווגות כb ound מסומן באדום. מסלולים (BC) של Pol1-PAmCherry מוצגים בתמונה מיקרוסקופית אור מועבר. מסלולים מסווגים כמחויב על פי מקדם הדיפוזיה שלהם מוצגים באדום. (ד) D * היסטוגרמה למסלולי Pol1 נמדדו בתאים משותקים על כרית agarose עם 100 מ"מ MMS וטופחו במשך 20 דקות לפני ההדמיה (N = 2,128 שירים). האוכלוסייה של מולקולות מאוגדים העוסקות בתיקון DNA מוצגת באדום. (EF) Pol1-PAmCherry עוקב על תמונה במיקרוסקופ אור מועברת מראה את המסלולים של אירועי תיקון DNA Pol1 אחת באדום. לחץ כאן לצפייה בתמונה גדולה יותר.

סרט 1. בניית התקנת PALM העידו."Target =" _blank JoVE_Uphoff_Movie1.avi "> לחץ כאן לצפייה בוידאו.
Discussion
אנו דנים כמה שיקולים מרכזיים להצלחה של הניסוי.
בחירה וביטוי של חלבון היתוך הניאון: יש לוח גדול של חלבוני ניאון photoactivatable וphotoswitchable 17. הבחירה הספציפית תלויה במאפייני מיקרוסקופ, במיוחד הלייזרים והמסננים זמינים. השילוב של 405 ננומטר ו561 ננומטר הוא אידיאלי עבור חלבוני ניאון photoactivatable משותפים. בחרנו PAmCherry 6 כי זה monomeric ולא הראיתי צבירה בתאים. יתר על כן, photoactivation בלתי הפיך מאפשר לספור את מספר fluorophores הופעל כדי למדוד מספרי עותק חלבון לכל תא. במקום להביע את חלבון ההיתוך מפלסמיד, אנו מעדיפים החדרה הכרומוזומלי של הגן המקודד לחלבון ההיתוך במוקד wild-type. זה מבטיח החלפה של החלבון של עניין להשלים עם הניאון version ושמירה על רמת ביטוי wild-type.
שיעור photoactivation: חשוב להתאים את קצב כזה photoactivation כי בממוצע פחות ממולקולה אחת לכל תא נמצאת במצב הניאון בכל מסגרת של הסרט. זה תלוי בעוצמת 405 ננומטר ומספר המולקולות עזב כדי להיות מופעל. בצפיפויות הדמיה נמוכות מאוד, עם זאת, לא כל המולקולות יהיו צילמו לפני סוף הסרט או סרטים ארוכים מאוד צריכים להיות נרכשים. מספר המסגרות שנרשמו לכל סרט תלוי במספר העותק של חלבוני היתוך לכל תא וכל החיים הממוצעים photobleaching של PAmCherry בתנאי העירור בשימוש. עותק מספר Pol1 הוא ~ 400 מולקולות / הערך הממוצע של התפלגות החיים photobleaching מעריכי תא 1 והיה ~ 4 מסגרות. על ידי הגדלת עוצמת 405 ננומטר בהדרגה, ההפעלה מופצת באופן שווה על פני 10,000 המסגרות של הסרט. לכן, כל תא הוא occupמטען על ידי מולקולות ניאון עבור סכום כולל של ~ 1,600 מסגרות, להבטיח חפיפה מועטת של PSFs וסיבוכים מעקב בסרט של 10,000 מסגרות.
עוצמות זמן חשיפה ועירור: בראש ובראשונה, זמני חשיפה צריכה להיות קצר מספיק כדי להתבונן PSFs החד בתנועה קצת טשטוש. עם זאת, יש לבחור את מסגרת הדולר להניב תנועה מולקולרית נצפית בין מסגרות רצופות מעבר לחוסר ודאות הלוקליזציה, אחרת פוטונים חיוניים מבוזבזים על ידי oversampling המסלול. התנועה של מולקולות מאוגדים יש נדגם במרווחי זמן ארוך מספיק כדי להיות מובחן מהתנועה הנראית של מולקולות מחויבות בשל אי וודאות הלוקליזציה באופן ברור. כשהזמן החשיפה מוגדר, צריכה להיות מותאמת עוצמת כוחות הביטחון הפלסטיניים. דיוק הלוקליזציה של כוחות הביטחון הפלסטיניים עולה עם מספר הפוטונים זוהו על משך הזמן של מסגרת. עוצמות עירור גבוהות יותר להגדיל את bu שיעור פליטת הפוטוןt גם שיעור photobleaching ואות רקע. השתמש בעוצמת העירור הנמוכה ביותר שנותנת את דיוק הלוקליזציה הרצויה. לPol1-PAmCherry בחרנו 15.26 msec / מסגרת ו3.5 עירור mW 561 ננומטר (400 W / 2 סנטימטר). זה חשוב כדי לאשר תא כדאיות לתנאי הדמיה מסוימים על ידי ניטור צמיחת תאים ומורפולוגיה לפני ואחרי רכישת נתונים (ראה מידע נוסף בUphoff et al. 7).
Pol1 מפגין זמן מחייב של ~ 2 שניות למצע ה-DNA ומרווחות in vivo 7, ולכן אנו מצפים שרוב המולקולות להיות גם במדינה המאוגדת או לא מאוגדת עבור כל משך הזמן של מסלול. מולקולות Bound מופיעות בעצם נייחות כי יש לי אתרי כרומוזום מקדם הדיפוזיה כמה סדרי גודל נמוך יותר (~ 10 -5 מיקרומטר 2 / sec, אלמור ואח'. 18) מאשר דיפוזיה Pol1 בציטופלסמה (~ 1 מיקרומטר 2 / sec).
ניתוח דיפוזיה: * D מקדם הדיפוזיה לכאורה מחושב מMSD של שירים בודדים, בממוצע למינימום של 4 שלבים (5 מסגרות) כדי להפחית את השגיאה הסטטיסטית. שים לב ש~ 75% ממולקולות אקונומיקה בתוך פחות מ -5 מסגרות לתנאי ההדמיה מתוארות. מסלולים קצרים כל כך לא מספקים ודאות סטטיסטית מספיק כדי להבחין מולקולות מאוגדת ומאוגדות. עם זאת, שברים היחסי של מולקולות מאוגדים ולא מאוגדים שידווחו על פעילות החלבון אינם תלויים במספר הכולל של מסלולים מנותחים.
זה שימושי כדי להסביר את שגיאת לוקליזציה כוחות הביטחון הפלסטיניים (loc σ) בחישוב * D בגלל חוסר הוודאות מוסיפה צעד אקראי לכאורה זה לזה לוקליזציה של מולקולה 15.
כדי לשפר את הסיווג של מולקולות מאוגדים ולשדר, אנו ממליצים על חישוב D בוט *שעות מההתקות בשלב יחיד וההתקות לאורך הזמן של שתי מסגרות. אז זה אפשרי לקבוע שני ספים נפרדים D *: * D (15 אלפיות שני) <0.15 מיקרומטר 2 / sec ו* D (30 אלפיות שני) <0.075 מיקרומטר 2 / sec.
שים לב ש* D הוא מקדם הדיפוזיה ברורה שהוא מושפע כליאת תא של המסילה ותנועת טשטוש עקב דיפוזיה בזמן החשיפה. כדי לחלץ מקדמי דיפוזיה משוחד מדויקים, היא הוכיחה שימושית כדי להשוות את ההצעה שנצפתה לנתונים מלאכותיים המבוססים על 5,7 מודל תנועה הבראונית סטוכסטיים. גם נתוני סימולציה יכולים לשמש כדי לבדוק את נהלי ניתוח נתונים.
יישומים אפשריים של שיטה זו: אנחנו תיארתי גישה כללית המאפשר הדמיה וכימות אינטראקציות-DNA חלבון in vivo על ידי השינוי בניידות של חלבון על כריכה לכרומוזום. הפעילויות של ה-DNA אומחייב חלבוני RNA המעורבים בתיקון, שכפול, שעתוק, ותחזוקת כרומוזום לכן יכולים להיות מיושמים בזמן אמת ברמת התא הבודד עם רזולוציה מרחבית מתחת לגבול ההשתברות האופטית. מעקב מולקולה בודדת photoactivated מרחיב שיטות מעקב קונבנציונליות, כי הם מוגבלים לכמה מולקולות שכותרת לכל תא. שיטה חלופית המודדת דיפוזיה מולקולרית in vivo היא שחזור הקרינה לאחר Photobleaching (FRAP). בעוד FRAP הוא שימושי מאוד למדידת מאפייני הדיפוזיה העולמית בתאים גדולים, הוא מוגבל ביכולתה כדי לפתור כמה מינים מולקולריים עם mobilities שונה בסביבה מרחבית הטרוגנית, במיוחד לתאי חיידקים קטנים.
יש לנו ליישם מולקולה בודדת photoactivated מעקב כדי למדוד את פעילות ה-DNA מחייבת ומגוירים subcellular של מגוון רחב של חלבונים שונים בE. coli כולל Pol1, האנזים DNA, חלבון ה-FIS, ה-DNAפולימראז III 7, כמו גם תחזוקה המבנית של חלבוני כרומוזומים MukB, E, ו-F 19. אנו צופים את השיטה גם יכולה להיות מותאמת לסוגי תאים אחרים.
Disclosures
המחברים מצהירים שאין להם אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מכירים ג'סטין פינקני ויוהנס Hohlbein לעזרה בבנייה של מיקרוסקופ העידו ושיימוס הולדן עבור תוכנת הלוקליזציה. רודריגו רייס-למוט הוא הודה למתן א זן חיידק. המחקר מומן על ידי הבריאות-F4-2008-201,418 נציבות האירופיות תכנית המסגרת השביעית גרנט FP7/2007-2013, בריטניה ביוטכנולוגיה ומדעי הביולוגיה המועצה למחקר גרנט BB/H01795X/1, והמועצה האירופית למחקר גרנט 261,227 לANK. DJS מומן על ידי Wellcome Trust Program גרנט WT083469. SU נתמכה על ידי דוקטורט MathWorks.
Materials
| Name | Company | Catalog Number | Comments |
| E. coli strain carrying a chromosomal insertion for a PAmCherry DNA-binding fusion protein | created by Lambda-Red recombination | ||
| MEM amino acids | Invitrogen | 11130-051 | minimal medium supplement |
| MEM vitamins | Invitrogen | 11120-052 | minimal medium supplement |
| Agarose | BioRad | 161-3100 | certified molecular biology grade |
| Microscope coverslips No 1.5 thickness | Menzel | BB024060SC | remove background particles by heating slides in furnace at 500 °C for 1 hr |
| Methyl methanesulfonate (MMS) | Sigma-Aldrich | 129925 | CAUTION: toxic |
| PALM setup | home-built | described in Uphoff et al.7 | |
| MATLAB | MathWorks | for data analysis and visualization | |
| Localization software | custom-written, available online | http://www.physics.ox.ac.uk/Users/kapanidis/Group/Main.Software.html | MATLAB and C++ software package that can be adapted for localization analysis. Cite Holden et al.13 if used in publication. |
| Tracking software | available online | http://physics.georgetown.edu/matlab/ | MATLAB implementation by Blair and Dufresne. Cite Crocker & Grier12 if used in publication. |
References
- Friedberg, E. C. DNA Repair and Mutagenesis. , American Society for Microbiology. Washington, DC. (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer spatial resolution. Science. 313 (5793), 1642-1645 (2006).
- Mortensen, K. I., Churchman, L. S., Spudich, J. A., Flyvbjerg, H. Optimized localization analysis for single-molecule tracking and super-resolution microscopy. Nat. Methods. 7 (5), 377-381 (2010).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nat. Methods. 5 (2), 155-157 (2008).
- English, B. P., et al. Single-molecule investigations of the stringent response machinery in living bacterial cells. Proc. Natl. Acad. Sci. U.S.A. 108 (31), (2011).
- Subach, F. V., et al. Photoactivatable mCherry for high-resolution two-color fluorescence microscopy. Nat. Methods. 6 (2), 153-159 (2009).
- Uphoff, S., Reyes-Lamothe, R., Garza de Leon, F., Sherratt, D. J., Kapanidis, A. N. Single-molecule DNA repair in live bacteria. Proc. Natl. Acad. Sci. U.S.A. 110 (20), 8063-8068 (2013).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc. Natl. Acad. Sci. U.S.A. 97 (12), 6640-6645 (2000).
- Reyes-Lamothe, R., Possoz, C., Danilova, O., Sherratt, D. J. Independent positioning and action of Escherichia coli replisomes in live cells. Cell. 133 (1), 90-102 (2008).
- Neidhardt, F. C., Bloch, P. L., Smith, D. F. Culture medium for enterobacteria. J. Bacteriol. 119 (3), 736-747 (1974).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nat. Methods. 5 (2), 159-161 (2008).
- Crocker, J. C., Grier, D. G. Methods of digital video microscopy for colloidal studies. J. Colloid. Interface. Sci. 179 (1), 298-310 (1996).
- Holden, S. J., et al. Defining the limits of single molecule FRET resolution in TIRF microscopy. Biophys. J. 99 (9), 3102-3111 (2010).
- Holden, S. J., Uphoff, S., Kapanidis, A. N. DAOSTORM: an algorithm for high-density super-resolution microscopy. Nat. Methods. 8 (4), 279-280 (2011).
- Wieser, S., Schütz, G. J. Tracking single molecules in the live cell plasma membrane-Do's and Don't's. Methods. 46 (2), 131-140 (2008).
- Arnauld, S., Nicolas, B., Hervé, R., Didier, M. Multiple-target tracing (MTT) algorithm probes molecular dynamics at cell surface. Protoc. Exch. , Available from: http://dx.doi.org/10.1038/nprot.2008.128 (2008).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. (11), 555-565 (2009).
- Elmore, S., Müller, M., Vischer, N., Odijk, T., Woldringh, C. L. Single-particle tracking of oriC-GFP fluorescent spots during chromosome segregation in Escherichia coli. J. Struct. Biol. 151 (3), 275-287 (2005).
- Badrinarayanan, A., Reyes-Lamothe, R., Uphoff, S., Leake, M. C., Sherratt, D. J. In vivo architecture and action of bacterial Structural Maintenance of Chromosome proteins. Science. 338 (6106), 528-531 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved