A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מערכת Swimmeret של סרטן הנהרות: מדריך מעשי לDissection של חוט העצב ותאי הקלטות של התבנית מוטורית
In This Article
Summary
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
Abstract
כאן אנו מדגימים את הנתיחה של חוט עצב בטן הסרטנים. ההכנה כוללת את הגרעינים שעבר שני חזה (T4, T5) ושרשרת של גרעיני בטן (A1 לA6). שרשרת זו של הגרעינים כוללת את החלק של מערכת העצבים המרכזית (CNS) שמניעה את התנועה מתואמת של pleopods (swimmerets): מערכת swimmeret. זה ידוע במשך למעלה מחמישה עשורים שבסרטנים כל swimmeret הוא מונע על ידי הליבה שלה עצמאי דפוס יצירה שיוצרת פעילות לסירוגין קצבי 1-3. הנוירונים המוטוריים innervating השרירים של כל swimmeret מהווים שני אנטומית ותפקודי אוכלוסיות נפרדות 4. אחת מהן הוא אחראי לביטול (שבץ הכח, PS) של swimmeret. האחרים מניע את ההימשכות (מכה החוזרת, RS) של swimmeret. הנוירונים מוטוריים של מערכת swimmeret מסוגלים לייצר באופן ספונטני דפוס מוטורי פיקטיווי, שהוא זהה לדפוס שנרשם בvivo 1.
מטרת דו"ח זה היא להציג את מערכת מודל מעניינת ונוחה ללימוד רשתות מניבת קצב ותיאום של שבבים עצמאיים לקורסי המעבדה המעשיים של התלמידים. הפרוטוקול סיפק כולל הוראות שלב-אחר-צעד לנתיחה של חוט עצב הבטן של הסרטנים, מצמיד של השרשרת בודדת של הגרעינים, גרעיני desheathing והקלטת הדפוס המוטורי הפיקטיבי swimmerets extracellularly ממערכת העצבים המבודדים.
בנוסף, אנו יכולים לפקח על הפעילות של תאי עצב swimmeret נרשמו intracellularly מהדנדריטים. כאן אנו גם מתארים בקצרה את הטכניקות הללו ולספק כמה דוגמאות. יתר על כן, המורפולוגיה של תאי עצב swimmeret ניתן להעריך באמצעות טכניקות צביעה שונות. כאן אנו מספקים דוגמאות של תאית (על ידי iontophoresis) נוירונים צבע מלא וbackfills של בריכות של הנוירונים מוטוריים swimmeret. במעבדה שלנואנו משתמשים בתכשיר זה ללמוד פונקציות בסיסיות של תנועה פיקטיבית, את ההשפעה של משוב תחושתי בפעילות של מערכת העצבים המרכזית, ותיאום בין שבבים ברמה תאית.
Introduction
Swimmerets של הסרטנים לשרת פונקציה בשליטה על יציבה והכה בקצב שבו החיות לשחות קדימה, לאוורר המחילות או הנקבות שלהם לאוורר את ביציהן 5, 6. Swimmerets של סרטני האות, leniusculus Pacifastacus, מתרחש בזוגות משניים לחמישית קטע בטן, עם איבר אחד בכל צד של 7 הבטן. מערכת העצבים המרכזית מייצרת בלהג שלו הקצבי המנוע אשר מניע את תנועת swimmeret בחיה שלמה, כמו גם בהכנת חוט עצב בודדת. כאשר אין משוב תחושתי או יורדים קלט נוכחי דפוס מנוע הקצבי מיוצר נקרא תנועה פיקטיבית 1, 2. במערכת swimmeret דפוס מנוע זה אינו שונה בכל פרמטר מהפעילות של swimmerets נמדד בבעלי החיים ללא פגע.
התנועה של כל swimmeret היא מונעת על ידי microcircuit שנמצא ובמוגבל לג אחדorresponding hemiganglion 1 -. 3 בכל microcircuit יש גרעין דפוס יצירה שמורכב מחמש interneurons spiking שאינו מזוהה. הם יכולים להיות מאופיינים מבחינה תפקודית כמונעים או של שבץ כוח (IPS) או מונעי של שבץ שבות (IRS) 8. שב"ס אלה וinterneurons IRS אינם מתנדים אנדוגני, ולא הפעילות לסירוגין היא מונע על ידי עיכוב הדדי 9. בגלל interneurons אלה מעכבת את הנוירונים המוטוריים swimmeret ישירות, תנועת PS-RS לסירוגין נוצרה 10. תנועה עם זאת, לא רק דורשת הדור של פעילות, אלא גם תיאום של השבבים העצמאיים השונים. במערכת swimmeret תיאום כזה היא הוקם על ידי microcircuit התיאום אשר מבטיח כי איברים פעילים בזמנים נכונים. microcircuit זה נבנה על ידי שלושה נוירונים שזוהו בכל מגזר 11-15.
פרוטוקול זה מספק עבור ההדואר הפעם הראשונה מדריך לנתיחה צעד-אחר-צעד לבודד את השרשרת של הגרעינים (T4 לA6, איור 1). אנו מראים כיצד להצמיד חוט עצב הבטן המבודד וdesheathe כל גנגליון. בהכנת מערכת עצבים מבודדת זה, תאי העצב אחראים לתנועת swimmeret מוכנים לשימוש בניסויי אלקטרו ומורפולוגי. בחלקו השני של פרוטוקול זה מדגים את התכונות העיקריות של הדפוס המוטורי swimmeret. זה כולל מדריך צעד-אחר-צעד לשיא extracellularly הפעילות של הנוירונים מוטוריים swimmeret. האקסונים של תאי עצב מוטורי RS להקרין באמצעות הסניף הקדמי של N1 עצב, בעוד האקסונים של תאי עצב מוטוריים PS להקרין באמצעות הסניף האחורי של אותו העצב (איור 1) 4. לכן הפעילות שלהם ניתן להקליט מענפים אלה עם אלקטרודות סיכת ההפרש.

איור 1: מערכת עצבים מבודדת מגנגליון חזה 4 (T4) לגנגליון בטן 6 (A6) ותרשים סכמטי שלו T4:. גנגליון חזה 4; T5: גנגליון חזה 5; A1, A2 ... A6 הגנגליון בטן 1, הגנגליון בטן 2 ... הגנגליון בטן 6; N1: עצב N1; N2: עצב N2; N3: עצב N3; PS: שבץ-כוח; RS: שבץ-שיבה. קיצורים כיוונית: = קדמי; P = אחורי.
הליך זה לנתיחה וטכניקת אלקטרו הפגינה נוחים לסטודנטים לתואר ראשון ועשוי להשלים קורסים מעשיים סטודנט בפיזיולוגיה. השרשרת בודדת של הגרעינים נעשתה שימוש במספר הניסויים כדי ללמוד לתפקד במערכת עצבים, תיאום, או אפנון של שבבי swimmeret 6, כמו גם שליטה עצבית של התנהגות מסתגלת בתנועה 16, 17. מערכת swimmeret הסרטנים וכך מספקת כמות עצומה הוראה או לא מענייניםגשם הזדמנויות שכל להתחיל עם דיסקציה של חוט עצב הגחון של סרטנים והקלטה תאית של הדפוס המוטורי הפיקטיבי.
Protocol
הליך זה לנתיחה הוא בהתאם לקהילות האירופיות הנחיית המועצה של 22 ספטמבר 2010 (2010/63 / איחוד אירופי).
1. הכנה
- להשיג סרטנים, leniusculus Pacifastacus (דנה), משני המינים ≥8 סנטימטר בגודל. להבטיח כי בעלי החיים הם חיוניים וגפי בטן ובטן הם ללא פגע.
- תשמור על עצמך כדי לבדוק את השריון ושציפורן זה קשה ונוקשה. יש לפני ובעלי החיים postmolt שריון רך ואינם מתאימים לניסויים, כי במהלך תהליך הנשרת פרמטרים רבים לשנות (למשל, ירידה בפעילות של תנועה).
- להרכיב את כל הכלים וחומרים המשמשים במהלך הניתוח, מצמיד וdesheathing של חוט העצב שמוצג באיור 2 ומופיעים במוספים סיפקו.

איור 2: חומרים וכלים המשמשים לנתיחה, מצמידות וdesheathing של חוט העצב.
הדלי גדול מלא בקרח (1); (2) מלוח סרטנים; (3) מנפק מלוח; (4) מיקרוסקופ לנתיחה; (5) צלחת לנתיחה; (6) מספריים חזקים; (7) מלקחיים (8) מספריים אביב; (9) צלחת פטרי מרופד בsylgard ברור; (10) סיכות תיקון; (11) מקור מנורה קר.
2. גרוס Dissection
- להרדים בעלי חיים על קרח במשך 15 - 20 דקות. לבצע את החלק הראשון של נתיחת ברוטו בספסל מעבדה ליד הכיור שכן הוא כולל שלב exsanguination והדגימה צריכה לשטוף באופן קבוע עם מי מלח הסרטנים במהלך ההליך.
- החזק צד הגחון בעלי חיים ולהשתמש במספריים חזקים לחתוך שני ציפורניים בבסיסיהם בסמוך לבית החזה (איור 3-1). הסר uropod ימין ועל שמאל (איור 3-2).
- הנח את צד הגחון בעלי החיים בצלחת לנתיחה מרופדת בsylgard השחור. Elevate cephalothorax על ידי החדרת קרח מתחת ולהצמיד את הבטן בtelson (איור 4 א).
- מלא את המתקן מלוח עם ~ 60 מיליליטר מלוח סרטנים מצוננים. Perfuse סרטנים עם מי מלח קר דרך הפתח הטופר (איור 4). מלוח עודף לנקז דרך החתכים בuropods. לכסות סרטנים עם קרח במהלך exsanguination
- לערוף את החיה עם רוחבי יחיד לחתוך רק אחורי לעיניו של בעל החיים באמצעות מספריים חזקים (איור 5 א). הסר את כל רגלי ההליכה ליד מפרקי הבסיס כפי שצוין באיור 5.
- לבודד את הבטן עם פרקי החזה האחרונים משאר cephalothorax. ביצוע חתך ראשון ברמה של רגלי ההליכה השניה (מגזר חזה 3) על ידי החדרת הקצה של המספריים לתוך הפתח של רגל ההליכה השנייה וחיתוך לצד השני. (איור 6 א-1).
- להאריך חתך ראשון זה על שני הצדדים באמצעות tהוא cephalothorax (איור 6 א-2).
- הפוך את החיה הפתוחה כדי להפוך חלק מהאיברים הפנימיים גלוי. לדחוף את בלוטת העיכול הבולטת (איור 6-3) לחלק הקדמי של הדגימה ולהשתמש במלקחיים כדי להסיר את אברי הרבייה מחלל הבטן.
- הסר את החלק הקדמי של cephalothorax (איור 6 ג). השתמש בחתכים לרוחב כדי להסיר את החלקים לרוחב של השריון, שמכסים את הזימים, משני צידי בית החזה שנותר (איור 6 ד-4). הסר את הזימים ולשטוף את הדגימה עם מי מלח קר.
- המשך לנתיחה עם חתך דרך לכל אורך צלחת sternal כפי שצוין באיור 6 ה-5. לעשות חתך זה בעמדות רוחב מקסימליים בין pleuron וswimmerets (סימונים אדומים איור 6-ה). המשך בצד עם אותו חתך האחר. יש לשטוף את הדגימה עם מי מלח קר.
- לבצע את הנתיחה שנותרה תחת dissectioמיקרוסקופ n. הנח בצד הגחון הבטן של הסרטנים בצלחת לנתיחה מרופדת בsylgard השחור ומלאות מלוחים סרטנים כך שהוא מכסה את הדגימה.
הערה: השלבים (2.12-4.8) הבאים כוללות הוראות כיוונית החלים על הנסיינים ימניים. בשלבים הבאים (2.12-6.8) חשוב להחליף מלוחים סרטנים במרווחים זמן קבועים, כל דקות 20-30 עם מי מלח קר, כדי לשמור על מערכת העצבים בריאים. - לתקן את הדגימה עם סיכות חרקים בדיעבד בtelson וanteriorly בשרידים של השריון. הנח את הדגימה כך שנקודות telson לשמאל ומקבילות לקצה השולחן.
- שימוש במלקחיים גסים ביד השמאל כדי לתפוס דרך פתח רגל הליכה (איור 7 א) ולמשוך את הדגימה (חץ לבן איור 7) פתוח. זהה את שני גדילי שריר מכופף גב הגדולים (איור 7-1 ו- C-1) ולחתוך גחונםבסיס כפי שמוצג באיור 7.
- זהה את עורק sternal (איור 7 ג-2), שיורד מגב (הלב) לגחון, במגזר חזה 4 th. עורק זה נמצא ממש מעל לחוט העצב (איור 7 ג-3), לפני שהוא הפרויקטים בעצב בחוט, ויצר את עורק הגחון.
- Transect עורק sternal. כפי שהודגם באיור 7C, להרים את העורק ראשון, באמצעות להב אחד המספריים, ורק לחתוך כאשר חוט העצב הממוקם ventrally גלוי.
- תקן את השרירים הכופפים גב anteriorly (לצד ימין). זה צריך להיעשות בעמדה המרבית מתוח עם סיכות כדי שלא יחסום את החזון ואת הדגימה נשארה מתוחה. כאשר גדילי השרירים גב קבועים (איור 8-1), הגרעינים הראשונים בטן, A1 ו- A2, עם העצבים הקשורים N1, N2, N3 וגלוי (איור 8).
- שימוש במלקחיים ביד השמאל כדי לתפוס את המפרטimen בפתח אחד של רגלי ההליכה. לאורך נתיחת ביצוע שלבים משכו בעדינות כדי לשמור את הדגימה פתוחה.
- Transect העצבים N3 במיקום המרוחק ביותר מחוט העצב. (איור 8-3).
- חותך את השרירים הכופפים הקרובים לapodeme הגחון כפי שמוצג באיור 8-4. הקפד שלא לפגוע בחוט העצב או עצבי N2.
- חזור על השלבים 2.18 2.19 ולN3 העצבים והשרירים הכופפים של A2 גרעיני הבטן נותר לA5.
- בגנגליון הבטן שעבר, A6, לחתוך את השרירים הכופפים גב מapodeme הגחון ואת הדגימה צריכה להיראות כפי שמוצגת באיור 9.
- חותך את הצלחת האחורית sternal לעצבים של A6 (איור 9-1) ולשמור את חלק הגחון (איור 9-2). מחק את חלק הגב עם שרירים כופפים (איור 9-3). תקן את צלחת sternal anteriorly עם סיכות דרך פתחי רגלי ההליכה,ובדיעבד לA6.
3. פיין Dissection
- הנח את הדגימה תחת מיקרוסקופ עם חלק הקדמי מופנה משם, והחלק האחורי לכיוון הקצה 'השולחנות.
- שימוש במלקחיים, כפי שמוצג באיור 10 א כדי להסיר את החלקים קדמי ביותר של Sterna cephalothoracic.
הערה: גרעיני החזה ועצבים הקשורים מכוסים בחלקן על ידי שרירי הרגל וSterna cephalothoracic. Sterna cephalothoracic ליצור שלד שמפריד בין החללים ממוקמים הרוחבית של רגלי הליכה אחד מהשני והמחלל המדיאלי בי חוט עצב הגחון מתגורר. - חותך את השרירים בין המבנים שנותרו שלד החיצוניים כפי שצוין באיור 10 ב -1 וB2. שימוש במלקחיים כדי לתפוס והרם את הקצה הקדמי של חוט עצב הגחון (איור 10 ג).
הערה: חוט העצב יהיה פגום בתהליך כל כך להימנע מלהרים את nervכבל e מספר פעמים. - חותך את העצבים בבית החזה רוחבי תוך הרמת חוט העצב (10C-3 איור). לשמור על העצבים האלה באורך מתאים לתולה. הסר את החלק לחץ בשרשרת הגרעינים, שהרים עם מלקחיים, על ידי חיתוך את כל הרקמה הקדמית לT4 (איור 10C-4).
- הנח את הדגימה עם החלק הקדמי בצד השמאל ולהתמקד בA1. חותך את N1 העצבים וN2 של A1 באורך מתאים (מקסימום. 1 סנטימטר) לתולה אותם.
- דגש על A2 ולזהות את העצבים N1, N2, N3 ושל מגזר זה (איור 11). עצבי N1 של גרעיני בטן A2-A5 מתגוררים בין שתי infoldings cuticular sternal בכל מגזר (איור 11 א-1) ומכוסים על ידי שרירים. לעשות חתך אחד לאורך infolding cuticular sternal האחורי. התחל בשפה הרוחבית של הבטן ולהמשיך לכיוון קו האמצע, כפי שמוצג באיור 11 א.
- אם N1 היעד הוא עדיין מפרץאדום עם רקמה כפי שמוצג באיור 11 (חץ אדום), חצה את צרור השריר, אבל קדמי הפעם לשני infoldings cuticular sternal והעצב N1 (איור 11-2).
- חותך N1 העצב כdistally כ( 11C-3 איור) אפשרי. N1 עצב גלוי לגמרי והסניף הקדמי והאחורי ניתן לזהות (11C איור).
- המשך N1 העצב הנגדי ולחתוך ראשון שרירים לאורך infolding cuticular sternal האחורי, החל מדיאלית, ליד גנגליון (איור 11D). אם העצב עדיין מכוסה על ידי רקמה, חצה את צרור השריר, אבל קדמי הפעם לשני infoldings cuticular sternal והעצב N1, דומה לאיור 11B-2. חותך את N1 העצב כdistally ככל האפשר.
- חותך את N2 העצבים של גנגליון זה לאורך מתאים (כ. 0.5 סנטימטרים) לתולה.
- חזור על שלבים 3.7-3.11 לעצבים של A3-A5.
- חותך את נרVes של גנגליון A6 כdistally ככל האפשר (איור 12 א). שימוש במלקחיים כדי לתפוס עצבים מרובים של A6 להרים גנגליון זה ולהתחיל לבודד את השרשרת של הגרעינים מצלחת sternal.
- בעודך מרים את חוט העצב, למשוך אותו בעדינות בכיוון הקדמי, כפי שהודגמה באיור 12 ב (חץ לבן). כגרעינים הבודדים הרימו, להסיר את עורק הגחון שעשוי להיות מצורף לצד הגחון של חוט העצב (12C איור). להמשיך את הרצף הזה לחתוך למשוך (בעדינות) עד חוט העצב הוא מבודד לחלוטין.
- העבר את השרשרת בודדת של הגרעינים לצלחת פטרי מרופד בsylgard ברור ומלאות מלוחים סרטנים (איור 12D).
4. הצמדת חוט העצב לתוך צלחת פטרי
הערה: השתמש בסיכות קטנות לחתוך מחוט נירוסטה (ראה תוספים) להצמיד חוט העצב. לגעת רק העצב מסתיים עם המלקחיים ולא squeezדואר connectives או הגרעינים.
- הצמד את השרשרת של הגרעינים בקו ישר, תוך יישום מתיחה עדינה.
- מסדרים את חוט העצב בצלחת פטרי עם צד הגב כלפי מעלה (איור 13, קו שחור). הצד הגחוני של הגרעינים יכול להיות מזוהה על ידי הקמירות שלה; צד הגב שטוח. הצמד את עצבי חזה לצדדים. המשך עם העצבים של A6, מתיחת חוט העצב לאורך ציר האורך שלו.
- הצמד את העצבים של A1 בזווית 90 מעלות ביחס לחוט העצב.
- המשך ל- A2 ולהצמיד את N2 העצבים בזווית של ° 35-45 ביחס לחוט העצב (איור 1 א).
- הפרד את העצבים N1 בענפים הקדמי וגם האחוריים שלהם לפני שתולה כפי שהודגם באיור 14. השתמש בשני זוגות מלקחיים בסדר להרים עם זוג מלקחיים אחד הקדמי ועם האחר הסניף האחורי של N1 העצב. תשמור על עצמך כדי לאסוף רק את הקצה הדיסטלי ביותרים של ענפי העצב. עכשיו למשוך אותם לגזרים בזהירות.
- הצמד את הסניף הקדמי של N1 העצב בזווית 90 מעלות ביחס לחוט העצב (איור 1 א). הצמד את הסניף האחורי של העצב N1 בין סניף N1 הקדמי והעצב N2.
- חזור על צעדי 4.4-4.6 לעצבים של גרעיני A3-A5. בעוד להתקבע חוט העצב למתוח אותו באורך כמו גם כיוונים רוחביים.
5. Desheathing הגרעינים
- מניחים את ההכנה בצורה כזאת שידיו של הנסיין תמיד נחים על מטוס יציב כדי למנוע רועד. כדי desheath הגרעינים להאיר את חוט העצב מלמטה.
- להתמקד בכל A1 הגנגליון בטן לA5. השתמש במספרי אביב בסדר לעשות חתך רוחב קטן דרך נדן גנגליון, אחורי לגנגליון ובין העצבים N2 וN3 (חץ אדום איור 15 א).
- להרים את נדן גנגליון באמצעות מאוד fמלקחיים וine לחתוך רוחבי על פני הנדן מעל connectives, כפי שמצוינים באיור 15 א-1. יש להיזהר שלא לסחוט או לחתוך את חוט העצב עם המספריים.
- עדיין מחזיק ומרים את נדן גנגליון עם המלקחיים ימשיכו לחתוך אותו לאורך הגבולות לרוחב של גנגליון (איור 15 ב-2 ו -3). הסר את הנדן. לחלופין להצמיד אותו לשני הצדדים של connectives באופן כזה שהוא קבוע אבל חוט העצב לא לחץ.
- חזור על שלבים 5.2-5.4 לכל A1 גרעיני הבטן לA5.
- Desheathe הגרעינים ובית החזה גנגליון A6 באופן דומה. כדי desheathe קדמי התחלת A6 לגנגליון ולהמשיך בכיוון אחורי. הצמד את נדן הגנגליון של A6 עד הסוף האחורי של השרשרת של הגרעינים.
6. תאי הקלטות ממנוע נוירונים
- להרכיב את כל הכלים וחומרים המשמשים להקלטות תאיים מוצגות in ומופיע איור 16B בתוספים. סקירה של הגדרת ההקלטה מוצגת באיור 16 א. התחל כל הציוד האלקטרוני המשמש בניסוי (איור 16C) זה, כך שהמגברים יכולים להתחמם לפחות 30 דקות לפני ההקלטה. הפעל את המחשב ולהפעיל את תוכנת ההקלטה.
- מניחים את השרשרת של הגרעינים על שולחן מיקרוסקופ ולהאיר מלמטה. הכנס את האלקטרודה ההקלטה לתוך sylgard הקרוב לעצב היעד ואת האלקטרודה ההתייחסות בעמדה סמוכה, אבל לרוחב לגרעינים (איור 17 א 'וב'). לכופף את עצב היעד סביב האלקטרודה הקלטה (17C איור).
- למתוח את העצבים מעט, כדי להבטיח מגע בין האלקטרודה והעצב ולהצמיד אותו לצד (igure F 17D). לתקן את כבלי אלקטרודה לשולחן מיקרוסקופ באמצעות פלסטלינה, כך שהם יישארו במיקום הרצוי.
- השתמש בהמזרק מלא בוזלין ומחט 20 מד (עם קצה מעוגל) (איור 17e-3) כדי לבודד את עצב היעד מפתרון הים. ראשון להספיג כמה וזלין על sylgard סביב האלקטרודה ההקלטה. התוצאה היא שכבה של וזלין מכסה את sylgard בקרבת האלקטרודה ההקלטה (איור 17e-4). שים לב שלא מורחים ישירות על העצב ולמנוע בועות אוויר בשכבה זו.
- לאטום את האלקטרודה ההקלטה עם וזלין מכל הצדדים עד לרמה של מי מלח (איור 17 ו) המשטח.
- חזור על תהליך זה עבור כל עצבי היעד שפעילותם צריך להיות במעקב.
- להתחיל בהקלטה. השתמש במצב מתמשך או פער חופשי רכישה וקצב דגימה של 5 kHz. הגדר את המגבר תאי לפרמטרים הבאים; להשיג עד 1,000 (מגביר את האות 1,000 פעמים, דואג לכלול פרמטר הגברה זה בהגדרות תוכנת רכישה)מגוון מסנן bandpass da של 300 הרץ (חתך נמוך) עד 2,000 הרץ (גבוה חתך).
תוצאות
עם ההקלטות תאי בו-זמנית מRS וPS, הנוירונים מוטוריים של גנגליון אחד, הפעילות לסירוגין של בריכות הנוירון מוטורי אלה, יכול להיות במעקב (איור 18), המייצגת את דפוס התנועה הפיקטיבי.
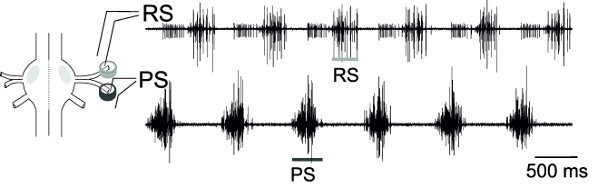
Discussion
האנטומיה של סרטנים וגרעיני הבטן שלהם כבר תיארו בעבר 5, 18, 19, 20, ומומלץ להכיר אותם לפני הנתיחה על מנת להימנע מחיתוך של עצבים חשובים.
זה קריטי כדי לשמור על ההכנה בטמפרטורות מתחת 23 ° C כדי למנוע השפלה של חוט העצב הבודד. זו יכ?...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
אנו מודים Jos Burgert על עזרה עם כמה מהדמויות. אנו מודים לאינגו Selbach (והקבוצה "Edelkrebsprojekt NRW") על מאמציו לספק את המעבדה עם חיות ניסוי. אנו מודים לאנה ג שניידר להגהת גרסאות הראשונות של כתב היד. מחקר זה נתמך על ידי SM אמי Noether DFG מענק 206 / 3-1 ומענק הפעלה של אוניברסיטת קלן לסגל נשי.
Materials
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
References
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45 (2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. . The crayfish: An introduction to the study of zoology. , (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M., Strausfeld, N. J., Miller, T. A. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. , 373-402 (1980).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved