Method Article
אוטומציה של ניסויי שבב seq כדי ליצור פרופילים אפיגנטיים על 10,000 תאים הלה
In This Article
Summary
Methods for mapping in vivo protein-DNA interactions are becoming crucial for every aspect of genomic research but they are laborious, costly, and time consuming. Here a commercially available robotic liquid handling system that automates chromatin immunoprecipitation for mapping in vivo protein-DNA interactions with limited amounts of cells is presented.
Abstract
Chromatin immunoprecipitation followed by next generation sequencing (ChIP-seq) is a technique of choice for studying protein-DNA interactions. ChIP-seq has been used for mapping protein-DNA interactions and allocating histones modifications. The procedure is tedious and time consuming, and one of the major limitations is the requirement for high amounts of starting material, usually millions of cells. Automation of chromatin immunoprecipitation assays is possible when the procedure is based on the use of magnetic beads. Successful automated protocols of chromatin immunoprecipitation and library preparation have been specifically designed on a commercially available robotic liquid handling system dedicated mainly to automate epigenetic assays. First, validation of automated ChIP-seq assays using antibodies directed against various histone modifications was shown, followed by optimization of the automated protocols to perform chromatin immunoprecipitation and library preparation starting with low cell numbers. The goal of these experiments is to provide a valuable tool for future epigenetic analysis of specific cell types, sub-populations, and biopsy samples.
Introduction
ככל שטכנולוגיות של הדור הבא הרצף (NGS) הפכו נפוצות ונגישה יותר, השיטה העיקרית למיפוי הגנום של אינטראקציות החלבון-DNA כעת הכרומטין immunoprecipitation אחרי גילוי NGS (שבב seq), המאפשר הגילוי של גורם שעתוק אתרי קישור או דפוסים של שינויי היסטון. שבב seq יש יתרון במתן נתונים תפוקה גבוהה של הגנום כולו שיכול לשמש לניתוח כמותי ואיכותי של אינטראקציות החלבון-DNA על ידי המדידה של שברי DNA המועשר. עם זאת, יש כמה חסרונות בניסויי שבב seq סטנדרטיים כגון הקושי בהשגת מספיק חומר כדי ליצור ספריית רצף.
ניסויי שבב מחולקים לשישה שלבים בסיסיים כוללים אזורים מחייבים 1) החלבון-DNA crosslinking 2 הכנת מדגם) הכוללת תמוגה תא וגז הכרומטין ידי sonication, 3) היווצרות immunocomplexes,4) משקעים של immunocomplexes, 5) שטיפת immunocomplexes, ו -6) elution של חומר המועשר וניתוח על ידי qPCR וNGS.
ההצלחה של assay שבב תלויה בשלושה גורמים עיקריים: הכנה טובה הכרומטין, כמות האנטיגן במדגם המקורי, ואת הספציפיות וזיקה של הנוגדן לאנטיגן המקור שלה. מגבלה העיקרית היא הדרישה לכמויות גבוהות של החל מספרים סלולריים על מנת לקבל DNA מספיק מועשר כדי ליצור ספריית רצף. למדענים שעובדים עם כמויות מדגם מוגבלות, כגון דגימות ביופסיה או תת-אוכלוסיות תאים, ניסויי שבב seq מאוד מאתגרים. מחקרים שנעשה לאחרונה הראו כי ניתן לבצע מבחני שבב seq כאשר עובדים עם כמות נמוכה של תאי 1, 2. Diagenode פיתח מערכת טיפול נוזל רובוטית שיכולה להפוך באופן מלא ניסויי שבב seq כאשר מתחילים עם מספר מצומצם של תאים.
אוטומציה מספקתיתרונות רבים על פני הכנה ידנית של דגימות שבב seq כפי שמפחית טעויות אנוש, מפחיתים שונות, ומצמצם את עלות ניסוי. פרוטוקולים חצי אוטומטי לimmunoprecipitation הכרומטין והכנת ספרייה כבר דיווחו אבל אף אחד ממחקרים אלה הראה נתונים בעת שימוש במספרים נמוכים תא 3, 4, 5, 6.
במאמר זה זרימת עבודה אוטומטית מלאה מתוארת בשני מבחני immunoprecipitation והכנת ספריית הכרומטין במערכת טיפול נוזל רובוטית שמשתמשת בטכנולוגיה מבוססת חרוז מגנטי ושיכולים לתת מענה למספר רב של פרמטרים באופטימיזציה הפרוטוקול. כאן, ניסויי שבב seq אוטומטיים בוצעו בהצלחה במספר מצומצם של תאים במטרה לפשט, תקנון, ומתן פתרון אמין ללמוד פרופילים אפיגנטיים באוכלוסיות תאים קטנות. פרוטוקול השבב האוטומטי המתואר במאמר זה כבר מותאם בתאי הלה באמצעות נוגדני היסטון ספציפיים וחומרים כימיים בut זרימת העבודה יכולה להיות מותאם לקווים אחרים תא ונוגדנים עם מקביל ניסיונית אופטימיזציה.
Protocol
1. ניסויי תקן שבב
- אוסף תא וcrosslinking DNA חלבון.
- לגדל תאי הלה-S3 למפגש של 80% -90%. הסר בינוני תרבות, לשטוף את הצלחת פעמיים עם 10 מיליליטר של תמיסת מלח פוספט 1x שנאגרו (PBS), ולהוסיף טריפסין-EDTA (1x) לצלחת בתרבית. דגירה לתקופה מקסימלית של 2 דקות כדי לנתק את התאים מהצלחת. איסוף תאים ולשטוף פעמיים עם 10 מיליליטר PBS.
הערה: זמני דגירה ארוכה יותר יביאו לנזק לתאים. - צנטריפוגה התאים למשך 5 דקות ב XG 500 וresuspend התאים 20 מיליליטר של PBS. להמשיך לספור את התאים.
- צנטריפוגה התאים למשך 5 דקות ב 500 XG, לבטל את supernatant ולהוסיף 500 μl של PBS. המספר האופטימלי של תאים לצעד הקיבעון הוא 10 מיליון תאים לכל 500 μl של PBS.
- להוסיף 13.5 μl של פורמלדהיד 37% הטריים לכל aliquot של 500 μl של השעיה תא. לקבע את התאים במשך 8 דקות ב RT.
- להוסיף 57 μl של solut 1.25 מ 'גליציןהיון לעצור את הקיבעון. דגירה במשך 5 דקות בRT עם ערבוב מתמיד על ידי מערבולת עדינה. עבודה על קרח מכאן ואילך.
- צנטריפוגה התאים ב XG 500 במשך 5 דקות על 4 מעלות צלזיוס וזורקים supernatant מבלי להפריע תא גלולה.
- שוטף את התאים פעמיים עם 1 מיליליטר PBS. מחק בעדינות supernatant ולשמור על התא גלולה על קרח.
- לגדל תאי הלה-S3 למפגש של 80% -90%. הסר בינוני תרבות, לשטוף את הצלחת פעמיים עם 10 מיליליטר של תמיסת מלח פוספט 1x שנאגרו (PBS), ולהוסיף טריפסין-EDTA (1x) לצלחת בתרבית. דגירה לתקופה מקסימלית של 2 דקות כדי לנתק את התאים מהצלחת. איסוף תאים ולשטוף פעמיים עם 10 מיליליטר PBS.
- תמוגה תא וגז הכרומטין
- הוסף 10 מיליליטר של iL1 מאגר תמוגה הקרה כקרח לתא גלולה (1 מיליליטר של חיץ תמוגה לכל 1 מיליון תאים הוא היחס האופטימלי). פיפטה מעלה ומטה מספר פעמים ודגירה של 10 דקות ב 4 ° C עם ערבוב עדין.
- צנטריפוגה lysate למשך 5 דקות ב XG 500 ו- 4 מעלות צלזיוס. בטל supernatant.
- הוסף 10 מיליליטר של חיץ תמוגה הקרה כקרח IL2 לlysates ומערבבים בעדינות על ידי pipetting מעלה ומטה. דגירה lysates במשך 10 דקות ב 4 ° C.
- צנטריפוגה במשך 5 דקות ב XG 500 ו- 4 מעלות צלזיוס וזורקים supernatant.
- Prepaמחדש את מאגר גז מלא הוספת קוקטייל 200x מעכבי פרוטאז (PIC) למאגר גז iS1. שמור את החיץ על קרח למשך 5 דקות ולעבוד על קרח לאחר מכן. הוסף 1 מיליליטר של מאגר גז iS1 המלא לכל 10 מיליון תאי גלולה ולערבב בעדינות על ידי pipetting מעלה ומטה. לפני sonication דגירה על דגימות קרח למשך 10 דקות כדי להפחית את הצמיגות של המדגם.
- גזירה 300 aliquots μl של הכרומטין ידי sonication באמצעות sonicator אמבט מים במשך 2-3 סטים של 10 מחזורים כל אחד. מחזור מורכב של 30 "ON" שניות ו -30 "OFF" שניות בהגדרת הספק גבוהה. לחלופין, להשתמש במכשיר הפיק-sonication עם זמן sonication קצר של 5 עד 10 מחזורים של "ON" 30 שניות, "OFF" 30 שניות. בקצרה מערבולת ולסובב את הצינורות בין הריצות. בעת שימוש בסוגים אחרים של sonicators, בצע את הוראות יצרן מתאים לגז הכרומטין.
- צנטריפוגה הכרומטין טעון ב16,000 XG במשך 10 דקות וגollect supernatant לשמש מייד בצעד IP. לחלופין, לאחסן הכרומטין ב -80 ° C עד 2 חודשים לשימוש עתידי.
- לנתח את יעילות גז הכרומטין לפני צעד immunoprecipitation באמצעות ג'ל agarose TAE 1-1.5% או bionalyzer. גדלי בר הכרומטין אופטימליים נעים בין 100-600 נ"ב.
2. ניסויי שבב Cell נמוכים
- אוסף תא וcrosslinking DNA החלבון
- לגדל תאי הלה-S3 למפגש של 80% -90%. הסר בינוני תרבות, לשטוף את הצלחת פעמיים עם 10 מיליליטר של תמיסת מלח פוספט 1x שנאגרו (PBS), ולהוסיף 1x טריפסין-EDTA לצלחת בתרבית. דגירה לתקופה מקסימלית של 2 דקות כדי לנתק את התאים מהצלחת.
הערה: זמני דגירה ארוכה יותר יביאו לנזק לתאים. - איסוף תאים על ידי הוספת מדיום תרבות מיליליטר 1 סרום המכיל לתוך צינור צנטריפוגה 1 מיליליטר. ספירת התאים.
- צנטריפוגה התאים למשך 5 דקות ב 500 x g. להביא את המספר הסלולרי10,000 תאים לכל מיליליטר של מדיום התרבות לקיבעון.
- להוסיף 27 μl של 36.5% פורמלדהיד מוכן הטרי לתוך צינור אחד לקיבעון. להפוך את הצינור שתיים או שלוש פעמים והדגירה 10 דקות ב RT.
- להוסיף 115 μl של 1.25 M פתרון גליצין לדוגמא, להפוך את הצינור שתיים או שלוש פעמים ודגירה 5 דקות ב RT. עבודה על קרח מכאן ואילך.
- צנטריפוגה התאים XG ב 300 במשך 10 דקות ב 4 מעלות צלזיוס. בטל supernatant לאט.
- לשטוף את התאים עם 1 HBSS הקר מיליליטר הקרח עם PIC (200x, ריכוז סופי 1x). להפוך את הצינור שתיים או שלוש פעמים כדי resuspend התאים ו צנטריפוגות ב XG 300 במשך 10 דקות ב 4 ° C. מחק בעדינות supernatant ולשמור על התא גלולה על קרח.
- לגדל תאי הלה-S3 למפגש של 80% -90%. הסר בינוני תרבות, לשטוף את הצלחת פעמיים עם 10 מיליליטר של תמיסת מלח פוספט 1x שנאגרו (PBS), ולהוסיף 1x טריפסין-EDTA לצלחת בתרבית. דגירה לתקופה מקסימלית של 2 דקות כדי לנתק את התאים מהצלחת.
- תמוגה תא וגז הכרומטין
- הוסף 25 μl של תמוגה השלמה הצפת TL1 (תמוגה מאגר TL1 + PIC) ל -10,000 תאים ולהתסיס ידני התחתון של הצינור לresuspend התאים. דגירה על קרח למשך 5 דקות.
- הוסף 75 μl של HBSS המלא (HBSS + PIC) חיץ לכל aliquot המכיל 10,000 תאים.
- גזירה 100 aliquots μl של 10,000 תאים על ידי sonication ל5 סטים של 5 מחזור כל אחד. מחזור מורכב של 30 "ON" שניות ו -30 "OFF" שניות בהגדרת ההספק הגבוהה. לחלופין, להשתמש במכשיר הפיק-sonication שימוש עם זמן sonication קצר של 5 מחזורים של "ON" 30 שניות, "OFF" 30 שניות. גדלי בר הכרומטין אופטימליים נעים בין 100-600 נ"ב. שים לב כי הכנות הכרומטין, סוגי התאים וsonicators שונה דורשים ניסויים נפרדים גז אופטימיזציה.
- צנטריפוגה הכרומטין טעון 14,000 XG במשך 10 דקות כדי להשליך את החומר מסיס ולאסוף את supernatant לשמש מייד בצעד IP. לחלופין, לאחסן הכרומטין ב -80 ° C עד 2 חודשים לשימוש עתידי.
- לנתח את יעילות גז הכרומטין לפני צעד immunoprecipitation באמצעות ג'ל agarose 1-1.5% טה אוbionalyzer. דגימות פינוק עם RNase לפני agarose ניתוח ג'ל על מנת לשפר את ההערכה החזותית של גז. גדלי בר הכרומטין אופטימליים נעים בין 100-600 נ"ב.
3. הכרומטין immunoprecipitation וספריית Prep
- בניסויים שבב סטנדרטיים אוטומטי
- להוסיף 120 μl של שבב המאגר H (שבב מאגר H + PIC) 100 μl טעון הכרומטין. השתמש 200 μl לIP ולשמור 2 μl 20 μl כמדגם קלט.
- בחר את פרוטוקול μl שבב 200 האוטומטי במכשיר האוטומציה. התפוקה של הפרוטוקול היא 1 עד 16 דגימות לריצה.
- כיתה להפעיל ניסוי שבב אוטומטי באמצעות, הכרומטין מתאים 1-2 מיליון תאים, 1-2 מיקרוגרם של אנטי-H3K79me3, -H3K27me3, -H3K4me3, -H3K4me2, -H3K9ac, -H3K9 / 14ac, -H3K36me3 וH3K9me3 שבב seq נוגדני polyclonal ארנב. כמויות נוגדנים אופטימליות משתנות בהתאם לשינוי היסטון והזיקה והמפרטificity של הנוגדן המקביל.
- השתמש בכמויות שווה של IgG ארנב הלא חיסוני כנוגדן שליטת אלוטיפ. לחלופין, להשתמש בחרוזים ללא ציפוי או נוגדן ספציפי נחסם כפקדי שבב. הוסף 20 μl של חלבון-חרוזים מגנטיים מצופים עבור כל תגובה.
- השתמש בחומרים כימי ערכת שבב seq היסטון האוטומטי לבצע ניסויי שבב אוטומטיים עם אנטי H3K79me3 ונוגדני polyclonal -H3K4me2. השתמש בחומרים כימי ערכת שבב seq האידיאלי לבצע ניסויי שבב עם אנטי H3K27me3, -H3K4me3, -H3K9ac, -H3K9 / 14ac, -H3K36me3 ו-H3K9me3.
- בחר את פרוטוקול השבב האוטומטי בהתאם להוראות התוכנה מיושמות במכשיר האוטומציה. הגדר את הפרמטרים של ניסוי השבב עד 4 שעות לצעד ציפוי נוגדן ו -15 שעות לצעד immunoprecipitation. צעד crosslinking ההפוך מתרחש במכשיר האוטומטי על 65 מעלות צלזיוס למשך 4 שעות.
- לטהר את ה- DNA הצולב ההפוך במערכת האוטומטית. AUT בחרפרוטוקולי omated לטיהור DNA עם פרוטוקול או ערכה באמצעות טיהור חרוז מגנטית מבוססת DNA. Elute DNA ב -25 μl מים.
- לכמת DNA immunoprecipitated על ידי מיצוי של 10% של ה- DNA immunoprecipitated. תשואת DNA immunoprecipitated תלויה באיכות של הכרומטין ונוגדנים, סוג תא ושינוי היסטון היעד. לכמת את ה- DNA באמצעות ערכת assay לפי הוראות יצרן.
- לנתח את האיכות של ה- DNA immunoprecipitated על ידי PCR כמותי באמצעות פריימרים לאזורים הגנומי שליטה שלילית לפחות חיובי 1 ו -1. אין להשתמש יותר מ -10% מכלל DNA immunoprecipitated להערכת מוספים לשבב.
- הכן את תגובות qPCR. הוסף 10 μl של תערובת אמן 2x SyberGreen qPCR, 1 μl של תערובת פריימר, 1-5 μl של DNA immunoprecipitated או קלט ומים עד סטרילי עד 20 μl סופי נפח תגובה. התכנית כוללת qPCR צעד denaturation ראשוני על 95 מעלות צלזיוסלמשך 5-10 דקות בהתאם לספק של פולימראז תקי וצריכה להיות מוגדרות טמפרטורות חישול פי פריימרים שנבחרו.
- פרוטוקולי הכנת ספריית שימוש אוטומטי בקנה אחד עם ריאגנטים הכנת ספריית Illumina שבב seq הזמינים המסחרית כדי לבנות הספריות בשתי DNA השבב, כמו גם את ה- DNA הקלט ניצל מאותה ההכנה הכרומטין. השתמש 10-20 ng של DNA immunoprecipitated מכל נוגדן להכנת ספרייה. הכן עד 16 ספריות אוטומטיות לריצה.
- רצף הספריות וליצור אשכולות על פי הוראות יצרן Illumina. ביצוע הניתוח עיקרי ביואינפורמטיקה (סינון אשכול, ייעוד בסיס, וכו ') בעקבות הצינור, מסנן Illumina הסטנדרטי וליישר את קורא להרכבת הגנום האנושית האחרונה (גרסה הנוכחית היא GRCh38) עם aligner Eland. השתמש 7 SICER או MACS 8 עבור שיחות שיא ולבצע ניתוחים במורד הזרם של פסגות wה- i הומר 9, BEDTools 10 או תוכנה מועדפת.
- בניסויים שבב מספר אוטומטי תא נמוך
- להוסיף 120 μl של חיץ שבב מלא tC1 (שבב מאגר tC1 + PIC) 100 μl טעון הכרומטין. השתמש 200 μl לIP ולשמור 20 μl כקלט.
- בחר פרוטוקול μl שבב 200 אוטומטי במערכת האוטומציה. התפוקה של הפרוטוקול היא 1 עד 16 דגימות לריצה.
- הפעל ניסוי שבב seq אוטומטי באמצעות ריאגנטים אוטומטיים שבב ונוגדני כיתה שבב מותאמים לעבודה בכמויות הכרומטין נמוכות. השתמש הכרומטין מקביל ל -10,000 תאים ו100,000 תאים, 0.5 מיקרוגרם של אנטי-H3K27me3, 0.25 מיקרוגרם -H3K4me3, 0.1 מיקרוגרם -H3K27ac, 0.25 מיקרוגרם -H3K9me3 נוגדני שבב seq Premium ארנב הארנב polyclonal כיתה. כמויות נוגדנים אופטימליות משתנות בהתאם לשינוי היסטון והזיקה והספציפיות של הנוגדן המקביל.
- השתמש בכמות שווה של ראב שאינו חיסוניIgG קצת כמו נוגדן שליטת אלוטיפ. לחלופין, להשתמש בחרוזים ללא ציפוי או נוגדן ספציפי נחסם כפקדי שבב. הוסף 10 μl של חלבון-חרוזים מגנטיים מצופים עבור כל תגובה.
- בחר את פרוטוקול השבב האוטומטי בהתאם להוראות התוכנה מיושמות במכשיר האוטומציה. הגדר את הפרמטרים של ניסוי השבב עד 4 שעות לצעד ציפוי נוגדן ו -15 שעות לצעד immunoprecipitation. צעד crosslinking ההפוך מתרחש במכשיר האוטומטי על 65 מעלות צלזיוס למשך 4 שעות.
- לטהר DNA הצולב ההפוך באמצעות עמודות ספין הבאים הוראות היצרן וelute בכמויות מ -6 μl 25 μl מים.
- לכמת את ה- DNA באמצעות ערכת assay מסחרית. לנתח את התוצאות על ידי qPCR באמצעות פריימרים לאזורי שליטה חיוביים ושליליים כדי להעריך את איכות השבב.
- השתמש בערכת הכנת ספרייה עם ריאגנטים הכנת ספרייה מותאמת להכין ספריות עם קוואן DNA הנמוךtities. השתמש 30 pg ו -300 pg של השבב ה- DNA (המקביל ל 10,000 ו100,000 ניסויי תאי בהתאמה) להכנת ספרייה. הכן ספריות באמצעות הפרוטוקול האוטומטי בקנה אחד עם ריאגנטים הכנת ספרייה. תפוקת הכנת הספרייה האוטומטית היא 1 עד 48 ספריות לריצה.
- בעקבות תיקון סופו של תבניות פעמיים תקועים DNA, ולקשור מתאמי גזע הלולאה cleavable המכילים אתרי פריימר רצף. בעקבות צעד הארכת DNA, להגביר את המדגם עם שיטת ההגברה איכות הגבוהה שתוארה בפרוטוקול ערכת הכנת הספרייה.
- לאחר הגברה ספרייה, לכמת ולטהר את הספריות הבאות הנחיות ערכת הכנת הספרייה. שים לב שבחירת הגודל לאחר הטיהור אינה הכרחית.
- רצף הספריות וליצור אשכולות על פי הוראות היצרן. ביצוע ניתוח עיקרי ביואינפורמטיקה (סינון אשכול, ייעוד בסיס, וכו ') בעקבות העמדהצינור ארד יצרן, לסנן, וליישר את קורא להרכבת הגנום האנושית האחרונה (גרסה הנוכחית היא GRCh38) עם aligner Eland 7. השתמש SICER 8 או 9 MACS עבור שיחות שיא ולבצע ניתוחים במורד הזרם של פסגות עם הומר, BEDTools 10, או כל תוכנה מועדפת.

איור 1. צילומי מסך של התוכנה המראה כיצד להגדיר ניסויי שבב אוטומטיים בקומפקט IP-הכוכבים. התוכנה מספקת את הגמישות לבחור את כמות הדגימות לריצה, כמו גם לשנות את הפרמטרים מרכזיים ניסיוניים (נוגדן הציפוי, IP ושוטף ) בהתאם לצרכי החוקר. ההליך האוטומטי מאפשר בדיקת תנאים שונים במקביל (כלומר, סוגים שונים וכמויות של נוגדנים, סוגים שונים וכמויות של תאים ולא שונים גםypes וכמויות של חרוזים מגנטיים באותו הטווח. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. צילומי מסך של התוכנה מראה כיצד להגדיר את הכנת ספרייה אוטומטית עבור סידור הדור הבא באמצעות ערכת הספרייה במערכת האוטומציה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
תוצאות
אופטימיזציה של ניסויי שבב seq אוטומטיים לשמונה סמני היסטון שונים
על מנת לפתח בהצלחה ולאמת את הפרוטוקולים האוטומטיים שבב, נוגדני כיתה שבב seq שאומתו בעבר בניסויי שבב Seq ידניים (מידע לא מוצג) נבחרו. נוגדני הכיתה שבב seq הבאים נבחרו למחקר זה: אנטי-H3K79me3, -H3K27me3, -H3K4me3, -H3K4me2, -H3K9ac, -H3K9 / 14ac, -H3K36me3 ו-H3K9me3. הסגוליות של כל נוגדני הכיתה שבב seq אושר בעבר על ידי כתם נקודה, מערכי פפטיד וניסויים המערביים כתם (מידע לא מוצג). ניסויי פיילוט שבב qPCR עם כמויות נוגדני הגדלת בוצעו כדי לקבוע את הרגישות של הנוגדנים (איור 3). qPCR עם לפחות שתי חיוביים ושני יעדי בקרה שליליים נותחו ופרופילים עם מוספים של חיובי על היעד שלילי גבוהים מפי חמישה מוסמכים לexper רצף iments. חשוב לבצע ניסויי שבב והשבב seq עם איכות גבוהה של הכרומטין טעון. כל ניסויי השבב מוצגים בפרסום זה בוצעו באמצעות הכרומטין הטרי. אפשר גם להקפיא את התאים הקבועים ב -80 ° C ולהמשיך בהכנת הכרומטין וגז ביום אחר. עם זאת, הכרומטין הוכן מהתאים קבועים קפוא עשויים להתנהג באופן שונה מהכרומטין מוכן טרי ולכן תנאי sonication ייתכן שיצטרכו להיות מותאמים עבור כל הכנת הכרומטין. כאשר עובדים עם סוגי תאים שונים, ניתן להשתמש במאגרי גז בהרכבים שונים של חומרי ניקוי (SDS). סוגי תאים כגון קווים עיקריים תא או תא גדלו בהשעיה הם תאים קשים לגזירה וידרשו מריכוזים גבוהים SDS (1%) ואילו שורות תאים כי הם קלים לגזירה כגון הלה ידרוש ריכוזים נמוכים SDS (0.1%) ב מאגרי גז.
res.jpg "/>
איור 3. אישור של נוגדני כיתה שבב באמצעות מערכת האוטומציה. השבב בוצע עם אנטי-H3K79me3, -H3K27me3, -H3K4me3, -H3K4me2, -H3K9ac, H3K9 / 14ac, נוגדני polyclonal ארנב -H3K36me3 ו-H3K9me3 על הכרומטין טעון מ 1 מיליון תאי הלה-S3 בהתאם לשינויי היסטון. פרוטוקולי שבב אוטומטיים עם כרכים עובדים 200 μl שמשו במכשיר האוטומציה לניסויי טיטרציה הנוגדן. כמויות נוגדנים של 1, 2, 5 ו -10 מיקרוגרם נבדקו לכל ניסוי שבב ו -2 מיקרוגרם IgG שימש כביקורת שלילית בכל ניסוי. מוספים להוערכו על ידי qPCR. תוצאות מוצגות כ% מקלט (הכמות היחסית של DNA immunoprecipitated לעומת הקלט DNA לאחר ניתוח qPCR). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
לאחר אימות וקביעת אופטימה כמויות l נוגדני כיתה שבב לשימוש במערכת האוטומציה, ניסויי שבב seq אוטומטיים בוצעו על מנת ליצור פרופילי רצף עבור כל שינוי היסטון (איור 4).

פרופילי שבב seq 4. היסטון איור נוצרו על ידי ניסויי שבב seq אוטומטיים. איור מציג את פרופילי שבב seq באזורים הגנומי שונים עבור H3K4me3, H3K9ac וH3K9 / 14acH3K4me2 H3K79me3, וH3K36me3. 4A מציג את התפלגות השיא לאורך X המלא -chromosome ו4B ההפצה באזור 75 kb המקיף את גן GAPDH. 4C מראה את הפרופילים של H3K27me3, H3K36me3 וH3K4me3 באזור 500 kb המקיף את גן MYT1 ו4D מציג את התפלגות H3K9me3 בZNF12 סביב 200 kb אזור."Target =" large.jpg _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
פרופילים אפיגנטיים היסטון לשישה שינויי היסטון שונים הקשורים לביטוי גנים נוצרו (H3K4me3, H3K9ac, H3K9 / 14ac, H3K4me2, H3K79me3 וH3K36me3). איור 4 א מציג פרופילי שבב seq לאורך X כרומוזום לסמני היסטון השונים. מתאם השיא מאוד נצפה בין 6 פרופילי היסטון השונים מציין את היכולות של מערכת אוטומטית להפיק נתונים מדויקים ואמינים. איור 4, 4C ו4D להראות ההפצה של פסגות לשינויים היסטון שונים באזורים הגנומי ספציפיים.
ניסויי immunoprecipitation הכרומטין אוטומטיים עד 200 תאים
הסכום המינימאלי של תאים שיכולים לשמש בניסויי שבב תלוי באיכות של הכרומטין, specificity ורגישות של הנוגדן והשפע של שינוי היסטון או החלבון למד. בחירת נוגדני כיתה שבב seq טובים היא חשובה בעת עבודה עם כמויות מוגבלות של מדגם והבחירה של חומרים כימיים אופטימליים וספקים שונים משפר את היעילות של התאוששות DNA ולתרום להצלחתו של ניסוי השבב. כדי לקבוע את הסכום המינימאלי של תאים שפרוטוקול השבב האוטומטי יכול לעבד, כמויות שונות של הכרומטין, נוגדן, וחרוזים מגנטיים נבדקו במערכת האוטומטית IP-Star באמצעות ריאגנטים שבב מותאמים במיוחד לעבודה עם כמויות נמוכות של הכרומטין.
ראשית, הכרומטין מ10,000 תאים היה sonicated כפי שתואר בפרוטוקול. תוצאות השבב אושרו על ידי qPCR (איור 5 א) שמראה העשרה משמעותית עם נוגדן H3K4me3 באזורי שליטה חיוביים ואות זניחה באזורי שליטה שליליים. לשם השוואה והוכחה של עקביות, additionaנתונים l הושגו עם H3K27ac, H3K9me3, ונוגדני H3K27me3, באמצעות 10,000 תאים מסופקים.
ניסויי שבב אוטומטיים בוצעו לאחר מכן כדי להדגים את היכולות של המערכת האוטומטית לעבודה עם כמויות נמוכות של תאים תוך שימוש באותו הנוגדן H3K4me3. השבב האוטומטי מבוצע היטב, הפגין על ידי סדרה של עשר תגובות IP שהיו לשחזור ולהשוות מאוד עם תוצאות מדריך לשבב (איור 5). ניסויים ידניים ואוטומטיים בוצעו ויתרונות של הפרוטוקולים האוטומטיים נראו בהפחתת ניסוי לניסוי שונות (איור 5 ג).
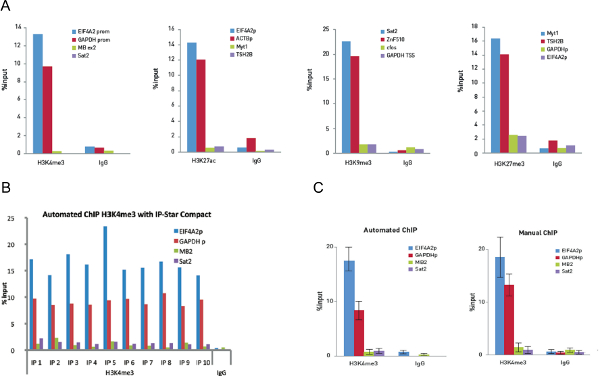
איור 5. אופטימיזציה של ניסויי שבב והשבב אוטומטי על 10,000 תאי ניסויי שבב ידניים בוצעו על 10,000 תאים ובאמצעות 0.25 מיקרוגרם של H3K4me3, 0.1 מיקרוגרם של H3K27ac, 0.5 מיקרוגרם של H3K9me3 ו -0.25 מיקרוגרם של נוגדני H3K27me3. כמויות זהות של IgG הארנב שמשו כביקורת. QPCR בוצע עם פריימרים לשני לוקוסים חיוביים ושני לוקוסים שליליים עבור כל assay שבב. איור 5 א 'מציג את ההתאוששות, מבוטאת באחוזים של קלט (הכמות היחסית של DNA immunoprecipitated לעומת הקלט DNA לאחר ניתוח qPCR). איור 5 מופעים 10 תגובות שבב לרוץ על IP-הכוכבים קומפקטיים באמצעות 0.25 מיקרוגרם נוגדן polyclonal H3K4me3 ו 0.25 מיקרוגרם של IgG ארנב נוגדני שליטה שליליים. לאחר מכן ניתוח qPCR בוצע עם פריימרים לאמרגן החיובי EIF4A2 הלוקוסים וGAPDH TSS וexon2 מיוגלובין לוקוסים השלילי וSat2. איור מציג את ההתאוששות, כאחוז מהקלט (כמות היחסית של DNA immunoprecipitated לעומת הקלט DNA לאחר ניתוח qPCR). איור 5 ג מציג נתונים H3K4me3 שבב של 10 ניסויי שבב ידניים בהשוואה ל -10 ניסויי שבב אוטומטיים. ברים שגיאה מייצגים s סטיות tandard של כל אחד מעשר חזרות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
על מנת להבין את הרגישות של פרוטוקולי שבב האוטומטיים, ניסויים בוצעו באמצעות כמות התאים שנעו בין 100,000 עד 200 תאים לכל IP. הנוגדן אנטי H3K27me3 שימש כזה הוא שינוי היסטון נפוץ מאוד. השימוש בנוגדני היסטון או אי-היסטון אחרים עשויים לדרוש יותר או פחות תאים, בהתאם לשפע של epitope והאיכות של הנוגדן. הניסויים אומתו על ידי PCR כמותי וזה היה ציין כי על ידי הפחתת כמויות של חרוזים ורקע נוגדנים בניסויים מצטמצם ומאפשרים תוצאות שבב qPCR מוצלחות עם קטן כמו 200 תאי נוגדנים (איור 6).
Iles / ftp_upload / 52,150 / 52150fig6highres.jpg "/>
איור 6. אוטומטי מבחני שבב על 200 תאים. תאי הלה-S3 ונוגדן מכוון נגד H3K27me3. הכרומטין היה טעון בין 1 מיליון תאים ודילולי סדרתי של הכרומטין זה (100,000 עד 200 שווה ערך תא) שמשו לכל תגובת שבב. 1 מיקרוגרם של H3K27me3 ו -10 μl של מצופה חרוזים מגנטיים חלבון שימש בניסוי 100,000 תאים, 0.5 מיקרוגרם של H3K27me3 ו -10 μl של חרוזים על 10,000 ו1,000 תאים, ו0.25 מיקרוגרם של H3K27me3 ו -5 μl של חרוזים עם 500 ו -200 תאים. 1 מיקרוגרם ו -0.5 מיקרוגרם של IgG של הארנב שמשו כנוגדן שליטה שלילי בעת ביצוע ניסויים עם 100,000 תאים ו1,000 תאי בהתאמה. 6A מציג את התפוסה של גני TSH2B וGAPDH ב% מעל הקלט. 6B תערוכות התפוסה היחסית של TSH2B לעומת שליטת GAPDH שלילית אזור גנומי.
ניתוח במורד הזרם של תוצאות שבב seq על10,000 תאים
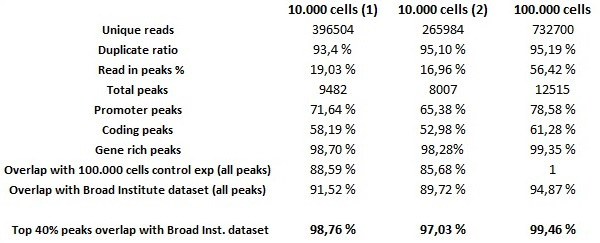
על מנת להעריך את האיכות הגלובלית של ניסויי שבב seq האוטומטי עם מספרי המוצא נמוכים של תאים, אוטומטי מבחני שבב seq בוצעו עם 0.25 מיקרוגרם של נוגדן H3K4me3 על 10,000 תאי הלה וניסויים שבב על 100,000 תאי הלה-S3 שמשו כביקורת חיובית לניסוי. הספריות האוטומטיות הוכנו באמצעות ריאגנטים ערכת הכנת ספריית MicroPlex מותאמים לספריות מוכנות עם כמויות DNA נמוכות. שימו לב שלמרות שניתן לבצע שבב ניסויים אוטומטיים מוצלחים עם פחות מ -10,000 תאים, הכמויות של DNA הוריד לא תהיינה מספיק כדי להכין את הספריות באמצעות ריאגנטים הערכה. דור ורצף אשכול בוצעו על פי הוראות היצרן. ביואינפורמטיקה ניתוחים לאחר התוצאות יוצאות דופן תכנית רצף מדגימות שבב מספר התא הנמוכה. בסיס נתוני 30 pg (המקביל ל -10,000 תאים של חומר מוצא ) מכיל רעשי רקע נמוכים ופסגות העשרה אמינות ביותר אשר אושר על ידי שניהם במערך 300 pg (המקביל ל 100,000 תאים של חומר מוצא) ובסיס נתוני H3K4me3 שנוצרו על ידי המכון ברוד לפרויקט ENCODE ששימש כהתייחסות חיצונית. חשוב לציין את נתוני Top 40 חפיפה היחס, שמתייחס לשיטה סטנדרטית המשמשת בפרויקט ENCODE 11 שבשבב seq נחשב לשחזור אם השוואה בין שני מערכי נתונים יש לפחות 80% חפיפה של 40% הטובים ביותר של הפסגות דורגו על ידי ציון משמעות. בסיס נתוני 30 pg ממלא קריטריונים אלה בהשוואה לשתי בסיס נתוני 300 pg (שוקל את כל הפסגות שלה, ולא רק 40% הטובים ביותר) והנתונים רחבים המכון (טבלת 1). בסיס הנתונים של 300 pg מראה פסגות כמעט זהות לנתונים רחבים מכון עם יחס 98% Top 40 חפיפה (איור 7).
ighres.jpg "/>
איור 7. מבחני שבב ודור ספרייה על 10,000 תאי ניסויי שבב seq נוצרו על 10,000 ו100,000 תאי הלה-S3 באמצעות נוגדן H3K4me3 (0.25 מיקרוגרם / μl). התגים נ"ב 35 מופו להגנום האנושי עם aligner Eland. בתקופת השיא שלאחר מכן קורא SICER יכול לזהות באופן אמין מוספים ממספרים סלולריים נמוכים, כמו גם ממיליוני תאים. מערכי נתונים נותחו ולעומת אחד עם השני ולנתוני ההתייחסות שנוצרו על ידי המכון ברוד. דגימות התאים נמוכות עולות בקנה אחד ויש לי גבוה מאוד דמיון. מדגם 30 pg ממלא את 11 קריטריונים (קידוד דקות. 80% של 40% העליונים של הפסגות צריכים חפיפה). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
טבלת 1.
Discussion
immunoprecipitation הכרומטין ואחריו רצף הוא כעת הליך סטנדרטי. הנה פרוטוקול שבב seq אוטומטי שיכול ליצור פרופילים אפיגנטיים הכרומטין עם כמה כמו 10,000 תאים של חומר מוצא מוצג.
אוטומציה של מבחני שבב והכנת הספרייה מאפשרת תקנון הליך שבב הייעול והפחתת שונות ניסיוני. מערכת הטיפול הנוזלית המוצגת כאן מבטלת רב של התהליכים ידניים הקשורים לשבב הפחתת הידיים בזמן לדקות רק 30, ממזערת אובדן מדגם, ומאפשרת שבב seq מדויק עם רק כמה picograms של קלט ספרייה. על מנת להשיג ניסויי שבב seq אוטומטיים מוצלחים, הוא גם חיוני לשימוש הכנות באיכות גבוהה טעון הכרומטין ונוגדני כיתה שבב seq בכל ניסוי המערכת משתמשת בטכנולוגיה מבוססת חרוז מגנטית ומציע גמישות לשנות פרמטרים ניסיוניים כגון דגירה זמן למעייל הנוגדןing וצעדי immunoprecipitation או שינוי של תנאי הכביסה מאפשרים לחוקר לנהל את כל הניסויים הנחוצים לאופטימיזציה שבב seq. המערכת האוטומטית היא פלטפורמה "פתוחה" שמאפשרת גם השוואה של חומרים כימיים מרובים במקביל לאופטימיזציה של תנאי ניסוי עבור כל קו תא בודד ונוגדנים ומאפשרת השוואה ישירה מסוגים שונים וריכוזים של הכרומטין, נוגדנים שונים וסוגים שונים של אפילו מגנטי חרוזים.
אחת המגבלות של המערכת האוטומטית הוא הצורך של הפיכה כל הפרוטוקולים בכמויות שנעות בין 5 μl 200 μl. עם זאת, המזעור של הניסויים בפלטפורמה אוטומטי זה גם מאפשר חיסכון בעלויות בחומרים כימיים.
בנוסף לפרוטוקולים שתוארו במחקר זה, המערכת ניתנת להתאמה וגם לאוטומטי מגוון רחב של יישומי חרוז מגנטי אחרים המבוססים כגון immunoprecipitationnd לכידתו של DNA מפוגל (טכנולוגיות MeDIP וMethylCap), immunoprecipitation של DNA hydroxylmethylated (hMEDIP), immunoprecipitation רציפה הכרומטין (ReChIP), immunoprecipitation RNA (RNA-IP), המרת bisulfite, ומבחני טיהור DNA.
Disclosures
The authors of this article, at the time of its writing, are employed by Diagenode S.A. and Diagenode, Inc., the manufacturer of the automated system described.
Acknowledgements
This work was supported by the BLUERPINT EU grant (BLUEPRINT – A BLUEPRINT of Haematopoietic Epigenomes). We also thank the Walloon Region (DG06) for its financial support.
Materials
| Name | Company | Catalog Number | Comments |
| PBS | Life technologies | 14190-094 | |
| Trypsin-EDTA | Sigma | T3924-100ML | |
| Formaldehyde 37% | Sigma | F8775-25 | |
| 1.25 M Glycine Solution | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Lysis Buffer iL1 | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Lysis Buffer iL2 | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Shearing Buffer iS1 | Diagenode | C01020010 | Component of the ideal ChIP-seq kit |
| Protease Inhibitors Mix (200x) | Diagenode | C01010130 | Component of the Auto True Micro ChIP kit |
| HBSS (no calcium, no magnesium, no phenol red) | Life technologies | 14175-053 | |
| Lysis Buffer tL1 | Diagenode | C01010130 | Component of the Auto True Micro ChIP kit |
| ChIP Buffer tC1 | Diagenode | C01010130 | Component of the Auto True Micro ChIP kit |
| ideal ChIP-seq kit | Diagneode | C01010051 | |
| ChIP-Buffer H | Diagenode | C01010020 | Component of the Auto Histone ChIP-seq kit |
| Auto Histone ChIP-seq kit | Diagenode | C01010020 | |
| Auto True Micro ChIP kit | Diagenode | C01010130 | |
| H3K79me3 polyclonal antibody-Classic | Diagenode | C15310068 | |
| H3K27me3 polyclonal antibody-Classic | Diagenode | C15410069 | |
| H3K4me3 polyclonal antibody-Classic | Diagenode | C15410030 | |
| H3K4me2 polyclonal antibody-Classic | Diagenode | C15410035 | |
| H3K9ac polyclonal antibody-Premium | Diagenode | C15410004 | |
| H3K9/14ac polyclonal antibody-Premium | Diagenode | C15410200 | |
| H3K36me3 polyclonal antibody-Premium | Diagenode | C15410058 | |
| H3K9me3 polyclonal antibody-Premium | Diagenode | C15410193 | |
| Rabbit IgG | Diagenode | C15410206 | |
| Protein-A coated paramagnetic beads | Diagenode | C01010020 | |
| Auto IPure | Diagenode | C03010010 | |
| MicroChIP DiaPure columns | Diagenode | C03040001 | |
| Universal SyberGreenMaster Mix 1.25 ml | Diagenode | DMMLD2D100 | |
| Quant-IT dsDNA | Invitrogen | Q32854 | |
| Illumina Sample Preparation kit fro Genomic DNA | Illumina | FC-121-3001 | |
| Illumina True-seq kit ChIP library Prep kit | Illumina | IP-202-1012 | |
| MicroPlex Library Preparation Kit | Diagenode | C05010010 | |
| Agencourt AMPure XP beads | Beckman Coulter | A63881 | |
| Illumina Library prep Quantification kit | Kapa Biosystems | KK4844 | |
| IP-Star Compact Automated System | Diagenode | B03000002 | |
| Bioruptor Plus | Diagenode | B01020001 | |
| Bioruptor Pico | Diagenode | B01060001 | |
| Qubit system | Invitrogen | Q32857 | |
| Illumina Hiseq systems | Illumina |
References
- Dahl, J. A., Collas, P. A rapid micro chromatin immunoprecipitation assay (microChIP). Nature Protocols. 3, 1032-1045 (2008).
- Adli, M., Bernstein, B. E. Whole-genome chromatin profiling from limited numbers of cells using nano-ChIP-seq. Nature Protocols. 6, 1656-1668 (2011).
- Blecher-Gonen, R., et al. High-throughput chromatin immunoprecipitation for genome-wide mapping of in vivo protein-DNA interactions and epigenomic states. Nature Protocols. 8, 539-554 (2013).
- Aldridge, S., et al. AHT-ChIP-seq: a completely automated robotic protocol for high-throughput chromatin immunoprecipitation. Genome Biology. 14, 124 (2013).
- Farias-Hesson, E., et al. Semi-automated library preparation for high-throughput DNA sequencing platforms. Journal of Biomedicin., & Biotechnology. 2010, (2010).
- Callejas, S., Alvarez, R., Benguria, A., Dopazo, A. AG-NGS: a powerful and user-friendly computing application for the semi-automated preparation of next-generation sequencing libraries using open liquid handling platforms. BioTechniques. 56, 28-35 (2014).
- Zang, C., et al. A clustering approach for identification of enriched domains from histone modification ChIP-Seq data. Bioinformatics. 25, 1952-1958 (2009).
- Zhang, Y., et al. Model-based analysis of ChIP-Seq (MACS). Genome Biology. 9, 137 (2008).
- Heinz, S., et al. Simple combinations of lineage-determining transcription factors prime cis-regulatory elements required for macrophage and B cell identities. Molecular Cell. 38, 576-589 (2010).
- Quinlan, A. R., Hall, I. M. BEDTools: a flexible suite of utilities for comparing genomic features. Bioinformatics (Oxford, England). 26, 841-842 (2010).
- Landt, S. G., et al. ChIP-seq guidelines and practices of the ENCODE and modENCODE consortia. Genome Research. 22, 1813-1831 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved