Method Article
הכנה, הדמיה, וכימות של מבחני תנועתיות Surface בקטריאלי
In This Article
Summary
Swarming motility is influenced by physical and environmental factors. We describe a two-phase protocol and guidelines to circumvent the challenges commonly associated with swarm assay preparation and data collection. A macroscopic imaging technique is employed to obtain detailed information on swarm behavior that is not provided by current analysis techniques.
Abstract
תנועתיות משטח חיידקים, כגון רץ, נבחנה בדרך כלל במעבדה באמצעות מבחני צלחת שמחייבים ריכוז מסוים של אגר ולפעמים הכללה של חומרים מזינים מסוימים במדיום הגידול. עריכת כגון המדיה מפורשת ותנאי גידול המשטח משמשת לתת לתנאים המועדפים שמאפשרים לא רק התפתחות חיידקים אבל תנועתיות מתואמת של חיידקים מעל המשטחים אלה בתוך נוזל בסרטים דקים. שחזור של צלחת נחיל ומבחני צלחת תנועתיות משטח אחרים יכול להיות אתגר מרכזי. במיוחד עבור "swarmers הממוזג" יותר שמפגין תנועתיות רק בטווח אגר של 0.4% -0.8% (wt / כרך), שינויים קלים בפרוטוקול או בסביבת מעבדה יכולה להשפיע על תוצאות assay נחיל מאוד. "יכולת רטיבות", או תכולת מים בממשק נוזל-מוצק-האוויר של מבחני צלחת אלה, היא לעתים קרובות משתנים מפתח להיות בשליטה. אתגר נוסף בהערכת הרץ הוא איך לכמת oהבדלים בין כל שני bserved ניסויים (או יותר). כאן אנו פירוט פרוטוקול שני שלבים תכליתיים להכין ואת מבחני נחיל תמונה. אנו כוללים הנחיות לעקוף את האתגרים הקשורים בדרך כלל עם הכנת תקשורת assay הנחיל וכימות של נתונים ממבחנים אלה. אנחנו במיוחד להדגים את השיטה שלנו באמצעות חיידקים המבטאים כתבים גנטיים ניאון או bioluminescent כמו, לוציפראז (operon סוויטה דה לוקס) חלבון פלואורסצנטי (GFP) הירוק, או כתמים סלולריים כדי לאפשר הדמיה אופטית זמן לשגות. בנוסף, אנו מראים את היכולת של השיטה שלנו כדי לעקוב אחר מתחרים מינים שורצים באותו הניסוי.
Introduction
חיידקים רבים לעבור על משטחים תוך שימוש באמצעים שונים של הנעה עצמית. אפשר לחקור פנוטיפים תנועתיות מסוימים במעבדה באמצעות מבחני צלחת שמושפעים מהסביבה הנוזלית הקשורים להרכב assay צלחת חצי מוצק. תת-קבוצה של מבחני צלחת תנועתיות משטח שימושי נוספת כרוכה בגז שלב-כלל באוויר חדר. בהתאם לכך, את התוצאה של כל assay תנועתיות משטח מסוים, דורשת שליטה קפדנית של הממשק של שלושה שלבים: המשטח המוצק הסביבתי המקומי, סביבה נוזלית, ואת מאפייני סביבת גז.
מצב תנועתיות הנפוצה ביותר למד בassay כגון שלושה שלבים ידוע כשורץ. שורץ תנועתיות היא תנועת הקבוצה מתואמת של תאי חיידקים המונעים על ידי שוטונים שלהם באמצעות סרטי נוזל דקים על משטחי 1. הוא למד בדרך כלל במעבדות באמצעות מבחני צלחת חצי מוצקים המכילים 0.4% -0.8% (wt / כרך) אגר 1. מערך שלפתוגנים אנושיים לנצל זאת תנועתיות התנהגות לחקור וליישב את המארח האנושי. לדוגמא, מיראביליס פרוטאוס משתמש רוחש תנועתיות לעלות השופכה, להגיע ומיישבי שלפוחית השתן וכליות 2. תנועתיות רוחשות נחשבות בדרך כלל שלב מקדים להיווצרות biofilm, הגורם העיקרי להיווצרות מחלה בפתוגנים אנושיים רבים 3.
פנוטיפ הרוחשים הוא מגוון מאוד בין מיני חיידקים; הצלחה ושחזור ניסיוני מאוד לסמוך על גורמים כגון הרכב תזונתי, סוג אגר והרכב, פרוטוקול עיקור (למשל, מעוקר), ריפוי תקשורת חצי מוצק, ולחות סביבה (למשל, שינויים עונתיים), בין יתר 3-5. ההשתנות של תגובות תנועתיות משטח מדגישה את האתגרים נתקלו במחקרים הללו והתקשורתיים השפעה המהותית והסביבה יכול תפעיל. לכמה מינים רוחשים, כמו Pseudomonas, mot שורץility יכול להתרחש במגוון של יצירות תקשורת, אם כי הפנוטיפ הנצפה וקצב התפשטות נחילי נלווה ישתנו מאוד 3. , גורמים בשילוב אלה יכולים להפוך את לימודי תנועתיות משטח מאתגרים מאוד. שינויים עונתיים במעבדה יכולים להשפיע על מבחני שלושת שלבים הבאים: מבחני עשויים לתפקד טובים יותר בלח-האוויר של הקיץ וגרוע באוויר היבש של החורף. כאן אנו מציגים הנחיות כלליות לעקוף כמה מהאתגרים הבולטים ביותר בעת ביצוע מחקרי צלחת תנועתיות פני השטח.
לחלק ממחקרי תנועתיות פני השטח, הפיתוח של פנוטיפים מסוימים הוא עניין רב. רוב אך לא כולם, מחקרים, שפורסמו לבחון רחש של P. aeruginosa להראות את היווצרות קנוקנות או פרקטלים קורנים ממרכז חיסון 3-9. הבדלים בין פ זני aeruginosa תועדו 5,8, אבל הרבה של הנוכחות או עדר של קנוקנות ניתן לייחס הספציפימדיום ג ופרוטוקול המשמשים למבחני צלחת תנועתיות נחיל אלה. כאן אנו כוללים פרטים על איך לקדם את נחילי יוצרי זלזל לפ aeruginosa. בגלל P. aeruginosa הוא רק אחד של חיידקים שורצים רבים, אנחנו כוללים גם פרטים על השיטה שלנו לבחון רץ של Bacillus subtilis וגלישה של xanthus Myxococcus. כמו P. aeruginosa, מחקר נוכחי בB. subtilis ומ ' xanthus משתרע על פני מגוון נושאים כמו חוקרים פועל כדי להבחין באספקטים של נִבִיגָה, תנועתיות, תגובת לחץ, והתנהגות 1,10 מעבר. יש צורך לכמת את הדפוסים ודינמיקה של ההתנהגות הספציפית (ות) עבור תאים אלה בקבוצות רוחשות.
רכישת נתונים תנועתיות פני השטח, ניתוח, ופרשנות יכולה להיות מסורבלת ואיכותית. פיתחנו פרוטוקול לניתוח מקרוסקופית מפורט של נחילי חיידקים המספק בנוסף לנחילי מורפולוגיה אזור ושלize (קוטר למשל,), מידע דינמי כמותי לגבי קצב התפשטות נחיל והפצת חיידקים או צפיפות bioproduct 7. יתר על כן, שיטה זו יכולה לנצל את חלבונים זמינים ניאון, הארה, וצבעים כדי להשיג מבט מקיף של אינטראקציות חיידקים 8, כמו גם לעקוב אחר הסינתזה של bioproducts (למשל, P. aeruginosa rhamnolipid 7,8) בתוך נחיל.
Protocol
1. הנחיל Assay Media הכנה והרכבת 4,5,7,8,11
- מדיה הכנה
הערה: ההרכב הבינוני המתואר להלן ישים לפ מחקרי היווצרות זלזל aeruginosa. אנא ראה מפרטים של חומרים על לוח 1 לפ aeruginosa, ב ' subtilis, ומ ' מבחני תנועתיות משטח xanthus.- מערבבים 200 מיליליטר של FAB-מינוס (NH 4) 2 SO 4 מדיום נחיל (לוח חומרים), 0.9 גר 'אגר נובל, ו -0.2 גרם של חומצות Casamino (טבלת 1) על ידי ערבוב עם בר ומערבב מגנטי. השתמש בכמויות קטנות (100-300 מיליליטר) כדי לשפר את ההתאמה בין ניסויים.
- החיטוי את תערובת 200 מיליליטר אגר / מדיה באמצעות זמן חשיפה של 22 דקות, טמפרטורת חשיפה של 121.1 מעלות צלזיוס, ואפשרות פורקן מהירה. הגדרות החיטוי תאפשר עיקור תקין והתכה אגר, אבל למנוע שזוף אגר.
הערה: אגר נובל נוטה קרמלויזואליזציה; תנועתיות חיידקים משתנים על אגר בקרמל. - מייד לאחר מחזור העיקור סכם, לסגור את המכסה של בקבוק התקשורת על מנת למנוע אובדן מים על ידי אידוי. עם זאת, יש לציין כי מכסת הדוקה יכולה לגרום "ואקום איטום" אפקט דמוי בבקבוק.
- לקרר את התקשורת עד 50 ° C תוך ערבוב בטמפרטורת חדר (RT) ולהוסיף 2 מיליליטר של גלוקוז 1.2 M סטרילי. לחלופין, הנח את המדיה באמבטית חממה או מים 60 מעלות צלזיוס עד מוכן לשימוש (עד 15 שעות מאוחר יותר), והמשך כפי שצוין. כדי למנוע את היווצרותן של בועות בתקשורת, ומערבב היטב באמצעות סרגל מערבבים המגנטי; בועות על פני השטח של אגר ימנעו אפילו רוחש.
הערה: למבחנים אחרים, להוסיף בשלב זה רכיבים רגישים לחום, שלא ניתן לעקר כגון חומרים מזינים או צבעים נוספים, בהתאם לצורך (למשל, תוספת של 8 μl Invitrogen Syto 63 צבע לכל 100 מיליליטר נמסה אגר לתמונה M. xanthus כפי שמוצג בRepresentative תוצאות, להלן). תוספת של כמה צבע עשויה להשפיע על בסיס התנהגות רץ, שיש לבדוק נגד שליטה הלא-צבע. - במנדף מעבדה, aliquot 7.5 מיליליטר של תקשורת סטרילית לכל צלחת פטרי קלקר בקוטר 60 מ"מ ולשמור על הצלחות בשכבה אחת (לא מוערם). למשטח גדול יותר רץ, aliquot 25 מיליליטר של תקשורת לכל 100 צלחת פטרי בקוטר מ"מ. חשוב למלא את המנות במשטח אופקי אפילו. השתמש בגובה העיניים של שור כדי לבדוק אם השטח הוא מפולס.
הערה: לפ מבחני aeruginosa, באמצעות תקשורת ספציפית נפח לכל צלחת ישפרו עקביות ושחזור. לB. subtilis ומ ' את מבחני xanthus, תוצאות תשואות יד לשפוך להשוות aliquots נפח מסוים.
- ריפוי צלחת
- לצלחות קטנות (60 מ"מ), תאפשר בינוני אגר המומס לרפא (שניהם מוגדרים נוזל עודף חצי מוצק והיבש) בשכונה נחשפה (כלומר, ללא מכסים) למשך 30 דקות. יותרצלחות (100 מ"מ) דורשות זמן רב יותר בריפוי (ראה דיון).
הערה: לחלופין, כמה מבחני עשויים לדרוש צלחות לרפא בלילה הספסל העליון (20-24 hr) המכוסה (כלומר, מכסים ב) בשכבה אחת (טבלת 1). הרץ הוא רגיש לשתי לחות העודפת ובלתי מספקת. לחות, זרם האוויר, והטמפרטורה של כל מעבדה נתון עשויות להצריך וריאציה לצלחת ריפוי לקדם רץ אופטימלי של חיידקך. - לחסן צלחות מייד לאחר תקופת הייבוש נגמרה. אין לאחסן את הצלחות לשימוש נוסף.
- לבצע את "מבחן התפשטות הדיו" על ידי איתור צלחת בדיקה עם תערובת 10 μl של 0.50% (כרך / כרך) השחור Waterproof היגינס הודו דיו ובידוד חיידקי 11. אם תערובת דיו / הבידוד מתפשטת בקלות (כלומר לא שומר על צורת טיפה) על פני השטח של התקשורת, התקשורת זקוקה לזמן נוסף לייבוש.
הערה: לזנים שרגישים במיוחד ללחות ( לדוגמא, P. aeruginosa), לבצע "בדיקת דיו התפשטות" מהירה 11 כדי לקבוע אם הצלחות הן יבשות מספיק.
- לבצע את "מבחן התפשטות הדיו" על ידי איתור צלחת בדיקה עם תערובת 10 μl של 0.50% (כרך / כרך) השחור Waterproof היגינס הודו דיו ובידוד חיידקי 11. אם תערובת דיו / הבידוד מתפשטת בקלות (כלומר לא שומר על צורת טיפה) על פני השטח של התקשורת, התקשורת זקוקה לזמן נוסף לייבוש.
- לצלחות קטנות (60 מ"מ), תאפשר בינוני אגר המומס לרפא (שניהם מוגדרים נוזל עודף חצי מוצק והיבש) בשכונה נחשפה (כלומר, ללא מכסים) למשך 30 דקות. יותרצלחות (100 מ"מ) דורשות זמן רב יותר בריפוי (ראה דיון).
- נחיל Assay הרכבת חיסון
- לחסן 6 מיליליטר של תקשורת בתרבות המרק (ראה טבלה 1 לפרטים נוספים) עם מושבה מבודדת מתרבות טרי (<5 ימים ההם אם נותרו בטמפרטורת חדר) Lysogeny מרק (LB) צלחת. דגירה תרבויות מרק הלילה (שעות ≤18) על 30 מעלות צלזיוס או 37 מעלות צלזיוס עם רעד אופקי (240 סל"ד).
- לחסן צלחות נחיל ידי תצפית עם 1-5 μl של תרבות מרק הלילה, או על ידי "תוקע את" אגר עם שן סטרילי להרים או מחט חיסון תיל.
הערה: אנו מעדיפים את השיטה השנייה, כי זה מקטין את הסיכוי של תזת הבידוד ומונע הוספת לחות נוספת לאזור משטח נחיל.
- נחיל Assay דגירה
- עבור assay הכללי, דגירה צלחות assay נחיל על 30 מעלותC או 37 ° C (או אפילו 42 מעלות צלזיוס למשך 'subtilis; טבלת 1) -זהו הוא חיידק ספציפי. הפוך את הצלחות במהלך דגירה, כך שעודף לחות מתעבה על המכסה, לא אגר.
הערה: טמפרטורה יכולה להשפיע על הפנוטיפ כמו גם קינטיקה. לP. נחילי aeruginosa, דגירה על 37 מעלות צלזיוס גורמת להרחבת צמיחה ונחיל מהר יותר מדגירה על 30 מעלות צלזיוס; עם זאת, את המורפולוגיה של נחילים אלה לעתים קרובות משתנה עם שינוי זה בטמפרטורה. - עבור הדמיה זמן לשגות, דגירה צלחות נחיל בטמפרטורה המתאימה לפני ההעברה לתחנת ההדמיה (ראה טבלה 1 לפרטים נוספים).
הערה: דגירה מראש הדמיה זו מאפשרת נחילים להתחיל הפיתוח שלהם ולהתבסס לפני שעבר לסביבה חדשה, אשר עשוי או לא עשוי להיות אופטימלי לשורץ תנועתיות.
- עבור assay הכללי, דגירה צלחות assay נחיל על 30 מעלותC או 37 ° C (או אפילו 42 מעלות צלזיוס למשך 'subtilis; טבלת 1) -זהו הוא חיידק ספציפי. הפוך את הצלחות במהלך דגירה, כך שעודף לחות מתעבה על המכסה, לא אגר.
2. הדמיה מקרוסקופית של Surface תנועתיות מבחני 7,8
- עבור הדמיה זמן לשגות, לאחר צלחות assay נחיל מקום תקופת דגירה מראש הדמיה על צלחת הדמיה ברורה בתוך בתחנת הדמיה vivo מסחרית. תמונה עד שש, בקוטר 60 מ"מ או ארבעה, 100 צלחות בקוטר מ"מ בכל פעם. מאז המצלמה לוכדת תמונות מתחת למטוס ההדמיה, להפוך את הצלחות, כך שהנתיב האופטי אינו חסום 8. לחלופין, לדגור על 30 מעלות צלזיוס או 37 ° C (טבלת 1) לתקופת הניסוי, ולהסיר את הצלחות להיות צילמה מן החממה במרווחי זמן קבוע.
- מניחים את המכסים של צלחות פטרי זקוף על גבי צלחת העמית שמחזיק את התקשורת המחוסנת. מלא את המכסים של צלחות פטרי עם מים כדי למנוע התייבשות מוגזמת במהלך הדמיה, ולהקיף את כל ההגדרה באמצעות אחר מגש ברור לשמור על לחות לאורך כל הניסוי.
- assay שימוש בהדמיה מולקולרית (MI) תוכנה 12, לרוץ (ים) בטמפרטורת חדר באמצעות imהזדקנות הגדרות מתוארות בטבלה 2. עבור הדמיה זמן לשגות, להגדיר את פרוטוקול עם הצעדים ומפרטים הדרושים.
3. עיבוד נתונים ופרשנות 7,8
- עיבוד תמונה
- השתמש בתוכנת MI לתמונות אצווה יצוא כקבצי TIFF 16-bit: קובץ> יצוא או יצוא מרובה> בחר קובץ (ים) ליצוא ומיקום יצוא.
- השתמש ImageJ לפתוח תמונה אחת או לייבא סדרת הזמן לשגות:
- פתח תמונה אחת: File> Open
- רצף יבוא הזמן לשגות תמונה: קובץ> יבוא רצף, ובחר "שמות מיין מספרי".
- עבור קבצים גדולים יותר זמן לשגות, בחר באפשרות "השתמש בערימה וירטואלית" בחלון "יבוא הרצף" לערום את התמונות מיוצאות לקטגוריות מתאימות (כלומר, GFP, RFP, וכו ').
- במידת הצורך, לשנות את התמונות מהקבצים של 16 סיביות לקבצים של 8 ביט: תמונה> סוג> 8 סיביות
הערה: כלים ImageJ מסוימים דורשים תמונות 8 ביט. - לקבוע אם אות העצמה לתמונה ברצף או זמן לשגות צריכה להיות הפוכה. הצב את הסמן על נקודת אור בתמונה (למשל הצמיחה, שכותרתו fluorescently) ולציין את עוצמת האות "ערך" מסרגל הכלים ImageJ. לאחר מכן, מקם את הסמן בנקודה כהה מחוץ לאזור הצלחת ולב עוצמת האות. אם עוצמת האות לנקודה הכהה היא גדולה יותר מהעוצמת לנקודת האור, עוצמת אות תמונה צריכה להיות הפוכה (בצע substeps 1-2 בהמשך).
- הפוך את אותות עוצמה: Edit> הפוך
- הפוך את טבלת חיפוש: תמונה> שולחנות בדיקה> הפוך LUT
- הפחת את הרקע: התהליך> חיסור רקע, ולהשתמש "רדיוס כדור מתגלגל" עם רדיוס פיקסל שהוא מחצית מממד תמונה אחת (לדוגמא, 1000 פיקסלים לp 2,000 x 2,000תמונת ixel).
- באופן מלאכותי צבע תמונה או זמן לשגות רצף: תמונה> שולחנות בדיקה, ובחר את הצבע המתאים מאפשרויות הרשימה.
- לסרטים עם שניים או יותר ערוצים, למזג ולאזן את הצבעים לפני השמירה כסרט (עיבוד תמונה, שלב 8). כדי למזג תמונות יחד, פתוחים כל ערימות התמונה בImageJ, ולאחר מכן בחר תמונה> צבע> מיזוג ערוצים, ולהקצות לכל מחסנית לערוץ צבע.
- להציל את רצף הזמן לשגות כמו AVI או QuickTime סרט: קובץ> שמירה בשם, ובחר בפורמט ומפרטים רצויים.
- ניתוח נתונים
- רכישת אזור גידול Surface בקטריאלי לכמת שיעור הרחבה
- תמונה פתוחה (ים) בImageJ
- כדי לחשב את הקוטר של הצלחת בפיקסלים, למתוח קו החוצה את מרכז צלחת assay עם האפשרות "סטרייט" ומלמדוד את אורכה: ניתוח> מדוד
- יחידת מדידת ברירת המחדל בImageJ היא piXel. להשיג מקדם המרה על ידי חלוקת הקוטר של צלחת assay (למשל, 60 לצלחת 60 מ"מ) באורך פיקסל הושג בשלב הקודם.
- לשנות את יחידת מדידה מפיקסל למ"מ: תמונה> מאפיינים
- לשנות את "יחידת אורך" ל "מ"מ", ואת "Pixel רוחב", "גובה פיקסל", ו- "עומק voxel" לגורם ההמרה מחושב בשלב הקודם. בחר בתיבה "גלובל" כדי לשמור על גורם המרה זו על פני מספר רב של תמונות.
הערה: אם ImageJ נסגר ונפתח מחדש, או שדה ראייה של תמונה משתנה (כלומר, תמונה אחת מוגדלת יותר מאשר אחר), חייב להיות מחושב מחדש מקדם ההמרה. לחלופין, לבצע את כל ניתוחים בפיקסלים ולאחר מכן הוסב למ"מ.
- לשנות את "יחידת אורך" ל "מ"מ", ואת "Pixel רוחב", "גובה פיקסל", ו- "עומק voxel" לגורם ההמרה מחושב בשלב הקודם. בחר בתיבה "גלובל" כדי לשמור על גורם המרה זו על פני מספר רב של תמונות.
- לכל מסגרת, להתחקות ולמדוד את שטח נחיל השימוש באפשרות "בחירות Freehand" בסרגל הכלים כדי לאתר את ouTLine של הנחיל ולמדוד את השטח באמצעות: ניתוח> מדוד. זה יפיק מדידות להיכנס, כי ניתן לשמור לניתוח נוסף בMicrosoft Excel או תוכניות דומות: קובץ> שמירה בשם
- רכישת עצמת צמיחת Surface בקטריאלי לכמת שיעור צמיחת Surface
- ברגע שהרקע מופחת (עיבוד תמונה, שלב 5), השתמש במסגרת האחרונה של הרצף כדי לקבוע את השטח המרבי של נחיל (ניתוח נתונים, שלב 1).
- השתמש בכלי הבחירה "הסגלגל" מסרגל הכלים כדי לצייר תיבה מסביב לצמיחת משטח החיידקים.
- הגדר את מתכוונים מדידת עוצמת פיקסלים בתיבה באמצעות: ניתוח> מדידות סט, ובחר "Mean ערך אפור".
- כדי להשיג מדידות אות עוצמה עבור כל מסגרת ברצף הזמן לשגות, ואילו על המסגרת הראשונה של הרצף ללכת ל: ניתוח> מדוד. זה יפיק מדידות להיכנס, כי ניתן לשמור לניתוח נוסף בMicrosoft תוכניות דומות Excel או: קובץ> שמירה בשם
- חלופה לסעיף הקודם (ניתוח נתונים, שלב 2). השתמש בתוסף ImageJ מאקרו להתקנה ולהפעיל תסריט מדידת עוצמת צמיחת משטח מאקרו.
- התקנת תסריט מדידה אוטומטית לנתח מסגרות מרובות בו זמנית: Plugin> מאקרו חדש>, ולהדביק את התסריט ובלבד (להלן) לתוך התיבה ולשמור כקובץ טקסט ImageJ מאקרו: File> Save, ולשמור בתיקיית יישום ImageJ תחת " פקודות מאקרו ".
numberOfFrames = N
ל( i = 0; i לרוץ ("מדד");
לרוץ ('הבא Slice [>]');
}
הערה: כאן משתנה "N" הוא מספר לא מוגדר של מסגרות. - ערוך את "numberOfFrames" בתוסף פקודות מאקרו עבור כל ניסוי על מנת לשקף את מספר המסגרות ברצף התמונה לפני הפעלת הסקריפט. שימוש: Plugin> מאקרו>עריכה, ולהקליד את המספר הנכון של מסגרות ברצף ולשמור (File> Save).
- עקוב substeps 1-3 בניתוח נתונים-שלב 2, ואילו במסגרת הראשונה של הרצף להפעיל את תוסף מאקרו: Plugin> מאקרו> הפעלה. זה יפיק מדידות להיכנס, כי ניתן לשמור לניתוח נוסף בMicrosoft Excel או תוכניות דומות: קובץ> שמירה בשם
- התקנת תסריט מדידה אוטומטית לנתח מסגרות מרובות בו זמנית: Plugin> מאקרו חדש>, ולהדביק את התסריט ובלבד (להלן) לתוך התיבה ולשמור כקובץ טקסט ImageJ מאקרו: File> Save, ולשמור בתיקיית יישום ImageJ תחת " פקודות מאקרו ".
- רכישת אזור גידול Surface בקטריאלי לכמת שיעור הרחבה
תוצאות
וריאציה בהכנת צלחת יכולה להשפיע במידה רבה שורצת תנועתיות. הריפוי או ייבוש הזמן לאחר מילוי בינוני אגר מומס משפיע על הווה סרט נוזל הדק במבחני כושר תנועת פני השטח ותנועתיות חיידקים לאורך זמן. שינויים בהרכב תזונתי משפיעים גם שורצים במשך כמה חיידקים. איור 1 א מציג השפעה לטווח קצר של זמן ייבוש על הפצה של הודו דיו והפצה של הבידוד ראשוני של Bacillus subtilis 11. איור 1 מראה את ההשפעה של זמן ייבוש ותוכניות תרשים 1C ההשפעות של אמוניום סולפט [(NH 4) 2 SO 4] על פיתוח זלזל לאחר מכן על ידי רוחש P. aeruginosa 5.
ניתן להשיג תמונות של נקודות קצה של תנועתיות משטח באמצעות אסטרטגיות הדמיה מרובות נתונים מדידים. איור 2 מראה תוצאות צמיחת משטח נציג ל P. aeruginosa רוחש ותמונת הקרינה GFP קשורים אליו; B. רץ subtilis ותמונת פליטת אור הקשורים אליו; וצמיחת משטח xanthus Myxococcus ותמונת הקרינה האדומה הקשורות של SYTO 64 מוכתם תאים.
הרחבת רכישת נתונים מעבר רק בדיקה והדמיה של תוצאות נקודת הסיום מאפשרת לחקר התנהגות דינמית (ות) עבור חיידקים גדלו משטח. איור 3 7 מציגה דוגמא של פ aeruginosa רוחש (צילם עבור תאי GFP להביע) וייצור rhamnolipid הקשורים אליו (הדמיה באמצעות הנילוס אדום כתם שומנים בדם) -the כימות של נתונים מתמונות אלה מוצג גם כדי להראות את קצב ההתפשטות של פ aeruginosa רוחש. וידאו 1 מציג זמן לשגות של B. רץ subtilis צילם באמצעות הארה של זן -expressing סוויטה דה לוקס. וידאו 2 8 מראה זמן לשגות של פ aeruginosa Typhimurium מ '(GFP להביע ירוק) וserovar enterica סלמונלה (לוקס להביע אדום) בassay נחיל תחרותי.
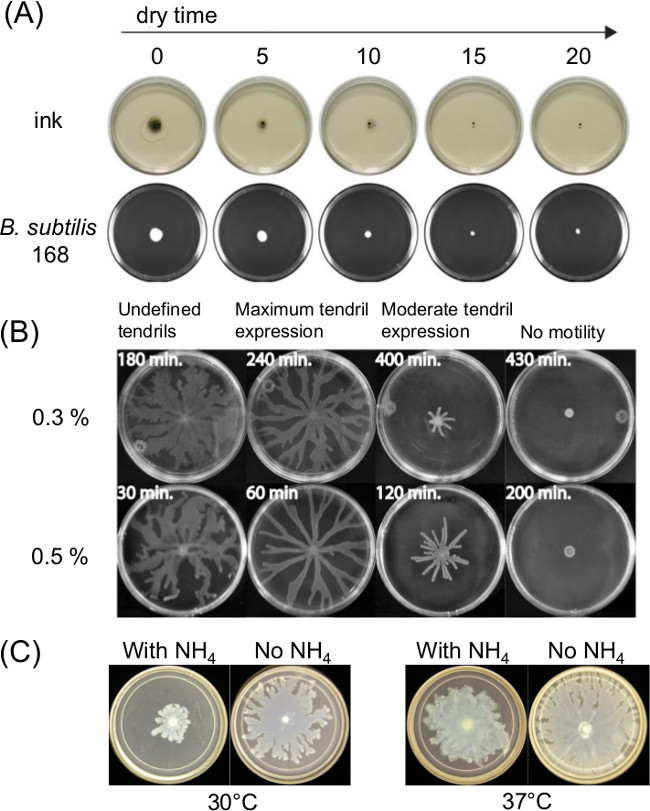
איור 1: דוגמאות לגורמים בהכנת assay תנועתיות משטח שמשפיעים על תוצאות assay השפעת () זמן ייבוש אגר על לחות משטח אגר והפצה של הבידוד לב. subtilis (Ref 8), (ב) זמן ייבוש אגר על P. aeruginosa רוחש (הודפס מחדש מRef 5 ברשות), ונוכחות (C) או העדרה של אמוניום סולפט על P. רץ aeruginosa והיווצרות זלזל.
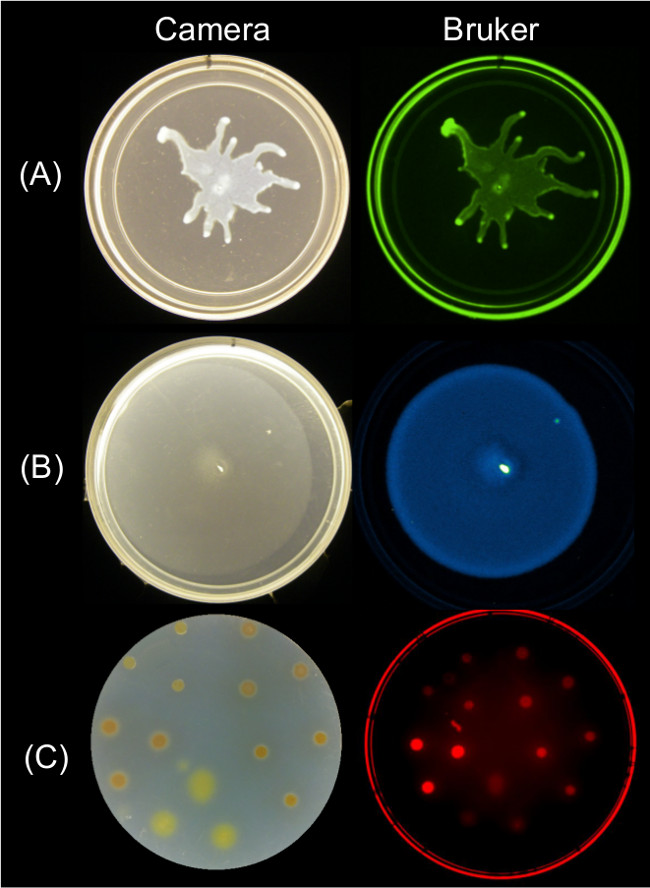
איור 2: משתנve גישות לצמיחת משטח הדמיה ותנועתיות של חיידקים באמצעות תחנת ברוקר הדמיה. צד על ידי צד תמונה של מצלמה (משמאל) ותמונת ברוקר (מימין) מראים () פ B. aeruginosa להביע באמצעות הגדרות ירוקות הקרינה, צילם-GFP (B) subtilis להביע xanthus פליטת אור לוקס באמצעות הגדרות הארה, ו- צילם כתב (C) מ 'מוכתם בSYTO 64 צילם באמצעות הגדרות אדומות הקרינה II. ראה טבלה 2 לקביעת פרטים.
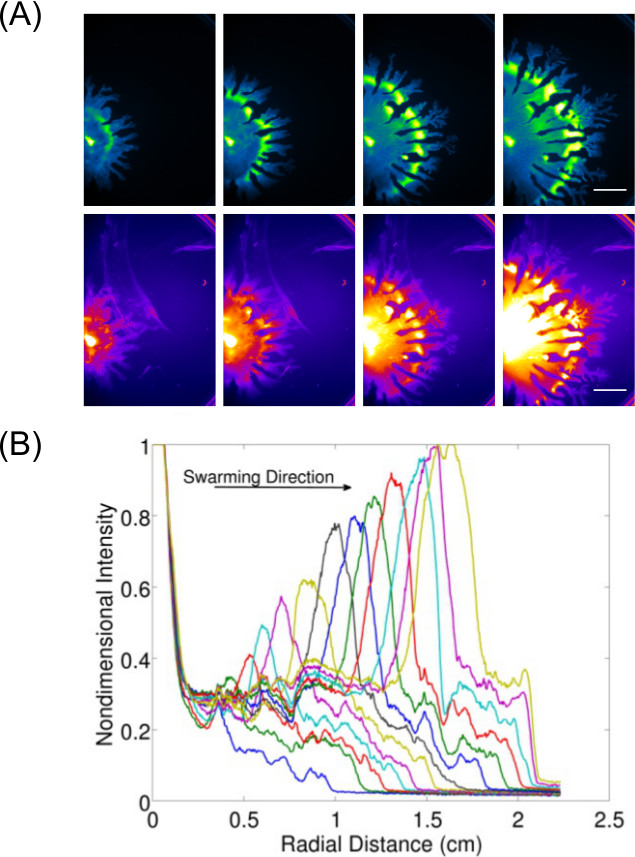
איור 3:. ניתוח איכותי וכמותי של assay תנועתיות פני השטח () ניתוח זמן לשגות של הפצת צפיפות תאים, ייצור rhamnolipid (כתם השומנים הנילוס האדום צילם באמצעות הקרינה האדומהאני הגדרות; סרגל קנה מידה = 15 מ"מ), וכימות (ב) לקצב התרחבות מתמונות הפצת צפיפות תאים של P. נחיל aeruginosa. (הודפס מחדש מRef 6 באישורו.)
וידאו 1. זמן לשגות הדמיה של B. subtilis נחיל. B. subtilis להביע סוויטה דה לוקס ונרשם באמצעות הגדרות ההארה. ראה טבלה 2 לקביעת פרטים.
וידאו 2. תחרות interspecies דמיינה ידי הדמיה הזמן לשגות. נחילים של פ aeruginosa (ירוק; להביע GFP ונרשם באמצעות ההגדרות ירוקות הקרינה) וס ' Typhimurium serovar enterica (אדום; Expresלשיר סוויטה דה לוקס ונרשם באמצעות הגדרות ההארה). ראה טבלה 2 לקביעת פרטים. (הדפסה חוזרת באישור Ref 7.)
| פ aeruginosa | מחקרי היווצרות זלזל P. aeruginosa | 'subtilis | xanthus מ ' | |
| תקשורת ותרבות מרק הלילה | FAB בתוספת 30 מ"מ גלוקוז | FAB בתוספת 30 מ"מ גלוקוז | LB | CTT |
| טמפרטורת דגירה התרבות מרק הלילה | 37 ° C | 37 ° C | 37 ° C | 30 שעות על 30 מעלות צלזיוס |
| תקשורת נחיל | FAB | FAB מינוס (NH 4) 2 SO 4 | 2% (wt / כרך) LB | CTT |
| תקשורת נחיל: רכיבים נוספים | 12 גלוקוז מ"מ | 10% CAA (wt / כרך), גלוקוז 12 מ"מ | n / | SYTO® 64 |
| סוג אגר | אגר, Noble | אגר, Noble | אגר מגורען | אגר, Noble Affymetrix |
| ריכוז אגר (wt / כרך) | 0.45% | 0.45% | 0.60% | 1.50% |
| גודל צלחת נחיל | 60 מ"מ | 60 מ"מ | 100 מ"מ | 150 מ"מ |
| תקשורת לכל צלחת נפח | 7.5 מיליליטר | 7.5 מיליליטר | יד שפכו | יד שפכו |
| הגדרת תקשורת נחיל / שיטת ייבוש | הוד; צלחות שנחשפו | הוד; צלחות שנחשפו | Benchtop; צלחות מכוסות | Benchtop; צלחות מכוסות |
| הגדרת תקשורת נחיל / זמן ייבוש | 30 דקות | 30 דקות | (20 -24 שעות) הלילה | (20 -24 שעות) הלילה |
| טמפרטורת הדגירה assay נחיל | 30 או 37 מעלות צלזיוס | 30 ° C | 37 ° C | 30 ° C |
| דגירה של הדמיה זמן לשגות | 30 מעלות צלזיוס במשך לפחות 4 שעות | 30 מעלות צלזיוס במשך לפחות 4 שעות | 37 מעלות צלזיוס במשך שעה 2 | RT עבור שעות 12 |
| אורך לכידת זמן לשגות | 24 שעות | 24 שעות | 10 שעות | 66 שעות |
| הגדרת זמן לשגות | 1 מסגרת דק '/ 10 | 1 מסגרת דק '/ 10 | 1 מסגרת דק '/ 6 | 1 מסגרת דק '/ 10 |
| נוסף לאחר מעוקר. | ||||
טבלה 1:. מפרט לSurface תנועתיות Assay הכנה כוללת משטחמפרטי הכנת assay תנועתיות לפ aeruginosa, ב ' subtilis, ומ ' xanthus.
| אות | הקרינה ירוקה | אדומה קרינתי | אדום הקרינה II | נְהוֹרָנוּת |
| חלבון או צבע | חלבון פלואורסצנטי ירוק (GFP) | חלבון mCherry או כתם האדום הנילוס rhamnolipid | SYTO® 64 | לוציפראז מoperon סוויטה דה לוקס |
| גל עירור (ננומטר) | 480 ± 10 | 540 ± 10 | 590 ± 10 | Off |
| אורך גל פליטה (ננומטר) | 535 ± 17.5 | 600 ± 17.5 | 670 ± 17.5 | ללא מסנן |
| זמן חשיפה (שניות) | 30 | 60 | 60 | 240 |
| זיוני תחנה | 4.0 | 4.0 | 2.5 | 1.1 |
| FOV (מ"מ) | 190 | 190 | 140 | 120 |
| משטח הפוקוס (מ"מ) | 27.5 | 27.5 | 12.2 | 4 |
| יניג (פיקסלים) | אף אחד | 2 x 2 | אף אחד | 8 x 8 |
מפרט הדמיה מפרטי תחנת ההדמיה ברוקר לקרינה אדומה וירוקה, והדמיה הארה של משטח צמיחת חיידקים: טבלה 2..
Discussion
השגת רץ לשחזור במעבדה יכולה להיות מאתגר, כמו מבחני נחיל רגישים מאוד לגורמים סביבתיים, כגון לחות וחומרים מזינים זמינים. ההיבט הקריטי ביותר של assay צלחת תנועתיות פני השטח הוא לחות על פני השטח אגר. לפני החיסון, תקשורת נחיל חייבת להיות יבשה מספיק כדי למנוע מתאי חיידקים שחיה על פני נוזל פני השטח, אבל לא כל כך יבשה כמו לעכב רוחש תנועתיות 5. דגירה צריכה להתבצע בסביבה מספיק לחה: לחות מעט מדי יכולה לגרום להתייבשות assay במהלך דגירה, בעוד לחות רבה מדי יכולה להוביל למשטח מלאכותי או artifactual מתפשט. אלא אם כן חממת לחות מבוקרת היא בהישג היד, לחות חממה והמעבדה יכולה להשתנות באופן דרמטי. כתוצאה מכך, מאגר מים נוסף, מכשיר אדים, או מסיר לחות בחממה ייתכן שיידרש כדי למנוע מעל ייבוש או ההצטברות של עודף לחות, תוך שמירה על relatלחות ive קרוב 80%. שמירה על לחות אידיאלית זה עשויה להוכיח מאתגר אם שינויי לחות עונתיות משמעותיים. אם זה המקרה, פרוטוקול assay הנחיל ידרוש קצת התאמות לחשבון לשינויים עונתיים בלחות. מצאנו כי שינוי זמן ייבוש תקשורת הנחיל הוא הדרך הפשוטה ביותר כדי להתאים לשינויי לחות עונתיים. ניטור לחות קבוע, הן בתוך ומחוץ לחממה, מומלץ. יתר על כן, מומלץ שהחוקרים לכייל ולאמת המכשירים, החממות, הקשקשים שלהם, וכו 'טעויות קטנות כמו בטמפרטורה, נפח או סכומם של רכיבי תקשורת יכול להשפיע שחזור של מבחני אלה.
צריך גם לציין שאת הסוג והגודל של הצלחת המשמש assay יכולים להשפיע על לחות צלחת, ובכך רוחש. צלחות אטום לא לפרוק את עודף לחות, ובכך תנועתיות השחייה מעודדת. בניגוד לכך, צלחות פתוחות פנים לאפשר יותר מדי לחות לברוח. צלחת פטרימספק סביבה אידיאלית כי זה פתחי אוורור מעודף לחות מספיק כדי למנוע נוזל לבנות, אבל שומר על לחות מספיק כדי למנוע את התקשורת מהתייבשות. שיטה זו מפרטת פרוטוקול assay תנועתיות משטח המאפשר הדמיה באיכות גבוהה. כדי לשמור על אגר ברור לכלים בקוטר 60 מ"מ הדמיה מלא 7.5 מיליליטר של תקשורת אגר. אם אינה נדרשת הדמיה מפורטת, כרכים עד 20 מיליליטר יכולים גם לספק תוצאות לשחזור.
בעוד תנועתיות רוחשת ניתן להשיג במגוון רחב של ריכוזים אגר, הטווח האופטימלי של אגר הנדרשים לרץ תלוי במין. בסך הכל, ריכוזים גבוהים יותר אגר אינם מאפשרים תנועתיות רוחשת, וכתוצאה מכך את הזמן הדרוש כדי לייצר עליות נחיל דימוי מוכן. P. aeruginosa בדרך כלל שורץ בריכוזים אגר בין .4-.7 1%, עם זאת אנו מוצאים כי רץ אופטימלי מתרחש בטווח צר הרבה יותר (0.4-0.5%). אחרים, כגון B. subtilis וS. entericנחיל באגר 0.6%, וparahaemolyticus Vibrio בשיעור של 1.5% אגר 10. הריכוז אגר הנדרש נקבע גם על ידי הסוג והמותג של אגר. agars טוהר גבוה יותר, כמו אגר נובל, מאוד לשפר שורץ בפ aeruginosa ועדיף על מגורען אגר 13,14. עם זאת, גרסאות אלה מטוהרות של אגר הם גם נוטים יותר לשזופים במהלך מחזור עיקור החיטוי; תלוי במכשיר, רצף מקוצר / שונה עיקור (לאולי לשנות את מחזור הפליטה כדי למנוע חשיפה לחום ממושך) עשוי להידרש להכין תקשורת נחיל באמצעות אגר נובל.
הרכב תקשורת גם משחק תפקיד בפנוטיפ הנחיל נצפה 3. P. מחקרי תנועתיות רוחשת aeruginosa מבוצעים בדרך כלל באמצעות מדיה תזונתית מינימאלית. אנחנו מעדיפים FAB 4,8 בינוני (לוח חומרים), אך כלי תקשורת אחרות, כגון M9, LB, או שינויים קלים לתקשורת הנפוצה אלה,שימש בהצלחה 9,15,16. היווצרות זלזל היא הטובה ביותר להשיג על מדיום המינימלי FAB בתוספת גלוקוז כמקור פחמן וחומצות casamino (CAA), אך ללא מקור חנקן נוסף (כלומר, (NH 4) 2 SO 4) 6,13. אם היווצרות זלזל או מורפולוגיה היא לא המוקד העיקרי של המחקר, ולאחר מכן בינוני מינימאלי FAB (לוח חומרים; טבלת 1) נטול CAA מומלץ כך שההשפעות של מקורות ספציפיים פחמן ו / או חומרים מזינים נוספים ניתן ללמוד בפירוט. מינים אחרים, כגון B. subtilis (המוצג כאן), הוא swarmers תכליתי, מסוגל שורץ על LB ואגר מגורענים. מינים אלה נחילים בקלות, הדורשים רק ~ 10 שעות כדי לפתח נחיל מלא. שיעור מהיר רוחש זה עושה הבא התקדמות הנחיל קשה שעלולים להיות אבל הפרוטוקול שלנו עושה כזה מעקב מאוד ריאלי. היכולת לבצע הדמיה הזמן לשגות נחיל מספקת substantial להקל ברכישת נתונים נחיל, במיוחד מswarmers נלהב כזה.
אנחנו מציגים,, פרוטוקול חזק מקיף שני שלבים והנחיות שמטרתן שיפור הביצוע והשחזור של מחקר תנועתיות משטח חיידקים והדגשנו בעיקר היבטים חשובים לבחון רץ בתיווך flagellar. פרוטוקול assay נחיל זה מפרט היבטים חשובים של הרכב תקשורת וטיפול בצלחות תנועתיות פני השטח כדי לספק לעקביות רבה יותר ושחזור בתוך ובין קבוצות מחקר. זה ישפר את בסיס השוואה בין מחקרים שונים. בנוסף, הגישה והפרוטוקול שהוצגה מספק אמצעים לעשות מחקר על תנועתיות רץ ומשטח פחות רגיש לשינויים סביבתיים על ידי הפיכת חוקרים מודעים לכך שגורמים כגון להשפיע על עבודתם ומתן פתרונות אפשריים (למשל, כיצד שינויים קטנים באגרו להשפיע רוחש 4,5 ). יתר על כן, הפרוטוקול הניתן ללכמת היבטים מקרוסקופית של רץ, מספק הזדמנות למדידת תכונות רבות של צמיחת משטח חיידקים שהיו בלתי ניתנים למדידה בעבר.
לא בדקנו את כל חיידקי ניע המשטח בפיתוח של פרוטוקול זה. ככזה, הוא צפוי כי שינויי פרוטוקול יידרשו למינים אינם מוצגים כאן. היעילות של פרוטוקול זה מוגבל על ידי הגבולות הגלומים של הציוד וחומרים מועסקים. לדוגמא, מחקרים הקשורים טמפרטורה אינם אפשריים עדיין עם תחנת ההדמיה הברוקר, מאז בקרת טמפרטורה היא לא תכונה של הציוד. בנוסף, השימוש בצבעים (כגון הנילוס אדום להכתים rhamnolipids) יכול להיות מגבלות הקינטית וריכוז 8. טכניקה זו מאוד מסתמכת על העיבוד והניתוח של תמונות דיגיטליות; אוטומציה משופרת של ניתוח נתונים (לדוגמא, באמצעות פקודות מאקרו נוספות פונקצית תסריט בImageJ) היה להפחית את הזמן הנדרש לניתוחולהרחיב את השימושיות של הנתונים. לבסוף, בשל חוסנו של פרוטוקול ההדמיה, יישומים עתידיים צריכים לשאוף בהרחבה בטכניקה זו כדי לבחון משטחי צמיחה פחות אחידים שרלוונטיים יותר למשטחים יישבו על ידי חיידקים פתוגניים וסביבתיים.
Disclosures
עמלות פרסום לכתבה זו מומנו באופן חלקי על ידי חברת ברוקר.
Acknowledgements
תמיכה חלקית עבור עבודה זו סופקה על ידי המכון הלאומי לבריאות (R01GM100470 ו1R01GM095959-01A1; לתואר שני וJDS) ומענק מתקן Core מהמדעים קליניים וTranslational מכון אינדיאנה (מומן בחלקו על ידי מענק # NIH UL1 TR000006; ל JDS).
Materials
| Name | Company | Catalog Number | Comments |
| Reagentsa | |||
| FAB Minimal Media: | Prepare every ~4 weeks. Top to 1 L with nanopure H2O. | ||
| (NH4)2SO4 | Sigma | A4418 | 2 g. Not used in P. aeruginosa tendril formation studies. |
| Na2HPO4 x 7H2O | Sigma-Aldrich | S9390 | 9 g |
| KH2PO4 | Sigma | P5655 | 3 g |
| NaCl | BDH | BDH8014 | 3 g |
| MgCl2 x 6H2O solution (198 g/L) | Fisher Scientific | M33 | 1 ml |
| CaCl2 x 2H2O solution (14 g/L) | Fisher Scientific | C79 | 1 ml |
| Trace metal solution (see below) | n/a | n/a | 1 ml |
| Trace Metal Solution: | Top to 1 L with nanopure H2O. Maintain in a glass bottle, stirring and covered with foil. | ||
| CaSO4 x 2H2O | Sigma-Aldrich | 255548 | 200 mg |
| MnSO4 x H2O | Sigma-Aldrich | M7634 | 20 mg |
| CuSO4 x 5H2O | Fisher Scientific | C493 | 20 mg |
| ZnSO4 x 7H2O | Sigma-Aldrich | Z4750 | 20 mg |
| CoSO4 x 7H2O | Sigma-Aldrich | C6768 | 10 mg |
| NaMoO4 x 2H2O | Sigma | S6646 | 10 mg |
| H3BO3 | Fisher Scientific | A74 | 5 mg |
| FeSO4 x 7H2O | Sigma-Aldrich | F7002 | 200 mg |
| CTT Media: | Prepare as needed. Top to 100 ml with nanopure H2O. | ||
| Tris-HCl, 1 M solution (adjust to pH 8.0) | Amresco | 0234 | 1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 8.0 and filter sterilize (0.2 μm pore). |
| K2HPO4, 1 M solution (adjust to pH 7.6) | Sigma-Aldrich | P3786 | 0.1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 7.6 and filter sterilize (0.2 μm pore). |
| MgSO4 solution | Fisher Scientific | M65 | 0.8 ml. Prepare a 1 M stock solution in nano pure H2O. Filter sterilize (0.2 μm pore). |
| Casitone | BD Diagnostics | 225930 | 1 g |
| Additional Reagents: | |||
| LB Broth, Lennox | BD Diagnostics | 240230 | 2% (wt/vol) |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | 30 mM for overnight broth cultures; 12 mM for swarm media. Prepare a 1.2 M filter sterilized stock solution in nano pure H2O. Add to media after autoclaving. |
| Casamino acids (CAA) | Amresco | J851 | 0.10% (wt/vol). Recommended for P. aeruginosa tendril formation studies. Add to media prior to autoclaving. |
| Agar, Noble | Sigma-Aldrich | A5431 | 0.45% (wt/vol). Preferred Noble agar for P. aeruginosa surface motility studies. Add to media prior to autoclaving. |
| Agar, Noble | Affymetrix | 10907 | 1.50% (wt/vol). Used in M. xanthus surface motility studies. Not recommended for P. aeruginosa motility studies. Add to media prior to autoclaving. |
| Agar, Granulated | Fisher Scientific | BP1423 | 0.60% (wt/vol) |
| Higgins Waterproof Black India Ink | Higgins | HIG44201 | 0.50% (vol/vol). Mix ink with inoculum to test swarm media surface moisture. |
| SYTO® 64 Red Fluorescent Nucleic Acid Stain | Invitrogen | S-11346 | Use 4 μl (for P. aeruginosa) or 8 μl (for M. xanthus) of SYTO® 64 per 100 ml of molten agar (added after autoclaving). |
| Relevant Materials and Equipment | |||
| Petri dish, sterile, 150 mm x 15 mm (Dia. x H) | VWR | 25384-326 | |
| Petri dish, sterile, 100 mm x 15 mm (Dia. x H) | VWR | 25384-342 | |
| Petri dish, sterile, 60 mm x 15 mm (Dia. x H) | VWR | 25384-092 | |
| In-Vivo Xtream | Bruker | Use for the macroscopic imaging of surface motility studies. http://www.bruker.com/products/preclinical-imaging/opticalx-ray-imaging/in-vivo-xtreme/overview.html | |
| Bruker MI software | Bruker | http://www.bruker.com/fileadmin/user_upload/8-PDF-Docs/PreclinicalImaging/Brochures/MI-software-brochure.pdf | |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| aSee MSDS of reagents for handeling and disposal information. | |||
References
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews: Microbiology. 8 (9), 634-644 (2010).
- Burall, L. S., et al. et al.Proteus mirabilis. genes that contribute to pathogenesis of urinary tract infection: Identification of 25 signature-tagged mutants attenuated at least 100-fold. Infection and Immunity. 72 (5), 2922-2938 (2004).
- Shrout, J. D., et al. The impact of quorum sensing and swarming motility on Pseudomonas aeruginosa. biofilm formation is nutritionally conditional. Mol Microbiol. 62 (5), 1264-1277 (2006).
- Kamatkar, N. G., Shrout, J. D. Surface hardness impairment of quorum sensing and swarming for Pseudomonas aeruginosa. PLoS One. 6 (6), e20888 (2011).
- Tremblay, J., Déziel, E. Improving the reproducibility of Pseudomonas aeruginosa. swarming motility assays. Journal of Basic Microbiology. 48 (6), 509-515 (2008).
- Caiazza, N. C., Shanks, R. M., O'Toole, G. A. Rhamnolipids modulate swarming motility patterns of Pseudomonas aeruginosa. Journal of Bacteriology. 187 (21), 7351-7361 (2005).
- Du, H., et al. High density waves of the bacterium Pseudomonas aeruginosa. in propagating swarms result in efficient colonization of surfaces. Biophysical Journal. 103 (3), 601-609 (2012).
- Morris, J. D., et al. Imaging and analysis of Pseudomonas aeruginosa. swarming and rhamnolipid production. Appl Environ Microbiol. 77 (23), 8310-8317 (2011).
- Tremblay, J., Richardson, A. P., Lépine, F., Déziel, E. Self-produced extracellular stimuli modulate the Pseudomonas aeruginosa. swarming motility behaviour. Environmental Microbiology. 9 (10), 2622-2630 (2007).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. J Bacteriol. 195 (5), 909-918 (2013).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis .do not exhibit swarming motility. Journal of Bacteriology. 191 (22), 7129-7133 (2009).
- . . Molecular Imaging. , (2014).
- Harshey, R. M., Matsuyama, T. Dimorphic transition in Escherichia coli. and Salmonella typhimurium.: surface-induced differentiation into hyperflagellate swarmer cells. Proceedings of the National Academy of Sciences, USA. 91 (18), 8631-8635 (1994).
- Rashid, M. H., Kornberg, A. Inorganic polyphosphate is needed for swimming, swarming, and twitching motilities of Pseudomonas aeruginosa. Proc Nat Acad Sci U.S.A.. 97 (9), 4885-4890 (2000).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa. PA14. Journal of Bacteriology. 189 (9), 3603-3612 (2007).
- Kuchma, S. L., et al. Cyclic-di-GMP-mediated repression of swarming motility by Pseudomonas aeruginosa.: the pilY1. gene and its impact on surface-associated behaviors. J Bacteriol. 192 (12), 2950-2964 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved