A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
איתור של Exosomal ביומרקר על ידי שחרור מושרה שדה חשמלי ומדידה (EFIRM)
In This Article
Erratum Notice
Summary
Exosomes are microvesicular structures found within biofluids that potentially carry important disease discriminatory biomarkers. Here, a novel method is used to specifically extract exosomes and rapidly test the exosomal cargo for both RNA/protein targets following the disruption of exosomes using non-uniform electric cyclic square waves.
Abstract
Exosomes הם מבני microvesicular שמשחקים תפקיד מתווך בתקשורת בין תאית. זה עניין ללמוד את המטען הפנימי של exosomes כדי לקבוע אם הם נושאים סמנים ביולוגיים מפלים מחלה. לביצוע ניתוח exosomal, יש צורך לפתח שיטה להפקת וניתוח exosomes מbiofluids היעד מבלי לפגוע בתוכן הפנימי.
שחרור חשמלי הנוצר על-שדה והמדידה (EFIRM) הוא שיטה לחילוץ במיוחד exosomes מbiofluids, לפרוק את מטענם, ובדיקת תוכן RNA / החלבון הפנימי שלהם. באמצעות microparticle נוגדן אנטי אנושי CD63 הספציפי מגנטי, exosomes הם זירז ראשון מbiofluids. החילוץ הבא, גלי מתח נמוך חשמליים מחזוריים מרובעים (CSW) מיושמים לשבש את קרום לפוחי ולגרום לפריקת מטען. התוכן של exosome הוא הכלאה לפריימרים DNA או נוגדנים משותקים על פני האלקטרודה לקואהntification של תוכן מולקולרי.
שיטת EFIRM יש יתרון להפקת exosomes ומטען פורק לניתוח ללא חיץ תמוגה. שיטה זו היא מסוגלת לבצע זיהוי ספציפי של שני מטרות RNA וחלבון סמן ביולוגי בexosome. EFIRM תמציות exosomes במיוחד המבוסס על סמני פני השטח שלהם בניגוד לטכניקות המבוסס על גודל.
במיקרוסקופ אלקטרונים הילוכים (TEM) וassay להדגים את הפונקציונליות של השיטה עבור לכידת exosome וניתוח. שיטת EFIRM הייתה מוחלת על exosomal ניתוח של 9 עכברים הוזרקו תאי H640 סרטן ריאות אנושיות (שורת תאי transfected להביע את סמן exosome CD63-GFP אדם) על מנת לבדוק את פרופיל exosome נגד 11 עכברים שקבלו בקרות מלוחה. רמות הגבוהות של סמנים ביולוגיים exosomal (GAPDH גן ההתייחסות וסמן פני חלבון האנושי CD63-GFP) נמצאו עבור H640 הזריק עכברים בשתי דגימות הסרום ורוק. יתר על כן, saliva ודגימות סרום הוכיחו שיש ליניאריות (R = 0.79). תוצאות אלה מרמזות ליכולת הקיום של סמנים ביולוגיים exosome רוק לגילוי המחלות דיסטלי.
Introduction
מחקר Exosome הוא תחום מתפתח של חקירה הבוחן microvesicles שומנים שנושאים 1 RNA, DNA 2, וחלבון 3 מטענים. חקירות קודמות של הביולוגיה exosome הובילו לזיהוי של exosomes בbiofluids כגון דם 4, 5 שתן, שד חלב 6, ורוק 7. מחקרים הוכיחו כי exosomes לשחק תפקיד במסלולים סלולריים שונים, מרחוק המדיטציה תקשורת בין מערכות הגוף שונות 8. בגלל התפקיד exosomes לשחק בתקשורת בין תאית, זה השערה הוא שהם עשויים לארוז מטרות biomolecule (חלבון, RNA, ו- DNA) מתואמות עם מצבי מחלה. במבחנה 3 ובעלי חי מודל 9 מחקרים מופיעים לאשש השערה זו. בחקירת תוכן exosomal לגילוי סמן ביולוגי, יש צורך לפתח מתודולוגיה לבידוד exosome סלקטיבית מbiofluids expulsi המושרה,על מטענים מexosomes, וכימות של מולקולות ביולוגיות exosome. במידה על עבודה זו, exosomes יוגדר כמבנה בעל קוטר של כ 70-100 ננומטר והוא בעל CD63 סמן משטח.
חוקרים בדרך כלל לטהר ראשון exosomes ידי ultracentrifugation 10 ולאחר מכן לעבד תוכן exosomal באמצעות השימוש בערכות מאגר תמוגה. שימוש בשיטות מאגר תמוגה דורשת פעמים דגירה נעות בין כמה דקות לכמה שעות. תהליך זה עשוי לגרום הניזק למטען exosome ולהוביל לטעום השפלה. לדוגמא, RNA exosome רוק שוחרר באמצעות מאגר תמוגה לסביבת חוץ-התאית המקיפה בעל זמן מחצית חיים של מתחת 1 דקות, מה שהופך את המדידה של RNA exosomal פוסט-תמוגה חיץ משימה קשה במיוחד ללא התוספת של חומרים כימיים ייצוב 11. ההשפעה מורכבת של הוספת חומרים כימיים שונים לתמוגה וייצוב עשויה להציג את הסוכנים שלסבך ולהפריע לanalysis של תוכן exosomal. גישה חלופית עשויה להיות מועילה למהירות פריקת תוכן exosomal ושמירה על המטען לאפיון בצורה בטוחה.
בעבודה זו, אנו מציעים את השימוש בשדה חשמלי לא אחיד לשחרורו של תוכן exosomal. חשמליים-שדות כבר ידועים לשאת את היכולת לקטב ולשבש את bilayer השומנים שיוצר קרום תא. העבודה הניסויית שלנו בוחנת שימוש בגלים מרובעים מחזוריים לא אחידים (CSW) לשיבוש מבנה microvesicle של exosomes ושחרור מטען בוצע. שיטה זו משתמשת במתחים בטווח מאה millivolt כמה, מה שאומר שרוב המולקולות ביולוגיות לא תופרענה. אנו מראים כי השימוש בגל מחזורי מרובע הוא מסוגל להניע שחרורו של תוכן mRNA exosome הרוק לסביבת fluidic שמסביב. גרסה זו של תוכן exosomal משולבת בצורה חלקה עם מערכת אלקטרודה שיכול לשמש כדי לכמת את רמות ביטוי הסמן הביולוגי 12,13. שיטה מוצעת זו מאפשרת ולניתוח מהירים, רגישים, מאגר תמוגה ללא תוכן exosome.

איור 1. סקירה כללית של EFIRM Workflow.. שיטת EFIRM מחולקת באופן כללי לשלושה שלבים עיקריים הנדרשים לטיהור וexosomes ניתוח.
שיטת תוכן exosomal שחרור וניתוח זה CSW מבוסס משמשת יחד עם microbeads המגנטי CD63 הספציפי לבידוד exosome. חרוזים CD63-זיקה אלה מאפשרים לבידוד סלקטיבי של exosomes מדגימות רוק (וbiofluids האחר). לאחר דגירה והפקת exosomes באמצעות חרוזים מגנטיים, החרוזים היגרו למערכת החיישנים אלקטרוכימיים לCSW תוכן שחרור וחלק ניתוח של הניסוי מבוסס. איור 1 נותן סקירה כללית של העבודהזרימה של שיטת EFIRM.
Protocol
1. הפקת Exosome מבוססת חרוז מגנטית
- פיפטה פתרון מעורב היטב של 5 μl של microparticles המגנטי מצופה streptavidin לμl 495 של חיץ פוספט שנאגרו מלוח (PBS) בצינור microcentrifuge כדי resuspend את החרוזים. לשטוף וresuspend החרוזים עם 500 μl של PBS שלוש פעמים באמצעות מתלה מגנטית. המדף הוא מערך של מגנטים בצד של יחידת דיור שיכול להחזיק את צינורות microcentrifuge המדגם.
- לכל שטיפה, בואו ראשון הצינורות לשבת על מדף דקות 1, ולאחר מכן להשתמש קצה פיפטה כדי להסיר את חיץ supernatant בזהירות מבלי להפריע חרוזים.
- מניחים את הצינורות על מדף רגיל ללא מגנטים בצד. הוסף 500 μl של PBS לתוך הצינורות, ולהשתמש בפיפטה לערבב את הפתרון וחרוזים יחד. ואז לשים את הצינורות בחזרה על המדף המגנטי להפריד שוב את החרוזים מהפתרון.
- בצע הסר זו של חיץ באמצעות מגנוט וresuspension בPBSסך הכל שלוש פעמים. זה מבצע שטיפה ראשונית של החלקיקים המגנטיים.
- Resuspend חרוזים לμl 490 של חיץ PBS, עם הצינור שהונח על החלק הלא-ממוגנט של המתלה המגנטית. Pipet 5 μl של נוגדן CD63 אנטי אנושי בעכבר biotinylated ב1.0 מ"ג / מיליליטר ריכוז המניה לתוך התערובת של חרוזים. השתמש פיפטה לערבב חרוזים ונוגדן בתמיסה.
- מניחים את צינורות microcentrifuge עם חרוז ותערובת נוגדני biotinylated על הכתף מדגם. הגדר את הפרמטרים המסובבים למסובבי מדגם לסיבוב גומלין ב 90 מעלות הטיה במשך 5 שניות ורוטטות בשעה 5 מעלות לשנייה 1. סובב את צינורות תערובת מדגם-חרוז בפרמטרים אלה למשך 30 דקות ב RT.
- הסר נוגדן מאוגד לאחר הצמידה.
- בעקבות 30 דקות של סיבוב ב RT, למקם את הצינורות בחזרה במעמד המגנטי במשך 5 דקות.
- בצע שלושה שוטף של חרוזים על ידי הסרת השלב הנוזלי באמצעות micropipette ולשטוף עם 500 μ; L של PBS. לאחר לשטוף המשולש, resuspend את החרוזים ב490 μl של קזאין-PBS ומניחים על חלק unmagnetized של המתלה.
- חילוץ Exosome באמצעות חרוזים מצופים נוגדן.
- לייבל כל צינור עם זיהוי מדגם ממוקד. פיפטה מדגם 10 μl של סרום או רוק לתוך צינור microcentrifuge. השתמש פיפטה לערבב מדגם וחרוזים מגנטיים על ידי pipetting מספר פעמים.
- מניחים את הצינורות עם מדגם ואנטי-אנושי חרוזים נוגדן CD63 על הכתף ולסובב לשעה 2 ב RT. השתמש באותם פרמטרים המסובבים כמתואר בשלב 1.2.
- בעקבות 2 שעות של מדגם מסתובב, לבצע שטיפה משולשת על ידי ממגנט לחרוזים נפרדים מפתרון, הסרת שלב נוזלי עם micropipette, וresuspending חרוזים ב500 μl של חיץ טריס-HCl. חרוזים התוצאה כעת חייבים exosomes ומוכנים לשחרור השדה החשמלי והמדידה.
2. שדה המושרה חשמלי פורסםnd מדידה של תוכן Exosomal
- Precoating הראשוני של אלקטרודה עם GADPH פריימר
- החל פלסטיק גם למערך אלקטרודות כדי למנוע זיהום צולב של אלקטרודות בודדות. לצורך ניסוי זה, להשתמש במערך אלקטרודות 16 חיישן עם כל אלקטרודה יחידה במערך המורכב של עבודה, דלפק, והאלקטרודה התייחסות עשויה זהב חשוף.
- הכן תערובת מניות של 100 ננומטר בדיקה DNA, 0.3 M KCl, ופירול 10 מ"מ על ידי pipetting ריאגנטים המניה לתוך צינור עם מים מזוקקים ultrapure. מערבבים היטב על ידי vortexing.
הערה: במחקר זה, הבדיקה DNA שנבחרה מתאימה לגן התייחסות GAPDH, שידוע שקיים בתוך exosomes. רצף הבדיקה המשמש הוא: 5'-ביוטין-AGGTCCACCACTGACACGTTG-3 ". השתמש את התערובת על כל האלקטרודות. - Pipet 60 μl של תערובת הבדיקה מונומר-DNA על פני השטח של כל אלקטרודה זהב. לבחון את האלקטרודות על מנת להבטיח שיש כיסוי הולם של העבודה, גounter, והתייחסות אלקטרודות על ידי התערובת הנוזלית.
- תערובת מונומר-הבדיקה Electropolymerize כדי ליצור שכבת פולימר ניצוח על פני האלקטרודה על ידי יישום פרופיל שדה מחזורי גל מרובע (CSW) חשמלי על פני השטח האלקטרודה. שדה חשמלי זה מורכב מהחלת 350 mV ל9 שניות ומייד עובר לmV 950 עבור 1 שניות. החל פרופיל גל זה מחזורי מרובע לאלקטרודה במשך 10 מחזורים, עבור הסכום כולל של של שדה חשמלי הוחל 100 שניות.
- יש לשטוף את משטח חיישן 3 פעמים עם מים ויבשים עם גז חנקן מזוקקים כדי להסיר נוזל מפני שטח של האלקטרודה. ודא נוזל שהוסר כראוי מן האלקטרודה.
- פריקת המטענים Exosome
- עומס 5 μl של 1 מיקרומטר של בדיקה גלאים לμl 495 מהתערובת המורכבת חרוז-exosome ולהשתמש פיפטה לערבב.
הערה: הבדיקה הגלאים היא רצף DNA פריימר המוצמד למולקולה והעמסת בסוף '3. Prob הגלאירצף דואר המשמש למחקר זה תואם את mRNA GAPDH נמצא בתוך exosomes. הרצף של חללית גלאי מצומדות והעמסת הוא: 5'-GCAGTGGGGACACGGAAGGCC-והעמסת-3 ". - פיפטה 60 μl של החללית ותערובת מורכבת חרוז-exosome על פני האלקטרודה זהב עם מערך מגנט מתחת. מערך מגנט זה מורכב משישה עשר 2.54 המגנטים ניאודימיום מ"מ הקוטר מיושרים למתאימות לאלקטרודות העבודה של החיישן. איור 2 א ממחיש את המיקום של המגנטים ופתרון חרוז-exosome.
- ברגע שהמדגם נטען על פני האלקטרודה, תחול 20 מחזורים של השדה החשמלי CSW עם 9 שניות ב-300 mV ושניות 1 ב+200 mV (200 סך הכל שניות). מטען exosomal כי הוא שוחרר יהיה להכליא פריימרים על פני השטח של האלקטרודה. אם סמנים של exosome פני השטח הם נושא החקירה, לדלג חלק זה של הניסוי. איור 2 מדגים את התהליך הזה.
- Wash-off analytes מאוגד על פני האלקטרודה על ידי משולש שטיפה פני האלקטרודה במים מזוקקים. ייבש את האלקטרודה עם גז חנקן.
- עומס 5 μl של 1 מיקרומטר של בדיקה גלאים לμl 495 מהתערובת המורכבת חרוז-exosome ולהשתמש פיפטה לערבב.
- כתב נוגדנים וReadout
- הוסף 60 μl של 150 יחידה / נוגדן אנטי והעמסת מיליליטר מוצמד לperoxidase חזרת (HRP ב 1: 1,000 דילול) בדילול מלא בקזאין / PBS.
- השתמש בנטייה מונעת חשמלי-שדה לHRP אנטי-והעמסת המורכבת לכריך הבדיקה. החל -200 mV עבור 1 שניות וmV 500 עבור 1 שניות במשך 5 מחזורים למשטח אלקטרודה. איור 2A מציג את מתחמי בדיקה לכידה וגלאי עבור שתי מערכת חומצות גרעין חלבון ו.
- משטח חיישן לשטוף Triple שימוש במים ויבשים עם גז חנקן מזוקקים.
- בעקבות לשטוף פעמי של נוגדן אנטי והעמסת עודף מאוגד, להוסיף 60 μl של Tetramethylbenzidine 5,5'-מצע 3,3 ', (TMB). לטעון המצע הזה לכל משטח חיישן באמצעות pipet רב ערוצית.
- לבצע קריאת אמפרומטריים של הנוכחי על ידי המדידה הנוכחית אלקטרודה ב-200 mV עבור 60 שניות באמצעות potentiostat אלקטרוכימיים מסוגל מדידה בו זמנית של 16 ערוצים. איור 2C הוא דוגמא לפרופיל הנוכחי במהלך קריאה.
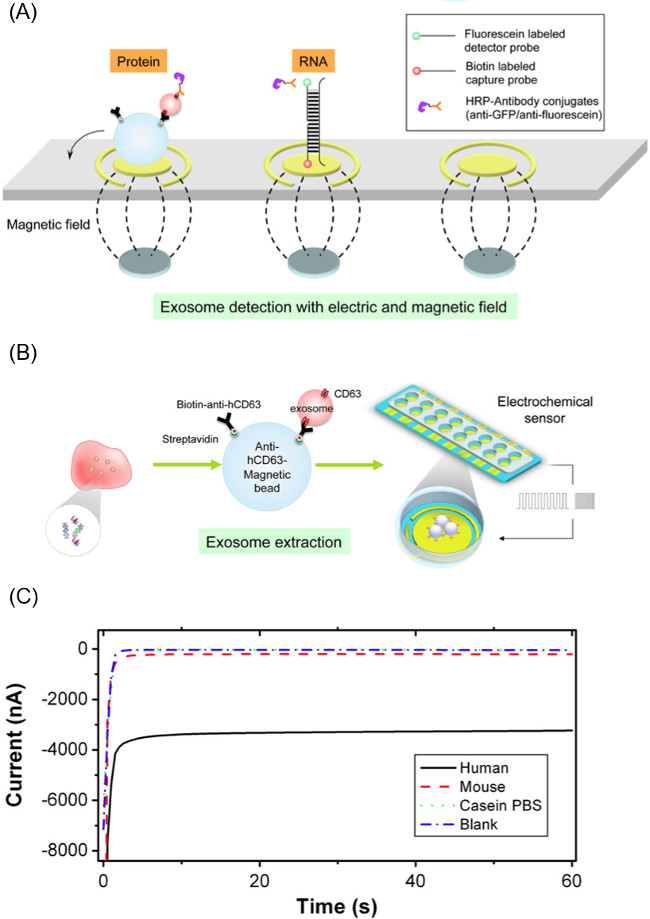
איור 2. רכיבים של EFIRM שיטה. () שיטה של חילוץ exosomes מBiofluid באמצעות microparticles המגנטי CD63 אנטי אנושי מצופה ולאחר מכן לפרוק את מטען exosome באמצעות גלים מרובעים מחזוריים להחיל מורכב חלקיקים-exosome. Scheme (B) של biosensor אלקטרודה המשמש לאיתור מטרות RNA / DNA / חלבון מexosome שוחרר. דוגמא מייצגת של קריאת אמפרומטריים מהמתודולוגיה EFIRM, (ג) שבו גודל נוכחי גדול יותר מתאים to רמות גבוהות יותר של biomolecule. נתון זה הוא מאל ויי et. 14 אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
תוצאות
אימות של לכידת Exosome של החרוזים באמצעות TEM
בידוד של exosomes מרוק באמצעות חרוזים מגנטיים CD63 אנטי אנושיים קבל תוקף בעקבות פרוטוקול חילוץ באמצעות מיקרוסקופ אלקטרונים הילוכים תמונות (TEM). TEM תערוכות חרוזים מגנטיים עם 70-100 גרגירים ...
Discussion
מאחר שהתוצאות מצביעות, חלקיקים מגנטיים CD63 אנטי אנושי מצופה יכולים ללכוד חלקיקים קטנים במיוחד שיש לי גודל הנע 70-100 ננומטר. חלקיקים שנתפסו זה עולה בקנה אחד עם הפרופיל שנצפה קודם לכן של exosomes. יתר על כן, השימוש בCSW המתח הנמוך בעקבות לכידתו של החלקיקים מוצג כדי להסיר אותם ממ...
Disclosures
דוד וונג הוא מייסד שותף של RNAmeTRIX Inc, חברת אבחון מולקולרית. PeriRx LLC רישוי משנה קניין רוחני הנוגע לאבחון מולקולרי מRNAmeTRIX. דוד וונג הוא יועץ לPeriRx.
Acknowledgements
עבודה זו נתמכה על ידי המרכז הלאומי למשאבי מחקר והמרכז הלאומי לקידום מדעי Translational, המכונים לאומי לבריאות, דרך גרנט UL1TR000124 (לFW); פליקס ומילדרד ייפ נתרמו Professorship וקרן משפחת בארנס (לDTWW), המכון הלאומי למחקר דנטלי וCraniofacial של המכון הלאומי לבריאות במספר פרס T90DE022734 (לMT). התוכן הוא באחריות בלעדית של הכותבים ולא בהכרח מייצג את הדעות הרשמיות של המכון הלאומי לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| Helios 16-Channel Reader System with Chip Interface | Genefluidics, USA | RS-1000-16 | |
| 16x Sensor Chip, Bare Gold, pack of 5 chips | Genefluidics, USA | SC1000-16X-B | |
| Biotinylated anti-human CD63 Antibody | Ancell, USA | 215-030 | |
| Dynabeads MyOne Streptavidin T1 | Invitrogen, USA | 65601 | |
| Neodynium Magnetics (1/10" dia. x 1/32" thick) | K&J Magnetics, USA | DH101 | |
| Ultrapure Distilled Water | Life Technologies, USA | 10977-023 | |
| Mettler Toldeo 3 M KCl Solution | Fisher Scientific, USA | 1911512 | |
| Pyrrole | Sigma-Aldrich, USA | W338605-100g | |
| Anti-Fluorescein-POD, Fab fragments | Roche, Germany | 11426346910 | |
| 3,3′,5,5′-tetramethylbenzidine substrate (TMB/H2O2, low activity) | Neogen, Usa | 330175 | |
| Phosphate Buffered Saline Solution | Life Technologies, USA | 10010023 | |
| Casein/PBS | Fisher Scientific, USA | 37532 |
References
- Rabinowits, G., Gerçel-Taylor, C., Day, J. M., Taylor, D. D., Kloecker, G. H. Exosomal MicroRNA: A Diagnostic Marker for Lung Cancer. Clinical Lung Cancer. 10 (1), 42-46 (2009).
- Thakur, B. K., et al. Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Research. 24 (6), 766-769 (2014).
- Lau, C. S., Wong, D. T. W. Breast Cancer Exosome-like Microvesicles and Salivary Gland Cells Interplay Alters Salivary Gland Cell-Derived Exosome-like Microvesicles In. Vitro. PLoS ONE. 7 (3), e33037 (2012).
- Bala, S., et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatolog. 56 (5), 1946-1957 (2012).
- Dear, J. W., Street, J. M., Bailey, M. A. Urinary exosomes: A reservoir for biomarker discovery and potential mediators of intrarenal signalling. Proteomics. 13 (10-11), 1572-1580 (2013).
- Lässer, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9 (1), 9 (2011).
- Palanisamy, V., et al. Nanostructural and Transcriptomic Analyses of Human Saliva Derived Exosomes. PLoS ONE. 5 (1), e8577 (2010).
- Camussi, G., et al. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney International. 78 (9), 838-848 (2010).
- Lau, C., et al. Role of pancreatic cancer-derived exosomes in salivary biomarker development. The Journal of Biological Chemistry. 288 (37), 26888-26897 (2013).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and Characterization of Exosomes from Cell Culture Supernatants and Biological Fluids. Current Protocols in Cell Biology. 3 (22), (2001).
- Park, N. J., Li, Y., Yu, T., Brinkman, B. M. N., Wong, D. T. Characterization of RNA in Saliva. Clinical Chemistry. 52 (6), 988-994 (2006).
- Wei, F., et al. Bio/Abiotic Interface Constructed from Nanoscale DNA Dendrimer and Conducting Polymer for Ultrasensitive Biomolecular Diagnosis. Small. 5 (15), 1784-1790 (2009).
- Wei, F., et al. Electrochemical Sensor for Multiplex Biomarkers Detection. Clinical Cancer Research. 15 (13), 4446-4452 (2009).
- Wei, F., Yang, J., Wong, D. T. W. Detection of exosomal biomarker by electric field-induced release and measurement (EFIRM). Biosensors and Bioelectronics. 44, 115-121 (2013).
Erratum
Formal Correction: Errata: Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM)
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM). The disclosures were updated.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved