Method Article
Microchambers agarose לסידן הדמיה לטווח ארוך של
In This Article
Summary
Imaging behavior and neural activity over long time scales without immobilization of the animal is a prerequisite to understand behavior. Agarose microfluidic chambers imaging (AMI) can be used to image neural activity and behavior for all life stages of Caenorhabditis elegans.
Abstract
ההתנהגות נשלטת על ידי מערכת העצבים. סידן הדמיה היא שיטה פשוטה בנמטודות השקופה Caenorhabditis elegans כדי למדוד את הפעילות של תאי עצב בהתנהגויות שונות. כדי לקשר בין פעילות עצבית בהתנהגות, בעלי החיים לא צריכים להיות משותקים אבל צריך להיות מסוגל לנוע. שינויים התנהגותיים רבים מתרחשים במהלך קשקשי זמן רבים ודורשים הקלטה על שעות רבות של התנהגות. זה גם עושה את זה הכרחי לתרבות התולעים בנוכחות מזון. איך יכולים להיות מתורבתים תולעים והפעילות העצבית שלהם צילמו על סולמות זמן רבים? Agarose Microchamber ההדמיה (AMI) פותחה בעבר לתרבות ולבחון זחלים קטנים ועכשיו הותאמה ללמוד את כל שלבי החיים המוקדם מL1 עד שלב הבוגר של ג elegans. ניתן לבצע AMI בשלבי חיים שונים של ג elegans. ההדמיה סידן לטווח ארוך מושגת בלי לשתק את בעלי החיים על ידי שימוש בחשיפות קצרה מופעלות חיצוני comתקופות- עם אלקטרון הכפלת הקלטת מכשיר מצלמה (EMCCD) תשלום מצמידים. להתרחק או סריקה יכולה בהיקף של עד בשיטה זו כדי תמונה עד 40 תולעים במקביל. לפיכך, שיטה מתוארת לתמונת התנהגות ופעילות עצבית על סולמות זמן רבים בכל שלבי החיים של ג elegans.
Introduction
Caenorhabditis elegans has been established as a model system to study behavior1. Due to its amenability to genetics, the molecular and cellular mechanisms underlying behavior can be studied. Many behaviors occur on long time scales. Two principal approaches can be used to observe motile animals over long time scales. The first approach is following the animal during movement using an automated stage or camera2-8 and the second is to restrict the movement to a range that is at least as small as the field of view of the camera9-14. Both methods have their advantages. Tracking allows following an animal over long spatial ranges but limits the number of animals that can be discerned in one experiment. Restricting the movement of the animals allows scaling up the observation to many individuals at the same time by using arrays of restricted compartments.
Because the nematode is transparent, live fluorescent imaging can be performed non-invasively15. Calcium imaging provides a functional readout for the activity of excitable cells and is established for C. elegans16-20. Calcium enters the cell via channels in the plasma membrane that open upon depolarization. Thus, calcium acts as a proxy for neural activity. Calcium sensors can be grouped in two major classes, ratiometric and non-ratiometric sensors. Both classes employ conformational changes of calcium-binding proteins induced upon binding of calcium. Ratiometric sensors contain two fluorescent proteins. When the lower-wavelength fluorescent protein is excited, a part of the light energy is transmitted to the higher wavelength fluorescent protein as a function of their distance in a process called Fluorescence Resonance Energy Transfer or Förster Resonance Energy Transfer (FRET)21. Non-ratiometric sensors are based on circularly permuted GFP and employ de-quenching of the fluorophore caused by calcium binding22. Each class has its advantages. While ratiometric sensors are less sensitive to movement or expression artifacts, non-ratiometric sensors typically have a higher dynamic range. Both ratiometric and non-ratiometric sensors have been useful to study the activity of excitable cells in C. elegans16-20,23,24.
When doing long-term fluorescence imaging, the experimenter will have to deal with several potential challenges: 1. Disturbance of behavior through excitation light: Worms are sensitive to short-wavelength fluorescence excitation light and avoid light from the violet to blue range that is used for calcium imaging25,26. Worms respond with either a backward or a forward escape response25,26. Thus, the amount of light needs to be controlled. 2. Bleaching of the fluorescent sensor protein: Often, bleaching of the fluorescent protein hampers long-term imaging. Typically, however, light intensities that are needed to observe bleaching are higher than the light intensities that cause disturbing effects on the behavior of the animals. Thus, bleaching is only a theoretical problem in this type of calcium imaging. 3. Worms inside the microchambers are not fixed and move constantly during wake behavior and images may appear blurred if the worm is not immobilized. All these challenges can be solved using extremely short exposure times with low light intensity. This can be realized by using a highly sensitive EMCCD camera with short exposure times and external triggering of a light emitting diode (LED). To expose the worms to the illumination light as briefly as possible (only during the exposure time of the camera) the LED is externally triggered using a transistor-transistor logic (TTL) signal that the camera emits during exposure resulting in an illumination of the worm for precisely the time the camera chip is exposed. This also means that the EMCCD chip will be dark during data readout, which is optimal for readout performance of this chip.
Previously, agarose microchambers have been developed for long-term fluorescence imaging of C. elegans larvae9. Here, it is described how agarose micro-chambers can be used for long-term calcium imaging for any life stage of C. elegans, how calcium imaging can be performed, and how this method can be upscaled to assay many individual worms in parallel.
Protocol
1. מכשירים, תרבות מדיה, ומנות
- שימוש במיקרוסקופ, כי הוא מסוגל לשמור על המדגם בפוקוס וכי הוא מצויד בשלב אוטומטי. לבנות דוד מכסה מחוייט או לרכוש פתרון מסחרי. הגדרת LED-EMCCD מערכת מצלמה שבחשיפה של המצלמה מתעוררת בי LED תאורה באמצעות אות TTL באמצעות הוראות יצרן.
הערה: ראה דיון לפרטים. - Polydimethylsiloxan בולים (PDMS):
- לפברק בולי PDMS במתקן מיקרופלואידיקה או יש לי בולי PDMS המיוצרים על ידי יציקה מסחרית. כדי להשתמש ביציקה מסחרית, לשלוח קובץ AutoCAD לחברה ולציין את העומק (15 מיקרומטר, למשל) של המכשיר. לאחר לידה מבית היציקה, לחתוך את שבב PDMS לבולים שלה 16 באמצעות אזמל.
- בונד כל חותמת פרט לשקופית זכוכית באמצעות פלזמה אוויר. עבור מליטה, לחשוף גם את חותמת PDMS ואת שקופיות זכוכית לפלזמת אוויר לדקות התקף 1 (באמצעות הגדרות הפלזמה הגבוהות ביותר ברמה של 0.5 mbar). ודא שהמשטחים למליטת הפנים כלפי מעלה במהלך טיפול פלזמה. לאחר מכן, הנח את חותמת PDMS לשקופית הזכוכית.
- קח צלחת תחתית 3.5 סנטימטר ולחתוך את אזור כיכר של 18 x 18 מ"מ מהמרכז התחתון של המנה באמצעות מכונת כרסום אנכית וחותכים סיבוביים חדים. השתמש מהירות סיבוב נמוכה של הלהב והאכלה איטית כדי למנוע מהפלסטיק נמס בשל חום המיוצר על ידי חיכוך. הכן כמה מנות בבת אחת.
הערה: צלחת התחתית ניתן לעשות שימוש חוזר פעמים רבות לאחר הניסוי אם הוא ניקה אחרי השרייה בO אתנול הטהור / N. - Agarose:
- לפזר agarose נקודה גבוה היתוך 3 גרם ב -100 מיליליטר S-סל (5.85 גרם NaCl, 1 גרם K 2 4 HPO, 6 גרם KH 2 PO 4, כולסטרול מיליליטר 1 (5 מ"ג / מיליליטר אתנול), H 2 O ל 1 L, לעקר ידי מעוקר) על ידי הרתחה. הפוך aliquots של מומס agarose ב 2 מיליליטר צינורות Eppendorf וstorדואר. כמו כן, להכין את קבוצה של agarose נקודת התכה נמוכה באותה הדרך בדיוק כפי שagarose הנקודה גבוה ההיתוך.
- לפני שימוש, מקום 3 aliquots של נקודה גבוהה היתוך agarose על בלוק חימום ב 95 - C ° 98. לפני שימוש, מקום אחד aliquot של נקודת התכה נמוכה agarose על בלוק חימום ב95-98 מעלות צלזיוס עד שהוא נמס ולאחר מכן על בלוק חימום ב30-35 מעלות צלזיוס.
2. בחירה של בעלי חיים
- לגדול תולעים בצפיפות נמוכה על צלחות NGM זרע להשיג חיות נקיות. ודא שיש שפע של מזון וכמה בעלי חיים רק על הצלחת.
- לזחלי L1 הדמיה, להעביר כ -30 ביצים המכילות עובר בשלב הכעך על צלחת NGM זרע טרי. להעברת שלבים מאוחר יותר זחל או ג הבוגר elegans, להעביר כ -30 תולעים על צלחת NGM זרע טרי.
3. הכנת Microchambers Agarose
- הכנת המנה:
- קח צלחת פלסטיק עם פתח מרובע של 18 x 18 מ"מ בתחתית ומניח אותו במהופך עם הפתיחה כלפי מעלה. סגור את הפתיחה על ידי הצבת חתיכת הסרט דביק-צדדי כפול של 20 x 20 מ"מ על הפתיחה. הפעל את המנה סביב כך שהסרט הדביק הוא בתחתית ומניח את הצלחת על משטח קשה. חותך את הפתיחה חופשית באמצעות אזמל.
- בעזרת פיפטה P1000, למלא 2 מיליליטר של 3% agarose נקודה גבוה היתוך בS-סל לתוך הצלחת. מניחים את agarose על האזור המקיף את הפתח ולתת לחזק. חכה עד agarose הוא מוצק.
- להסתובב הצלחת ולקלף את סרט מגן המכסה את הקלטת דו צדדי הדביקה, כך שהצד הדביק יישאר על הצלחת ויהיה חשוף.
הערה: כתוצאה מכך, טבעת יפה של סרט דביק תקיף מחוץ לפתיחה. Agarose משמש כמאגר לחות שמאוחר יותר יהיה להקיף את המדגם.
- יציקה של microchambers:
- לחשוף המשטח PDMS דואר ליציקה עם פלזמה אוויר למשך 20 - 60 שניות.
הערה: טיפול פלזמה זה הופך את פני השטח PDMS הידרופילי, המונע את הלכידה של בועות אוויר ומייצר הדפסים חדים יותר. - לבנות שני מפרידי של גובה שווה על ידי לערום 5-9 שקופיות זכוכית. מקום, במקביל לצדם הארוך, ערימת spacer הראשונה, אז שקופית יחידת זכוכית, ואז שוב ערימת spacer. מניחים את שקף הזכוכית המכיל את חותמת PDMS orthogonally פני מפרידי. התאם את הגובה של מפרידי, כך שיש מרחב של כ -1.5 מ"מ בין משטח דפוס של בול PDMS ואת שקופיות זכוכית היחידה.
- מניחים ירידה של agarose נקודה החם הנוזלי גבוה היתוך לשקופית כוס אחת ליד חותמת PDMS ומהירות להחליק PDMS להחתים אנכי לתוך agarose הנוזלי. בואו agarose לחזק. בדוק שהוא מקבל מראה אטום, אשר בדרך כלל לוקח בערך 2 דקות. לשלוף את החותמת אנכית עם מהלך אחד.
הערה: זה נוח לGLUE spacer מחליק יחד עם קלטת דו צדדי דביקה. התנועה האנכית של הבול מונעת בועות אוויר מנלכדה בagarose.
- לחשוף המשטח PDMS דואר ליציקה עם פלזמה אוויר למשך 20 - 60 שניות.
- העבר את הביצים או התולעים יחד עם OP50 חיידקים על גבי agarose באמצעות בחירת חוט פלטינה עדינה. להפיץ ביצה אחת או תולעת אחד לתא יחד עם מזון באמצעות עפעף. מלא כ -30 ביצים על משטח אחד agarose.
- חותך את לוח agarose מכיל microchambers מולא בריבוע של 15 x 15 מ"מ על כך שיתאים בצורה יפה בפתיחה של המנה. להרים את לוח agarose המרובע עם מלקחיים ומניחים אותו במהופך על coverslip זכוכית של 20 x 20 מ"מ. ירדו פעם אחת, לא להרים אותו שוב או להחליק אותו מסביב כי זה עלול לגרום לחיידקים והתולעים שדחפו את התאים שלהם.
- עצרת של המנה:
- מניחים את coverslip הזכוכית על פתיחת צלחת הפלסטיק. לחץ בעדינות את coverslip הזכוכית על הטבעת עשויה מקלטת דו צדדי דביקה.יש להיזהר שלא לשבור את הכוס.
- הפעל את הצלחת הפוכה ולהשתמש פיפטה P1000 כדי למלא את הפער בין הלוח אגר המכיל microchambers ומאגר agarose עם agarose נקודת התכה נמוכה נוזל מקורר לכ -30 מעלות צלזיוס. חכה עד agarose יש הקרושה.
- חותם את הצלחת עם מכסה. עבור מיקרוסקופים הפוכים להשתמש מכסה מחומם. עבור מיקרוסקופים זקופים להשתמש מכסה רגיל ולאטום את הצלחת עם Parafilm.
- לאחר שסיימתי את הכנת microchambers, לבדוק אותם תחת סטראו. המילוי הנכון הוא קריטי. ראה דיון לפרטים.
הדמיה 4. סידן
- השתמש זנים מהונדסים מבטא חיישני סידן מקודדים גנטי כגון HBR16 (goeIs5 [pnmr-1 :: SL1-GCaMP3.35-SL2 :: UNC-54-3'UTR, UNC-119 (+)]) 27.
- השתמש במיקרוסקופ מתחם מצויד לepifluorescence רחב בתחום. חבר את פלט TTL של המצלמה EMCCD לקלט TTL של LED, כך שכל פעם שהמצלמה מתעדת מסגרת המדגם יהיה מוארת. השתמש זמן חשיפה של כ -5 אלפיות שניים. השתמש רווח EM בטווח של 50 - 300.
- ציין ריצת סרט פרץ לשעה 24 בכל תולעת שצלמה כל 15 - 30 דקות הראשונות במשך 20 שניות עם דסק"ש, אז במשך 20 שניות עם הקרינה GFP להקליט GCaMP, ולאחר מכן לקחת תמונה סופית של אות mKate2 נלקח ל שליטה על רמות ביטוי. השתמש במסגרת שיעור של 2 / sec בכל פרץ.
- לבדיקת נתונים חזותית, להשתמש במפה בצבעים מלאכותיים כדי לשפר את הנראות של שינויים קטנים בעוצמת הקרינה. נתונים עלילת ניאון כΔF / F, עם F להיות ערך הבסיס הממוצע של הקרינה. ניתן למצוא תיאור מפורט של ניתוח נתונים סידן בספרות 20.
5. AMI המקביל של תולעים מרובים
- מניחים את הצלחת המכילה את microchambers על מיקרוסקופ, להתמקד במדגם ולעסוק autofocus. הגדר את פרוטוקול תוכנה כך שהמצלמה רוכשת פרץ של 40 מסגרות תמונה ב -20 שניות בכל חצי שעה למשך 24 שעות, שתגרומנה 1,920 מסגרות לתולעת, כמות סבירה של נתונים. להגדיר את הסריקה, כך שהוא מבקר בכל תולעת באמצעות הבמה. מטרה לצלם כ -30 תולעים בריצה אחת.
- תולעים מרובים תמונה על ידי התקרבות החוצה, כלומר, באמצעות הגדלה נמוכה. השתמש בהגדלה נמוכה כדי לכסות כמה microchambers עם שבב המצלמה ולצלם כמה microchambers הסמוך בו-זמנית. לאחר סיום רכישת תמונה, להפריד את הנתונים עבור כל תא בודד על ידי חיתוך אזור של עניין כיסוי חיה אחת.
- כדי להעריך במהירות את נתוני ניידות, להשתמש חיסור מסגרת 28-32.
6. שלבי חיים שונים של ההדמיה ג elegans
- השתמש microchambers agarose לכל שלבי החיים של ג elegans מL1 למבוגרים וdauers כולל. השתמש בממדי התא המתאימים לDIFשלבי החיים ferent שמוצגים בטבלה 1.
| שלב חיים | גודל תא | עומק הלשכה | זמן הקלטה טיפוסי | הגדלה |
| L1 | 190 x 190 מיקרומטר | 10 - 15 מיקרומטר | ביצה - אמצע L2 | 400X |
| L2 | 370 x 370 מיקרומטר | 15 מיקרומטר | ביצה - L3 | 200X |
| זחל dauer | 370 x 370 מיקרומטר | 25 מיקרומטר | 4 ימים | 200X |
| L3 | 700 x 700 מיקרומטר | 45 מיקרומטר | L2 - L4 | 200X |
| L4 | 700 x 700 מיקרומטר | 45 מיקרומטר | L4 הצעיר - מבוגרים צעירים | 100X |
| מבוגרים צעירים | 700 x 700 מיקרומטר | 45 מיקרומטר | 12-24 שעות | 100X |
טבלת 1. גדלי הלשכה לשלבי חיים שונים. מוצגים הם ממדי תא והגדלה כי הם שימושיים עבור שלבים שונים מותאמים לשבב מצלמה 8 x 8 מ"מ.
תוצאות
ניתן ליישם microchambers agarose לכל שלב בחיים של ג elegans. כפי שניתן לראות באיור 1 א, ניתן לצפות פיתוח זחל ושנת התנהגות במהלך lethargus L1. מוצגים הם בגדלים תא שהם 190 x 190 מיקרומטר, 10 מיקרומטר עמוקים. אם קשקשי זמן ארוכים יותר נדרשים, ניתן להשתמש בתאים גדולים יותר. כפי שניתן לראות באיור 1, באמצעות תא עם ממדים גדולים יותר (370 x 370 מיקרומטר, 25 מיקרומטר עמוקים) מאפשר פיתוח של ג elegans מביצה עד למבוגרים. תרשים 1C מציג ניתוח של שינויים ארוך טווח בהתנהגות באמצעות חיסור מסגרת של תולעת גדלה בתא מביצה עד למבוגרים. מוצגים הן עוצמות ממוצעים לאחר ניכוי מסגרת לפרצים נבחרו במהלך שרות וlethargus. נמוך העצימות הממוצעים לאחר ערכי חיסור המסגרת היא, נמוך הניידות של התולעת. מוצגים נבחרו עקבות פרץ ממצב בעקבות אחד ומצב lethargus אחד לכל שלב זחל.עלייה שנצפתה בעוצמה ממוצעת במהלך הפיתוח היא בעיקר בשל ניגוד וגודל מוגברים של בעלי החיים. 1D איור מראה זחל dauer, שלב חיים אלטרנטיבי שעוסק בתנאים סביבתיים שליליים 33 ב. גודל תא הוא 370 x 370 מיקרומטר, 15 מיקרומטר עמוקים. שים לב שזחל dauer הושם לתוך התא ללא חיידקים שבמזון, שיגרום יציאה מהשלב זחל dauer. איור 1E תערוכות תולעת בוגרת שכבר הטילה ביצים רבות לתוך התא. ממדי הלשכה משמשים למבוגרים היו 700 x 700 מיקרומטר, 45 מיקרומטר עמוקים. לבסוף, איור 1F תערוכות אנדרוגינוס מבוגר והזדווגות זכר בתוך תא בוגר.
סידן הדמיה בתולעים ניע אפשרית עם חיישני סידן GCaMP. איורים 2A, הדמיה סידן תכנית ב 'של הפקודה interneuron AVA לזחל L1 27. איורים 2C, D להראות פעילות סידן לsaשלי סוג של נוירון בבעלי חיים מבוגרים.
דרוג את הדמיה לטווח ארוכה הוא אפשרי על ידי סריקה ועל ידי התקרבות החוצה. איור 3 א מציג את איכות התמונה של הדמיה בו זמנית של 30 תולעים על שבב מצלמה אחת עם מצלמה 5 מגה פיקסל. איור 3 מציג את איכות התמונה של 4 תולעי סידן צילם בו זמנית.

איור 1. התאמת AMI לכל שלבי החיים של ג elegans. זחל () צילם מתחילת L1 עד השלב מוקדם בL2 190 x 190 מיקרומטר תאים. פיתוח (ב ') מביצה עד מבוגרים בחדר 370 x 370 מיקרומטר. (ג) ניידות של תולעת הוערכה באמצעות חיסור מסגרת. מוצגת היא עוצמת הממוצעת של כל התמונות של התמונה לאחר חיסור מסגרת לסרט פרץ נבחר אחד לכל STA זחלGE לבעקבות והתנהגות lethargus. (ד) זחל dauer בהיעדר מזון בתא מיקרומטר 370 x 370. אנדרוגינוס (ה) למבוגרים עם ביצים רבות הניחו לx 700 700 מיקרומטר קאמרי. (F) הזדווגות של זכר ואנדרוגינוס בתוך חדר 700 x 700 מיקרומטר. YA פירוש מבוגרים צעירים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
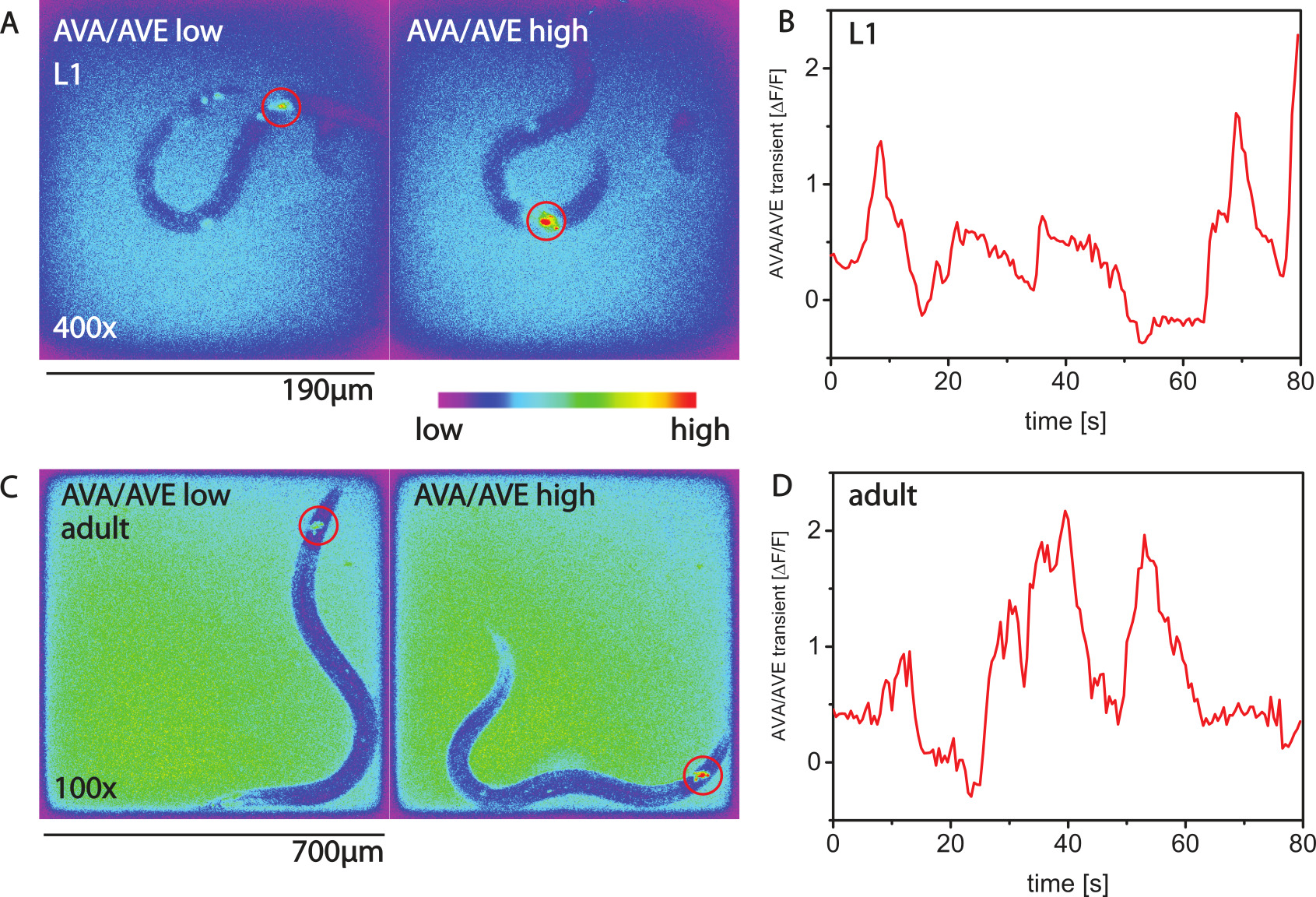
הדמיה איור 2. סידן עם עמי. () סידן הדמיה עם GCaMP3 בinterneuron פקודת AVA של זחלי L1 באמצעות האמרגן NMR-1. מוצגים הן שתי תמונות בצבעים מלאכותיים. בתמונה משמאל, הפעילות של AVA היא נמוכה והתולעת לא עושה תנועה לאחור. בתמונה מהימין הפעילות של AVA היא גבוהה והתולעת, הוא נע לאחור. ארעיים סידן (ב ') על פני זמן לתולעת L1. (C, D) ארעיים סידן בבעלי חיים מבוגרים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

תולעי איור 3. הדמיה מרובה במקביל על ידי התקרבות החוצה. () הדמיה סימולטני של 30 תולעי L1 לכל מסגרת באמצעות 190 x 190 מיקרומטר תאים והגדלה 100x (באמצעות מטרת 10X) ושבב מצלמה 16.6 x 14 מ"מ. הדמיה סימולטני של ארבעה תולעי L3 לכל מסגרת באמצעות 370 x 370 מיקרומטר תאים וההגדלה 100x ואזור של עניין של שבב מצלמה 16.6 x 14 מ"מ (B).et = "_ blank"> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
חומרה
המיקוד של מיקרוסקופ בדרך כלל ייסחף במהלך רכישת תמונה לטווח ארוך. עבור מיקרוסקופי מתחם, להתמקד-שמירת מערכות ניתן לרכוש מהיצרנים הגדולים מיקרוסקופ. במקרה מיקרוסקופ מתחם עם שליטת דגש הוא יקר מדי, חלופה פשוטה תהיה להשתמש סטראו. מיקרוסקופי מתחם לאפשר את השימוש ביעדים עם צמצם גבוה מספרי (NA) ויכולים להיות אוטומטיים בקלות. מטרות שמן 40X מתאימות גם. עדשות טבילה במים הן לא אידיאליים בגלל האידוי במהלך הדמיה לטווח ארוך. התערבות ההפרש לעומת זאת (DIC) יוצרת ניגוד נחמד שעוזר למעקב שינויים מורפולוגיים והתנהגות, אלא גם הדמיה שדה בהירה פשוטה ניתן להשתמש. לדסק"ש או הדמיה שדה בהירה, להשתמש באור אדום על ידי הצבת מסנן אור אדום לתוך נתיב Dia-הארת מיקרוסקופ. לסריקה של כמה microchambers שלב אוטומטי הוא הכרחי. הביצועים הטובים ביותר הוא AChieved כאשר שלב משמש שיש האצה והאטה קוי וניתן להגדיר את מהירות סריקה נמוכה כדי למנוע הפרעה לבעלי החיים במהלך סריקה. אנחנו לא נצפו תגובות התנהגותיות או עליית סידן בתאי עצב mechanosensitive (ALM וPLM) במהלך סריקה, המצביעות על כך סריקה איטית אכן לא להפעיל את מערכת mechanosensitive של התולעת (מידע לא מוצג). ניתן להשתמש במערכות LED מסחריות. מספר חברות מציעות פתרונות מוכנים לשימוש הכוללים נוריות באורכי גל שונים. הנורית צריכה את האפשרות של חיצוני מפעילה LED עם אות TTL. מצלמה רגישה מאוד נחוצה לסידן הדמיה של העברת בעלי חיים. מצלמות EMCCD הן המצלמות רגישות ביותר בשוק. המצלמה צריכה להיות פלט TTL במהלך החשיפה (פלט "אש" המכונה גם). דוד מיכסה הנדרש כדי למנוע התעבות על המכסה אם באמצעות מיקרוסקופ הפוכה. במיקרוסקופ זקוף, הצלחת תוצב כך שWi המכסהאהיה בתחתית ובכך עיבוי מנע ולא חימום מכסה נדרש. המכסה צריך חוזקה לסגור את הצלחת על מנת למנוע אידוי של מים במהלך הדמיה לטווח ארוך.
בולי PDMS
פני השטח של חותמת PDMS המכילה את המבנה ליציקת agarose מתמודד משקופיות הזכוכית, התומכת בחותמת PDMS. ניתן למצוא רשימה עם חברות המציעות שבבי מייקרו-נוזליים מותאם אישית על ויקיפדיה (http://en.wikipedia.org/wiki/List_of_microfluidics_related_companies).
מילוי נמטודות לתאיהם
זהו השלב הקריטי ביותר בפרוטוקול ויש לשקול את הנקודות הבאות:) הריריות של agarose היא קריטיות להעברת התולעים והדמיה. אם agarose לח מדי, כלומר, יש Cov נוזליering על שטח של כמה microchambers, זה לא יהיה אפשרי לחלק מזון ותולעי חיידקים באופן מבוקר כי הנוזל יהפוך את החיידקים לזרום משם. אם agarose יבש מדי אז החיידקים ותולעים לא יכולים לקבל את הבחירה בקלות מה שאומר שהכוח מוגבר צריך לשמש לרדת תולעים וחיידקים שגורמים לניזק בקלות לagarose. בעת המילוי בהרבה תולעים agarose עלול להתייבש. במקרה הגרוע ביותר agarose יהיה כל כך יבש בסופו של הדבר שתאי יקרסו. אם agarose יבש מדי ניתן rehydrated זה על ידי הצבת טיפה קטנה (כ 2 μl) של S-סל על הצד של השבב שבו אין תולעים. לאחר מכן טובל את חוט הפלטינה להרים לתוך הנוזל ואפילו למשוך חלק מהנוזל לאזור שבו התאים מלאים בתולעים. B) כמות המזון היא קריטית עבור הדמיה מוצלחת לטווח ארוך. אם אין מספיק אוכל, התולעים יכולים נגמרים שלו. אם יש אוכל מוגזם החלל של החדרלא מתנהג כמו נוזל אלא כמו מוצק ויאפשר תולעים לברוח מהחדר על ידי דחיפת החיידקים. מטרה לקבל השעיה חיידקים שממלאת את כל החדר. התולעים נמצאים בקשר מתמיד פיזי עם המשטח אגר וזכוכית לאורך רוב אורכם במהלך הניסוי והתנהגות הזחילה נראית דומה לתנועה על צלחת ושונה לחבטו בנוזל. ג) מכאני המזיק של agarose יכול להרוס את הניסוי. בחירת קנס היא חיונית. לא צריכים אותו פינות חדות. ריסים רכים שמחוברים לקצה pipet ניתן להשתמש כדי להעביר חיידקים או תולעים לתאים במקום להשתמש איסוף פלטינה. ברוב המקרים, עם זאת, agarose overdried היא הסיבה לנזק. הבחירה או עפעף צריך, באופן אידיאלי, רק בקושי נוגע בagarose עצמו, ואת סרט מים על פני השטח agarose צריך למשוך את התולעים וחיידקים. כאשר איטום התאים, שוב, את הלחות של agarose היא חיונית. לא צריךלהיות כל נוזל חופשי על פני השטח agarose כי זה עלול לשטוף את החיידקים ותולעים באיטום. בועות גדולות ניתן להסיר בעדינות על ידי הרמת פינה של הלוח אגר. בועות קטנות שהם קטנים יותר מאשר התא לעתים קרובות להילכד בתוך התאים. בועות אלה הן לא בעיה ותיעלמנה על ידי קליטה. לאחר הרכבת הצלחת, לבדוק שוב שagarose הוא לא יבש או רטוב מדי. התאים צריכים להיות יפה אטומים ולא צריך להיות שום זרימה של נוזל בין תאים. אם agarose הוא רטוב מדי, התאים לא לאטום כמו שצריך. תולעים יכולים לברוח או האוכל שלהם יהיה נשטף. אם המדגם הוא לח מדי, פשוט לפתוח את המכסה ולתת יבש agarose לדקה או שתיים. אם agarose הוא יבש מדי, התאים עלולים לקרוס והתולעים לברוח.
גמלון ידי התרחקות
הדמיה הקרינה, להתרחק מוגבל על ידי הכמות הנמוכה של אור המתקבל בהגדלה נמוכה. כמו כן, Eמצלמות MCCD מותאמות לרגישות ולעתים קרובות יש רזולוציה נמוכה יחסית. עם זאת, גמלון הדמיה פי ארבעה הוא גם אפשרי. לדוגמא, ארבעה חדרים של 190 מיקרומטר x 190 מיקרומטר יכולים להתאים למסגרת אחת בעת השימוש 140X הגדלה (מושגת באמצעות 20X אובייקטיבי ומצלמה 0.7X הר) ופיקסל 512 x 512, 8 x 8 מ"מ מצלמה. מצלמה ברזולוציה גבוהה עם שבב גדול (כגון מצלמות sCMOS, 16.6 מ"מ x 14 מ"מ שבב, 2560 x 2,560 פיקסלים = 5.5 מגה פיקסל) מייעלת גמלון של דסק"ש והדמיה שדה בהיר. לדוגמא, עד 30 תולעי L1 ב190 מיקרומטר x 190 מיקרומטר תאים יכולים להתאים לכל מסגרת של המצלמה בעת השימוש בהגדלת 100x (ראה איור 3). בעיקרון, להתרחק וסריקה גם יכולה להיות משולבת כדי להשיג מספרים גדולים עוד יותר של בעלי חיים. רוב הנוירונים להישאר די טוב בפוקוס, כך שרק אחד מישור מוקד צריך להיות צילם. אם נוירונים נמצאים לצאת מהפוקוס, AZ סריקה באמצעות כונן piezo ניתן לקחת בכל פעם עמ 'oint.
הסתגלות להתנהגויות שונות
פרוטוקול זה נותן רעיון טוב של ההתנהגות על פני טווחי זמן ארוך. ברור, העיתוי של ההתפרצויות צריך להיות מותאם להתנהגויות שונות ושלבי חיים.
מגבלות של הטכניקה
מספר גורמים להגביל את משך הזמן של הדמיה. החשוב ביותר היא כמות המזון. ברגע שהמזון נצרך, זחלים יפסיקו לפתח. לפיכך, בתאים קטנים תולעים (190 x 190 מיקרומטר) לפתח עד שלב L3 ולאחר מכן לעצור. אם נדרש זמן ארוך יותר הדמיה, תאים גדולים יותר צריכים להיות בשימוש. משך הזמן המרבי של הדמיה לטווח הארוך הוא בטווח של 2.5 - 3 ימים. אם נדרש הדמיה יותר, התולעים צריכים להיות התאוששו והניחו לתאי חדשים. כאשר ההדמיה תולעים בוגרות, מגבלה אחרת נגרמת על ידי הצאצאים של התולעים האלה. תולעים בוגרות מטילות ביצים שממנו בוקע זחלים. זחלים אלה גם יישארו בתוך החדר, לצרוך מזון, ועלול להפריע לניתוח התמונה. אם צאצאים היא בעיה, פתרון הוא או להשתמש מבוגרים סטרילי או למקום שוב ושוב את התולעים לתאי טריים. כדי לשחזר תולעים, לוח agarose המכיל את התא הוא לחתוך חינם עם אזמל, הוא משך את coverslip, וממוקם על צלחת NGM שממנו ניתן לשחזר את התולעים. מגבלה נוספת היא ההגבלה של התולעים לאזורים קטנים יחסית. זה עלול להיות בעיה אם תנועה ארוך טווח צריכה להיות מנותחת. בעוד בעלי חיים בתאים יכולים להיות מגורה באופן מכאני וoptogenetically 21,27,34,35, הטבע האטום של החדר יקשה ליישם ממריצים מסיסים או הפכפכים. גזים ביולוגיות חשובים כגון חמצן או פחמן דו חמצני יכולים לפזר בחופשיות באגר. מאגר האוויר הגדול בצלחת צריך לשמור על ריכוז הגז בתאים קבועים על פני הזמן הדרוש לניסויים. עם זאת, יש לזכור כי concentratio החמצן המקומיn בתא עשוי להיות דומה יותר לתנאים שנמצאו בתרבות נוזלית מתרבות על הצלחת.
משמעות ביחס לשיטות קיימות
מכשירי microfluidic התקדמו התנהגות והתפתחותי מאוד למדו בג elegans. לעתים קרובות, מבני microfluidic עשויים 12 PDMS. כאן אנו מתארים פרוטוקול להפקת תאי תרבות microfluidic עשויים agarose. כוחה של טכניקה זו הוא השילוב של איכות גבוהה הדמיה, מתאם של התנהגות עם מדידות פיסיולוגיות, הדמיה לטווח ארוך, ותפוקה גבוהה באופן סביר. איכות תמונה גבוהה מושגת על ידי הדמיה באמצעות coverslip הזכוכית באמצעות מטרות NA גבוהות. כתוצאה מכך, ניתן לבצע הדמיה הקרינה כגון הדמיה סידן והדמיה confocal של מבני subcellular. בגלל בעלי החיים אינם משותקים כמו במערכות אחרות, זה מאפשר התאמה של התנהגות עם מדידות פיסיולוגיות. בקause יש בעלי החיים מזון בשפע, הם ממשיכים בפיתוח המאפשרים הדמיה לטווח ארוך. מערכת זו יכולה תולעים רבים תמונה בריצה אחת, כי בעלי חיים מוגבלים לתאי המוגדרים שלהם. כך, בשיטה זו ניתן לשנות בקלות 9,27,34-36.
יישומים עתידיים
עד כה, מערכת זו נעשתה שימוש בעיקר ללמוד שנת התנהגות בג זחלי elegans L1. עם זאת, ההסתגלות לכל השלבים תאפשר ללמוד מגוון רחב של התנהגויות גם בdauers ומבוגרים. מגוון רחב של התנהגויות ניתן ללמוד עם טכניקה זו החל הזדווגות להטלת ביצים.
Disclosures
המחברים מצהירים שאין להם אינטרסים כלכליים מתחרים.
Acknowledgements
מקס פלאנק החברה ומלגת קבוצת ג'וניור בית הספר למוסמכי גטינגן לHB במימון עבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| High melting point agarose | Fisher Bioreagents | BP(E)164-1000 | |
| Top Vision low melting point agarose | Thermo Scientific | R0801 | |
| LED system | CoolLED | pE-2 | |
| Compound microscope | Nikon | TiE | |
| Stereomicroscope | Leica | M5 | |
| EMCCD camera | Andor | iXon 897 | now sold as iXon Ultra 897 |
| sCMOS camera | Andor | Neo | |
| Plasma cleaner | Harrick | PDC-23G2 | |
| Lid heater | MPI workshop | custom made | |
| Plastic dish | Falcon | 08-757-100A | |
| Z-stage for the microscope | Prior | Nano Scan Z | |
| X-Y stage for the microscope | Prior | Proscan III | |
| PDMS stamp | Abbott Laboratories | custom made | |
| Red light filter | Chroma | ET660/50m | |
| 35 mm Petri dish | Falcon | Falcon Disposable Petri Dishes, Sterile, Corning | |
| Double sided sticky tape | Sellotape/Henkel | double sided 25 mm x 33 m | alternatively advance double sided sticky tape from Rubance Adhesives can be used. |
References
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Husson, S. J., Costa, W. S., Schmitt, C., Gottschalk, A. Keeping track of worm trackers. WormBook. , 1-17 (2012).
- Yemini, E., Jucikas, T., Grundy, L. J., Brown, A. E., Schafer, W. R. A database of Caenorhabditis elegans behavioral phenotypes. Nature Methods. 10, 877-879 (2013).
- Likitlersuang, J., Stephens, G., Palanski, K., Ryu, W. S. C. elegans tracking and behavioral measurement. Journal of Visualized Experiments : JoVE. , e4094 (2012).
- Yemini, E., Kerr, R. A., Schafer, W. R. Tracking movement behavior of multiple worms on food. Cold Spring Harbor Protocols. 2011, 1483-1487 (2011).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in. C. elegans. Nature Methods. 8, 592-598 (2011).
- Ramot, D., Johnson, B. E., Berry, T. L., Carnell, L., Goodman, M. B. The Parallel Worm Tracker: a platform for measuring average speed and drug-induced paralysis in nematodes. PLoS One. 3, e2208 (2008).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proceedings of the National Academy of Sciences U S A. 110, E4266-E4273 (2013).
- Bringmann, H. Agarose hydrogel microcompartments for imaging sleep- and wake-like behavior and nervous system development in Caenorhabditis elegans larvae. Journal of Neuroscience Methods. 201, 78-88 (2011).
- Yu, C. C., Raizen, D. M., Fang-Yen, C. Multi-well imaging of development and behavior in Caenorhabditis elegans. Journal of Neuroscience Methods. 223, 35-39 (2014).
- Luke, C. J., Niehaus, J. Z., O'Reilly, L. P., Watkins, S. C. Non-microfluidic methods for imaging live. C. elegans. Methods. 68, 542-547 (2014).
- San-Miguel, A., Lu, H. Microfluidics as a tool for C. elegans research. WormBook. , 1-19 (2013).
- Shi, W., Qin, J., Ye, N., Lin, B. Droplet-based microfluidic system for individual Caenorhabditis elegans assay. Lab Chip. 8, 1432-1435 (2008).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10, 1862-1868 (2010).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Kerr, R., et al. Optical imaging of calcium transients in neurons and pharyngeal muscle of. C. elegans. Neuron. 26, 583-594 (2000).
- Suzuki, H., et al. In vivo imaging of C. elegans mechanosensory neurons demonstrates a specific role for the MEC-4 channel in the process of gentle touch sensation. Neuron. 39, 1005-1017 (2003).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. EMBO Journal. 24, 63-72 (2005).
- Frokjaer-Jensen, C., et al. Effects of voltage-gated calcium channel subunit genes on calcium influx in cultured C. elegans mechanosensory neurons. Journal of Neurobiology. 66, 1125-1139 (2006).
- Kerr, R. A. Imaging the activity of neurons and muscles. WormBook. , 1-13 (2006).
- Miyawaki, A., Griesbeck, O., Heim, R., Tsien, R. Y. Dynamic and quantitative Ca2+ measurements using improved cameleons. Proceedings of the National Academy of Sciences U S A. 96, 2135-2140 (1999).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6 (2), (2013).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Edwards, S. L., et al. A novel molecular solution for ultraviolet light detection in Caenorhabditis elegans. PLoS Biology. 6, e198 (2008).
- Ward, A., Liu, J., Feng, Z., Xu, X. Z. Light-sensitive neurons and channels mediate phototaxis in C. elegans. Nat Neurosci. 11, 916-922 (2008).
- Turek, M., Lewandrowski, I., Bringmann, H. An AP2 transcription factor is required for a sleep-active neuron to induce sleep-like quiescence in. C. elegans. Current Biology. 23, 2215-2223 (2013).
- Singh, K., et al. C. elegans Notch Signaling Regulates Adult Chemosensory Response and Larval Molting Quiescence. Current Biology. 21, 825-834 (2011).
- Raizen, D. M., et al. Lethargus is a Caenorhabditis elegans sleep-like state. Nature. 451, 569-572 (2008).
- Iwanir, S., et al. The microarchitecture of C. elegans behavior during lethargus: homeostatic bout dynamics, a typical body posture, and regulation by a central neuron. Sleep. 36, 385-395 (2013).
- Nagy, S., Raizen, D. M., Biron, D. Measurements of behavioral quiescence in Caenorhabditis elegans. Methods. , (2014).
- Nagy, S., et al. A longitudinal study of Caenorhabditis elegans larvae reveals a novel locomotion switch, regulated by Galphas signaling. eLife. 2, e00782 (2013).
- Cassada, R. C., Russell, R. L. The dauerlarva, a post-embryonic developmental variant of the nematode Caenorhabditis elegans. Developmental Biology. 46, 326-342 (1975).
- Schwarz, J., Lewandrowski, I., Bringmann, H. Reduced activity of a sensory neuron during a sleep-like state in Caenorhabditis elegans. Current Biology. 21, R983-R984 (2011).
- Schwarz, J., Spies, J. P., Bringmann, H. Reduced muscle contraction and a relaxed posture during sleep-like Lethargus. Worm. 1, 12-14 (2012).
- Schwarz, J., Bringmann, H. Reduced sleep-like quiescence in both hyperactive and hypoactive mutants of the Galphaq Gene egl-30 during lethargus in Caenorhabditis elegans. PLoS One. 8, e75853 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved