A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניטור נייד Orthotopic השרשה והיקפי חיסון במודל השני-45 syngeneic עכברוש מזותליומה
In This Article
Summary
הדור של מודל עכברים orthotopic של מזותליומה pleural הממארת על ידי השתלה של תאי II-45 מזותליומה לתוך חלל pleural של חולדות המוסמכות חיסוניים מוצג. שיטת cytometric זרימה לנתח שבע תת תא חיסון בבעלי החיים אלה מדגימת דם 25 μl גם מתוארת.
Abstract
התגברות העצומה של עניין בטיפולים מבוסס חיסון לסרטן כגון חיסונים ומעכבי מחסום חיסוניים, והבנה מוגברת של התפקיד של מייקרו-הסביבה של הגידול בתגובה לטיפול, באופן קולקטיבי מצביעה על הצורך במודלים orthotopic חיסון מוסמך לבדיקות פרה-קליניות טיפולים החדשים אלה. מסמך זה מדגים כיצד להקים מודל חולדה חיסון מוסמך orthotopic של מזותליומה pleural הממארת. התקדמות מחלה ניטור בדגמי orthotopic מסכלת את המיקום הפנימי של הגידולים. לlongitudinally לעקוב אחר התקדמות מחלה והשפעתה על מחזור תאים חיסוניים בזה ומודלים של עכברים אחרים של סרטן, צינור יחיד cytometry זרימת assay דורש רק 25 μl כל הדם מתואר. זה מספק כימות מדויק של שבעה פרמטרים חיסוניים: ימפוציטים מוחלט, מונוציטים ונויטרופילים, כמו גם תת-T תאי CD4 ו CD8, B-תאים ותאים קטלניים. צוללות שונותETS של פרמטרים אלה הם שימושיים בנסיבות ובדגמים שונים, עם נויטרופילים יחס הלימפוציטים שיש התועלת הגדולה ביותר לניטור התקדמות מחלה במודל מזותליומה. ניתוח במחזור רמות תא חיסון בשיטת צינור יחיד זה גם יכול לסייע בניטור התגובה לטיפולים מבוסס חיסון והבנת המנגנונים שבבסיס המוביל להצלחה או כישלון של טיפול.
Introduction
מזותליומה ממאירה (MM) היא גידול ממאיר אגרסיווי שנובע מהתאים הפכו בקרום (mesothelium) שקווי הריאות וחללים בטן, לב ואיברי רבייה פנימי, והוא הגידול הראשוני הנפוץ ביותר של חלל הריאות או 1,2 הצדר . חשיפה לסיבי אזבסט מהווה 80% מכל MM, ותוך איסור על שימוש אזבסט הוכנסו לפני עשרות שנים ברוב מדינות מערב, השימוש הנרחב שלה בקהילה השאיר מורשת קטלנית. ארגון הבריאות העולמית מעריך כי 107,000 אנשים ברחבי העולם מת מדי שנה ממחלות הקשורות לאזבסט, עם שיעורי תמותה ממשיכים להגדיל. גל שכיחות שאינה בעיסוק חדש הוא גם מתעורר ויש הבנה קטנה של מתי, ובאיזו רמה זה יהיה שיא 3.
רוב האנשים עם MM מאובחנים מאוחר כאשר כימותרפיה מערכתית מייצגת את אחד מאפשרויות קיימא רק 4. רוב effectiיש כימותרפיה ו'טיפול סטנדרטי 'הנוכחי (pemetrexed יחד עם ציספלטין 5) זוהה לפני מעל 10 שנים. עם זאת כישלון של טיפול זה הוא בלתי נמנע ואין אפשרויות מוכחות שני קו, עוזבים חולים עם פרוגנוזה עגומה וחציון הישרדות של 12 חודשים בלבד 2. לכן, יש צורך מסופק דחוף לטיפולים יעילים יותר. למרות הבדיקה של מספר הטיפולים חדשניים בניסויים קליניים אף אחד מהם הביא לשינויים בפרקטיקה. זה נובע בחלקו (5%) ההעברה הנמוכה של תוצאות פרה-קליניות, מבוצעת בדרך כלל בדגמי עכבר xenograft, להגדרה הקלינית 6-8. מודלים כאלה בנאמנות לא לשחזר את ההיבטים המורכבים של מייקרו-הסביבה של הגידול המתרחש במקומות שאינם פיסיולוגיים, לעתים קרובות בהעדר מערכת חיסונית מתפקדת 9.
דגמי orthotopic syngeneic ליצור סביבת גידול משמעותי יותר מציאותית מגommonly השתמש במודלי xenograft תת עורית כגידולים להתרחש במיקום הפיזיולוגי הנכון עם 10,11 מערכת חיסוני בשלמותה. הגודל הגדול יותר של העכברוש משפר את השימוש בו כמודל מחלה מכרסם, במיוחד במחקרי סמים שבו דם סידורי שואב נדרשים כדי להעריך את התגובה לטיפול ורעילות 12. יתר על כן, בדגמים שבי ניטור התקדמות מחלה קשה בשל המיקום של הגידולים (כגון בחלל פלאורלי), את היכולת לעקוב אחר התקדמות מחלה באמצעות גורמים הנמצאים במחזור הוא מאוד אטרקטיבי. הדור של מודל orthotopic syngeneic של מזותליומה pleural באמצעות חולדות חיסון מוסמכת מתואר. בנוסף, שיטה קלה ויחסית לא פולשנית לניטור התקדמות המחלה pleural על ידי מדידת תאים חיסוניים במחזור מתואר גם.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הנהלים הקשורים בעלי חיים בוצעו בהתאם להמלצות בקוד האוסטרלי עיסוק לטיפול והשימוש בבעלי חיים למטרות מדעיות. הפרוטוקול עבור מחקר זה אושר על ידי הוועדה בבית החולים הטיפול בבעלי חיים ואתיקה המלכותית החוף הצפוני. נקבה פישר 344 חולדות (F344, 150-200 גר ') נשמרו במתקן קירנס, Kolling מכון בתנאים סטנדרטיים (שעות אור 12 / מחזורים כהים וגישה חופשית למזון ומים).
הערה: תרשים זרימה לכל הפרוצדורות מוצג באיור 1.
1. הכנת תאים להשתלה
- קו תרבות מזותליומה העכברוש השני-45 תאים (הידוע גם בIL-45; שהופק על ידי הקדמת הצפק של אזבסט crocidolite) בRPMI 1640 תקשורת (RPMI) בתוספת סרום 10% שור עוברי (FBS) ולגדול בתנאים סטנדרטיים (37 ° חממת humidified C עם 5% CO 2). Maintaבידי passaging ותת-culturing בכ 01:50 פעמיים בשבוע בבקבוק 2 75 סנטימטר.
- הכן ריאגנטים לתרבית תאים וaliquots החם על 37 מעלות צלזיוס. ריאגנטים נדרשים כוללים תקשורת בסרום חופשית RPMI (SFM), RPMI עם 10% FBS, בופר פוספט (PBS) ושל 0.5% טריפסין- EDTA.
- תרבות תאים להשתלה למפגש כ 70-80%. זה מבטיח שהם נמצאים בשלב הצמיחה ליניארית.
- קציר תאים על ידי השלכת התקשורת, שטיפת פעם אחת עם 5 מיליליטר של PBS סטרילי ולאחר מכן הוספת 3 מיליליטר של 0.5% טריפסין-EDTA.
- חזור צלוחיות לחממה לכ 5 דקות עד שכל התאים הפכו לא חסיד.
- ברגע שהתאים שאינם חסיד, להוסיף 3 מיליליטר של RPMI עם 10% FBS כדי להשבית טריפסין. לאסוף ותאי צנטריפוגה XG ב 300 במשך 3 דקות.
- שטוף את התא גלולה ב 10 מיליליטר של SFM ו צנטריפוגות שוב ב XG 300 במשך 3 דקות.
- תא גלולה לשטוף שוב עם 10 מיליליטר של SFM ו צנטריפוגות כאמור לעיל.
- Resuspend תאי 10 מיליליטר של SFM ולבצע ספירת תאים באמצעות hemocytometer או מכשור דומה.
- לדלל תאים כך ש100 μl מכיל את כמות התאים להיות מושתל.
הערה: גידול הודגם במינון נמוך כמו ב100 μl 100 תאים אך מינון סטנדרטי הוא 500,000 תאים ב100 μl. - הכן מספיק תאים בתקשורת למספר החולדות להיות מושתל (כלומר, 100 μl / חולדה), בתוספת לפחות 0.5 מיליליטר נוסף כדי לפצות על הפסדים מיחולו והנפח המת של המחט.
- הכן SFM מספיק (ללא תאים) שמושתל לתוך חולדות שליטה (כלומר, 100 μl / חולדה), בתוספת לפחות 0.5 מיליליטר נוסף.
הערה: התאים וSFM מוכנים כעת להשתלה. הם צריכים להיות כל הזמן על 37 מעלות צלזיוס ומושתלים בתוך 2 שעות של קציר כדי לשמור על יכולת קיום.
2. השרשה בvivo של תאים
- מניחים את החולדה F344 (> 13 שבועות של גיל) לתוך תא האינדוקציה ולהרדים באמצעות 1.4% שאיפת isoflurane (או השיטה בשימוש במתקן). ברגע שהעכברוש נראה מהלכו ישן מהתא לחרטום (עם isoflurane 1.4% זורם), מניח אותו על הגב שלה עם חזה פונה כלפי מעלה (תצוגת הגחון). הדבר זה מאפשר לאיברים הפנימיים להתיישב הרחק מחלל החזה. בדקו את הרפלקסים על פי פרוטוקולים מוסדיים כדי להבטיח את העכברוש הוא בהרדמה מלאה.
- לגלח את האזור הנכון costalis Regio (חזה) כדי להסיר את הפרווה.
- נקה את האזור המגולח עם 80% אתנול V / V.
- זהה את אתר ההזרקה: בצד ימין, למצוא את הבלוטה 2 החל גולגולת. אתר ההזרקה הוא 0.5 סנטימטר הפרוקסימלי לזה, בין ה -3 והצלעות 4 מקצה הזנב של כלוב הצלעות. (איור 2 א).
- לערבב בעדינות II-45 תאים לresuspend. לאט לאט למשוך את ההשעיה התא (או SFM לחולדות שליטה) ל1 מיליליטר ו# 160; מזרק ללא מחט מחוברת. אם מחט מחוברת לציור של תאים יש פוטנציאל לתאים לגדול לאורך קו הזרקת מחט. צרף 23G x 1¼ מחט. ראש המחט ולהסיר את כל בועות אוויר.
- ברגע שהמזרק והמחט דרוכים, מקום 20 מ"מ ארוך וspacer קוטר 5 מ"מ מעל פיר המחט. זה משמש כדי למנוע את המחט לחדור עמוק מדי לתוך חלל פלאורלי במהלך ההזרקה. כ 5 מ"מ 12 מ"מ של מחט חשופה מספיק לחדירה דרך הצלעות מבלי לפגוע בכל איברים.
- לאט לאט להכניס את המחט בין הצלעות, לצייר את הבוכנה כדי להבטיח כלי דם לא ניקבו (לא דם אמור להופיע במזרק) אז להזריק 100 תאי μl או SFM. (איור 2).
- הסר את המחט בעדינות לגלגל את העכברוש מצד לצד כדי להפיץ תאים בחלל החזה.
- מניחים את החולדה לכלוב ולבדוק להתאוששות. העכברוש דואר צריך להיות ער בתוך דקות 1 ומתחיל לנוע.
- חזור על פעולה עבור כל חולדה באמצעות מחט חדשה. שימוש חוזר באותו המחט יגרום צמיחת תאים לאורך קו ההזרקה של המחט.
- צג רווחתם של בעלי החיים מדי יום.
- להרדים בעלי חיים בנקודתי קצה מוגדרים מבחינה אתית כנשלט על ידי ועדת האתיקה של בעלי החיים המוסדית. נקודות הקצה האתיות לחולדות בניסויים אלה היו ירידה במשקל של יותר מ -10% או נשימה מאומצת.
3. זנב וריד דם אוסף
- אם הדם הוא שייגבה מייד השתלת הודעה תא, לשמור על העכברוש הרדים. אם דגימת דם בנקודת זמן אחרת, להרדים את העכברוש באמצעות 1.4% שאיפת isoflurane. בדקו את הרפלקסים על פי פרוטוקולים מוסדיים כדי להבטיח את החולדה מורדמת באופן מלא.
- מניחים את החולדה על הצד שלה ולאתר וריד זנב לרוחב.
- לעקר את הזנב עם 80% אתנול ולתייג ג 0.5 מיליליטר EDTAצינור ollection.
- לאסוף דם, תמיד להתחיל בסוף הזנב של הזנב (כשליש מהדרך לאורך). זה מאפשר ניסיונות נוספים קרוב יותר לסוף הגולגולת של הזנב במקרה הניסיון הראשון נכשל. לא לדגום מחדש caudally כמו זה יכול לגרום קריש דם.
- מקם מקביל 23G x 1¼ מחט לווריד לרוחב והחלק אותו לווריד בזווית רדודה כל כך שהיא חודרת כ 10 מ"מ (איור 3 א).
- הערה: אם הווריד כבר ניקב בהצלחה הדם יהיה גלוי בסוף הקובץ המצורף של המחט (איור 3).
- טיפת דם תהווה על הזנב באתר של ניקור המחט. לאסוף את הדם הזה בעזרת פיפטה והעברה ל0.5 מיליליטר שכותרתו (או קטן יותר) צינור איסוף EDTA. לμl 25 assay תא החיסון מספיק. החל גזה עם לחץ לנקב אתר עד שדימום ייפסק.
- קפיצי צינור הדם לערבב הדם וEDTA ל- PRקרישת אירוע. שמור את הזמן בין איסוף דם וערבוב עם EDTA הקצר ככל האפשר כדי למנוע קרישה.
- בעת איסוף דם מדגימות EDTA-דם חנות חולדות מרובות במעמד ב RT עד ניתוח. דם תהליך בתוך 2 שעות של אוסף.
לדוגמא הכנה 4. לפרופיל תא חיסון בשיטה מבוססת ביד
הערה: שיטת פלטפורמה אחת זה מסתמכת על שימוש בצינורות ספירה מוחלטים זמינים מסחרי שיש להם מספר ידוע של חרוזים לכל דגימה. צינורות אלה מכילים כדורי lyophilized שלפזר במהלך הכנת מדגם, משחררים את החרוזים. חרוזים שכותרתו fluorescently ועל ידי gating על אוכלוסיית חרוז, ניתן לחשב ספירה מוחלטת.
- ודא המדגם כולו דם EDTA הוא גם מעורב על ידי הצבתו במיקסר סיבובי איטי במשך כמה דקות. תווית צינור ספירה מוחלטת אחד לכל דגימה. גלולה המכילה את החרוזים צריכה להיות גלויה מתחת tהוא בעל חרוז מתכת בחלק התחתון של הצינור.
- העבר את 25 μl של כל דם EDTA לתוך צינור ספירה מוחלט שכותרת. גלולה חרוז תתמוסס על תוספת של הדם.
- לכל צינור להוסיף 20 μl של קוקטייל T / B / Killer תא טבעי (NK) אנטי-חולדה, 10 μl של אנטי-עכברוש CD8a PE, 10 μl של אנטי-עכברוש CD4 (תחום 1) FITC ו -10 μl של אנטי-עכברוש CD45 PE / Cy7 (איור 4 א). Fluorophores מוגדרת בטבלה 1.
- צנטריפוגה בקצרה הצינור (300 XG) על מנת להבטיח את הנוגדנים ותאים נמצאים בחלק התחתון של הצינור ולא נדבקו לצד של הצינור. מערבולת לערבב דגירה במשך 15 דקות ב RT.
- לlyse תאי דם אדומים להוסיף 400 μl של 10 מ"מ טריס, 0.15 מ 'חיץ אמוניום כלוריד (pH 7.5) ומערבולת לערבב. תמוגה הושלמה כאשר המדגם מופיע (4B דמויות ו- C) שקופים ולא מעונן. אי lyse המדגם לחלוטין יוביל להגדלהרקע ד ושקר מורם ספירה בעת ניתוח על ידי cytometry זרימה.
5. זרימה Cytometric עיבוד של דוגמאות
הערה: בצע בצבע 4 cytometer זרימה.
- פתח את התוכנה במצב רכישה ותבנית חדשה עם 8 מגרשים כמתואר באיור 5.
- התאם את הגדרות מכשיר לאלה המופיעים בטבלה 1 ולהגדיר את השער R1 (FITC [FL-1] לעומת APC [FL-4]), איור 5Ai) לספור את חרוזי הניאון. השערים האחרים אינם חשובים כמו בשלב רכישה זו, אך יידרשו לניתוח. חרוזים הספירה מוחלטים שימוש בפרוטוקול זה מכילים צבעי ניאון וניתן לאתר בכל ערוץ אף הם החלשים ביותר בערוץ הכחול.
- באמצעות דגימת דם שליטה מוכנה, מערבולת ולאחר מכן לטעון על cytometer ולהפעיל במהירות נמוכה (μl 12 / min) על התקנת מצב כל כך יכולים להיות מותאמים שערי רכישת נתונים.
- הגדר את הרכישה ללאסוף 10,000 אירועים בשער חרוז R1.
- הגדרת תיקייה להקליט נתונים ולהגדיר מספר קובץ וקובץ מדגם תווית בתפריט רכישה.
- טען את המדגם כדי להיות מנותח על cytometer ולהגדיר את קצב הזרימה עד בינוני (35 μl / min). הפעל כל מדגם באותו קצב הזרימה. קצב הזרימה ייתכן שיצטרך להיות מגוון לנמוך (μl 12 / min) או גבוה (60 μl / min), אבל בינוני הוא בדרך כלל מתאים. בקצב הזה זה לוקח בערך 90 עד 120 שניות לרכוש 10,000 אירועי חרוז לכל דגימה.
- לאחר המדגם נטען לצפות מגרשי הפיזור לעשות אירועים בטוחים מופיעים בשער חרוז R1. בתחילה יכולה להיות כמה חוסר יציבות בלחץ מדגם גרימת להיסחף במגרשי הפיזור. חכה לזה כדי לייצב.
- ברגע שהתייצב, לחץ על לרכוש ולאפשר מדגם לרוץ. ברגע שcytometer סיים רכישת 10,000 אירועי חרוז בR1 cytometer יפסיק לרכוש ולשמור את כל הנתונים.
- הסר את המדגם וזורקים לזרום ט"ולהיות. Cytometer מוכן למדגם הבא עכשיו. להפעיל את כל הדגימות ולאחר מכן להמשיך למצב ניתוח.
6. ניתוח תא חיסון
הערה: אסטרטגיות gating והאלגברה בוליאנית משמשות להגדיר כל אוכלוסיית תא. אלגברה בוליאנית היא שיטת ניתוח היגיון מבוססת המאפשרת לפעולות מרובות בהגדרה אחת. תוכנת ניתוח cytometer הזרימה (למשל, BD CellQuest) מאפשרת לשימוש באלגברה בוליאנית. המשוואות משמשות לחשבון פעיל לתגובתיות השלילית המשמעותית המסייעת בהגדרת התא לזהות כל אוכלוסיית תאים ספציפי יותר. "האזורים" משמשים להגדרה "שער". אזורים להגדיר ממדי מרחב 2 ואילו יכולים להיות מורכבים שערים של אזורים רבים המחוברים על ידי מפעילים אלגברית (+, *, -, מוגדר בטבלה 2).
- לעבור את התוכנה למצב ניתוח. תבנית ניתוח צריך להיות שנוצרה כדי להתאים איור 5 עם החלקות ושערים לראות.
- לנתח כל קובץ בודד (כלומר, כל דגימה בודדת) בנפרד. שערי הגדר R1 עד R9 ולאחר מכן הקימו את האלגוריתמים לכל סוג תא כהגדרתו בטבלה 2 (גם מוצגים באיור 5).
- השתמש בדלפק סטטיסטיקת התא לחשב אוכלוסיות תאים בודדות שהוגדרו על ידי שערים ואלגוריתמים (לוח 2 ואיור 5). האלגוריתמים יתאימו מספרים סלולריים באופן אוטומטי בדלפק סטטיסטיקת תא.
- לחשב תת תא באמצעות המשוואה הבאה:
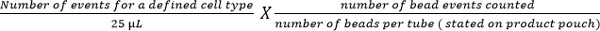
הערה: מספר אירועי תא נספרו (למשל, אירועי תאי CD4 T) הוא מנויים באמצעות המשוואה לעיל כדי לתת תא מספר לμl דם. דוגמאות לכך הן שמוצגים באיור 5.
Access restricted. Please log in or start a trial to view this content.
תוצאות
השיטה הנהוגה במאמר זה לדור של מודל orthotopic של מזותליומה pleural באמצעות השני-45 תאים הביאה חיות נכנעו למזותליומה בזמן שחזור והמהיר, ללא חולדות מתות בשל שיטת ההשתלה. כותרות של מספר התאים המושתלים קבעו כי 1x 10 3 תאים היו המספר המינימאלי הנדרש למודל penetrant מלא (engraftment 100%). המ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
מאמר זה מפרט שיטה לייצור מודל syngeneic עכברוש orthotopic של מזותליומה pleural ושיטה פשוטה לניטור התקדמות מחלה באמצעות דגימת דם אורך.
המודל השני-45 פותח על ידי חשיפת פישר 344 חולדות לסיבי אזבסט 13. למרות חשיפה זו מייצגת את הדינמיקה האמיתית ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The syngeneic rat mesothelioma II-45 cell line was a kind gift from A/Prof. Emanuela Felley-Bosco, Zurich University.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| EDTA Collection tube (0.5 ml) | Greiner Bio One GmbH | 450480 | |
| Rat T/B/NK Cell cocktail | BD Pharmingen | 558509 | anti-Rat CD3 APC (IgM clone 1F4), anti-Rat CD45RA Fitc (IgG1 clone OX-33), anti-Rat CD161a PE (IgG1 Clone 10/78) |
| anti-RAT CD8a PE | Biolegend | 200608 | (IgG1vClone G28) |
| anti-Rat CD4 FITC (Domain 1) | Biolegend | 203406 | (IgG1 Clone OX-38) |
| anti-Rat CD45 PE/Cy7 | Biolegend | 202214 | (IgG1 Clone OX-1) |
| TruCount Tubes | Becton Dickinson | 340334 | Box of 50 absolute counting tubes |
| RPMI 1640 media | Life Technologies | 11875-119 | |
| foetal bovine serum (FBS) | Scientifix | FBS500-S (lot# 010101-1) | |
| trypsin-EDTA | Life Technologies | 15400-054 | |
| PBS tablets | Medicago AB | 09-9400-100 | |
| 23Gx1¼ Needle | Becton Dickinson | 302008 | |
| 1 ml Syringe | Becton Dickinson | 302 100 | |
| Fischer 344 Rat | Animal Resources Centre, Perth Australia | F344 | |
| I.S.O (Isoflurane USP) | Veterinary Companys Australia (VCA) | B7058 | |
| II-45 Rat Mesothelioma line | Zurich University | Note: The cell line was given as a gift and is not commercially available at the ATCC | |
| FACSCalibur 4 color | Becton Dickinson | 342975 | |
| TRIS-HCL | SIGMA | T3253 | |
| Ammonium Chloride | SIGMA | 9718 | |
| Anaesthetic Machine (The stinger) | Advanced Anaesthesia specialists | #00449 |
References
- Kao, S. C., et al. Malignant mesothelioma. Intern Med J. 40 (11), 742-7450 (2010).
- Zucali, P. A., et al. Advances in the biology of malignant pleural mesothelioma. Cancer Treat Rev. 37 (7), 543-558 (2011).
- Olsen, N. J., et al. Increasing incidence of malignant mesothelioma after exposure to asbestos during home maintenance and renovation. Med J Aust. 195 (5), 271-274 (2011).
- Zucali, P. A., et al. Thymidylate synthase and excision repair cross-complementing group-1 as predictors of responsiveness in mesothelioma patients treated with pemetrexed/carboplatin. Clin Cancer Res. 17 (8), 2581-2590 (2011).
- Vogelzang, N. J., et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 21 (14), 2636-2644 (2003).
- Lowenstein, P. R., Castro, M. G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther. 9 (5), 368-374 (2009).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Yakisich, J. S. An Algorithm for the Preclinical Screening of Anticancer Drugs Effective against Brain Tumors. ISRN Pharmacol. 2012, 513580(2012).
- Basu, D., Herlyn, M. Defining microenvironments within mouse models that enhance tumor aggressiveness. Cancer Biol Ther. 8 (4), 380-381 (2009).
- Abolhassani, M., et al. Screening of well-established drugs targeting cancer metabolism: reproducibility of the efficacy of a highly effective drug combination in mice. Invest New Drugs. 4 (4), 1331-1342 (2011).
- Hudson, A. L., et al. Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma. Sci Rep. 4, 6152(2014).
- Iannaccone, P. M., Jacob, H. J. Rats! Dis Model Mech. 2 (5-6), 206-210 (2009).
- Craighead, J. E., et al. Characteristics of tumors and tumor cells cultured from experimental asbestos-induced mesotheliomas in rats. Am J Pathol. 129 (3), 448-462 (1987).
- Hunter, S. D., et al. Lymphocyte subset analysis by Boolean algebra: a phenotypic approach using a cocktail of 5 antibodies and 3 color immunofluorescence. Cytometry. 15 (3), 258-266 (1994).
- Brando, B., et al. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42 (6), 327-346 (2000).
- Schnizlein-Bick, C. T., et al. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Clin Diagn Lab Immunol. 7 (3), 336-343 (2000).
- Gajkowska, A., et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 44 (1), 53-60 (2006).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Kao, S. C., et al. High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy. Clin Cancer Res. 16 (23), 5805-5813 (2010).
- Kao, S. C., et al. Validation of prognostic factors in malignant pleural mesothelioma: a retrospective analysis of data from patients seeking compensation from the New South Wales dust diseases board. Clin Lung Cancer. 14 (1), 70-77 (2013).
- Burt, B. M., et al. Circulating and tumor-infiltrating myeloid cells predict survival in human pleural mesothelioma. Cancer. 117 (22), 5234-5244 (2011).
- Weir, C., et al. Streptavidin: a novel immunostimulant for the selection and delivery of autologous and syngeneic tumor vaccines. Cancer Immunol Res. 2 (5), 469-479 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved