A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כדאיות של מבנים ניידים Bioprinted באמצעות מדפסת הקרטזיאני Dispenser שלוש
In This Article
Summary
A Cartesian bioprinter was designed and fabricated to allow multi-material deposition in precise, reproducible geometries, while also allowing control of environmental factors. Utilizing the three-dimensional bioprinter, complex and viable constructs may be printed and easily reproduced.
Abstract
Tissue engineering has centralized its focus on the construction of replacements for non-functional or damaged tissue. The utilization of three-dimensional bioprinting in tissue engineering has generated new methods for the printing of cells and matrix to fabricate biomimetic tissue constructs. The solid freeform fabrication (SFF) method developed for three-dimensional bioprinting uses an additive manufacturing approach by depositing droplets of cells and hydrogels in a layer-by-layer fashion. Bioprinting fabrication is dependent on the specific placement of biological materials into three-dimensional architectures, and the printed constructs should closely mimic the complex organization of cells and extracellular matrices in native tissue. This paper highlights the use of the Palmetto Printer, a Cartesian bioprinter, as well as the process of producing spatially organized, viable constructs while simultaneously allowing control of environmental factors. This methodology utilizes computer-aided design and computer-aided manufacturing to produce these specific and complex geometries. Finally, this approach allows for the reproducible production of fabricated constructs optimized by controllable printing parameters.
Introduction
הנדסת רקמות משתמשת בעקרונות של ביולוגיה והנדסה בפיתוח תחליפים פונקציונליים לשמור, לשחזר, או לשפר את רקמת יליד ו. היכולת לייצר מבני biomimetic תלת-ממדיים על פי דרישה תאפשר התקדמות מדעית וטכנולוגית בהנדסת רקמות, כמו גם בחיישנים מבוססי תאים, תרופה / הקרנה רעיל, דגמי רקמה או גידול, ואחרים. הארגון תלת-ממדי של מבני רקמות מהונדסות הוא מרכיב בסיסי של שיטת הייצור משום שהיא חייבת באופן הדוק לחקות את האינטראקציה מאורגנת מאוד של תאים ומטריקס ברקמות מקומיות.
פיגומים תלת ממדיים מתכלים ויוצרי צורת גורמים קריטיים ביצירת מבני רקמת רומן כי תאים נודדים כדי ליצור שכבה דו-ממדית של תאים, אבל חוסר היכולת לגדול בהעדיף תלת-ממדי. הפיגום משמש כבסיס זמני לתאקובץ מצורף ושגשוג, ולכן הוא חייב להיות בנוי מחומרים עם נקבוביות שליטה ופריקות ביולוגיות, וintegrit המכני מספיק. חומרי הפיגום לא צריכים להיות רעילים לתאים או ליצור תגובה שלילית מהמארח. הידרוג כבר בשימוש נפוץ בשיטות של הנדסת רקמות, ובשל hydrophilicity, הידרוג לאפשר חילופי נוזל וגז בכל רחבי structur. על ידי שילוב של הידרוג'ל שונה, המאפיינים של הידרוג'ל המסונתזת הם לשינוי כדי לעמוד בדרישת יישום נפרדת.
גישת הנדסת רקמות הקונבנציונלית כרוכה ביצירת פיגומי ההקרבה נקבובי acellular שהם זורעים עם תאי פוסט-fabricatio. טכניקות רבות כבר מועסקות, כגון מליטה סיבים, ליהוק ממס, ולהמס דפוס, אבל הוכיחו להיות מוצלח מינימאלי עבור יישומי הנדסת רקמות. שיטות מליטה סיבים לאפשר סיבים להיות מתואמים בצורות מסוימות, אך הם מסוגלים רק פרוducing דק מאוד פיגום. שיטות יציקת ממס מיוצרות מבנים נקבוביים ביותר, עם זאת הקרום מיוצר הגדול ביותר היה 3 מ"מ בלבד thic. לכן, יצירת מבנים תלת-ממדיים היא לא ריאלי תוך שימוש בטכניקות אלה. טכניקות דפוס להמיס הוכיחו מוצלחות בייצור פיגומים תלת ממדיים, אבל טמפרטורות גבוהות הנדרשים שלא ניתן לשלב חומרים ביולוגיים במהלך עיבוד הייצור. פיגומים שנזרעו לאחר ייצור-מוגבלים ביכולתם לעמוד בדרישות של הנדסת רקמות לייצר פיגומים תלת ממדיים עם microstructures והמוגדר מראש או לשליטה. נושא מרכזי נוסף בטכנולוגיות זריעת פיגום מוצקות הוא המחסור של כלי דם ומכאניים ירודים.
Bioprinting מאז הורחב לשלושה ממדים באמצעות ג'לים רעיל, מתכלה, תרמו-הפיך להתגבר על החסרונות של קונבנציונלי. כמה לא הייצור החופשי המוצקechniques כיום מועסק הוא הדפסת bioprinting והזרקת דיו בסיוע לייזר. טכניקות bioprinting בסיוע לייזר להשתמש במקור פעמו לייזר, צלחת יעד, ומצע קבלה כדי ליצור תלת-ממדי. עם זאת, טכניקה זו היא מוגבלת בשל תפוקה נמוכה, כדאיות תא נמוכות, ורק יכולה לייצר הסדרים מוגבלים של מבנים מפוברק כי רק prepolymers photocrosslinkable יכול לשמש ליצירת הידרוג'ל crosslinked. הדפסת דיו פותחה כמתודולוגיה ללא מגע שמתרבה נתוני תמונה דיגיטליים על מצע על ידי הפקדת דיו picoliter. עם זאת, הדפסת דיו אינו מייצר מבנה ברזולוציה גבוהה, בונה denaturation חלבון המהיר ניסיון, ורבים מהתאים lysed בתצהיר.
נכון לעכשיו, שיטות bioprinting ייצור תוסף חדשות פותחו. במערכות אלה תאים, חלבונים, גורמי צמיחה, והידרוג biomimetic משולבים בדרך כלל למאטר מטריצהials במהלך תהליך הייצור ובמקביל הופקד באמצעות מפעילים מבוקרים מחשב כדי ליצור מבנים המבוסס על פיגום תלת ממדי תא עמוס המחקים את ארכיטקטורה של ילידים באופן הדוק. הידרוג התא-לאדן מהווה bioink, אשר יכול להיות הטרוגנית, הכוללים סוגים שונים של תאים, או הומוגנית. תוסף מערכות ייצור ההפקדה bioink הנפתח ידי שחרור או שכבה אחר שכבה באמצעות מזרקים וטיפים חד פעמי על במה מבוקרת מחשב מסוגל לנוע בכיווני x, y, z. באמצעות תוכנת מחשב, הארכיטקטורה של פיגומים מודפסים ניתן להשפיע בקלות בהתאם לדרישות של היישום. שלא כמו טכניקות קונבנציונליות, טכנולוגיות תלת-ממדיות רפואיות (הדמיית תהודה מגנטית, טומוגרפיה ממוחשבת) ניתן לשלב עיצובים, יצירת מבנה מטופל ספציפי. שיטות אלה גם מאפשרות את האפשרות של ייצור תחליפי כלי דם כי מבנים מיוצרים עם l גבוה יותרצפיפות מהספריה תא, המאפשר אינטראקציות תא-תא ושיפור הסיכוי לsurviva לאחר ההשתלה.
מדפסת Palmetto היא מערכת רב-מתקן תלת-ממדית בנויה מותאם אישית שמשתמשת בשיטות ייצור הרובוטית לתכנות כדי ליצור מבנים תלת-ממדיים הטרוגנית רקמה (איור 1). זה מאפשר את השימוש בריבוי של חומרים בשילובים ייחודיים לייצר מבנים הטרוגנית. האתחול של bioprinter הוא אחד הצעדים החשובים ביותר בbioprinting כי זה מאפשר לך להגדיר מגוון רחב של פרמטרים כדי לייעל את printability של מבני bioprinted.
Bioprinter כולל תהליך סוג אצווה עם רצפי הפעלה, תפעול וכיבוי נשלטים על ידי בקר מתוכנת היגיון (PLC), שבו המשתמש פועל באמצעות לוח בקרת מסך מגע אינטראקטיבי (איור 1,). על מנת למנוע זיהום של ביוחומרים הגיוניים bioprinter מוקף בפולי חיובי בלחץ (methacrylate מתיל) קאמרי (PMMA) עם arrestance יעילות גבוהה חלקיקים (HEPA) -filtered מערכת זרימת האוויר (איור 1, B, C). הפנים של המדפסת ניתן לעקר באמצעות המקורות מובנים אור אולטרה סגול (איור 1, D). הרכיב של bioprinter המרכזי הוא רובוט מיצוב תכנות מלא שיכול reproducibly למקם קצה מתקן עם דיוק של 10 מיקרומטר (איור 1, E). ישנם שלושה מכשירי, אשר מסוגל להפקיד בנפחים קטנים כמו 230 NL באמצעות בורגי (איור 1, F). הם באופן עצמאי לתכנות באמצעות מחשבים נפרדים ששולטים פרמטרים הדפסה עבור כל מתקן (איור 1, G). מחלק רוטרי הבורג מנצל את הסיבוב של בורג מונע במנוע להעביר bioink את מזרק ומתוך קצה המזרק. מכשירי אלה רכובים על גבי pneumaticalקן כלי ly המבוקר (איור 2 א, ב '), המאפשר לרובוט לעבור מנפק רכוב על גבי הזרוע הרובוטית Z-הציר בשליטה מתוכנתת (איור 1, H).
רובוט XYZ מקבל הוראות הדפסה מתוכנת עיצוב מחשב עם מערכת הפעלה (איור 1, I). כל תכנית מכילה מקומות מחלק, שגרה כיול, ופרוטוקולי שינוי-מנפק. העיצוב של מבנים שנוצרו בעיקר מורכב מXYZ קואורדינטות שבו כל מתקן יהיה להפקיד חומר. Bioprinter כולל שני חיישנים אופטיים אור (איור 2 ג) הקובעים את XYZ קואורדינטות של סוף קצה מזרק. חיישנים אלו שולחים לתאם מידע לרובוט, אשר משתמש בם כדי לחשב את עמדות של קצות קצה מתקן. יש לייזר עקירה נוסף (איור 2 ד) שמקרין קרן לייזר אדומה 633 ננומטר דיודה של גודל נקודה 30 x 100 מיקרומטר למדוד מרחק עם AccuraCY של 0.1 מיקרומטר. כאשר הקרן היא מאוד ממוקדת הרובוט קובע את מרחק Z של משטח ההדפסה. מדידה זו, ומדידת חיישני אור האופטית של סוף הקצה בZ, מאפשר חישוב מדויק Z קואורדינטות המשמש למקום קצה המתקן ביחס למשטח ההדפסה. הטיפים מנפק להעביר רוחבי ואנכי דרך חיישן אור האופטי X-הציר בכיוון כדי למצוא את מרכזי Y ו- Z, ורוחבי באמצעות חיישן ציר Y כדי למצוא את המרכז של ציר ה- X. משטח ההדפסה ממופה באמצעות הנוסחא למישור שטוח בחלל XYZ: + גרזן על ידי + CZ = ד כדי לקבוע היכן הוא ביחס למשטח העמדה של סוף הקצה מחלק. שלב המדפסת (איור 1, J) מחזיק מדגם צלחת פטרי עד 80 מ"מ קוטר ומשתמש אמבט מים הסירקולציה המחודשת כדי לשמור על הטמפרטורה הקבועה (איור 1, K). טמפרטורת שלב ניתן להגדיר בטווח של -20 ונשארה יציב ב. יש מצלמה USB רכובעל Z-זרוע הרובוט לספק תצוגה מוגדלת של קצה מחלק בתהליך ההדפסה (איור 1, L). יש מצלמה שנייה רכובה לעבר החלק העליון של הפנים התא שמספק תצוגה של bioprinter מלאה בתהליך ההדפסה (איור 1, L).
תוכנת ציור תכנון בעזרת מחשב קובע את הדפוס בתצהיר ומאפשרת למשתמש ליצור טיפות במרווחים בהדרגה ומבנים מורכבים (איור 3). מסלולים תלת ממדים יכולים להיות מקודדים באופן ידני לתוך תוכנת עיצוב המדפסת תואמת או מיובא מתוכנה נפרדת בעזרת מחשב ציור עיצוב (איור 4, טבלת 1). תוכנת המדפסת תואמת מאפשרת וריאציות של פרמטרים כגון הדפסה בשיטה בתצהיר (תצהיר אגל בודד או בתצהיר מסלול רציף), גיאומטריה תלת ממדית של המסלולים, שיעור בתצהיר, מרחק בין קצה קצה המזרק וsubstמשטח הדפסת שיעור, משך הזמן להפקיד ירידה בודדת, והגובה ולהאיץ את המזרק הוא הרים בין בתצהיר של הטיפות. כל תכנית מכילה מקומות XYZ מחלק, שגרות כיול קצה, ופרוטוקולים משתנים מתקן לספק סביבת סטרילית, ללא התערבות מפעיל, במהלך הדפסה. בקר ההיגיון לתכנות (PLC) של הרובוט מקבל הוראות מהמחשב פועלות תוכנת העיצוב ושולט בעיתוי של אירועים מהבקרים החיצוניים (למשל, מכשירי). כדי לעשות זאת, PLC משתמש במנגנון לולאה לשלוט מכשירי , מכשיר רובוטי מיצוב, וגורמים סביבתיים.
bioprinting ישיר לכתוב תלת ממדי ניצול, מערכת מחלק נוזלית סיבובי בורג מאפשר התהליך של הפקדת תאים להיות יותר יעיל, מדויק, וקל יותר משיטות קודמות. מחקר זה מראה bioprinter נבנה מותאם אישית הוא מסוגל לייצר לספירהמבני הידרוג'ל LL-עמוס כדאיות גבוהה תא.
Protocol
1. הכנת מצע המכיל ג'לטין לBioprinting תלת הממדי של הידרוג אלגינט
- הכן את מצע סידן / ג'לטין הבא שיטת מצע סידן / ג'לטין שתוארה על ידי פאטאקי et al 11, כדי למנוע כדאיות מופחתת קשורה עם תכולה גבוהה. שיטת מצע סידן / ג'לטין היא מפורטת להלן.
- לשלב ליבש סידן כלורי (1.5% WT), נתרן כלורי (0.9% WT), וג'לטין חזירי (2% wt) במים מזוקקים ולהרתיח במשך 2 דקות כדי ליצור פתרון ג'לטין 100 מ"מ.
- יוצקים 5 מיליליטר של פתרון ג'לטין / סידן לתוך צלחות פטרי סטנדרטית 100 מ"מ, לערבל את הפתרון בסביבה כדי לעשות אפילו ציפוי על פני השטח, ומניחים על משטח שטוח במקרר לO ג'ל / N (לאפשר לג'ל לפחות 8 שעות לפני השימוש).
- כדי להגדיל את האטימות של פני השטח המצע, להוסיף טיטניום דו-חמצני (0.3% WT) ל/ פתרון 2 ג'לטין CaCl. מערבבים במשך 10 דקות. AUToclave פתרון ג'לטין / Tio 2 על מחזור הנוזלים למשך 30 דקות כדי לעקר אותה.
- להוסיף 3 מיליליטר של / Tio 2 פתרון ג'לטין אל פני השטח של צלחות ג'לטין שהוכנו קודם לכן. מערבולת את התערובת כדי לוודא שהוא מתחלק באופן שווה על פני השטח. לאפשר לג'ל בO מקרר 4 ° C / N (לאפשר לג'ל לפחות 8 שעות לפני השימוש). מצעים יש להשתמש תוך 3 ימים.
2. אלגינט חמצון
- חמצן bioink אלגינט נתרן הבא השיטה לאלגינט חמצון חלקית על ידי Bouhadir אל et 30 מתוארים להלן.
- כדי להפוך פתרון אלגינט חמצון 5%, לפזר 1 גרם של אלגינט נתרן במים מזוקקים 100 מיליליטר. להוסיף תמיסה מימית של נתרן periodate (0.25 מ ', 0.25 mmol), סוכן חמצון, כדי לייצר פתרון חמצון 5%. מערבבים במשך 19 שעות ב RT. להוסיף אתילן גליקול 40 מיליליטר לפתרון לאחר 24 שעות לסיים את המחשבהction.
- ממיסים 2.5 גרם של נתרן כלורי בפתרון. להוסיף סכום עודף של אתיל אלכוהול (2: 1 יחס) כדי לזרז alginates חמצון. צנטריפוגה הפתרון XG ב 1000 כדי לאסוף את משקעים ומחדש לפזר אותם במים מזוקקים. חזור על לשטוף אתנול.
- להקפיא-לייבש את כדורי חמצון אלגינט ולאחסן ב -20 ° C עד מוכן לשימוש.
- לקבוע את מידת החמצון על ידי מדידת אחוז נתרן periodate צרך לפני שהופסק על ידי אתילן גליקול.
- הכן פתרון יודיד האשלגן (20% w / v, pH 7.0 חיץ פוספט נתרן) ופתרון thyodene (10% w / v, חיץ פוספט 7.0 נתרן pH). לערבב את שני פתרונות עם אלגינט חמצון ב RT.
- בהדרגה לשחרר את פתרון periodate אלגינט נתרן והגיב לתוך התערובת של פתרונות יודיד האשלגן וtheodyne. מדוד את הספיגה של התערובת spectrophotometrically ב426 ננומטר. כשזה הגיעמקסימום, להקליט נפח שימוש של פתרון periodate אלגינט ונתרן כV 1.
- התגובה היא
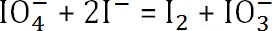 . כמות periodate נתרן unreacted היא
. כמות periodate נתרן unreacted היא 
- להפחית את כמות הנתרן periodate unreacted מהריכוז המקורי כדי לקבוע את כמות הנתרן שנצרך periodate. שימוש בנוסחא הקודמת, לקבוע את מידת החמצון הסופית של אלגינט.
3. אלגינט פפטיד הצמידה
- ligands המצומד עם רצף נחשף ארגינין-גליצין-aspartate (פפטיד) להכין בעבר אלגינט חמצון על-ידי ביצוע שיטת נטיית RGD-אלגינט על ידי רולי et al 31 מתוארות להלן כדי לקדם מצורף תא ומתפשט.
- השתמש carbod המימיכימיה iimide עם G 4 המצומד RGDSPto 31.
- ממיסים 1 גרם של 5% אלגינט חמצון בחומצת 0.1 מ '2 (N-morpholino) ethanesulfonic (MES) חיץ, pH = 4. מוסיף 1-ethyl- carbodiimide (dimethylaminopropyl) (EDC, 0.54 mmol) ו- N-Hydroxysuccinimide ( NHS, 0.27 mmol) ב -2: 1 יחס לצורת ביניים אמיד.
- להוסיף 0.28 mmol פפטיד, צימוד לעמוד השדרה של פולימר אלגינט באמצעות אמין המסוף. מערבבים בRT O / N.
- לעצור את תגובת הצימוד על ידי הוספת נתרן כלורי 2.5 גר 'לפתרון. להוסיף סכום עודף של אתיל אלכוהול (2: 1 יחס) כדי לזרז alginates חמצון. צנטריפוגה את התערובת על 4,000 XG במשך 5 דקות כדי לאסוף את משקעים. לשאוב את התקשורת במכסת מנוע תרבית תאים ומחדש לפרק את משקעים במים מזוקקים. חזור על לשטוף אתנול.
- להקפיא-לייבש את משקעים עד שהופך יבשים לחלוטין (יופיע כחומר אבקתי לבן) ולאחסן במקרר -20 ° C לשימוש מאוחר יותרלהשתמש.
4. תאי סטרומה רקמת שומן אדם תרבית התאים (של hADSC)
- תאי סטרומה רקמת תרבות שומן אנושי ב -75 סנטימטרים טופלו צלוחיות תרבית תאים (צלוחיות T75), מכוסים 15 מיליליטר DMEM גלוקוז הנמוך עם 10% בסרום שור עוברי 1% פניצילין, סטרפטומיצין, גלוטמין 1%, וantimycin 1%. (של hADSC) לשנות את התקשורת, בשכונה תרבית תאים, כל יומיים עד שהם הגיעו confluency (80-90%).
- ברגע שהמחוברות, להעביר את צלוחיות T75 למכסה מנוע תרבית תאים ולהשעות את hADSC של השימוש בשיטת עיכול אנזים טריפסין.
- בשכונה, לשאוב את כל תקשורת תרבות תא משל התאים. לשטוף עם 5 מיליליטר של פוספט שנאגר מלוח של Dulbecco עם סידן ומגנזיום (DPBS ++). לשאוב DPBS ++ הנחה של התאים.
- בעוד שבמכסה המנוע, לעשות פתרון של טריפסין וDPBS ++ על ידי ערבוב 1 מיליליטר DPBS טריפסין ו -4 מיליליטר ++. כל בקבוק דורש 5 מיליליטר של solutיון, כדי להפוך את הנפח המתאים למספר צלוחיות ומחוברות. הוסף 5 מיליליטר של טריפסין / DPBS ++ לכל בקבוק ולשים אותם בחממה במשך 2 דקות.
- לאחר 2 דקות, להסיר את צלוחיות והקש קל הצדדים שלהם כדי לשחרר את התאים מהתחתית. תסתכל על כל בקבוק תחת מיקרוסקופ כדי להבטיח את התאים מושעים. מניחים את צלוחיות בחזרה למכסת מנוע תרבית תאים ולהוסיף 3 מיליליטר של תקשורת בתרבות התא המתאימה לכל בקבוק. זה מסיים את תגובת טריפסין.
- העבר את התקשורת הסלולרי עמוסה מכל בקבוק ולשים בחרוטי 50 מיליליטר. צנטריפוגה XG ב 1000 במשך 5 דקות. התאים אמורים להופיע כגלולה לבנה קטנה בתחתית חרוטי. העבר בחזרה למכסת מנוע תרבית תאים ולשאוב את התקשורת. Resuspend התאים 2 מיליליטר של תקשורת בתרבות התא.
- ספירת התאים באמצעות hemocytometer מתחת למיקרוסקופ. ברגע שהתאים נספרו, בשכונה התרבות, aliquot הסכום של מדיה המכיל ~ 1.3 million תאים והעברה לחרוטי 15 מיליליטר. צנטריפוגה חרוטי 15 מיליליטר המכילים את התאים שוב במשך 5 דקות ב 1000 x גרם.
- בשכונה התרבות, reseed תאים שנותרו בT-75 צלוחיות מרובות, הוספת ריכוז של 350,000 תאים ~ לכל בקבוק. הוסף 15 מיליליטר של תקשורת DMEM ולחזור לחממה עד מחוברות שוב.
- ברגע שמחזור צנטריפוגה הוא מוחלט, לחזור חרוטי 15 מיליליטר לתרבית התאים. לשאוב התקשורת מהתא גלולה, וresuspend התאים בתמיסה מימית אלגינט בריכוז של 1.3 מיליון תאים למיליליטר של bioink, terteriating הפתרון לעתים קרובות ולכן יש חלוקה הומוגנית של תאים בbioink. טען את פתרון התא עמוס לתוך מזרק 3 מיליליטר מדפסת תואמת סטרילי ולדפוק על קצה פלסטיק סטרילי 22 G.
5. הגדרת Bioprinter
- הפעל את bioprinter, כל אחד מהמחשבים מנפק, וrecirculating אמבט מים.
- ידני להגדיר את טמפרטורת אמבט מים הסירקולציה המחודשת למנגנון gelation.
- הגדרה ידנית של פרמטרים הדפסה עבור כל מתקן במחשב מתקן correlating. הגדר את לוותר נפח 230 מספר NL, של backsteps 0, והשיעור לוותר ל10μl -sec.
- פתח את תוכנת העיצוב והתכנית לצפייה התצוגה של המצלמה USB במחשב.
- שימוש בתוכנה, להזין באופן ידני את הקואורדינטות למערך נקודה 5 X 5 עם 2.4 מ"מ מרווח בין טיפות.
- הגדר את הפרמטרים ההדפסה להיות: מרחק בין קצה קצה ומשטח מצע = 0.1 מ"מ; מזרק גובה יוסר בין תצהירים = 20 מ"מ; את משך זמן לתצהיר = 1 שניות.
- שמור את התכנית ולשלוח אותו לרובוט.
- מניחים את צלחת פטרי ג'לטין / Tio 2 המכיל בשלב מדפסת 4 ° C. סגור ולנעול את דלת התא.
- השתמש במועצה המחוקקת הפלסטינית לINItialize מקורות אור אולטרה סגול, ולעקר את החדר למשך 90 שניות.
- ברגע שהעיקור הוא מלא, לפתוח את התא ולטעון את המזרק המכיל לסגור 1. התלוי באלגינט לאקדח של hADSC ולנעול את דלת התא.
- השתמש במועצה המחוקקת הפלסטינית כדי להפעיל את מערכת המאוורר, לחכות 30 שניות ללחץ פנימי שיווי משקל.
- במחשב, להפעיל את התכנית המכילה את הפרמטרים מסלול והדפסה הגיאומטריים.
- לאורך כל תהליך ההדפסה, לצפות בתצוגה של המצלמה USB במחשב כדי לאשר הדפסה מדויקת ואחידה.
- ברגע שסיימה הדפסה, לאפשר לבונת ג'ל ל-40 דקות.
הערכת הכדאיות 6. סלולארי
- מכסה את המבנים שלא הולכים להיות צילמו מייד לאחר הדפסה בDMEM וחנות בחממה עד הזמן של הדמיה.
- כדי לכמת את יכולת הקיום של המבנים, להכתים אותם באמצעות assay כדאיות / רעיל מבוסס ניאון,תמונת ND באמצעות מיקרוסקופ confocal.
- בעקבות הוראות הערכה, להכין פתרון מכתים המכיל AM calcein וhomodimer-1 ethidium. כדי להפוך 10 מיליליטר של פתרון מכתים, להוסיף 20 μl של homodimer-1 ethidium ו -5 μl של calcein בבוקר עד 10 מיליליטר של סטרילית, פוספט שנאגר מלוח של הכיתה תרבית רקמת Dulbecco (+ מגנזיום, + סידן; DPBS ++).
- לטבול את מבני bioprinted בפתרון הכתם במשך 15 דקות בחושך.
- תמונת בונה המוכתמת באמצעות מערכת מיקרוסקופ confocal בימים 0 ו8. קח מספר תמונות של כל מבנה bioprinted, באמצעות פרמטרים Z-ערימה של 30 פרוסות אופטיות על עומק 300 מיקרומטר, ולספור באופן ידני את התאים. אם תאים מופיעים צהובים או ירוק לספור אותם כחיים, ואם אדום, לספור אותם כמת.
- לחשב את אחוז כדאיות תא כמספר תאי חיים מחולקים במספר הכולל של תאים במבנה; תא הכדאיות = מספרתאי חיים (ירוק + צהוב) / מספר התאים הכולל (ירוק + צהוב + אדום) x 100%.
- לחשב את הסכום של תא התפשטות עבור כל דגימה כמספר התא של יום 8 מחולק במספר התאים ביום 0; התפשטות תאים = ספירת תאים חיות ב -8 / תא חי היום יום לסמוך על 0 x 100%.
7. RGD פפטיד הצמידה ניתוח
- כדי לנתח את ההצלחה של נטיית פפטיד RGD באלגינט, להשוות אלגינט RGD-מצומדות ואלגינט אינו מצומדות. כדי לעשות זאת, תמונת המבנים שהודפסו ב( 4 ', 6-Diamidino-2-Phenylindole, dihydrochloride) כתמים (DAPI) וphalloidin.
- הפוך phalloidins עובד פתרון על ידי דילול 5 μl של פתרון מניות methanolic עם 200 μl של DPBS ++. חנות ב -20 ° C עד שימוש.
- הפוך פתרון 300 מיקרומטר מניות של כתם DAPI הבא המשוואה: (ז .10509 / L) / (350.3 g / mol) = 3 × 10 -4 M = 0.0003 M = 0.300 מ"מ = 300 מיקרומטר. הפוך הדואר DAPI עובד פתרון על ידי דילול מניות פתרון 1: 100 בDPBS ++ להשיג 3 מיקרומטר פתרון. חנות ב -20 ° C עד שימוש.
- לחלוטין להטביע את המדגם בparaformaldehyde 4%. דגירה עבור שעה 1 ב RT. לשטוף שלוש פעמים עם DPBS ++, המאפשר הפתרון לשבת במשך 5 דקות כל אחד לשטוף. להעביר את מדגם ג'ל מהבאר לשקופיות זכוכית, מרפרף על פני ג'ל בתהליך. לטבול את הג'ל ב 0.1% Triton X-100 (0.1 גר '/ 100 מיליליטר) בDPBS ++ במשך 10 דקות. לשטוף שלוש פעמים עם DPBS ++, המאפשר לכל אחד 5 דקות לשטוף.
- להכתים את המבנים המודפסים עם phalloidin ידי טבילתם בפתרון עובד. מכסה בנייר כסף ודגירה של 4 שעות. להסיר את הכתם ולשטוף phalloidin שלוש פעמים עם DPBS ++. לשטוף הראשון צריכים להיות מהיר, שטיפות האחרונות צריכה לשבת במשך 5 דקות כל אחד.
- להכתים את המבנים המודפסים עם DAPI ידי טבילתם בפתרון עובד DAPI. מכסה בנייר כסף ולדגור על RT למשך 30 דקות. לשטוףשלוש פעמים עם DPBS ++, המאפשרות לכל לשטוף לשבת במשך 5 דקות. להתבונן ותמונת הדגימות במערכת מיקרוסקופ confocal.
תוצאות
התוצאות מראות bioprinter מסוגלת הפקדת הידרוג תא-לאדן במקומות תלת ממדים ספציפיים באופן מדויק ועקבי באמצעות תוכנה בעזרת מחשב. תוכנות אלה קובעות את המיקום של כל טיפה ולשלוט רבים של הפרמטרים לבקבוק (איור 3,4). הדירות של bioprinter להפקיד כראוי בביו-חומרים היא יסוד להצלחה ש?...
Discussion
ההתמקדות העיקרית של הנדסת רקמות היא לגשר על הפער בין מחסור באיברים ולצרכי השתלה על ידי פיתוח תחליפים ביולוגיים מסוגלים להחזיר, שמירה, או שיפור functio רקמות ילידים. זה הוביל לייצור הישיר של פיגומים עם מורכב, גיאומטריה חיצונית נכונה מבחינה אנטומית, ושליטה מדויקת geometr הפנ?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי תמיכת ממשלה לפי EPS-0903795 גרנט מס 'המוענק על ידי הקרן הלאומית למדע, NIH NIDCR R01-DE019355 (MJY PI), וגרנט 8P20 GM103444 (י"מ PI).
Materials
| Name | Company | Catalog Number | Comments |
| Positioning Robot (JR2000 XYZ) | Janome | ||
| Dispensers: SDAV Linear Drive SmartDispensers | Fishman Corporation | ||
| Optical Light Sensors: | Keyensce | ||
| Displacement Laser: OD Mini | SICK | ||
| Recirculating Water Bath: Polystat | Cole-Parmer | EW-12122-02 | |
| USB Cameras: Dino-Lite Premier 5MP | AnMo Electrionics/YSC Technologies | AD7013MT | |
| Printer-Compatible Computer Design Software: JR-C Points | Janome | Comes with purchase of Janome Robot | |
| Computer-Aided Design Drawing Software: Visual PathBuilder | RatioServ | Can be downloaded at: www.ratioserv.com/index.php/downloads | |
| Printer 3 cc Syringes: | Fishman Corporation | 122051 | |
| 22 G Dispenser Tips | Fishman Corporation | Z520122 | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 10035-04-8 | |
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Porcine Gelatin | Sigma-Aldrich | 9000-70-8 | |
| Titanium Dioxide | Sigma-Aldrich | 13462-67-7 | |
| Protanal LF 20/40 Alginate (Sodium Alginate) | FMC BioPolymer | 9005-38-3 | |
| Hydrochloric Acid | Sigma-Aldrich | 7647-01-0 | |
| Ethylene Glycol | Mallinckrodt Baker, Inc | 9300-01 | |
| Sodium Periodate | Sigma-Aldrich | 7790-28-5 | |
| hADSC | Lonza | PT-5006 | Store in vials in liquid nitrogen until use. |
| Dulbecco's Modified Eagle's Medium | Gibco Life Technologies | 11965-092 | Warm in 37 °C water before use. |
| Trypsin/EDTA | Lonza | CC-5012 | Warm in 37 °C water before use. |
| Calcein AM | Gibco Life Technologies | C3100MP | Store in the dark at -80 °C until use. |
| Live/Dead Mammalian Viability Assay Kit | Invitrogen Life Technologies | L-3224 | Store in the dark at -80 °C until use. |
| MES Hydrate | Sigma-Aldrich | M2933 | |
| N-Hydroxysuccinimide | Sigma-Aldrich | 130672 | |
| 1-ethyl-(dimethylaminopropyl) carbodiimide (EDC) | Sigma-Aldrich | E1769 | 10 G |
| Dulbecco's Phosphate-Buffered Saline, +Calcium, +Magnesium | Life Technologies | 14040133 | Warm in 37 °C water before use. |
| Dulbecco's Phosphate-Buffered Saline, -Calcium, -Magnesium | Life Technologies | 14190144 | Warm in 37 °C water before use. |
| RGD Peptides | International Peptides | ||
| Alexa Fluor 546 Phalloidin Stain | Invitrogen Life Technologies | A22283 | Store at -20 °C until use |
| (4’, 6-Diamidino-2-Phenylindole, Dihydrochloride) (DAPI) Stain | Life Technologies | R37606 | Store at -20 °C until use |
References
- Langer, R., Vacanti, J. P. . Tissue Engineering. Science. 260 (5110), 920-926 (1993).
- Derby, B. Review: Printing and Prototyping of Tissues and Scaffolds. Science. 338 (6109), 921-926 (2012).
- Kachurin, A. M., et al. Direct-Write Construction of Tissue-Engineered Scaffolds. Mat. Res. Soc. Symp. Proc. 698, 10-1557 (2002).
- Sachlos, E., Czernuszka, J. T. Making Tissue Engineering Scaffolds Work. Review on the Application of Solid Freeform Fabrication Technology to the Production of Tissue Engineering Scaffolds. European Cells and Materials. 5, 29-40 (2003).
- Yeong, W. Y., Chua, C. K., Leong, K. F. Rapid Prototyping in Tissue Engineering. Challenges and Potential. Trends Biotechnol. 22 (12), 643-652 (2004).
- Landers, R., Pfister, A., Hubner, U., John, H., Schmelzeisen, R., Mulhaupt, R. Fabrication of Soft Tissue Engineering Scaffolds by means of Rapid Prototyping Techniques. Journal of Materials Science. 37 (15), 3107-3116 (2002).
- Murphy, S. V., Skardal, A., Atala, A. Evaluation of Hydrogels for Bio–Printing Applications. Journal of Biomedical Materials Research Part A. 101A (1), 272-284 (2013).
- Burg, K. J. L., Boland, T. Minimally Invasive Tissue Engineering Composites and Cell Printing. IEEE Eng Med Biol Mag. 22 (5), 84-91 (2003).
- Billiet, T., Vandenhaute, M., Schelfhout, J., Van Vlierberghe, S., Dubruel, P. A Review of Trends and Limitations in Hydrogel-Rapid Prototyping for Tissue Engineering. Biomaterials. 33 (26), 6020-6041 (2012).
- Khalil, S., Nam, J., Sun, W. Multi–Nozzle Deposition for Construction of 3D. Biopolymer Tissue Scaffolds. Rapid Prototyping Journal. 11 (1), 9-17 (2005).
- Pataky, K., Braschler, T., Negro, A., Renaud, P., Lutolf, M. P., Brugger, J. Microdrop Printing of Hydrogel Bioinks into Three–Dimensional Tissue–Like Geometries. Adv Mater. 24 (3), 391-396 (2011).
- Pati, F., Shim, J. H., Lee, J. S., Cho, D. W. Three-Dimensional Printing of Cell–Laden Constructs for Heterogeneous Tissue Regeneration. Manufacturing Letters. 1 (1), 49-53 (2013).
- Gruene, M., et al. Laser Printing of Three–Dimensional Multicellular Arrays for Studies of Cell–Cell and Cell–Environment Interactions. Tissue Eng. 17 (10), 973-982 (2011).
- Khalil, S., Sun, W. Bioprinting Endothelial Cells With Alginate for 3D Tissue Constructs. J Biomed Eng. 131 (11), 1-8 (2009).
- Xu, T., et al. Hybrid Printing of Mechanically and Biologically Improved Constructs for Cartilage Tissue Engineering Applications. Biofabrication. 5 (1), 1-10 (2012).
- Zhang, T., Yan, K. C., Ouyang, L., Sun, W. Mechanical Characterization of Bioprinted in vitro Soft Tissue Models. Biofabrication. 5 (4), 1-10 (2013).
- Chung, J. H. Y., et al. Bio–ink Properties and Printability for Extrusion Printing Living Cells. J. Biomater. Sci., Polym. Ed. 1 (7), 763-773 (2013).
- Yang, S., Leong, K. F., Du, Z., Chua, C. K. The Design of Scaffolds for Use in Tissue Engineering. Part II. Rapid Prototyping Techniques. Tissue Engineering. 8 (1), 1-11 (2002).
- Ferris, C. J., Gilmore, K. G., Wallace, G. G., Panhuis, M. Biofabrication: An Overview of the Approaches Used for Printing of Living Cells. Appl. Microbiol. Biotechnol. 97 (10), 4243-4258 (2013).
- Lu, L., Mikos, A. G. The Importance of New Processing Techniques in Tissue Engineering. MRS Bull. 21 (11), 28-32 (1996).
- Wake, M. C., Gupta, P. K., Mikos, A. G. Fabrication of pliable biodegradable polymer foams to engineer soft tissues. Cell Transplant. 5, 465-473 (1996).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J. Organ Printing: Tissue Spheroids as Building Blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Norotte, C., Marga, F. S., Niklason, L. E. Scaffold–free Vascular Tissue Engineering Using Bioprinting. Biomaterials. 30 (30), 5910-5917 (2009).
- Devillard, R., et al. Cell Patterning by Laser–Assisted Bioprinting. Methods Cell Biol. 119, 159-174 (2014).
- Binder, K. W., Allen, A. J., Yoo, J. J. Drop–on–Demand Inkjet Bioprinting: a Primer. Gene Ther Reg. 6 (1), 33 (2011).
- Xu, T., et al. Viability and Electrophysiology of Neural Cell Structures Generated by the Inkjet Printing Method. Biomaterials. 27 (19), 3580-3588 (2006).
- Calvert, P. Inkjet Printing for Materials and Devices. Chem Mater. 13 (10), 3299-3305 (2001).
- Chang, C. C., Boland, E. D., Williams, S. K. Direct–Write Bioprinting Three–Dimensional Biohybrid Systems for Future Regenerative Therapies. J Biomed Mater Res B Appl Biomater. 98 (1), 160-170 (2011).
- Li, M. G., Tian, X. Y. A Brief Review of Dispensing–Based Rapid Prototyping Techniques in Tissue Scaffold Fabrication: Role of Modeling on Scaffold Properties Prediction. Biofabrication. 1 (3), 1-10 (2009).
- Bouhadir, K. H., Lee, K. Y., Alsberg, E., Damm, K. L., Anderson, K. W., Mooney, D. J. Degradation of Partially Oxidized Alginate and its Potential Application for Tissue Engineering. Biotechnol Prog. 17 (5), 945-950 (2001).
- Rowley, J. A., Madlambaya, G. Alginate Hydrogels as Synthetic Extracellular Matrix Materials. Biomaterials. 20 (1), 45-53 (1999).
- Smith, C. M., Christian, J. J., Warren, W. L. Characterizing Environmental Factors that Impact Viability of Tissue–Engineered Constructs Fabricated by a Direct–Write Bioassembly Tool. Tissue Engineering. 13 (2), 373-383 (2007).
- Ozbolat, I., Yu, Y. Bioprinting Towards Organ Fabrication: Challenges and Future Trends. IEEE Trans Biomed Eng. 60 (3), 691-699 (2012).
- Peltola, S. M., Melchels, F. P., Grijpma, D. W., Kellomaki, M. A. A Review of Rapid Prototyping Techniques for Tissue Engineering Purposes. Annals of Medicine. 40 (4), 268-280 (2008).
- Malda, J., et al. 25th Anniversary Article: Engineering Hydrogels for Biofabrication. Adv Mat. 25 (36), 5011-5028 (2013).
- Murphy, S. V., Atala, A. 3D Bioprinting of Tissues and Organs. Nat Biotech. 32 (8), 773-785 (2014).
- Jia, J., et al. Engineering Alginate as Bioink for Bioprinting. Acta Biomaterialia. 10 (10), 4323-4331 (2014).
- Forty, R. A., Steinberg, M. S. The Differential Adhesion Hypothesis: a Direct Evaluation. Developmental Biology. 278 (1), 255-263 (2005).
- Wang, L., Shansky, J., Borselli, C., Mooney, D., Vandenburgh, H. Design and Fabrication of a Biodegradable, Covalently Crosslinked Shape–Memory Alginate Scaffold for Cell and Growth Factor Delivery. Tis Eng Part A. 18 (19-20), 2000-2007 (2012).
- El–Sherbiny, I. M., Yacoub, M. H. Hydrogel Scaffolds for Tissue Engineering: Progress and Challenges. Global Cardiology Science, & Practice. 3 (38), 316-342 (2013).
- Smith, C. M., et al. Three–Dimensional BioAssembly Tool for Generating Viable Tissue-Engineered Constructs. Tissue Engineering. 10 (9–10), 1566-1576 (2004).
- Ozbolat, I. T., Chen, H. Development of a ‘Multi-arm Bioprinter’ for Hybrid Fabrication of Tissue Engineering Constructs. Robotics and Computer–Integrated Manufacturing. 30 (3), 295-304 (2014).
- Kolesky, D. B., Truby, R. L., Gladman, A. S., Busbee, T. A., Homan, K. A. Three-Dimensional Bioprinting of Vascularized, Heterogeneous Cell–Laden Tissue Constructs. Adv Mater. X. Adv Mater. X, x-y (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved