A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמית ratiometric של pH התאי Biofilms השיניים
In This Article
Summary
לצבוע ratiometric רגיש pH משמש בשילוב עם מיקרוסקופ סריקת לייזר confocal וניתוח תמונה דיגיטלית לפקח pH תאיים biofilms שיניים בזמן אמת.
Abstract
ה- pH ב biofilms חיידקים על השיניים היא בעלת חשיבות מרכזית עבור עששת, מחלה עם שכיחות ברחבי העולם גבוהה. Nutrients מטבוליטים אינם מתחלקים באופן שווה ב biofilms שיניים. גומלין מורכב של וספיחה כדי ותגובה עם חומר אורגני ביופילם מפחית השבילים דיפוזיה של מומסים ויוצר הדרגתיים תלולה של מולקולות, כוללים חומצות אורגניות, מעבר ביופילם. שיטות מיקרוסקופיות פלורסנט כמותי, כגון הדמיה זמן החיים הקרינה או pH ratiometry, יכול להיות מועסק על מנת להמחיש pH במיקרו-סביבות שונות של biofilms שיניים. pH ratiometry מנצל משמרת תלויי pH של פליטת ניאון של צבעים pH רגיש. חישוב יחס הפליטה בשני אורכי גל שונים מאפשר קביעת pH מקומית תמונות מיקרוסקופיות, ללא קשר הריכוז של הצבע. בניגוד microelectrodes הטכניקה מאפשרת ניטור הוא הדרגתי pH אנכי ואופקית בזמן אמת עםמתוך מכאני להפריע ביופילם. עם זאת, יש להקפיד להבדיל במדויק בין תאי חוּץ ו התאיים של ביופילם. הנה, לצבוע ratiometric, seminaphthorhodafluor-4F 5 (ו -6) חומצה קרבוקסילית (C-SNARF-4) הוא מועסק כדי לפקח pH תאיים in vivo גדל biofilms שיניים של הרכב מינים שאינם מוכרים. בחשיפה לגלוקוז לצבוע תלוי-המרוכז בתוך כל תאי חיידקי biofilms; הוא ובכך לשמש הוא כתם אוניברסלית חיידקים כסמן של pH התאי. לאחר רכישת תמונה מיקרוסקופית confocal, ביומסה החיידקים תוסר כל התמונות באמצעות תוכנת ניתוח תמונה דיגיטלית, המאפשרת לחשב pH התאי באופן בלעדי. ratiometry pH עם צבע ratiometric הוא מותאם היטב כדי ללמוד pH התאי biofilms הדקה של עד 75 מיקרומטר עובי, אבל מוגבל בטווח pH בין 4.5 ו -7.0.
Introduction
השיטה המתוארת כאן מאפשר ניטור pH תאיים biofilms שיניים בטווח שבין 4.5 ו -7, באמצעות צבע ratiometric seminaphthorhodafluor-4F 5 (ו -6) חומצה קרבוקסילית (C-SNARF-4) בשילוב עם מיקרוסקופ סריקת לייזר confocal ו ניתוח תמונה דיגיטלי. צבע פלואורסצנטי המועסק הוא pH רגיש ומציג שינוי פליטתו פלורסנט בהתאם למצב של protonation. פליטת הניאון של פסגות מולקולת protonated ב 580 ננומטר, ואת פליטת מולקולת deprotonated ב 640 1 ננומטר. היחס בין עוצמות פליטת הניאון בשני חלונות זיהוי הכולל שתי פסגות הפליטה (576 - 608 ננומטר 629 - 661 ננומטר) ובכך משקפים pH בשלב הנוזלי, ללא קשר ריכוז לצבוע. עם א א PK של ~ 6.4 לצבוע מתאים לדמיין pH בסביבות חומציות מתונה.
PH ב biofilms חיידקי היא בעלת חשיבות מרכזית לכל התהליכים המטבוליים.במקרה של biofilms שיניים, pH במטריצה התאית הוא הגורם ארסי מפתח לפיתוח עששת. תקופות ממושכות עם pH הנמוך ביתרון ממשק ביופילם-שן להאט איבוד מינרלי האמייל הבסיסי 2. בשל הארכיטקטורה תלת-ממדי המורכבת של biofilms, מטבוליטים, כוללים חומצות אורגניות, אינם מפוזרים באופן אחיד על פני ביופילם. מאוד ופחות microenvironments acidogenic ניתן למצוא בסמיכות מרחבית קרובות 3.
במשך עשרות שנים, הדרגתיים pH אנכי biofilms נרשמו בעזרת microelectrodes 4-6. בעוד שהם מציעים רזולוצית מרחבית טובה בשל גודל טיפ הקטן שלהם, הם לא מתאימים היטב כדי לפקח הדרגתיים אופקיים. יתר על כן, החדרת אלקטרודה מפריעה ביופילם מכנית. טכניקות מיקרוסקופיות פלורסנט כמוני מציעות את היתרון של ביטוי חזותי שינויי pH באזורים שונים של ביופילם ללא מכנים להפריעNCE. שדות מיקרוסקופים מבט שונים ניתן לבחור באופן חופשי צלמו שוב ושוב לאורך תקופות ממושכות 1,7-9. עם זאת, כאשר מפרשים תמונות ביופילם מיקרוסקופיות, חשוב להבחין בין הקרינה הנובעת ביומסה מיקרוביאליים הקרינה הנובעת מן המרחב התאי. בתנאים חומציים, pH בתוך תאי חיידקיים שונה pH בתוך תאי מטריקס, כמו החיידקים פעילים להעביר פרוטונים על פני קרום התא שלהם על חשבון אדנוזין אדנוזין 10. בהקשר של עששת, pH חיידקי תאיים אין השפעה ישירה על האמייל הבסיסי ואילו pH תאיים הנמוך מוביל איבוד מינרלים. מיצוע pH ב תמונות מיקרוסקופיות שמכילות הוא חיידקים ללא באזורים וחיידקים מוביל לתוצאות שגויות. השימוש כתם אחרים יחד עם צבע pH הרגיש על מנת להמחיש את ביומסה החיידקים ולבדל בין אזורי חוּץ ו תאיים מביא abאת הסיכון לזיהום הניאון של מרחב התאים ומדידות שווא 11.
כתב היד הנוכחי ולכן מתאר את השימוש של צבע ratiometric ב תפקיד כפול; הן כסמן pH ו ככתם חיידקים אוניוורסלי. כמו לצבוע תלוי-מרוכזים תאים חיידקיים, השילוב של הדמיה מיקרוסקופית confocal ונוהל ניתוח תמונה דיגיטלית מדויקת מאפשר קביעת pH תאיים בטווח שבין 4.5 ו -7.0 ב biofilms שיניים דק.
Protocol
פרוטוקול הניסוי נבדק ואושר על ידי ועדת האתיקה של מחוז ארהוס (M-20,100,032).
1. הכיול מיקרוסקופי Confocal של דיי ratiometric
- עבור רכישת תמונה, משתמש במיקרוסקופ confocal הפוך המצויד באינקובטור, טבילה אובייקטיבית מי צמצם 63X / 1.2-מספרית, קו ליזר 543 ננומטר וגלאי META.
- הכן HEPES חיץ פתרונות מניות (50 מ"מ, מותאם 4.5-8.5 pH בצעדים של 0.1 יחידות pH). פיפטה 100 μl של כל פתרון לתוך הבארות של צלחת 96-גם ברורה תחתונה עבור מיקרוסקופ פלואורסצנטי.
- יש להשתמש בכפפות ניטריל בעת טיפול לצבוע ratiometric C-SNARF-4. כן פתרון מניות 1 מ"מ של הצבע sulfoxide דימתיל. הוסף 5 μl של פתרון המניות היטב כל עם חיץ HEPES. מניחים את צלחת 96-היטב על המיקרוסקופ.
- הפעל את המיקרוסקופ. פתח את תוכנת מיקרוסקופ. לחץ על לוחות הבאים: רוכשת → לייזר; רוכש → Micro; רוכשת Config →; רוכשת סריקת →; רוכשת → שלב. לחמם את החממה עד 37 מעלות צלזיוס.
- הפעל את קו לייזר 543 ננומטר על ידי לחיצה על לייזר 543 ננומטר "על" כפתור בחלון "בקרת לייזר". בחר את מטרת טבילה במי צמצם 63X / 1.2-מספריים בחלון "בקרת מיקרוסקופ".
- הגדר את גלאי META לפקח הקרינה בו זמנית בתוך 576- ל 608 ננומטר (ירוק) ו 629- ל 661 ננומטר (אדום) במרווחים ( "בקרת תצורה" → "CHS"). התאם את עוצמת הלייזר ( "בקרת תצורה" → "עירור"). הגדר את החריר להניב עובי פרוסה אופטי של 1.6 מיקרומטר ( "בקרת סריקה" → "החריר").
- לרכוש תמונה של כל פתרון חיץ HEPES, 5 מיקרומטר מעל תחתית הזכוכית של צלחת 96-היטב. הערה: ברגע שמטוס המוקד ממוקם מתחת תחתית הזכוכית, אין אור ניאון ניתן לראותעל המסך. אחרי כל תמונה שלישית, להגדיר את כוח הליזר לאפס ולקחת תמונה עבור רקע חיסור.
- בצעו את הניסוי כיול בשלושה עותקים (1.2-1.7).
- קבע את עוצמת פלורסנט הממוצעת וסטיית התקן בכל התמונות האדומות וירוקות.
- חשב את R יחס ואת סטיית התקן של הממוצע, S R, עבור כל תמונה על פי משוואות (1) ו- (2)
(1)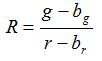
(2)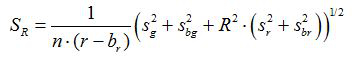
g, r, s g s r והם הממוצעים וסטיות תקן את התמונות ירוק ואדום בהתאמה. g b, b r, s br bg ו- s הם הערכים המתאימים עבור תמונות רקע. n 2 הוא מספר הפיקסלים צילמו. - מגרש את היחסים המחושבים עבור כל ערך pH מהניסויים כיול השלושה לשכפל דיאגרמה לבנות עקום מצויד מסדרה זו של נקודות נתונים (כלומר באמצעות התוכנה SigmaPlot 13). הפוך פונקציה מתמטית מעקומה המצוידת שיכול להמיר יחסים לתוך ערכי ה- pH 10.
- חשב את R יחס ואת סטיית התקן של הממוצע, S R, עבור כל תמונה על פי משוואות (1) ו- (2)
2. אוסף של דגימות biofilm שיניים Grown באתרו
- בחר מתנדב העומדים בקריטריוני כלה ודרה רלוונטיים למחקר. הפוך הופעות אלגינט של קשת השיניים העליונה והתחתונה שלהם. הפכו מודלים יצוקים מן ההופעות הללו מייצרים סד אקריליק בלסת התחתונה. לעצב את הסד עם מסגרת אקריליק buccal מחוברת בכבל לשוני אורתודונטי המאפשר המתנדב לנגוס חסימה רגילה 12.
- מיתון מקדחה בתוך מסגרת buccal של סד אקריליק (איור 1 ) בעזרת burs אקריליק שיניים כדי לאפשר החדרת לוחות זכוכית לאיסוף ביופילם. עומקה של המיתון צריך להיות לפחות 1.5 מ"מ, ואילו הרוחב והאורך של המיתון עשוי להשתנות בהתאם למספר של לוחות זכוכית להיות מוכנסות.
- לקבלת אוסף ביופילם, השתמש מחוייט ללא ניאון לוחות זכוכית (4 x 4 x 1 מ"מ 3) עם חספוס פני שטח של חצץ 1,200 כדי לחקות את דפוס קולוניזציה על אמייל טבעי 11.
- לעקר את לוחות זכוכית על ידי מעוקר לפני ההרכבה. הר לוחות זכוכית עם שעווה דביק שקעים מסגרת buccal של כל צד השקוע מעט אל פני השטח של משטח אקרילי על מנת להגן על ביופילם מכוחות גזירה שמפעילות התנועה של הלחיים 11.
הערה: מספר לוחות זכוכית להציב במיתון עשוי להשתנות בין 3 ו -14, תלוי מטרת המחקר. - הכנס את המכשיר בפה של המתנדב. הדרך את volunteer לשמור על המכשיר התוך דרך הפה במשך כל תקופת הניסוי. הדרך המתנדב לאחסן את המכשיר באריזה נגד שכר אורתודונטי עם פיסת ממחטת נייר רטובה (כדי לשמור אותו לח) בטמפרטורת חדר במהלך צחצוח שיניים וצריכת מזון ומשקאות אחרים מאשר מים. הדריכו המתנדב לא לגעת מסגרת אקריליק buccal עם לוחות זכוכית תוך שימת והסרת המכשיר.
הערה: תקופת הניסוי עשויה להשתנות תלוי מטרת המחקר (יום אחד עד מספר שבועות). - מוציאים בזהירות את לוחות הזכוכית מהמכשיר בסוף תקופת הניסוי. הסר את השעווה הדביקה סביב המלוחות עם סכין ולהעביר אותם עם פינצטה במכל סגור, biofilm פונה כלפי מעלה, עד ניתוח מיקרוסקופי. שמור את המיכל ולח עם ממחטת נייר רטוב. בצע הדמיה pH בתוך כמה שעות לאחר איסוף ביופילם.
3. הדמיה pH Biofilm
- להכיןפתרון הרוק ידי הוספת dithiothreitol לרוק שנאספו על פי שיטת דה יונג et al. 13. לכייל פתרון הרוק ל- pH 7.0 ולהוסיף גלוקוז בריכוז של 0.4% (wt / כרך). פיפטה 100 μl לכל ביופילם להיות מנותח לתוך צלחת 96-היטב זכוכית התחתונה עבור במיקרוסקופ. הוסף 5 μl של צבע ratiometric לכל טוב.
- מניחים את צלחת 96-היטב על הבמה מיקרוסקופ. הפעל את המיקרוסקופ קו לייזר 543 ננומטר. לחמם את החממה עד 37 מעלות צלזיוס. השתמש באותן הגדרות מיקרוסקופ ובאשר הכיול של הצבע (ראה צעדים 1.5-1.6). חכה 30 דקות, עד הצלחת 96-היטב הגיעה טמפרטורת עבודה.
- תרים אחד או יותר לוחות זכוכית עם סט דק של פינצטה ולמקם אותם הבארות מלאות הרוק, לוח אחד לכל היטב, עם biofilms פונה כלפי מטה.
- לרכוש תמונות יחידות ( "בקרת הסריקה" → "יחיד") או Z- ערימות ( "בקרת הסריקה" → "התחל") spanning עומק biofilms בתחומים שונים. לרכוש Z- ערימות לבחור המספר הפרוס להיות צלם ( "בקרת הסריקה" → "Z הגדרות" → "Num פרוסה") ולסמן את Z-Position עבור הרבעון הראשון לבין הפרוסה האחרונה בתוכנת מיקרוסקופ ( "בקרת סריקה "→" Z הגדרות "→" ראשון לציון ";" מארק אחרון ").
הערה: Z-ערימות עם עומק של עד 75 מיקרומטר ניתן לרכוש עם ניגודיות טובה בין אזורים תאיים ו תאיים. - כדי לעקוב אחרי שינויי pH בשדה מיקרוסקופי מבט לאורך זמן, לסמן את XY-העמדה בתוכנת מיקרוסקופ ( "שלב ובקרת הפוקוס" → "מארק הממוצע") ולקחת תמונות חוזרות ונשנות בנקודות רצופות זמן ( "בקרת סריקה" → " אֶחָד"). לוקחים בקביעות תמונות עם כוח לייזר מוגדר כאפס עבור רקע חיסור.
4. ניתוח תמונה דיגיטלית
- אקספוrt התמונות המיקרוסקופיות כקבצי TIF, השתמשו יצוא קובץ אצווה של תוכנת מיקרוסקופ ( "מאקרו" → "יצוא קובץ יצווה"). סמן את הקבצים להיות מיוצאים ולשמור תמונות ערוץ אדומות וירוקות בתיקיות נפרדות כקבצי TIF ( "התחילו תצווה יצוא"). שנה את שמות הקבצים בשני התיקיות לתת להם מספרים עוקבים.
- ייבא את סדרת תמונה האדומה וירוקה לתוך תוכנה כגון Daime (ניתוח תמונה דיגיטלי באקולוגיה מיקרוביאלית) 14. לפלח את התמונות בערוץ הירוקות עם ספי בהירות נבחרו בנפרד (קטע → → הפילוח אוטומטי סף מותאם אישית). בחר את ספי בהירות בזהירות (בדרך כלל בין 20 ו -80), כך שכל חיידקים (בהיר יותר תאי מטריקס), אבל לא המטריצה יוכרו כאובייקטים במהלך פילוח. אמת חזותית שהאזורים מוכרים כאובייקטים מתאימים היטב ביומסה החיידקים.
- מעביר את שכבת מטרת הגרם המפולחתמונות ערוץ reen לתמונות מסלול אדום המתאימות (שכבת אובייקט העברת מגזר →). השתמש בפונקצית עורך האובייקט לדחות ולמחוק את כל אובייקטי תמונות הערוץ האדומות וירוקות. עכשיו רק את תאי מטריקס הוא עזב את התמונות ביופילם. לייצא את תמונת סדרת מעובד כקבצי TIF.
- ייבא את סדרת התמונה לתוך ImageJ (http://rsb.info.nih.gov/ij; v.1.47). לקבוע את עוצמת הקרינה הממוצעת תמונות רקע שצולמו עם לייזר כבוי (לנתח → היסטוגרמה). הפחת את הרקע המתאים מהתמונות האדומות וירוקות (תהליך → הפחת מתמטיקת →).
- עדיין ImageJ, לחלק את סדרת תמונה הירוקה (G1) על ידי עצמו (מחשבון תמונת התהליך →). ואז להכפיל את סדרת תמונה המתקבלת (G2) עם סדרת תמונה הירוקה (G1). זה יניב סדרת תמונה (G3), שבו NaN מוקצה לכל הפיקסלים השייכים לאזורים שהוכרו כאובייקטי Daime. המשך ב tהוא באותו אופן עם סדרת התמונה האדומה (R1 / R1 = R2; R2 x R1 = R3).
הערה: ככל ביומסה חיידקי הוסרה מהתמונות בשלב 4.3, עוצמת הניאון היא 0 באזורים אלה. שלב 4.5 יש צורך להמיר את הערך 0 עד נאן, המאפשר חישוב יחס בשלב 4.6. - החלת המסנן 'Mean "(תהליך → מסננים → Mean; רדיוס: 1 פיקסל) כדי לפצות על רעש הגלאי. מחלק את תמונת הסדרה הירוקה ידי סדרת תמונה האדומה (מחשבון תמונת תהליך →). התוצאה הוא יחס ירוק / אדום עבור כל פיקסל הנותר במרחב התאי של התמונות. השתמש צביעת שווא עבור ייצוג גרפי של יחסים בתמונות (לוחות בדיקת → תמונה). חשב את היחס הממוצע של כל תמונה (לנתח → היסטוגרמה).
- המר את היחסים הירוקים / אדום לערכי pH פי הפונקציה המצוידת תחת 1.9.2). הערה: דוגמא עבור נתוני כיול עקום מצויד יכולה לראות et Schlaferאל 2015 11.
תוצאות
השיטה המוצגת מאפשרת pH תאיים ניטור טיפות במיקרו-סביבות שונות של biofilms שיניים בטווח מה PH 4.5 עד 7 בזמן אמת. אם תנאי הניסוי נבחרים כמתואר לעיל, pH מתחיל לרדת בכל התחומים של biofilms זמן קצר לאחר החשיפה לגלוקוז.
Discussion
ניטור מיקרוסקופי של pH ביופילם מספק מספר יתרונות, לעומת מדידות אלקטרודה או microelectrode 4-6. טכניקות מיקרוסקופיות להתיר לקבוע pH עם רזולוציה מרחבית גבוהה ולאפשר לכידה הן הדרגתיים pH אופקי ואנכי ב biofilms מבלי להפריע ביופילם מכאנית. ניסיונות קודמים של ניטור pH המיקרוסקופי, ?...
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
המחברים מבקשים להודות חבייר א גרסיה Lene גרונקיאר לקבלת סיוע טכני Merete ק Raarup לדיונים פוריים. עבודה זו מומנה על ידי ארהוס אוניברסיטת Research Foundation ואת סיימון ספייס קרן.
Materials
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
References
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved