A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יישום של מערכת קוהרנטית אנטי סטוקס פיזור ראמאן (CARS) על טי: ספיר OPO לייזר מבוסס תקן לייזר מיקרוסקופ סריקה
In This Article
Summary
קוהרנטית אנטי סטוקס ראמאן פיזור (CARS) מיקרוסקופיה מבוסס על רטט טבוע של אג"ח מולקולה התיר ללא תווית כימי סלקטיבית הדמית תא חייה. עבודה זו מציגה יישום טכניקה מיקרוסקופיה משלימים על מיקרוסקופ סריקת לייזר multiphoton התקן על בסיס Ti femtosecond: לייזר ספיר לייזר OPO.
Abstract
מיקרוסקופים סריקת לייזר המשלב femtosecond Ti: לייזר ספיר מתנד פרמטרי אופטי (OPO) לשכפל קו לייזר נהיו זמינים ביולוגים. מערכות אלה נועדו בעיקר עבור מיקרוסקופ פלואורסצנטי שני פוטונים רב ערוצית. עם זאת, ללא כל שינוי, מיקרוסקופיה אופטית שאינו ליניארי משלימה כגון דור השני הרמוני (SHG) או דור הרמוני שלישי (THG) יכולה גם להתבצע עם הסט-אפ הזה, המאפשר הדמיה ללא תווית של מולקולות מובנהיות או בינוני מימי ממשקי שומנים. טכניקות אלו מתאימות גם אותו להסתכלות-vivo, אבל מוגבלות וספציפי כימיים. מבחינה כימית הדמיה סלקטיבית ניתן לקבל אותות הרטט הגלום מבוסס על פיזור ראמאן. מיקרוסקופיה Confocal ראמאן מספקת רזולוצית מרחבית 3D, אבל זה דורש הספק ממוצע גבוה וזמן רכישה ארוך. כדי להתגבר על קשיים אלה, ההתקדמות בטכנולוגיית לייזר התירו development של מיקרוסקופיה רטט הקוית האופטית, ב אנטי סטוקס ראמאן קוהרנטי במיוחד פיזור (CARS). מיקרוסקופיה CARS ולכן התפתחה ככלי רב עצמה עבור הדמית תא ביולוגית חייה, על ידי שומני מיפוי כימי (באמצעות רטט למתוח CH), מים (באמצעות תנודות מתיחת OH), חלבונים או דנ"א. בעבודה זו, אנו מתארים את יישום הטכניקה CARS על מיקרוסקופ סריקת לייזר multiphoton תקן מצמידים OPO. היא מבוססת על סנכרון בזמן של שני קווי לייזר על ידי התאמת אורך אחד בנתיב קרן לייזר. אנו מציגים יישום צעד-אחר-צעד של טכניקה זו על מערכת multiphoton קיימת. רקע בסיסי באופטיקה ניסיונית הוא מסייע למערכת המוצגת אינה דורשת ציוד משלים יקר. כמו כן, אנו ממחישים CARS הדמיה מתקבל על נדני המיאלין של עצב השת של מכרסמים, ואנו מראים כי הדמיה זו יכולה להתבצע בו זמנית עם הדמיה אופטית לא לינארית אחר, כגון t הסטנדרטיוו-פוטון טכניקת קרינה ואת הדור השני-הרמוני.
Introduction
מיקרוסקופיה אופטית הפכה טכניקה גדולה להדמיה הורסת של תהליכים דינמיים חיים במערכות ביולוגיות עם רזולוצית subcellular. מיקרוסקופ פלואורסצנטי הוא כיום בניגוד ההדמיה הנפוץ ביותר בשימוש בתאי חיים בשל סגולי והרגישות 1 הגבוהים שלה. לוח צבעים גדול של בדיקות ניאון התפתח (צבעי אקסוגניים, חלבונים מקודדים גנטי, חלקיקים מוליכים למחצה). טכניקות פלורסנט מבוסס תאורת מדגם שונות פרחו (כגון מיקרוסקופיה confocal או שני פוטונים) לבצע הדמית 3D וכדי להפחית חסרון עיקרי של שיטה זו אשר photobleaching 2. מגבלות נוספות כוללות את הדרישה של תיוג fluorophore כי רוב המינים מולקולריים אינם פלורסנט מהותי ולכן fluorophores אלה צריכים להיות מוצגים באופן מלאכותי במדגם צלם. מניפולציה מלאכותית זו עלולה להיות הרסנית במיוחד עבור מולקולות קטנות או גורם סירצילום רעיל ential. סיבות אלו הופכות מיקרוסקופ פלואורסצנטי לא מתאים לתצפיות ב- vivo. לפיכך, השימוש בטכניקות הדמיה אופטיות עם רגישות גבוהה וניגודים מולקולריים מסוימים ללא השימוש של מולקולות ניאון רצוי מאוד במדע הביו-רפואי.
כמה שיטות הדמיה קויות אופטיות ללא תיוג או מכתים צמחו, כולל 5 השני-הרמוני דור (SHG) 3,4 ושלישי-הרמוני דור (THG). מיקרוסקופיה SHG נעשתה שימוש כדי הסדרים מבניים תמונה ברמה המולקולרית כגון microtubules או קולגן 6. THG מופק heterogeneities האופטי כגון ממשק בין 7 בינוני ושומנים מימיים. THG גם הודגם המיאלין תמונה 8,9. יכול להיות מיושם הן טכניקות על מיקרוסקופ פלואורסצנטי שני הפוטונים ודורשים רק קרן לייזר אחת. עם זאת הם דורשים עוצמת הלייזר בהספק גבוה (בדרך כלל 50mW ב 860 ננומטר במשך 10 SHG, 25 - 50 מגה ואט עם 1,180 ננומטר עבור 9 THG), המהווה מזיק בדגימות חיים, ואינו מספק את הספציפיות הכימיות כי נדרשה מבנים ביולוגיים ספציפיים באופן חד משמע תמונה.
מבחינה כימית הדמיה סלקטיבית ניתן לקבל אותות הרטט מולקולרי הגלום מבוסס על פיזור ראמאן. כאשר קרן אור פוגעת משנה, פוטונים יכולים להיספג מפוזרים על ידי אטומים או מולקולות. רוב הפוטונים המפוזרים תהיה אותה האנרגיה, כלומר, תדר, כמו פוטוני האירוע. תהליך זה נקרא פיזור ריילי. עם זאת, מספר קטן של פוטונים יהיה מפוזר בתדירות אופטית שונה מהתדירות של פוטוני האירוע, כלומר, עם תהליך פיזור קשיח נקרא פיזור ראמאן. ההבדל באנרגיה שמקורה העירור של אופני תנודה תלויים במבנה מולקולרי סביבה. לכן, ראמאן ספונטנית prov פיזוראידו הדמיה סלקטיבית כימי כמו יש מולקולות שונות תדרי רטט ספציפיים. עם זאת, הוא מוגבל בשל האות החלשה מאוד שלה. מיקרוסקופיה Confocal ראמאן פותחה ומספקת רזולוצית מרחבית 3D, אבל זה דורש רכישת כוח וארוכה ממוצעים הגיע זמן 11. כדי להתגבר על קשיים אלה, ההתקדמות בטכנולוגיית לייזר אפשרו עלייה של מיקרוסקופיה הרטט אופטית לא לינארית, ב פיזור אנטי סטוקס ראמאן קוהרנטי מסוים (CARS) 11,12,13.
CARS הוא תהליך אופטי לא לינארית מסדר שלישי. שלוש קרנות ליזר, מורכב קרן משאבה בתדר ω P, קרן סטוקס בתדר ω S וקרן בדיקה (לרוב להיות המשאבה) מתמקדות בדגימה וליצור קרן אנטי סטוקס בתדר ω AS = ( 2ω P - ω S) 14. האות אנטי סטוקס ניתן לשפר באופן משמעותי כאשר ההבדל התדירבין המשאבה לבין סטוקס הקורות והוא מכוון R Ω הרטט המולקולרי ראמאן = (ω P - ω S). אות CARS מבוססת על אינטראקצית פוטון מרובה. זה יוצר אפוא הזמנות אות קוהרנטית גודל חזק יותר פיזור ראמאן ספונטני.
מיקרוסקופיה CARS הוצגה לראשונה באופן ניסיוני על ידי דאנקן et al. 15. Zumbusch et al. השתפר אז הטכניקה, באמצעות שתי אלומות לייזר femtosecond ממוקד האינפרה-אדום הקרוב עם עדשה אובייקטיבי של הצמצם המספרי גבוה, מה שמאפשר את המצב התאמת שלב של מכוניות הימנעות רקע שני הפוטונים שאינם התהודה 16. מיקרוסקופיה CARS ולכן התפתחה ככלי רב עוצמה עבור הדמיה תא ורקמות חיים, על ידי איתור מולקולות כימית כגון שומנים (באמצעות רטט למתוח CH) 17,18, מים (דרך למתוח OH ויברציות), חלבונים, DNA בתאים חיים 19,20 אבל גם deuterated תרכובת כימיתים עבור תרופות 21 יישומים קוסמטיים 22.
המגבלה העיקרית של מיקרוסקופיה הקוית מקורו המורכב ואת עלות המקורות האופטיים. מערכת CARS דורשת שני לייזרים מתכווננים גל עם משכי דופק קצרים ועם temporally מרחבית רכבות דופקות מסונכרנים. מיקרוסקופים CARS מוקדם התבססו על שני מסונכרן picosecond Ti: לייזרים ספיר 20. CARS הדמיה גם התקבל Ti femtosecond יחיד: לייזר ספיר יצירת מקור אור supercontinuum 23. לאחרונה, מקורות לייזר מורכב יחיד femtosecond Ti: לייזר ספיר שאיבה מתנדים פרמטרית אופטיים מתכונן (OPO) שימשו במשך מיקרוסקופיה CARS. הגדרה זו מאפשרת קורות מסונכרנים באופן זמני מעצם מהותו עם הבדל של תדירויות בין המשאבה לבין קרן סטוקס מכסה ספקטרום התדר המולקולרי המלא 24. בנוסף, מיקרוסקופים סריקת לייזר המבוסס על מודעות מראשיתליזר FS מפתח וכן OPO, המשמש בעיקר קרינת שני פוטונים (TPF) זמינים כעת עבור-פיסיקאים שאינם. הפוטנציאל של סט-אפ כזה יכול להיות מאוד משופר ללא צורך בהשקעה הנוספת על ידי שילוב של הדמיה אופטית לא לינארית שני, מאחר ולכל שיטת הדמיה קוי (NLO) הוא רגיש מבנים או מולקולות ספציפיות. הדמית NLO מולטימודליות ולכן מהוונת את הפוטנציאל של מיקרוסקופיה NLO עבור דגימות ביולוגיות מורכבות 25. הצימוד של טכניקות אלה אפשר את חקירת שאלות ביולוגיות רבות, בפרט על מטבוליזם שומנים, פיתוח עור או סרטן 26, פיתוח שרירי שלד 27, טרשת עורקת 28. יתר על כן, יישום סריקת קרן ליזר עם מכוניות נותן את היכולת של הדמיה גבוה שיעור, כלומר, כלי מושך ללמוד תהליכים דינמיים in vivo.
מטרת עבודה זו היא להראות כל צעד ליישם tCARS הוא טכניקה על מיקרוסקופ סריקת לייזר multiphoton סטנדרטי. המיקרוסקופ מבוסס על fsec Ti: לייזר ספיר וכן OPO (שאוב על ידי Ti: ספיר לייזר) מופעל על ידי תוכנה עבור ביולוגים. השילוב בוצע על ידי התאמת אורך אחד בנתיב קרן לייזר על מנת לסנכרן בזמן שתי הקורות. אנו מתארים את השלב-אחר-צעד ליישום הטכניקה הזו מחייב רקע בסיסי בלבד באופטיקה ניסיון. כמו כן, אנו ממחישים CARS ההדמיה מתקבלים על נדני המיאלין של עצב השת של מכרסמים, ואנחנו מראים הדמיה זו יכולה להתבצע בו זמנית עם הדמיה אופטית לא לינארית אחר, כגון טכניקת קרינת שני פוטונים סטנדרטיים דור שני-הרמוני.
Access restricted. Please log in or start a trial to view this content.
Protocol
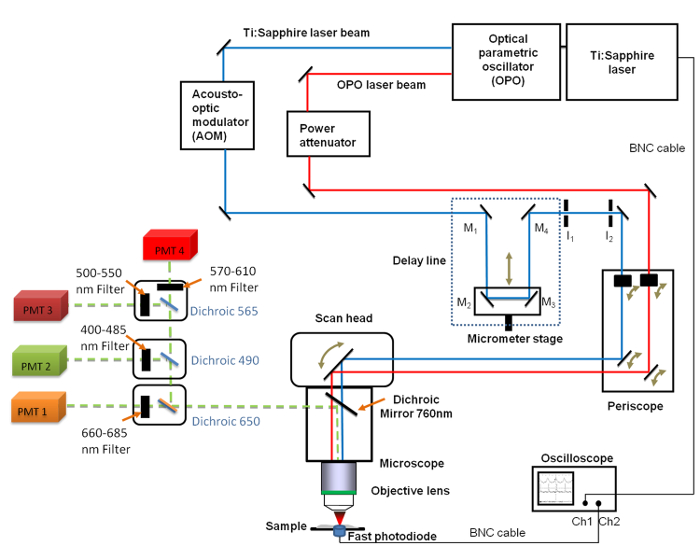
איור 1. מבט סכמטי של ההגדרה הכללית הוא כולל את Ti:. ספיר (680 - 1,080 ננומטר) ואת OPO (1,050 - 1,300 ננומטר) לייזרים, קו העיכוב עם 4 המראות (M 1 עד M 4), אוסצילוסקופ הצום, פוטודיודה ושתי דיאפרגמה קשתית מסודרת אני 1 ואני 2. מראות M 2 ו- M 3 שתוקנו על במת תרגום ליניארי המאפשרת לשנות את אורך קו העיכוב עם רזולוצית מיקרומטר. 660 -. לעבור סינון להקת ננומטר 685 הוצב מול הצינור המכפיל (PMT) המשמש הדמית CARS אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
1. אתחול של מערכת לייזר
- ודא כי Ti: גל ספיר מוגדר 800 ננומטר או להגדירגל זה על Ti: ספיר בקר אספקת החשמל. סובב את המפתח ממצב המתנה למצב מופעל כדי לעבור על Ti: ספיר לייזר.
- הפעל את הלייזר OPO בחלק האחורי של הבקר OPO ולפתוח את Ti: תריס ספיר על Ti: ספיר בקר אספקת החשמל.
- הפעל את מחשב הלוח כדי לשאוב את OPO. לחץ על הסמלים מחובר OPO ו מרוחקים המחוברים בטאבלט. חכו 30 - 40 דקות עבור מתחמם.
- הפעילו את המחשב מיקרוסקופ מפעילים את המתגים "רכיבים מיקרוסקופ". הפעל את התוכנה על ידי לחיצה כפולה על הסמל בשולחן העבודה.
- אל הכרטיסייה רכישת התוכנה, פתח את כלי לייזר במנהל להגדרות כדי להפעיל את שני לייזרים מהתוכנה. בחר Ti: ספיר לייזר און OPO על לייזר. בדוק את הערך של כוח לייזר אופטי (ערכים טיפוסיים של 3,700 מילי-ואט ב 800 ננומטר ו 700 mW ב 1000 ננומטר).
- כדי להגדיר את נתיב קרן לייזרים,לפתוח את כלי נתיב אור בקבוצת הכלי 'מנהל התקנת תיבת סימון הצינור המכפיל הראשון (PMT).
- כדי לבדוק את Ti: ליזר ספוט ספיר במוצא של המטרה, פתח את כלי ערוצים בקבוצת כלי פרמטר הרכישה. בחר את Ti: כוח ספיר בשווי נמוך (סביב 1%), להפחית את הרווח ל -0 (אין תמונה נדרשת בשלב זה) ולחץ על הכפתור הרציף כדי להתחיל בהליך הסריקה להשיק את קרן הליזר דרך המטרה מיקרוסקופ. בדוק את הנוכחות של נקודה אדומה על ידי תצפית ישירה על ידי מיצוב כרטיס הצפייה לייזר IR במוצא של המטרה מיקרוסקופ אוויר (10X).
- כדי לבדוק את המקום לייזר OPO, להפסיק את הסריקה של Ti: ספיר לייזר על ידי לחיצה על כפתור עצור. בחר את כוח OPO בשווי נמוך בחלון הערוצים ולחץ על Cכפתור ontinuous.
2. הגדרות מיקרוסקופ
- באופן ידני למקם את מראה dichroic עם אורך גל הפסקה ב 760 ננומטר במחוון sideport במרחב האינסוף מעל מזנקי המטרה להשיק את האור עד 760 ננומטר מן המדגם לתוך PMTs זיהוי שאינו descanned מצב (NDD).
- הגדר את מסנן מעביר פס צר אווניו 660 - 685 ננומטר בקוביה רפלקטור NDD מול PMT1 להקליט רק את המכוניות לאותת ב- 670 ננומטר לשחזר את התוצאות המוצגות בעבודה זו.
- מקום מסנן פס צר הנע בין 500 כדי 550 ננומטר בקוביית רפלקטור NDD מול PMT3 להסתכלות קרינה של המיאלין. מקום מסנן פס צר החל 565 כדי 610 ננומטר בקוביה רפלקטור מול PMT4 להסתכלות SHG.
- כדי לבחור בתוכנה ההקלטה של האות על הגלאי עם מסנן אד הוק לעבור הלהקה, פתח את כלי נתיב האור בתפריט מנהל ההתקנה בכרטיסיית הרכישה. הפעל את PMT הרצוי (תיבת סימון) ובחר צבע עבור הערוץ הזה. בעבודה זו, הירוק נבחר למכוניות, אדום קרינת מגנט עבור SHG.
3. סנכרון Temporal
הערה: שתי אלומות לייזר מקורן באותו Ti: לייזר ספיר אבל הקורה OPO מתעכב כשזה נוצרת כך שתי הקורות אינם מסונכרנים בזמן כשהם מגיעים מיקרוסקופ. המטרה כאן היא לעכב אחת משני הקורות מחדש לסנכרן אותם בזמן לפני שהם מגיעים המיקרוסקופ.
- צור קשר עם כבלי BNC ערוץ קלט CH1 של האוסילוסקופ לפלט לייזר BNC חשמל (Sync. מתוך). חבר את ערוץ הקלט CH2 של האוסילוסקופ אל פוטודיודה ולבחור את ערוץ CH1 כערוץ ההדק ידי MENU TRIGGER לחיצה, אזי מקור כפתור הראשי התפריט ולאחר מכן על הלחצן בצד תפריט שמתאים הערוץ הנבחר CH1.
- התפקיד ולתקן עם הודעות הרכבה אופטיות פוטודיודה במישור המוקד של מטרה מיקרוסקופ אוויר (10X) או בנתיב הקרן של המיקרוסקופ לאחר הסרת המטרה. הערה: אם יש צורך, להסיר את הקבל המוביל שלה.
- בכלי ערוצים (קבוצת כלי פרמטר רכישת), להגדיר את Ti: לייזר באורך גל ספיר ב 830 ננומטר בהספק נמוך (כלומר, פחות מ -1% של מלוא העוצמה). בכלי מצב הרכישה, לצמצם את אזור הסריקה לנקודה אחת כדי להאיר את photodiode עם הקרן הקטנה ביותר. הפעל את סריקת הליזר על ידי לחיצה על הכפתור הרציף.
- AUTOSET לחץ על הלוח הקדמי במשקף ידני להעביר את המיקום של פוטודיודה כדי לקבל את הרכבות הדופק על המסך. כפתור ההפעלה / STOP לחץ להקפיא את התצוגה.
- כדי לשמור עותק של התצוגה אוסצילוסקופ, הכנס 3.5inch תקליטון לכונן התקליטונים או לחבר את יציאת GPIB בלוח האחורי למחשב. לאחר מכן לחצו MENU SHIFT ומודפס, פורמט העיתונות (הראשי) כדי לבחור את התמונה בפורמט TIFF ולציין בתפריט פורט את ערוץ הפלט. לחצו על לחצן ומודפס כדי להקליט את התצוגה אוסצילוסקופ של רכבות הדופק של Ti: ספיר לייזר.
- כבה את Ti: סריקת ליזר ספיר על ידי לחיצה על הכפתור העצור. על ידי לחיצה על כלי ערוצים להגדיר את אות OPO ב 1,107 כוח ננומטר ונמוך. הפעילו את הסריקה לייזר OPO ולהקליט את רכבות הדופק של לייזר OPO על האוסילוסקופ. כבה את סריקת ליזר OPO.
- השווה את המשמרת הזמנית בין Ti: ספיר ואת אותות OPO.
הערה: המעבר הזמני משמרת t נותן את משך העיכוב קו L DelayLine שצריכה להיות מיושמת, לאחר המשוואה: L delayLine = ג5; t המשמרת כאשר c היא מהירות האור. - בחר באחד מקווי לייזר.
הערה: בעבודה זו, טי: קו לייזר ספיר נבחר משום מקום פנוי היה זמין ליד קו לייזר זה. בנוסף, בחירה זו מאפשרת להשיג מחדש יישור קו לייזר עם אור לייזר גלוי. - פתח קו הליזר ידי הסרת צינורות המגן במיקום שבו קו העיכוב ייושם.
זהירות! תלבשו משקפי בטיחות מתאימים ולהסיר צמידי שרשרת או לצפות מורידים. - בחר אורך גל בטווח הנראה לעין כדי להיות מסוגל לראות את קרן הלייזר בקלות (700 ננומטר למשל, בהספק נמוך בכלי ערוצים של התוכנה). הפעילו את הסריקה לייזר.
- מניח ולהגדיר עם הודעות הרכבה אופטיות שתי דיאפרגמה קשתית לאורך קו הליזר הפתוח. איריס עמד אחת ביציאה של קו העיכוב ומקום איריס האחר בכניסה של הפריסקופ.
הערה: PEשולטת riscope ידי שתי מראות ממונע הטיס על ידי התוכנה זווית הכניסה של קרן לייזר לתוך הראש סריקת מיקרוסקופ סורק לייזר. - להקטין את הצמצם הסרעפת איריס ולהתאים את עמדות הסרעפת כדי להתאים את נתיב קרן לייזר. תקן אותם על השולחן האופטי. התאם את המיקום האנכי של סרעפת איריס ניידת שלישית, כדי לבדוק את גובה קרן הליזר תוך מיצוב ברציפות בארבע המראות של קו הדיחוי.
הערה: דיאפרגמה איריס אלה תשמש מלאים עבור ההליך מחדש יישור על ידי הצגת שביל ללכת. - מניח את המראה M1 רכוב על מראה קינמטיקה קומפקטי הר בכניסה של קו העיכוב (כפי שמוצג באיור 1) ולהתאים את עמדתה והכיוון שלה כדי לשמור על גובה הקורה עם השימוש של סרעפת איריס הניידת. מקום מראות M2 ו M3 (רכוב גם על mounts במראה קינמטיקה קומפקטית) ב 90 מעלות לבמה תרגום אשר יוצב ב midcourse. מקמו אותם כדי להתאים את אורך קו עיכוב כפי שחושב קודם לכן.
- לשנות את הכיוון של M2 ו M3 עם השימוש של סרעפת איריס הניידת. גדר M4 (קבוע גם על הר קומפקטי) ביציאה של קו העיכוב (ממש לפני איריס ואני 1 כפי שמוצג באיור 1) ולהתאים את עמדתה בזהירות וזווית כדי להתאים את נתיב קרן ליזר דרך שתי דיאפרגמה איריס הקבועה.
- מקם את הכרטיס הצפייה לייזר במוצא של המטרה מיקרוסקופ ולבדוק את פרופיל קרן לייזר על ידי לחיצה על רציף כדי להפעיל את הסריקה לייזר. שים דיסק בהיר אחיד. במידת הצורך, לשנות את הכיוון במקצת של M4.
- עמדה שוב פוטודיודה מהר תחת קרן לייזר במישור המוקד מדגם של המיקרוסקופ. שים את המשמרת הזמני בין Ti: קרן לייזר ספיר ואת קרן OPO על האוסילוסקופ.
הערה: במידת הצורך, לשנות את אורך קו עיכוב ידי הזזת המערכת כולה M2, M3 רכוב עלשלב תרגום (מבלי לשנות את כוונון תרגום הבמה) כדי לסנכרן שני פולסים. יכולים להידרש שינויים של סנטימטרים ספורים.
4. חפיפה מרחבית של הקורות
הערה: כדי ליצור אות CARS, החפיפה המרחבית של שתי אלומות לייזר נדרשת. התאורה החלופית של שני קורה באותו החרוזים מוכתמים לאורך עם שני צבעי ניאון שונים ניתן להשתמש כדי לציין את המשמרת מרחבית. התאמות קנס של עמדות המראה אז יכול למזער את המשמרת.
- השתמש מראש רכוב microspheres ניאון. או הר microspheres השעיה על מיקרוסקופ שקופיות נקיות כמפורט להלן:
- לפני הדגימה, לערבב (על מערבל הקורטקס או על ידי sonicating) הפתרון חרוז להיות בטוח כי החרוזים מושעים באופן אחיד.
- החל 5 μl של ההשעיה חרוז אל פני השטח של שקופית ולהפיץ עם קצה פיפטה. חכו אגל להתייבש ולאחר מכן להחיל 5 μl של הרing בינוני, כגון גליצרול, מים או שמן טבילה על המדגם היבש של חרוזים. מכסים את המדגם עם coverslip לאטום את coverslip עם דבק המתייבש או פרפין נמס.
- מניח את חרוזי פוליסטירן ניאון קבועים בשקופית מיקרוסקופ תחת מטרת מי 20X. להוסיף כמה טיפות של מים כדי לטבול את המטרה.
- כדי להשיג את המיקוד על החרוזים, לפתוח את אתר כרטיסייה בתוכנה כדי לעבור ממצב סריקת ליזר בהתבוננות הישירה של המדגם עם העין, על ידי לחיצה על הכפתור באינטרנט. פתח את כלי Ocular לבחירת מסנן אד הוק להדליק את מנורת הלוגן על ידי לחיצה על הסמלים.
- הסרה ידנית המראה dichroic במחוון sideport בחלל אינסוף ולהשתמש בכונן התמקדות של מיקרוסקופ כדי למקד את המטוס מדגם ידי התבוננות חרוזים עם oculars. חלף מראה dichroic.
- באתר הכרטיסייה, לעבור למצב סריקת לייזר על ידי לחיצה על כפתור מנותק. עבור לכרטיסיית הרכישה להגדיר את הפרמטרים לסריקה: לבחור את גודל מסגרת 512 פיקסלים, מהירות סריקה של 9, גידול ממוצע של 1, עומק סיבי של 8 ביט ולהגדיל את אזור הסריקה למקסימום.
- בכלי הערוצים של כרטיסיית הרכישה, להוסיף מסלול (Track 1) אם כבר לא טופל. בחר את אורך הגל 830 ננומטר צריכת חשמל נמוכה עבור Ti:. קרן לייזר ספיר סמן את הצבע לירוק בתיבת מסלול 1 מהחלון ערוצים ובסופו של PMT3 או בתיבת PMT4 מהחלון נתיב האור.
- בכלי הערוצים של כרטיסיית הרכישה, להוסיף מסלול שני (מסלול 2). בחר את אורך הגל 1,107 כוח ננומטר נמוך עבור קרן לייזר OPO. סמן את הצבע לאדום בתיבת מסלול 2 מחלון הערוצים ובתיבת PMT3 מן חלון נתיב האור.
- התאם את הרווח של שני מסלולי 600. ואז, ברצף להחיל את הסריקה של שתי הקורות על המדגם על ידי לחיצה על רציף.
- שים את התמונה באזור המסך לתוך בתצוגת 2D. בבלוק מלא אפשרות צפיית תצוגה, לכוון את עוצמת התצוגה.
הערה: במקרה צורך, הזז את כונן ההתמקדות מעט כדי למצוא את מטוס מוקד החרוזים. התאם את היבול וזום את התמונה חרוזה אחד או בקבוצה של חרוזים סמוכים. - השתמש בבקר פריסקופ כדי לכסות את קורות במישור xy. בתוך התוכנה, פתח את הכרטיסייה השמורה. הקש על אפשרויות המערכת ולהציג את חלון כלי פריסקופ ממונע. השתמש התאמות גסות ועדינות של מראות פריסקופ של Ti: קרן ליזר ספיר כדי לסנכרן בחלל שני תמונות.
- עבור מניפולצית פריסקופ, השתמש ברי ההתאמה הראשונות אנכי ואת second אחד לתנועות אופקיות של קרן הליזר. הזז את הקורה עם מראה הקלט עד שהתמונה גלויה מעט, ולאחר מכן לפצות על עוצמת הליזר עם מראה הפלט של הפריסקופ על ידי לחיצה על "קלט" ו- "פלט".
- כדי אנכי חופפים קורות, בכרטיסייה השמורה, פתח את כלי Collimator ולהתאים את הערך של מרחק המוקד של Ti: קרן ליזר ספיר.
- זז בעדינות את המיקום האנכי האובייקטיבי לבדוק את ההבדל של התמקדות בשני התמונות. לחלופין, לקחת Z- מחסנית של המדגם על ידי פתיחת בלשונית רכישת כלי-סטאק Z ולבחור את פרמטרים שונים (טווח, מספר פרוסות). לחץ Ortho באזור מסך תמונה כדי לראות את קורות חתך צירי. מקסם את-חפיפת z ידי עושה את אותו נוהל מספר פעמים.
5. התאמות סופיות קוהרנטית אנטי סטוקס פיזור ראמאן (CARS) תצפית אות מ שמן זית ד"רoplets
- שים טיפה של שמן זית על צלחת זכוכית ולכסות אותו על ידי להחליק כיסוי זכוכית. להוסיף כמה טיפות של מים כדי לטבול טבילה אובייקטיבי מים 20X. פוקוס בקצה להחליק את המכסה באמצעות oculars (כפי שהוסבר קודם לכן 4.2).
- בכלי ערוצים של הכרטיסייה רכישה, בחר במסלול 1 את אורך הגל 830 ננומטר עבור Ti: קרן לייזר ספיר ב 1,107 ננומטר עבור OPO. סמן שני לייזרי מסלול 1 כדי לקבל סריקה בו זמנית של שני הלייזרים. סמכויות סט בשווי נמוך בתור התחלה.
- בחלון נתיב האור, בחר PMT1. הפעילו את סריקות לייזר על ידי לחיצה על כפתור רציף. הזז מעט את הפוקוס כדי לספק אור הלייזר לתוך שכבת שמן דקה.
- במידת הצורך, להגדיל את הכוח האופטי של שני לייזרים. התאם את עוצמת התצוגה של דבוקת שליטה אפשרות צפייה תצוגה. לאט לאט להזיז את במת התרגום של קו העיכוב עד האות הופכת sigבצורה משמעותית משופר.
- לאחר היישור בסדר הושלם, ולבדוק אם זה באמת CARS לאותת: הזז את במת התרגום מעט; עוצמת האות חייבת להיות חלשה יותר. ו / או לכבות אחד של קרן לייזר, או Ti: ספיר לייזר או OPO. שוב שחייבת להיות ריקבון חזק בעצמה לעומת אות CARS.
- כדי להשיג את אות CARS מקסימלית, בחר באפשרות על בתוכנה כדי לספק ערך של עוצמת הממוצע של התמונה כולה (בתצוגת histo של כרטיסיית המסך באזור). התאימו את אורך הגל (כמה ננומטר), אזי x, y, z העמדות של קורה המוקד על מנת למקסם את הערך העוצם מתכוון.
מארז 6. של נתיב האור של קו העיכוב
- מאז המערכת הסופית מוקדשת-פיזיקאי עישון, להקיף את נתיב האור של קו העיכוב עם צינורות או תיבת מתחם, כדי למנוע גישה ישירה אל קרן ליזר כוח מזיקים שאינם גלויה גבוה שיא. תשמור על עצמך כדי לספק גישה אל במת התרגוםכַּפתוֹר.
7. כוונון אורך גל למכוניות
- השתמש במשוואה
 כדי לכוון את אורכי גל הלייזר לרטט ראמאן הרצוי. כדי לשחזר את התוצאות המוצגות בעבודה זו למכוניות תמונה לאותת מאג"ח CH שיש מתיחה רטט של 3015 ס"מ -1, בחר λ Ti: ספיר = 830 ננומטר λ OPO = 1,095 ננומטר.
כדי לכוון את אורכי גל הלייזר לרטט ראמאן הרצוי. כדי לשחזר את התוצאות המוצגות בעבודה זו למכוניות תמונה לאותת מאג"ח CH שיש מתיחה רטט של 3015 ס"מ -1, בחר λ Ti: ספיר = 830 ננומטר λ OPO = 1,095 ננומטר.
הערה: תדירות התנודות מאפיין ראמאן שנצפתה דגימות ביולוגיות, כגון מים, אג"ח CH ניתן למצוא אוונס ואח 13 או אליס ואח '29... - השתמש במשוואה
 כדי לקבוע את אורך גל הפליטה של אות CARS. עבור הדמיה אג"ח CH ידי מכוניות, לבחור מסנן פס צר ב 670 ננומטר מאז CARS λ = 670 ננומטר עם אורכי גל הלייזר המוצגים 7.1.
כדי לקבוע את אורך גל הפליטה של אות CARS. עבור הדמיה אג"ח CH ידי מכוניות, לבחור מסנן פס צר ב 670 ננומטר מאז CARS λ = 670 ננומטר עם אורכי גל הלייזר המוצגים 7.1.
הערה: יישום טלפון נייד הוא available לחשב CARS λ מ λ P ו- λ הערכים S (ראה התייחסות 30).
8. תצפית של מכוניות איתותים ומוכתמות המיאלין מקיצוצי גיד הנשה
הערה: כל הניסויים בבעלי החיים נערכו בהתאם לתקנות מוסדיות.
- הכן את קיצוצי גיד הנשה הציריים האורך בשקופית מיקרוסקופ כמוצג Ozçelik et al. 31.
- הכן את הפתרון מכתים אדום fluoromyelin ידי דילול 300 פי פתרון המניות לתוך PBS. להציף את הקיצוצים העצבים עם הפתרון המכתים במשך 20 דקות ב RT. הסר את הפתרון לשטוף 3 פעמים במשך 10 דקות עם PBS.
- מקם את הקיצוצים תחת מטרת הטבילה במי 20X. מניחים coverslip. להוסיף כמה טיפות של PBS כדי לטבול את המטרה ולהתאים את הפוקוס של המטרה כדי לקבל תמונה ברורה של חתכים דרך oculars (כמפורט לעיל ב 4.2).
- 1 מסלול, בחר את Ti: ספיר לייזרים OPO ולהגדיר אורכי הגל שלהם כדי 830 ננומטר 1,095 ננומטר, בהתאמה. בחלון נתיב האור, בחר PMT1 וצבע ירוק.
- ב 2 מסלול, בחר הלייזר OPO (אורך הגל 1,095 ננומטר) בלבד. בחלון נתיב האור, בחר PMT4 וצבע אדום.
- עבור הלייזרים שניהם, בחר צריכת חשמל נמוכה ולהגדיר את הרווח 600 בתור התחלה. הפעל את סריקות הליזר ולהתאים את הפרמטרים הבאים כדי לשפר מכוניות אותות קרינת ניגודים: ערכי כוח, ידית הבמה תרגום (מעט מאוד), אורכי גל (כמה ננומטר), עוצמת תצוגה.
- כדי להקליט תמונות סופיות ברזולוציה גבוהה, בחר בכלי מצב רכישת הפרמטרים הבאים: גודל מסגרת של 1,024 פיקסלים, מהירות סריקה של 7, מיצוע של 4. לחץ על לחצן הצמד להקלטת תמונה אחת. שמור את התמונה בצורת הקנייניתב להקליט את התמונה ואת פרמטרי רכש מלאים.
9. תצפית של מכוניות איתותי SHG מקיצוצי גיד הנשה
- הכן את גיד הנשה כמוצג Ozçelik et al. 31.
- בצע את ההליך כפי שמוסבר חלק 8 כדי לקבל תמונה דרך oculars ולבחירת CARS פרמטר אות (מסלול 1).
- ב 2 מסלול, בחר הלייזר OPO (גל 1095 ננומטר) בלבד. בחלון נתיב האור, בחר PMT3 וצבע מגנטה.
- בצע את ההליך כפי שמוסבר חלק 8 לעבור על סריקות לייזר ולשמור תמונות ברזולוציה גבוהה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תדירות הרכבת הדופק לסטנדרטים Ti: לייזר ספיר הוא בדרך כלל סביב 80 מגה-הרץ. OPO יש אותו תדר שכן הוא שאוב על ידי Ti: ספיר לייזר. אוסצילוסקופ מהיר של MHz 200 לפחות ולכן נדרש. פוטודיודה מהיר בטווח 600 עד ננומטר 1,100 נדרש גם. המעבר הזמני המקסימאלי מתרחש כאשר Ti: ספיר ו...
Access restricted. Please log in or start a trial to view this content.
Discussion
החלק המאתגר ביותר של העבודה הוא סנכרון הזמני של קרני לייזר. זה דורש פוטודיודה מהיר בשילוב עם אוסצילוסקופ מהר, אבל רק חופפים גסים בזמן יכולים להתבצע בהתחלה. ואז התאמה נוספת של כמה ס"מ נדרש. לבסוף, מהלכי מיקרומטר ידי במת תרגום ליניארי מאפשרים ביצוע ההתאמה בסדר הסופי ש...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The authors want to thank Dr. Philippe Combette (IES, UM, Montpellier, France) for the loan of the fast oscilloscope and acknowledge financial supports from Montpellier RIO Imaging (MRI). HR acknowledges ANR grants France Bio Imaging (ANR-10-INSB-04-01) and France Life Imaging (ANR-11-INSB-0006) infrastructure networks for coherent Raman imaging developments. This work was mainly supported by an European Research Council grant (FP7-IDEAS-ERC 311610) and an INSERM - AVENIR grant to NT.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Oscilloscope | Tektronix | TDS 520D | 500 MHz |
| Photodetector | Thorlabs | DET08C/M, T4290 | 5 GHz InGaAs, 800 - 1,700 nm |
| Ti:Sapphire laser Chameleon Ultra Family II | Coherent | ||
| Optical parametric oscillator OPO Compact Family | APE Berlin | ||
| Axio Examiner microscope LSM 7 MP | Carl Zeiss | ||
| Motorized periscope | Newport | ||
| Objective W Plan-Apochromat 20X/1.0 | Carl Zeiss | ||
| Beam combiner | Carl Zeiss | ||
| Acousto-optic modulator | Carl Zeiss | ||
| OPO power attenuator | Carl Zeiss | ||
| Photomultiplier tube | Carl Zeiss | ||
| ZEN software | Carl Zeiss | ||
| Bandpass filters | Carl Zeiss | LSM BiG 1935-176 | 400 - 480 nm; 500 - 550 nm; 465 - 610 nm |
| Dichroic mirror | Carl Zeiss | Cutoff wavelength 760 nm | |
| Silver mirrors | Newport | 10D20ER.2 | λ/10, 480 - 20,000 nm, Quantity 4 |
| Single-axis translation stage with standard micrometer | Thorlabs | PT1/M | Quantity 1 |
| Aluminium breadboard | Thorlabs | MB1015/M | Quantity 1 |
| Mirror mount | Thorlabs | KMSS/M | Quantity 4 |
| Mirror holder for Ø1" Optics | Thorlabs | MH25 | Quantity 4 |
| Iris diaphragms | Thorlabs | ID8/M | Quantity 3 |
| Protective box | Thorlabs | TB4, XE25L900/M, T205-1.0, RM1S | Quantity 1 |
| Optical posts | Thorlabs | TR40/M, PH50/M, PH75/M, BA2/M | Quantity 8 (lengths depending on the set-up) |
| 661 - 690 nm bandpass filter | Semrock | 676/29 nm BrightLine® single-band bandpass filter | Quantity 1 |
| Fluorescent beads | ThermoFisher | TetraSpeck™ Fluorescent Microspheres Size Kit | |
| Laser viewing card | Thorlabs | IR laser viewing card | |
| Laser safety glass | Newport | LV-F22.P5L07 | |
| FluoroMyelin™ Red Fluorescent Myelin Stain | ThermoFisher | F34652 |
References
- Valeur, B., Berberan-Santos, M. N. Molecular Fluorescence: Principles and Applications. , 2nd Edition, Wiley-VCH Verlag GmbH. (2012).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Moreaux, L., Sandre, O., Mertz, J. Membrane imaging by second-harmonic generation microscopy. JOSA B. 17 (10), 1685-1694 (2000).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc. Natl. Acad. Sci. USA. 99 (17), 11014-11019 (2002).
- Yelin, D., Silberberg, Y. Laser scanning third-harmonic-generation microscopy in biology. Opt. Express. 5 (8), 169-175 (1999).
- Campagnola, P. J., Millard, A. C., Terasaki, M., Hoppe, P. E., Malone, C. J., Mohler, W. A. Three-dimensional high-resolution Second-Harmonic Generation imaging of endogenous structural proteins in biological tissues. Biophys. J. 81 (1), 493-508 (2002).
- Olivier, N., et al. Cell lineage reconstruction of early zebrafish embryos using label-free nonlinear microscopy. Science. 329 (5994), 967-971 (2010).
- Farrar, M. J., Wise, F. W., Fetcho, J. R., Schaffer, C. B. In vivo imaging of myelin in the vertebrate central nervous system using third harmonic generation microscopy. Biophys. J. 100 (5), 1362-1371 (2011).
- Lim, H., Sharoukhov, D., Kassim, L., Zhang, Y., Salzer, J. L., Melendez-Vasquez, C. V. Label-free imaging of Schwann cell myelination by third harmonic generation microscopy. Proc. Natl. Acad. Sci. U.S.A. 111 (50), 18025-18030 (2014).
- Strupler, M., Pena, A. M., Hernest, M., Tharaux, P. L., Martin, J. L., Beaurepaire, E., Schanne-Klein, M. C. Second harmonic imaging and scoring of collagen in fibrotic tissues. Opt. Express. 15 (7), 4054-4065 (2007).
- Cheng, J. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: Instrumentation, theory, and applications. J. Phys. Chem. B. 108 (3), 827-840 (2004).
- Volkmer, A. Vibrational imaging and microspectroscopies based on coherent anti-Stokes scattering microscopy. J. Phys. D: Appl. Phys. 38, R59-R81 (2005).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annu. Rev. Anal. Chem. 1, 883-909 (2008).
- Mukamel, S. Principles of nonlinear optical spectroscopy. , Oxford University Press. New York. (1995).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Opt. Lett. 7 (8), 350-352 (1982).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Phys. Rev. Lett. 82 (20), 4142-4145 (1999).
- Folick, A., Min, W., Wang, M. C. Label-free imaging of lipid dynamics using Coherent Anti-Stokes Raman Scattering (CARS) and Stimulated Raman Scattering (SRS) microscopy. Curr. Opin. Genet. Dev. 21 (5), 585-590 (2011).
- Wang, P., Liu, B., Zhang, D., Belew, M. Y., Tissenbaum, H. A., Cheng, J. X. Imaging lipid metabolism in live Caenorhabditis elegans using fingerprint vibrations. Angew. Chem. Int. Ed. Engl. 53 (44), 11787-11792 (2014).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Cheng, J. X., Jia, Y. K., Zheng, G., Xie, X. S. Laser-scanning coherent anti-Stokes Raman scattering microscopy and applications to cell biology. Biophys J. 83 (1), 502-509 (2002).
- Chiu, W. S., Belsey, N. A. N., Garrett, L., Moger, J., Delgado-Charro, M. B., Guy, R. H. Molecular diffusion in the human nail measured by stimulated Raman scattering microscopy. Proc Natl. Acad. Sci. U.S.A. 112, 7725-7730 (2015).
- Chen, X., Grégoire, S., Formanek, F., Galey, J. -B., Rigneault, H. Quantitative 3D molecular cutaneous absorption in human skin using label free nonlinear microscopy. J. of Control. Release. 200, 78-86 (2015).
- Kano, H., Hamaguchi, H. In vivo multi-nonlinear optical imaging of a living cell using a supercontinuum light source generated from a photonic crystal fiber. Opt. Express. 14 (7), 2798-2804 (2006).
- Brustlein, S., Ferrand, P., Walther, N., Brasselet, S., Billaudeau, C., Marguet, D., Rigneault, H. Optical parametric oscillator-based light source for coherent Raman scattering microscopy: practical overview. J. Biomed. Opt. 16 (2), 021106(2011).
- Chen, H., et al. A multimodal platform for nonlinear optical microscopy and microspectroscopy. Opt. Express. 17 (3), 1282-1290 (2009).
- Yue, S., Slipchenko, M. N., Cheng, J. X. Multimodal nonlinear optical microscopy. Laser Photonics Rev. 5 (4), 496-512 (2011).
- Sun, Q., Li, Y., He, S., Situ, C., Wu, Z., Qu, J. Y. Label-free multimodal nonlinear optical microscopy reveals fundamental insights of skeletal muscle development. Biomed Opt Express. 5 (1), 158-166 (2013).
- Le, T. T., Langohr, I. M., Locker, M. J., Sturek, M., Cheng, J. X. Label-free molecular imaging of atherosclerotic lesions using multimodal nonlinear optical microscopy. J. Biomed. Opt. 12 (5), 054007(2007).
- Ellis, D. I., Cowcher, D. P., Ashton, L., O'Hagana, S., Goodacre, R. Illuminating disease and enlightening biomedicine: Raman spectroscopy as a diagnostic tool. Analyst. 138, 3871-3884 (2013).
- A•P•E Angewandte Physik & Elektronik GmbH. , Germany. Available from: http://www.ape-berlin.de/en/page/calculator (2015).
- Ozçelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30 (11), 4120-4131 (2010).
- Heinrich, C., Hofer, A., Ritsch, A., Ciardi, C., Bernet, S., Ritsch-Marte, M. Selective imaging of saturated and unsaturated lipids by wide-field CARS-microscopy. Opt. Express. 16 (4), 2699-2708 (2008).
- Kyriakidis, N. B., Skarkalis, P. Fluorescence spectra measurement of olive oil and other vegetable oils. J. AOAC Int. 83 (6), 1435-1439 (2000).
- King, R. Microscopic anatomy: normal structure. Handb. Clin. Neurol. 115, 7-27 (2013).
- Monsma, P. C., Brown, A. FluoroMyelin Red is a bright, photostable and non-toxic fluorescent stain for live imaging of myelin. J. Neurosci. Methods. 209 (2), 344-350 (2012).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. X. Coherent anti-stokes Raman scattering imaging of axonal myelin in live spinal tissues. Biophys. J. 89 (1), 581-591 (2005).
- Wang, H. W., Fu, Y., Huff, T. B., Le, T. T., Wang, H., Cheng, J. X. Chasing lipids in health and diseases by coherent anti-Stokes Raman scattering microscopy. Vib. Spectrosc. 50 (1), 160-167 (2009).
- Jung, Y., Tam, J., Jalian, H. R., Anderson, R. R., Evans, C. L. Longitudinal, 3D in vivo imaging of sebaceous glands by coherent anti-stokes Raman scattering microscopy: normal function and response to cryotherapy. J. Invest. Dermatol. 135 (1), 39-44 (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved