A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
נוהל מסתגל מעבדת האבולוציה של מיקרואורגניזמים שימוש Chemostat
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים פרוטוקול להשיג אבולוצית מעבדה אדפטיבית של מיקרואורגניזמים בתנאים באמצעות תרבות chemostat. כמו כן, ניתוח גנטי של הזן התפתח נדון.
Abstract
Natural evolution involves genetic diversity such as environmental change and a selection between small populations. Adaptive laboratory evolution (ALE) refers to the experimental situation in which evolution is observed using living organisms under controlled conditions and stressors; organisms are thereby artificially forced to make evolutionary changes. Microorganisms are subject to a variety of stressors in the environment and are capable of regulating certain stress-inducible proteins to increase their chances of survival. Naturally occurring spontaneous mutations bring about changes in a microorganism's genome that affect its chances of survival. Long-term exposure to chemostat culture provokes an accumulation of spontaneous mutations and renders the most adaptable strain dominant. Compared to the colony transfer and serial transfer methods, chemostat culture entails the highest number of cell divisions and, therefore, the highest number of diverse populations. Although chemostat culture for ALE requires more complicated culture devices, it is less labor intensive once the operation begins. Comparative genomic and transcriptome analyses of the adapted strain provide evolutionary clues as to how the stressors contribute to mutations that overcome the stress. The goal of the current paper is to bring about accelerated evolution of microorganisms under controlled laboratory conditions.
Introduction
מיקרואורגניזמים יכול לשרוד ולהסתגל סביבות מגוונות. תחת לחץ חמור, הסתגלות יכולה להתרחש באמצעות רכישת פנוטיפים מועילים ידי מוטציות גנומי אקראיות סלקציה חיובית לאחר 1-3. לכן, תאים מיקרוביאליים יכול להתאים על ידי שינוי מטבולי או רשתות רגולטוריות לצמיחה אופטימלית, אשר נקרא "התפתחות מסתגלת". נטיות חיידקים חשובות אחרונות, כגון התפרצויות של חיידקים לבין ההתרחשות של זנים של חיידקים חזקים, הם קרובים מאוד אדפטיבית אבולוציה בתנאים מלחיצים. בתנאי מעבדה מוגדרים, אנו מסוגלים ללמוד את המכניזם של אבולוציה מולקולרית ואף לשלוט על הכיוון של אבולוצית חיידקים עבור יישומים שונים. בניגוד יצורים רב-תאיים, חד תאיים אורגניזמים מתאימים גם לאבולוציה מעבדה אדפטיבית (ALE) מהסיבות הבאות: הם להתחדש במהירות, הם שומרים על אוכלוסיות גדולות, וזה קל ליצור ולתחזק Homסביבות ogeneous. בשילוב עם התקדמות טכניקות רצפי DNA וטכנולוגיות תפוקה גבוהה, ALE מאפשר תצפית הישירה של שינויים גנומית להוביל שינויים רגולטוריים מערכתיים. דינמיקה מוטציוני ומגוון מהאוכלוסייה הם גם נצפה. אסטרטגיות הנדסה גנטית ניתן לקבוע מניתוח זני ALE 4,5.
תרבות Chemostat היא שיטה המשמשת כדי להשיג תאים יציבים ולהגדיל את הפרודוקטיביות תהליכי תסיסה 6. מדיום חדש מתווסף מרק התרבות שנקטף במהלך התהליך (האחרון כולל בינוניות ביומסה). לתרבות לטווח ארוך chemostat, לעומת זאת, משנה את הפרודוקטיביות היציב של התרבות ומביא על הצטברות של מוטציות ספונטניות ובחירת במהלך התרבות (איור 1 א). תחת לחץ ברירה שונה (לחצים), ההצטברות של מוטציות היא משופרת. עלייה הדרגתית של הלחץ לטווח ארוך chemostat מספק מבחר רציף של מוטציות שפועלות נגד גורמי הלחץ הנתונים, כגון טמפרטורה, pH, לחץ האוסמוטי, הרעבה מזינה, חמצון, מוצרי קצה רעילים, וכו 'העברת קולוני מתוך בינוני מוצק והעברה סידורית של מדיום נוזלי (חזר תרבות אצווה) גם לאפשר לחוקרים לקבל מיקרואורגניזמים התפתחו (איור 1b ו 1c). למרות שתרבות chemostat דורשת שיטות מסובכות, הברכה של גיוון (מספר חזרות וגודל אוכלוסייה) הוא גבוהה יותר מזה שהושג באמצעות עברת מושבה וטכניקות העברת סדרתי. חשיפת המתח היציבה תאים בודדים וירידת וריאציה במדינת הסלולר במהלך תרבות chemostat (מצב יציב) יתרונות אחרים של ALE לעומת טכניקות התרבות מבוססת יצווה. ALE-induced מתח של Escherichia coli נתון בתנאי succinate גבוהים הוא הציג במאמר זה.
Iles / ftp_upload / 54,446 / 54446fig1.jpg "/>
איור 1: שיטות של האבולוציה מעבדה אדפטיבית (א) Chemostat;. (ב) העברת סדרתי; (ג) העברת המושבה. הדמויות העליונות להמחיש את הרעיון של שיטות ALE, ואת הדמויות התחתונות להמחיש את מספר התאים גדלו במהלך ALE. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
1. הכנת ציוד
- השג צנצנת chemostat (150-250 מ"ל) או בקבוק Erlenmeyer (250 מ"ל) המכיל יציאת כניסת ויציאת לשקע. חברו את יציאות עם צינורות סיליקון המאפשר ספיקות של 10-100 מ"ל / שעה. לחלופין, להשתמש פורקן אוויר, יציאת האוויר, ויציאות לשקע כניסת מים בטמפרטורה מבוקרת.
- השג מכשיר מתאים את צנצנת chemostat המספקת שליטת תסיסה והטמפרטורה (או להשתמש חממה רועדת סיבובית).
- השג שתי משאבות פריסטלטיות כדי לספק בינוני טרי ולאסוף את התרבות.
- השג צנצנת מאגר (10-20 L) המכילה יציאת בינוניים יציאת כניסת אוויר.
- השג צינורות סיליקון מתאים שיעור הדילול (כלומר, מ"מ 0.8 מזהה, מגוון זרימת .06-36 מ"ל / דקה; L / צינורות S 13).
הכנה בינונית 2. ועיקור
- בינוני ראשוני
- ממיסים 0.3 גלוקוז גרם, 0.08 גרם NH 4Cl, 0.05 גרם NaCl, 0.75 גרם Na 2 4 HPO · 2H 2 O, ו -0.3 גרם KH 2 PO 4 ב 90 מ"ל מים מזוקקים (DW) בצנצנת chemostat.
- סוגרים את הצנצנת chemostat יחד עם צינורות באמצעות מלחציים. אין לאטום את פתח האוורור.
- לעקר את צנצנת chemostat ב חיטוי ב 121 מעלות צלזיוס במשך 15 דקות. לאחר העיקור, לאחסן בצנצנת chemostat בטמפרטורת החדר.
- ממיסים 0.02 גרם MgSO 4 · 7H 2 O, 0.01 גרם CaCl 2, ו תיאמין 0.1 מ"ג ב 10 מ"ל DW (פתרון).
- פתרון סינון באמצעות מזרק מסנן מזרק מראש מעוקרים (מסנן נקבובי 0.45 מיקרומטר).
- מוסיפים את פתרון filtrates לצנצנת chemostat.
- בינוני מתח
- ממיסים 30 גרם גלוקוז, 8 גרם NH 4 Cl, 5 גרם NaCl, 75 גרם Na 2 HPO 4 · 2H 2 O, 30 גרם KH 2 4 פו, hexahydrate succinate Disodium 300 גרם (Na 2 · succinate · 6H 2 O; הדחק השתמשו בניסוי זה) ב 9.9 L DW בצנצנת המאגר.
- סוגרים את הצנצנת המאגר יחד עם צינורות באמצעות מלחציים. אין לאטום את פתח האוורור.
- לעקר את צנצנת המאגר ב חיטוי ב 121 מעלות צלזיוס במשך 15 דקות. לאחר העיקור, לאחסן בצנצנת בטמפרטורת החדר.
- ממיסים 2 גרם MgSO 4 · 7H 2 O, CaCl גרם 1 2, ו -10 מ"ג תיאמין 100 מ"ל DW (פתרון).
- פתרון מסנן עם מזרק מזרק מסנן מראש מעוקרים (מסנן 0.45 מיקרומטר נקבובית).
- מוסיפים את פתרון filtrates לצנצנת המאגר.
- בסביבה נקייה מחיידקים, לחבר את צינורות סיליקון מעוקר לצנצנת המאגר ולצרף המשאבות peristaltic.
- בינוני מתח גבוה
- הכן את המדיום כאמור בסעיף 2.2, אבל עם ריכוז גדול יותר של עקה (כלומר, 3-5 גר '/ ל גבוהה של הסתגלות succinate).
הערה: פרוטוקול זה הוא להסתגלות מתח הבבית יכול להיות מועבר דרך המדיום. במקרה של לחצים פיזיים כגון טמפרטורה, תסיסה, או תאורה, טיפוח צריך להיות מתוכנן בהתאם.
- הכן את המדיום כאמור בסעיף 2.2, אבל עם ריכוז גדול יותר של עקה (כלומר, 3-5 גר '/ ל גבוהה של הסתגלות succinate).
3. טיפוח ראשוני
- לחסן מושבה אחת של wild-type E. coli במבחנה 15 מ"ל המכיל 4 מ"ל של מדיום הראשונית.
- דגירת המבחנה בתוך חממת רעד במשך 12 שעות ב 37 מעלות צלזיוס, 220 סל"ד.
- בסביבה נקייה מחיידקים, העברת 1 מ"ל של preculture לצנצנת chemostat.
- דגירה צנצנת chemostat, מתן אוורור (50 מ"ל אוויר / min) תסיסה (200 סל"ד), ב 37 מעלות צלזיוס במשך 6 שעות.
הסתגלות מתח 4.
- בסביבה נקייה מחיידקים, חבר את הקצה של הצינור סיליקון מהמשאבות לצנצנת chemostat.
- הפעל את המשאבה לשקע (10 מ"ל / שעה ומעלה) ולאסוף תרבות.
הערה: התרבות צריכה להיות בשלב המעריכים, בדרך כלל 4-8 שעות לאחר טיפוח ראשוני. - ChEck הצפיפות האופטית (600 ננומטר) של התרבות מן הצינורות המוצאים.
- הפעל את משאבת כניסת (10 מ"ל / שעה, המתאים לשיעור של דילול של 0.1 hr -1).
- בדוק את הצפיפות האופטית של התרבות ב 600 ננומטר משקע צינורות כל 24 שעות.
- הפעילו את chemostat למשך 96 שעות (מחזור 9.6-פי) או יותר. אם הצפיפות האופטית היא יציבה, להחליף את המאגר המכיל את מדיום המתח הגבוה. אם הצפיפות האופטית נמוכה מ -0.2, להפסיק את משאבת כניסת האכלת 6 שעות. הפעל מחדש את משאבת הכניסה ולבדוק כי הצפיפות האופטית היא מעל 0.2.
- בהדרגה להגדיל את הריכוז של גורם הדחק ידי שינוי למאגר המכיל ריכוז גבוה מלחץ.
- קח דגימות של התרבות המותאמת בכל פעם שהוא מגיע ציון דרך (למשל, זן מותאם 100 גר '/ ל מתח succinate), ולאחסן לניתוח גנומי נוסף.
- עבור אחסון מדגם, לערבב המדגם תרבות (0.5 מ"ל) עם soluti גליצרול 80% מעוקריםעל (0.5 מ"ל) ולאחסן אותו ב -80 מעלות צלזיוס.
הערה: אם מיקרואורגניזם רוכש יכולת לבזות את הלחץ במהלך תהליך ALE, ריכוז הלחץ בתוך מכל התסיסה אינו זהה לזה במאגר הטרי.
5. בידוד חד מושבה של הזנים מותאם-מתח
- כן בינוני צלחת אגר (1.6% אגרו) המכיל את אותו לחץ ובאותו הריכוז בינוני.
- פלייט תרבות לשקע (0.1 מ"ל) מן chemostat, ו לדגור על 37 מעלות צלזיוס למשך 16 שעות.
- פיק מושבות אחת מהצלחת באמצעות קיסם סטרילי ולחסן אותם 15 מ"ל מבחנות המכילות אותו הדחק ובאותו ריכוז בינוני כמו chemostat, דגירה במשך 6 שעות.
- העברת 1 מ"ל של מרק התרבות לתוך בקבוק 250 מ"ל Erlenmeyer המכיל 50 מ"ל של מדיום. קציר 0.5 מ"ל של מרק התרבות בכל שעה 1, ולמדוד את OD ב 600 ננומטר. השווה את שיעור הצמיחה של strai המותאםn לזה של זן פראי סוג נתון גורם הדחק.
תוצאות
להסתגלות מתח גבוה-succinate, סוג-בר E. coli W3110 זן היה בתרבית chemostat בבית D = 0.1 hr -1 עבור 270 ימים (איור 2).
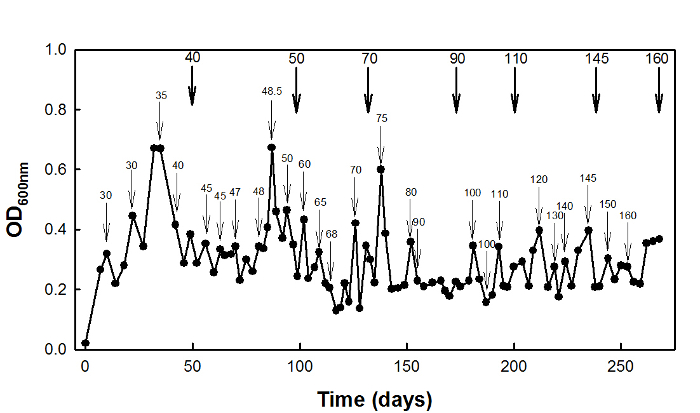
איור 2: הסתגלות מתח גבוה-succinate של E. coli W3110 באמצעות תר...
Discussion
מיקרואורגניזמים הם יהיו מסוגלים להתאים כמעט לכל סביבות בגלל קצב הצמיחה המהיר שלהם המגוון הגנטי. אבולוצית מעבדה מסתגלת מאפשרת מיקרואורגניזמים להתפתח בתנאים תוכנן, אשר מספק דרך בחירת אורגניזמים בודדים מחסה מוטציות ספונטניות שאינן מועילים בתנאים הנתונים.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This study was financially supported by the Korean Ministry of Science, ICT and Future Planning (Intelligent Synthetic Biology Center program 2012M3A6A8054887). P. Kim was supported by a fellowship from the Catholic University of Korea (2015).
Materials
| Name | Company | Catalog Number | Comments |
| Mini-chemostat fermentor | Biotron Inc. | - | manufactured by special order |
| silicon tubing | Cole-Parmer | Masterflex L/S 13 | tubing size can be varied depending on the dilution rate and the size of fermentor jar. |
| reservoir jar | Bellco | Media storage bottle | 20 L |
| chemicals | Sigma-Aldrich | - | reagent grade |
| glucose | Sigma-Aldrich | G5767 | ACS reagent |
| NH4Cl | Sigma-Aldrich | A9434 | for molecular biology, suitable for cell culture, ≥99.5% |
| NaCl | Sigma-Aldrich | 746398 | ACS reagent, ≥99% |
| Na2HPO4·2H2O | Sigma-Aldrich | 4272 | 98.5-101% |
| KH2PO4 | Sigma-Aldrich | 795488 | ACS reagent, ≥99% |
| MgSO4·7H2O | Sigma-Aldrich | 230391 | ACS reagent, ≥98% |
| CaCl2 | Sigma-Aldrich | 793639 | ACS reagent, ≥96% |
| thiamine·HCl | Sigma-Aldrich | T4625 | reagent grade, ≥99% |
| Na2·succinate·6H2O | Sigma-Aldrich | S2378 | ReagentPlus, ≥99% |
References
- Rando, O. J., Verstrepen, K. J. Timescales of genetic and epigenetic inheritance. Cell. 128, 655-668 (2007).
- Kim, H. J., et al. Short-term differential adaptation to anaerobic stress via genomic mutations by Escherichia coli strains K-12 and B lacking alcohol dehydrogenase. Front Microbiol. 5, 476 (2014).
- Mendizabal, I., Keller, T. E., Zeng, J., Yi, S. V. Epigenetics and evolution. Integr Comp Biol. 54, 31-42 (2014).
- Lee, J. Y., Seo, J., Kim, E. S., Lee, H. S., Kim, P. Adaptive evolution of Corynebacterium glutamicum resistant to oxidative stress and its global gene expression profiling. Biotechnol Lett. 35, 709-717 (2013).
- Lee, J. Y., et al. Artificial oxidative stress-tolerant Corynebacterium glutamicum. AMB Express. 4, 15 (2014).
- Narang, A. The steady states of microbial growth on mixtures of substitutable substrates in a chemostat. J Theor Biol. 190, 241-261 (1998).
- Kwon, Y. D., Kim, S., Lee, S. Y., Kim, P. Long-term continuous adaptation of Escherichia coli to high succinate stress and transcriptome analysis of the tolerant strain. J Biosci Bioeng. 111, 26-30 (2011).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nat Rev Genet. 14, 827-839 (2013).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25, 2078-2079 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved