A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אלקטרופורזה הנימים לפקח פפטיד האריך על Chitosan סרטים בזמן אמת
In This Article
Summary
Free solution capillary electrophoresis is a fast, cheap and robust analytical method that enables the quantitative monitoring of chemical reactions in real time. Its utility for rapid, convenient and precise analysis is demonstrated here through analysis of covalent peptide grafting onto chitosan films for improved cell adhesion.
Abstract
אלקטרופורזה נימים חינם-פתרון (CE) מפרידה analytes, תרכובות טעונות בדרך כלל פתרון באמצעות היישום של שדה חשמלי. לעומת טכניקות פרדה אנליטית אחרות, כגון כרומטוגרפיה, CE הוא זול, חזק ואפקטיבי לא דורש הכנת מדגם (במשך מספר מטריצות טבע מורכבות או דוגמאות פולימריות). CE הוא מהיר וניתן להשתמש בו כדי לעקוב אחר האבולוציה של תערובות בזמן אמת (למשל, קינטיקה כימית תגובה), כמו האותות נצפו עבור התרכובות המופרדות הם ביחס ישר לכמות שלהם בתמיסה.
הנה, את היעילות של CE מודגמת לניטור השתלת קוולנטי של פפטידים על גבי סרטי chitosan עבור יישומים ביו שלאחר מכן. התכונות מיקרוביאלית ביולוגיות של Chitosan להפוך אותו חומר אטרקטיבי עבור יישומים ביו כגון מצעי צמיחת תאים. קוולנטית השתלת rgds פפטיד (ארגינין - גליצין -חומצה אספרטית - סרין) על פני השטח של סרטי chitosan שואפת לשפר מצורף תא. מבחינה היסטורית, כרומטוגרפיה וניתוח חומצת אמינו שימשו לספק מדידה ישירה של כמות פפטיד מורכבים. עם זאת, ההפרדה והיעדר המהירה של הכנת מדגם מסופקת על ידי CE מאפשרים פחות ניטור מדויק עדיין בזמן אמת של תהליך השתלת פפטיד. CE הוא מסוגל להפריד בין לכמת את המרכיבים השונים של תערובת התגובה: הפפטיד (לא מורכב) ואת סוכני הצימוד הכימי. בדרך זו את השימוש לספירת תוצאות בסרטים משופרים עבור יישומים במורד זרם.
סרטי chitosan אופיינו באמצעות ספקטרוסקופיית מצב מוצק NMR (תהודה מגנטית גרעינית). טכניקה זו דורשת זמן רב ולא ניתן ליישם בזמן אמת, אבל מניב מדידה ישירה של פפטיד ובכך מאמתת את טכניקת CE.
Introduction
אלקטרופורזה נימי פתרון חינם (CE) היא טכניקה שמפרידה תרכובות פתרונות המבוססים על 1,2 היחס האחראי ל-חיכוך שלהם. החיוב לגודל- יחס לעתים קרובות מוזכר בספרות, אבל פישוט זה אינו חל על polyelectrolytes, לרבות פוליפפטידים בעבודה זו, וגם הוצג לא להיות מתאים 3 מולקולות אורגניות קטנות. CE נבדל טכניקות הפרדה אחרות בכך שהוא לא מקיים בשלב נייח, אלקטרוליט רקע בלבד (בדרך כלל חיץ). זה מאפשר את הטכניקה כדי להיות חזקה ביכולתה לנתח מגוון רחב של דוגמאות עם מטריצות מורכבות 4 כגון סיבים צמחיים 5, מבשל תסיסה 6 השתלה על פולימרים סינטטיים 7, דגימות מזון 8, ופפטידים מסיסים כמעט 9 ללא הכנת מדגם מייגע טָהֳרָה. מדובר בהישג משמעותי עבור polyelectrolytes מורכבים אשר יש בעיות פירוק (יםuch כמו chitosan 10 ו gellan מסטיק 11) ולכן קיים כפי מצטבר או זרז בתמיסה כבר נותח בהצלחה ללא סינון מדגם. יתר על כן, הניתוח של סוכרי דגני בוקר מעורב הזרקת דגימות עם חלקיקים של דגימות דגני בוקר זרז במים 8. זה גם מרחיב את הניתוח של polyelectrolytes מסועף או קופולימרים 12,13. עבודה נרחבת גם הושלמה בפיתוח טכניקות CE במיוחד עבור ניתוח של חלבונים עבור פרוטאומיקה 14, ההפרדה כיראליות של פפטידים טבעיים או סינתטיים 15 והפרדות שבב של חלבונים ופפטידים 16. מאז ההפרדה והניתוח להתבצע בתוך נימים, רק בנפחים קטנים של מדגם וממסים משמשים המאפשרים CE יש עלות ריצה נמוכה יותר מאשר טכניקות הפרדה אחרות כולל 5,6,17 כרומטוגרפיה. מאז ההפרדה על ידי CE היא מהירה, הוא מאפשר לבקרהטבעת של קינטיקה התגובה. הדבר בא לידי ביטוי במקרה של השתלת פפטידים על גבי סרטי chitosan עבור הידבקות תא משופר 18.
Chitosan הינו פוליסכריד נגזר N -deacetylation של כיטין. ניתן להשתמש סרטי Chitosan עבור יישומים ביו שונים כגון bioadhesives 19 מצעי צמיחת תאי 18,20, בשל biocompatibility של chitosan 21. מצורפים תא חלבוני מטריצה ספציפית תאיים, כמו פיברונקטין, collagens ו laminin, קשור ישירות ההישרדות של התאים 22. יש לציין, תאים מסוגים שונים לעתים קרובות דורשים מצורפים חלבונים תאים מטריקס שונים להישרדות ותפקוד תקין. מצורף תא סרטי chitosan הוצג להיות משופר באמצעות השתלת פיברונקטין 23; עם זאת, הכנה, טיהור השתלת חלבונים גדולים כאלה אינה כלכליים. לחילופין מגוון של פפטידים קטנים havדואר הוכח להיות מסוגל לחקות את תכונות חלבונים מטריקס גדולים. לדוגמה, פפטידים כגון RGD mimetics פיברונקטין (ארגינין - גליצין - חומצה אספרטית) ו rgds (ארגינין - גליצין - חומצה אספרטית - סרין) שימשו כדי להקל ולהגדיל תא מצורף 24. קוולנטיים השתלת rgds על גבי סרטי chitosan הביאה מצורף תא משופר עבור תאים המכונים לצרף פיברונקטין in vivo 18. נציב חלבונים גדולים אוהב פיברונקטין עם פפטידים קטנים יותר, שיש אותה פונקציונלי מספקת צמצום משמעותי בעלויות.
הנה, פפטיד השתלה כדי chitosan בוצע כפי שפורסם בעבר 18. כפי שהוכח בעבר, גישה זו מספקת השתלת פשוטה ויעילה באמצעות סוכני צימוד EDC-HCl (1-אתיל-3- (3-dimethylaminopropyl) carbodiimide) ו NHS (-hydroxysuccinimide N) כדי functionalize חומצה קרבוקסילית של rgds להיות מורכב על גביסרט chitosan. שני יתרונות של שיטה זו הם השתיל כי היא אינה דורשת שינוי כלשהו של chitosan או של הפפטיד, וזה מתבצע במדיום מימי על מנת למקסם את התאימות עם יישומי תרבית תאים בעתיד 18,20. כמו סוכני הצימוד ואת פפטיד ניתן לטעון, CE היא שיטה מתאימה לניתוח של קינטיקה התגובה. חשוב לציין, ניתוח של קינטיקה התגובה באמצעות CE מאפשר ניטור בזמן אמת של תגובת ההשתלה, ובכך מאפשר הוא ייעול לכימות מידת ההשתלה.
אמנם זה לא הכרחי באופן שגרתי, התוצאות של ניתוח CE ניתן תוקף off-line על ידי מדידה ישירה של הפפטיד השתיל על סרטי chitosan באמצעות NMR מצב מוצק (תהודה מגנטית גרעינית) ספקטרוסקופיה 25,26 כדי להדגים את השתלת קוולנטי של הפפטיד על הסרט 18. עם זאת, בהשוואה ל ספקטרוסקופיה NMR מצב מוצק, ניתוח בזמן אמת שמספקCE מאפשרת כימות של צריכת פפטיד בזמן אמת ובכך את היכולת להעריך את קינטיקה של התגובה.
השיטה הנ"ל היא פשוטה ומאפשרת הניתוח בזמן האמת של פפטיד השתלה גבי סרטי chitosan עם כימות עקיפה של מידת ההשתלה. השיטה הוכיחה ניתן להאריך את הערכה כמותית בזמן אמת של תגובות כימיות שונות כל עוד המגיבים או המוצרים להיות מנותח ניתן לטעון.
Protocol
1. הכנת סרטי Chitosan
- תשקול 2 גרם של חומצה אצטית קרחונית, להשלים 100 מיליליטר עם מי ultrapure.
- תשקלי 1.7 גרם של אבקת chitosan, להוסיף 100 מ"ל של תמיסה מימית חומצה 2% מ / מ 'אצטית. מערבבים במשך 5 ימים עם בר ערבוב צלחת בחישה מגנטית בטמפרטורת החדר מכוסה או ברדיד אלומיניום או בחושך.
- צנטריפוגה פיזור chitosan ב 1,076 XG ב 23 מעלות צלזיוס במשך שעה 1. אסוף את supernatant עם מזרק וזורק את המשקע.
- עבור כל סרט, aliquot 10 מ"ל של השעיה chitosan לתוך צלחת 9 ס"מ פטרי מפלסטיק בטמפרטורת החדר. השאר את הסרטים מכוסים להתייבש במשך 7 ימים לפחות.
- מספרי שימוש לחתוך סרטים היבשים לתוך 1 x 1 ריבועי סנטימטר. הערה: הניסוי יכול להיות מושהה בשלב זה.
2. הכנת פוספט שנאגר מלוח (PBS)
- תשקלי נתרן כלורי 8 גרם, אשלגן כלורי 0.2 גרם, phos מימן Disodium 1.44 גרםphate ופוספט dihydrogen אשלגן 0.24 גרם.
- ממסי כימיקלים אלה נשקלו ב 800 מיליליטר מי ultrapure ו לכייל פתרון עם חומצה הידרוכלורית מרוכזת ל- pH 7.4.
הערה: הניסוי יכול להיות מושהה בשלב זה.
3. הכנת 75 מ"מ נתרן Borate ההצפה ב- pH 9.2
- תשקול 3.0915 גרם של חומצה בורה. לפזר אותו 75 מ"ל מים ultrapure.
- לכיל הפתרון חומצה בורית כדי pH של 9.2 עם פתרון נתרן הידרוקסידי בריכוז של 10 M ומעלה.
זהירות: פתרונות סודיום הידרוקסיד מרוכז הם מאכלים יש לטפל בכפפות. - שלם עם מי ultrapure להשיג 100 מיליליטר של תמיסה. זה מניב חיץ borate נתרן 500 מ"מ ב- pH 9.2.
- לדלל את חיץ borate נתרן 500 מ"מ עם מים ultrapure למאגר borate 75 מ"מ נתרן. הערה: הניסוי יכול להיות מושהה בשלב זה.
4. הכנת Chitosan FiLMS עבור תגובת ההשתלה
- לשטוף 10 סרטים chitosan מרובע (1 x 1 ס"מ) ב 5 מ"ל של PBS עבור שעה 2 בצלחת פטרי בטמפרטורת החדר.
- במהלך תקופה זו, להכין ולאמת את מכשיר אלקטרופורזה הנימים (שלב 5).
5. הכנה ותיקוף של כלי אלקטרופורזה נימי
- הכן סיליקה התמזגו נימי 43.5 ס"מ חשוף עם קוטר פנימי של 50 מיקרומטר (43.5 ס"מ אורך כולל, אורך יעיל לחלון זיהוי הוא בדרך כלל 35 ס"מ) באמצעות החלשת את הציפוי החיצוני פולימר של נימי על אורך קבוצה עם תשמיש בוטה אז מצלם נימים.
- יצירת חלון עבור הנימים באמצעות מצית לשרוף את ציפוי הפולימרים ב -8.5 סנטימטרי המכניסה ואחרי שהוא מתקרר לנגב את זה נקי עם אתנול. לשרוף את הציפוי של הנימים בכל קצה במשך כמה מילימטרים עם מצית, ואחרי שהוא מתקרר לנגב את זה נקי עם אתנול.
- Insi נימי מקוםחלון איתור דה ולהתקין אותה קלטת הנימים ידי הצבתו באורכים שווים הכניסה והיציאה וסובב אותו למוטות את הקלטת. ואז להתקין את הקלטת במכשיר אלקטרופורזה הנימים.
- הגדר את הפרמטרים של השיטה עבור כל פרדה. בתפריט התוכנה ובחר "שיטה" ואז "ערוך את השיטה כולו". הגדר את הטמפרטורה, זמן, מתח, בקבוקונים המשמשים להפרדה (למשל 25 ° C, 10 דקות, 30 kV).
- במקטע מראש המיזוג, להגדיר את הגלים הרצופים: 10 דקות עם 1 M נתרן הידרוקסידי (במים), 5 דקות עם 0.1 M נתרן הידרוקסידי (במים), 5 דקות עם מי ultrapure ו -5 דקות עם חיץ borate 75 מ"מ נתרן ב- pH 9.2 עבור השיטה הראשונה של סדרת ניתוחים.
- לקבלת השיטות הבאות, להגדיר את הסט אדמומי ברציפות בקטע מראש המיזוג: 1 דקות עם 1 M נתרן הידרוקסידי (במים), 5 דקות עם חיץ borate נתרן 75 מ"מ ב- pH 9.2.
- במקטע ההזרקה, להגדיר פרמטרים עבור הזרקת הידרודינמית עם לחץ 30 mbar במשך 10 שניות לכל השיטות. בקטע ההפרדה, הגדר את תנאי ההפרדה עד 30 קילו ב 25 מעלות צלזיוס למשך 9 דקות עבור כל השיטות.
הערה: בדוק במדריך למשתמש של מכשיר לספירה ספציפי בתור נוהל להפעלת מכשיר CE עשוי להשתנות בין יצרנים. הכן את פתרון הידרוקסיד 1 M נתרן ביום.
- להזריק ולהפריד תקן פנימי נייטרלי (10 μl של dimethylsulfoxide v / v 10% (DMSO), במים מדולל לתוך 450 μl של חיץ borate נתרן 75 מ"מ). ואז להזריק ולהפריד באותו אופן תקן oligoacrylate (מומס במי ultrapure ב 10 גרם ∙ ל -1; לראות רשימה של חומרים) כדי לבדוק את תוקפו של הנימים. השהה את הרצף כאן עד תגובת ההשתלה הוא מוכן להתחיל.
6. הארכת rgds גבי סרט Chitosan
- תשקול את הפפטיד (1 מ"ג rgds)ואת סוכני צימוד (3 מ"ג EDC-HCl ו -2 מ"ג NHS).
- 2 שעות לאחר תחילת השריה הסרט chitosan ב PBS, לפזר את הפפטיד ואת סוכני צימוד 5 מ"ל של PBS.
- קחו aliquot 50 μl של פתרון זה. הוסף 2 μl של 10% v / v DMSO במים כתקן נייטרלי הפנימי aliquot. ניתוח aliquot עם לסה"נ (ראה שלב 7).
- הסר את 5 מ"ל של PBS נהגו לשטוף את הסרטים chitosan מצלחת פטרי. מוסיף את הפתרון 5 מיליליטר של סוכני פפטיד צימוד כדי בצלחת פטרי המכילה סרטי chitosan.
- מכסה את צלחת פטרי עם סרט פרפין ומניח אותו על שייקר מסלולית בטמפרטורת חדר. קח 50 aliquots μl של תקשורת תגובה בזמנים קבועים.
הערה: בפעם הניתוח הכוללת עם CE היא 15 דקות, אפוא aliquot ניתן לקחת כל 15 דקות (או כל 30 דקות אם שתי תגובות מנוטרות במקביל, וכו ').- הוסף 2 μl של 10% v / v DMSO במים כתקן נייטרלי פנימי לכל אלiquot.
הערה: Aliquots צריך להיות מנותח עם CE ברגע שהם נלקחים (ראה שלב 7).
- הוסף 2 μl של 10% v / v DMSO במים כתקן נייטרלי פנימי לכל אלiquot.
- לאחר 4 שעות של טלטול והסרת aliquot, הסר את צלחת פטרי מן שייקר. הסר את מדיום תגובת מצלחת פטרי. הוסף 5 מ"ל של PBS לשטוף את הסרטים chitosan.
- הסר את PBS בצלחת פטרי, יש לשטוף את הסרט chitosan עם מים ultrapure ולאפשר להם להתייבש במשך הלילה. הסר את מי ultrapure ולאחסן הסרטים ב -20 ° C בצלחת פטרי מפלסטיק.
ניטור 7. תגובת הארכת שימוש CE
- להזריק ו aliquots נפרד של התקשורת התגובה מיד לאחר הסרת מצלחת פטרי באמצעות התנאים ניתוח כאמור בסעיף 5.2.
- עם השלמת ההפרדות לשטוף את הנימים עם מי ultrapure במשך 10 דקות. לייבש אותו באמצעות סומק עם בקבוקון ריק (אוויר) במשך 10 דקות.
הערה: יכול להיות מושהה הניסוי בשלב זה.
8. בגיד נתונים tment עבור CE
- בדוק את תוקפו של כל ההפרדה, על ידי סימון כי הן הנוכחי במהלך הפרידה ואת זמן ההעברה של הסמן ניידות electroosmotic (DMSO במקרה זה) הם דומים לאלה שנצפו להפרדת oligoacrylate סטנדרטי.
הערה: עד 10-15% וריאציה מקובל מהערך הנוכחי צפוי של כ -50 מיקרו-אמפר וערך העברה חד של 1.3 דקות (ערכים ניידות electrophoretic אמור לשמש במקום פעמים הגירה אם ההדירות גבוהה נדרשת). - עבור כל הפרדה מוצלחת, לייצא את הנתונים הגולמיים מתוכנת אלקטרופורזה נימים ידי בחירת ערכת נתונים ספציפית, לחיצה ימנית על יצוא ובחירת אות מתאימה.
- המר את הנתונים הגולמיים שרשמו לסה"נ (כפי שהוצג ספיגת UV כפונקציה של זמן הגירה). המר את ציר ה- X (מ 'הגירה בזמן t) לתוך μ ניידות electrophoretic הבאים משוואה 1:
n 1 "src =" / files / ftp_upload / 54,549 / 54549eq1.jpg "/> (1)
כאשר L ד את הזמן ממושך הגלאי, L t הוא האורך הכולל של הנימים, V הוא המתח, ו- T איו היא זמן ההעברה של מצלצלים ניטראליים (תקן DMSO הפנימי במקרה זה) 27.
המר את ציר Y של הנתונים הגולמיים (ספיגת ב au) על חלוקת W mobilities electrophoretic (μ) בעקבות משוואה 2: 28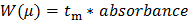 (2)
(2)
9. אפיון נוסף של סרטי פפטיד מורכב 18
- הכנס סרטי chitosan מורכב פפטיד, התגלגלו סביב עצמם, בתוך הרוטור NMR 4 מ"מ מצב מוצק. מלא את הרוטור עם פוספט שנאגר מלוח להתנפח הסרטים, ולסגור את הרוטור. חכה כמה שעות.
- ולנתח את הסרט עם 13 </ sup> ספקטרוסקופיה C תמ"ג 18.
תוצאות
CE הוא גם מתאים לפקח על ההשתלה של פפטידים (למשל, rgds) על גבי סרטי chitosan. סוכני צימוד מתאימים כוללים EDC-HCl ו NHS אשר מפעיל את הפפטיד להיות מורכבת על גבי chitosan (איור 1). CE הוא מסוגל להפריד בין המולקולות השונות של עניין מן מדיום התגובה. כדי להקצות את ?...
Discussion
הפשטות של הפרוטוקול המתואר כאן עושה אותו אידיאלי כדי יישום נרחב. עם זאת, תשומת לב מיוחדת צריכה להיות משולם כדי הצעדים העיקריים הבאים.
הכנת מכשיר לספירת פרופר
חשוב להפריד סטנדרט ידוע ...
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
MG, MO'C and PC thank the Molecular Medicine Research Group at WSU for Research Seed Funding, as well as Michele Mason (WSU), Richard Wuhrer (Advanced Materials Characterisation Facility, AMCF, WSU) and Hervé Cottet (Montpellier) for discussions.
Materials
| Name | Company | Catalog Number | Comments |
| Water | Millipore | All water used in the experiment has to be of Milli-Q quality | |
| Chitosan powder (medium molecular weight) | Sigma-Aldrich | 448877 | lot MKBH1108V was used. Significant batch-to-batch variations occur with natural products such as polysaccharides |
| Acetic acid - Unilab | Ajax Finechem | 2-2.5L GL | laboratory reagent |
| Dimethylsulfoxide | Sigma-Aldrich | D4540 | laboratory reagent, slightly hazardous to skin, hazardous if ingested |
| Sodium hydroxide | Sigma-Aldrich | 221465 | laboratory reagent, corrosive |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide | Sigma-Aldrich | D80002 | Irritant to skin |
| N-hydroxysuccinimide | Sigma-Aldrich | 130672 | Irritant to skin |
| Sodium chloride | Ajax Finechem | 466-500G | laboratory reagent |
| Potassium chloride - Univar | Ajax Finechem | 384-500G | analytical reagent, slight skin irritant |
| Disodium hydrogen phosphate - Unilab | Ajax Finechem | 1234-500G | laboratory reagent, slight skin irritant |
| Potassium dihydrogen phosphate - Univar | Ajax Finechem | 4745-500G | analytical reagent, slight skin irritant |
| Oligoacrylate standard | custom made | See reference for synthetic protocol: Castignolles, P.; Gaborieau, M.; Hilder, E. F.; Sprong, E.; Ferguson, C. J.; Gilbert, R. G. Macromol. Rapid Commun. 2006, 27, 42-46 | |
| Boric acid | BDH AnalR, Merck Pty Ltd | 10058 | Corrosive |
| Hydrochloric acid - Unilab | Ajax Finechem | A1367-2.5L | laboratory reagent, corrosivie |
| Fused silica tubing | Polymicro (Molex) | TSP050375 | Flexible fused silica capillary tubing with standard polyimide coating, 50 µm internal diameter, 363 µm outer diameter |
| Agilent 7100 CE | Agilent Technologies | G7100CE | Capillary electrophoresis instrument |
| Orbital shaker | IKA | KS260 | |
| Electronic balance | Mettler Toledo | MS204S | |
| Milli-Q Synthesis | Millipore | ZMQS5VF01 | Ultrapure water filtration system |
| Parafilm | Labtek | PM966 | Parrafin wax |
References
- Muthukumar, M. Theory of electrophoretic mobility of a polyelectrolyte in semidilute solutions of neutral polymers. Electrophoresis. 17, 1167-1172 (1996).
- Barrat, J. L., Joanny, J. F. . in Advances in Chemical Physics, Vol Xciv Vol. 94 Advances in Chemical Physics. , 1-66 (1996).
- Fu, S. L., Lucy, C. A. Prediction of electrophoretic mobilities. 1. Monoamines. Anal. Chem. 70, 173-181 (1998).
- Harvey, D. . Modern Analytical Chemistry. , (2000).
- Oliver, J. D., Gaborieau, M., Hilder, E. F., Castignolles, P. Simple and robust determination of monosaccharides in plant fibers in complex mixtures by capillary electrophoresis and high performance liquid chromatography. J. Chromatogr. A. 1291, 179-186 (2013).
- Oliver, J. D., Sutton, A. T., Karu, N., Phillips, M., Markham, J., Peiris, P., Hilder, E. F., Castignolles, P. Simple and robust monitoring of ethanol fermentations by capillary electrophoresis. Biotechnology and Applied Biochemistry. 62, 329-342 (2015).
- Thevarajah, J. J., Sutton, A. T., Maniego, A. R., Whitty, E. G., Harrisson, S., Cottet, H., Castignolles, P., Gaborieau, M. Quantifying the Heterogeneity of Chemical Structures in Complex Charged Polymers through the Dispersity of Their Distributions of Electrophoretic Mobilities or of Compositions. Anal. Chem. 88, 1674-1681 (2016).
- Toutounji, M. R., Van Leeuwen, M. P., Oliver, J. D., Shrestha, A. K., Castignolles, P., Gaborieau, M. Quantification of sugars in breakfast cereals using capillary electrophoresis. Carbohydr. Res. 408, 134-141 (2015).
- Miramon, H., Cavelier, F., Martinez, J., Cottet, H. Highly Resolutive Separations of Hardly Soluble Synthetic Polypeptides by Capillary Electrophoresis. Anal. Chem. 82, 394-399 (2010).
- Mnatsakanyan, M., Thevarajah, J. J., Roi, R. S., Lauto, A., Gaborieau, M., Castignolles, P. Separation of chitosan by degree of acetylation using simple free solution capillary electrophoresis. Anal. Bioanal. Chem. 405, 6873-6877 (2013).
- Taylor, D. L., Ferris, C. J., Maniego, A. R., Castignolles, P., in het Panhuis, M., Gaborieau, M. Characterization of Gellan Gum by Capillary Electrophoresis. Australian Journal of Chemistry. 65, 1156-1164 (2012).
- Thevarajah, J. J., Gaborieau, M., Castignolles, P. Separation and characterization of synthetic polyelectrolytes and polysaccharides with capillary electrophoresis. Adv. Chem. 2014, 798503 (2014).
- Sutton, A. T., Read, E., Maniego, A. R., Thevarajah, J., Marty, J. -. D., Destarac, M., Gaborieau, M., Castignolles, P. Purity of double hydrophilic block copolymers revealed by capillary electrophoresis in the critical conditions. J. Chromatogr. A. 1372, 187-195 (2014).
- Righetti, P. G., Sebastiano, R., Citterio, A. Capillary electrophoresis and isoelectric focusing in peptide and protein analysis. Proteomics. 13, 325-340 (2013).
- Ali, I., Al-Othman, Z. A., Al-Warthan, A., Asnin, L., Chudinov, A. Advances in chiral separations of small peptides by capillary electrophoresis and chromatography. J. Sep. Sci. 37, 2447-2466 (2014).
- Kasicka, V. Recent developments in capillary and microchip electroseparations of peptides (2011-2013). Electrophoresis. 35, 69-95 (2014).
- Taylor, D. L., Thevarajah, J. J., Narayan, D. K., Murphy, P., Mangala, M. M., Lim, S., Wuhrer, R., Lefay, C., O'Connor, M. D., Gaborieau, M., Castignolles, P. Real-time monitoring of peptide grafting onto chitosan films using capillary electrophoresis. Anal. Bioanal. Chem. 407, 2543-2555 (2015).
- Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 31, 603-632 (2006).
- Li, Z., Leung, M., Hopper, R., Ellenbogen, R., Zhang, M. Feeder-free self-renewal of human embryonic stem cells in 3D porous natural polymer scaffolds. Biomaterials. 31, 404-412 (2010).
- Domard, A. A perspective on 30 years research on chitin and chitosan. Carbohydr. Polym. 84, 696-703 (2011).
- Shekaran, A., Garcia, A. J. Nanoscale engineering of extracellular matrix-mimetic bioadhesive surfaces and implants for tissue engineering. Biochim. Biophys. Acta Gen. Subj. 1810, 350-360 (2011).
- Custodio, C. A., Alves, C. M., Reis, R. L., Mano, J. F. Immobilization of fibronectin in chitosan substrates improves cell adhesion and proliferation. J. Tissue Eng. Regen. Med. 4, 316-323 (2010).
- Boateng, S. Y., Lateef, S. S., Mosley, W., Hartman, T. J., Hanley, L., Russell, B. RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes. Am. J. Physiol. Cell Physiol. 288, C30-C38 (2005).
- Lefay, C., Guillaneuf, Y., Moreira, G., Thevarajah, J. J., Castignolles, P., Ziarelli, F., Bloch, E., Major, M., Charles, L., Gaborieau, M., Bertin, D., Gigmes, D. Heterogeneous modification of chitosan via nitroxide-mediated polymerization. Polym. Chem. 4, 322-328 (2013).
- Gartner, C., Lopez, B. L., Sierra, L., Graf, R., Spiess, H. W., Gaborieau, M. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-ray Diffraction. Biomacromolecules. 12, 1380-1386 (2011).
- Castignolles, P., Gaborieau, M., Hilder, E. F., Sprong, E., Ferguson, C. J., Gilbert, R. G. High resolution separation of oligo(acrylic acid) by capillary zone electrophoresis. Macromol. Rapid Commun. 27, 42-46 (2006).
- Chamieh, J., Martin, M., Cottet, H. Quantitative Analysis in Capillary Electrophoresis: Transformation of Raw Electropherograms into Continuous Distributions. Anal. Chem. 87, 1050-1057 (2015).
- Maniego, A. R., Ang, D., Guillaneuf, Y., Lefay, C., Gigmes, D., Aldrich-Wright, J. R., Gaborieau, M., Castignolles, P. Separation of poly(acrylic acid) salts according to topology using capillary electrophoresis in the critical conditions. Anal. Bioanal. Chem. 405, 9009-9020 (2013).
- Chung, T. W., Lu, Y. F., Wang, S. S., Lin, Y. S., Chu, S. H. Growth of human endothelial cells on photochemically grafted Gly-Arg-Gly-Asp (GRGD) chitosans. Biomaterials. 23, 4803-4809 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved