A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בודה UV-Vis ראמאן ספקטרוסקופיה פלטפורמת Immunoassay
* These authors contributed equally
In This Article
Summary
Nanoparticle-based optical probes have been designed as a vehicle for detecting antigens using Raman and UV-Vis spectroscopy. Here we describe a protocol for preparing such probes for a UV-Vis/Raman spectroscopy immunoassay in such a way to incorporate future multiplexing capabilities.
Abstract
Immunoassays המשמשים לאיתור חלבונים המבוססת על נוכחות של נוגדנים הקשורים. בשל השימוש הנרחב שלהם במחקר במסגרות קליניות, תשתית גדולה של מכשירי immunoassay וחומרים ניתן למצוא. לדוגמא, 96 ו 384 גם צלחות קלקר זמינות מסחרית ויש תכנון סטנדרטי כדי להכיל מכונות ספקטרוסקופיה אולטרה סגולות-גלוי (UV-Vis) מיצרנים שונים. בנוסף, מגוון רחב של נוגדנים, תגי זיהוי, וסוכני חסימת עיצובי immunoassay אישית כגון מבחני immunosorbent enzyme-linked (ELISA) זמין.
למרות התשתית הקיימת, ערכות ELISA סטנדרטיים אינם לענות על כל הצרכים המחקר, המחייב פיתוח immunoassay אישית, אשר יכול להיות יקר זמן רב. לדוגמא, ערכות ELISA יש ריבוב נמוך (זיהוי של יותר אנליטי אחד בכל פעם) יכול כפי שהם תלויים בדרך כלל קרינה או colשיטות orimetric לגילוי. מדד-צבע וניתוחים פלורסנט מבוססת יש יכולות מוגבלות ריבוב בשל פסגות רפאים רחבות. לעומת זאת, ראמאן בשיטות מבוסס ספקטרוסקופיה יש יכולת הרבה יותר עבור ריבוב בשל פסגות פליטה צרות. יתרון נוסף של ספקטרוסקופיית ראמאן הוא שכתבי ראמאן לחוות photobleaching פחות משמעותי מאשר תגי פלורסנט 1. למרות היתרונות שכתבי ראמאן יש מעל תגי פלורסנט colorimetric, פרוטוקולים לפברק immunoassays המבוסס ראמאן מוגבל. מטרת מאמר זה היא לספק פרוטוקול להכין בדיקות פונקציונליות לשימוש בשילוב עם לוחות קלקר לגילוי ישיר של analytes ידי ניתוח UV-Vis ו ספקטרוסקופיית ראמאן. פרוטוקול זה יאפשר לחוקרים לקחת עשה זאת בעצמך גישה לגילוי רב-אנליטי בעתיד תוך ניצול תשתית שנקבעה מראש.
Introduction
immunoassays כריך האופייני בעקיפין לזהות הנוכחות של אנטיגן באמצעות שני נוגדנים. הנוגדן ללכוד מאוגד משטח יציב ויוצר קומפלקס נוגדן-אנטיגן כשהוא קרוב אנטיגן המתאים. נוגדן זיהוי מכן הוא הציג נקשר אנטיגן. לאחר הכביסה, הנוגדן / אנטיגן / שרידי ההרכב נוגדן והוא זוהה על ידי נוגדן זיהוי שכותרתו כפי שמודגם באיור 1 א. זיהוי טיפוסי נעשה על ידי גלאי פלורסנט או colorimetric, הגבלת ריבוב עד 10 analytes בשל פסגות רפאים רחבות 2,3. לעומת זאת, מערכות מבוססות ראמאן יש הרבה פסגות פליטת צרה וכתוצאה מכך יכול ריבוב משופר עם מקורות בטענת זיהוי סימולטני של עד 100 analytes 2,3.
מקורות ספרות רבים זמינים אשר מכסים היבטים חשובים הקשורים Immunoassays 4 - 6 כגון צעד-אחר-צעדפרטים ליצירת ערכות ELISA אישית. למרבה הצער, פרוטוקולים אלה הם לגילוי פלורסנט או colorimetric, הגבלת יכולת ריבוב של immunoassays אישית. כדי לתת מענה לצורך זה, אנו מציגים נוהל מפורט לפברק את immunoassay UV-Vis / ראמאן שפורסמו בעבר 7 עבור immunoassay ישירה כפי שמודגם באיור 1B.
פרוטוקול זה כולל ייצור של בדיקות מבוססות ננו-חלקיק זהב פונקציונלי, באיור 2. ההליך לעשות בדיקות ראמאן / UV-Vis מתחיל באמצעות קשירה לכתבי ראמאן אל פני השטח של ננו-חלקיקי זהב (AuNPs). AuNPs הם פונקציונלי אז עם נוגדנים הקשורים פוליאתילן גליקול (PEG). אתרי קישור היא נשאר על AuNPs חסומים באמצעות קשירת תיאול פוליאתילן גליקול methoxy (MPEG-SH) כדי AuNPs למנוע עוקב חייב הלא ספציפי במהלך ניתוח. בדיקות AuNP המוכנות נבדקות באמצעות קשירה אנטיגניםמקובע בארות צלחת קלקר כפי שמודגם באיור 1B. לאחר שטיפת הצלחת, חלליות AuNP מזוהות באמצעות ספקטרוסקופיית UV-Vis בעוד כתבי ראמאן הקשורים מזוהים עם ספקטרוסקופיית ראמאן. שילוב נתונים ספקטרליים UV-Vis ראמאן מספק שתי שיטות של ניתוחים, שיפור היכולות של immunoassay זה.
Protocol
1. הכנת Buffers
- פוספט שנאגר מלוח (PBS)
- לדלל 50 מ"ל של 10x PBS עם 450 מ"ל מים כיתה HPLC לבצע ריכוז 1x PBS. סינון סטרילי הפתרון עם מסנן 0.22 מיקרומטר.
- פתרון חנות בטמפרטורת החדר.
- הכנת טריס בופר + Tween 20 (TBST)
- לדלל 50 מ"ל של 10x טריס בופר (TBS) עם 450 מ"ל מים כיתה HPLC לבצע ריכוז 1x. הוסף 250 μl של Tween-20 עבור 0.05% (v / v) של Tween-20. סינון סטרילי הפתרון עם מסנן 0.22 מיקרומטר.
- חנות בטמפרטורת החדר.
- הכנת האדם סרום אלבומין (HSA) פתרון חסימת
- לשקול 0.45 גרם של HSA לתוך 15 מ"ל של PBS 1x מסונן סטרילי לבצע 3% w / v פתרון HSA. הפתרון וורטקס עד HSA נמס לגמרי.
- חנות פתרון HSA על 4 מעלות צלזיוס.
הערה: שור סרום אלבומין(BSA) יכול לשמש גם כפתרון חסימה.
- הכנת נוגדן PEGylated (PEG-Ab) פתרון
הערה: פתרון הנוגדן חייב להיות חופשי מחלבונים מובילים או ייצוב כגון BSA, אשר יפריעו עם תגובות נטייה ידי מתחרה על n-hydroxysulfosuccinimide (NHS) אתרי קישור. אם הנוגדן מגיע פתרון טריס או חיץ גליצין, הוא חייב לעבור חילופי חיץ כדי למנוע אמינים או מלחי אמוניום מלהפריע תגובת נטיית NHS. אם הנוגדן הוא בצורה lyophilized, זה יכול להיות resuspended פי המלצת היצרן בריכוז של 1-10 מ"ג / מ"ל.- עבור נוגדנים חיץ טריס או גליצין, לבצע חילופי חיץ סודיום ביקרבונט 100 מ"מ באמצעות טור desalting. השתמש חיץ 100 מ"מ להעלות את ה- pH ל 8.5 כ לזרז את התגובה נטיה.
- סודה אורתו-pyridyl דיסולפיד-PEG-NHS (OPSS-PEG-NHS) עם 100 מ"מ שלביקרבונט הגנות לנפח של 1 מ"ל בריכוז של 1 מ"ג / מ"ל או יותר.
הערה: OPSS-PEG-NHS צריכה להיעשות טרי בשימוש בתוך כ -20 דקות. קבוצת NHS על יש OPSS-PEG-NHS זמן מחצית חיים של כ 20 דקות בתמיסה מימית ב- pH 8.5. - להוסיף OPSS-PEG-NHS לפתרון נוגדן בבית 2: 1 יחס (PEG: נוגדן) יחס נטיה לשמש דגימות הבדיקה. בתוך צינור microcentrifuge נפרד, להוסיף OPSS-PEG-NHS לפתרון אנטיגן בבית 2: יחס נטיה 1 לשמש עבור שליטה.
ההערה: 2: יחס 1 בהנחה יעילה נטיית 50%. המטרה היא לתייג כל נוגדן עם שרשרת PEG אחד. בשלב זה, על-תיוג עדיף תחת התיוג. השתמש המשוואה הבאה כדי לקבוע את הכמויות המתאימות של פתרון OPSS-PEG-NHS נוגדנים:
כאשר V הוא נפח, C הוא ריכוז לידי ביטוי מולקולות אוtibodies לכל מיליליטר. תחתי PEG וא.ב. הם OPSS-PEG-NHS נוגדנים, בהתאמה. ההיקף הסופי צריך להיות כ 250 μl. - דגירת פתרון PEG-Ab ב 4 מעלות צלזיוס למשך 8 שעות או למשך הלילה. פתרון חנות בעבודת aliquots של כ 25 μl ב -20 ° C כדי להגביל את מחזורי הפשרת ההקפאה הקפד להשתמש צינורות מחייב נמוכים.
2. כן UV-Vis / ראמאן בדיקות
- כן פתרון AuNP חשוף
- כן פתרון 2 מיליליטר של AuNPs עם בריכוז של כ 1 x 10 11 חלקיקים לכל מיליליטר.
- אם AuNPs צריך להיות מרוכז, למלא צינורות צנטריפוגות מחייב נמוכים עם 2,000 μl של מניית AuNP צנטריפוגות ב 5000 XG במשך 20 דקות או עד supernatant ברור. הסר את supernatant ידי pipetting, נזהר שלא להפריע גלולת AuNP.
- מערבבים את פתרונות AuNP הנותרים לתוך צינור אחד ולהעריך את Concentration על ידי קבלת מדידת UV-Vis והשוואת ערכים לריכוזים המכונים זה הוא קשר ליניארי.
- כן פתרון 2 מיליליטר של AuNPs עם בריכוז של כ 1 x 10 11 חלקיקים לכל מיליליטר.
- קבע את יחס תיוג כתב ראמאן המתאים
- כן פתרון עבודה של כתב ראמאן מומס מתנול. ריכוז זה יהיה תלוי הכתב בשימוש. בעבודה זו, להכין יודיד 3,3'-diethylthiatricarbocyanine (DTTC) בשעה פתרון עבודה של 200 מיקרומטר.
- בהנחת נפח סופי של 100 μl לכל היטב, להוסיף מספיק של פתרון כתב עבודה היטב כל בשורה הראשונה של צלחת 96-היטב כך כתב ראמאן ינוע בריכוזים מ -0.2 מיקרומטר עד 10 מיקרומטר. להוסיף מספיק מים HPLC כיתה היטב כל כך שהעוצמה היא 80 μl. הוסף 20 μl של AuNP היטב כל מה שהופך נפח סופי של 100 μl עבור כל טוב. דוגמא מסופקת בלוח 1.
- מדוד את UV-Vis הספקטרום מ -400 ל700 ננומטר באמצעות UV-Vis קריאת-צלחת ספקטרופוטומטר. הריכוז המתאים הוא הריכוז הגבוה ביותר עם פסגות שהוגדרו עבור ספקטרום UV-Vis. חזור על שלב 2.2.2 להגדיל ריכוזים עד יחס הריכוז הגבוה ביותר של כתבי ראמאן כדי AuNPs נמצא.
הערה: הצבע ואת הצורה AuNP, גודל, והיצרן להשפיע על הריכוז המתאים. לכן, על פי הצעדים הרשומים חייבים להיות מוערכים שינו תלוי הרכיבים המשמשים. פרוטוקול זה מעורב השימוש לצבוע בעלי מטען חשמלי חיובי. ככזה, מחייב בין AuNP והכתב היה לשפר את המצב באמצעות AuNPs טעונים שלילית. הדבר נעשה באמצעות AuNPs כתרים ציטראט. עיין בסעיף הדיון לפרטים נוספים.
- כריכת כתב רמן PEG-Ab כדי AuNP
- כן שני 1.5 מיליליטר אצוות של AuNP וכתב ראמאן בריכוז נקבע בעבר, המאפשר כתב ראמאן להיקשר AuNPs למשך 30 דקות בטמפרטורת חדר.
- מוסיפים את הנוגדן PEGylated (PEG-Ab) אצווה אחת של הפתרון הכתב AuNP ראמאן ליצור 200: 1 יחס של נוגדנים לחלקיקים. פתרון זה יהיה עבור דגימות הבדיקה. בתוך צינור microcentrifuge נפרד, מוסיפים את אנטיגן PEGylated אל אצווה השני של פתרון הכתב AuNP ראמאן בבית 200: 1 של נוגדן לחלקיקים כדי לשמש מלאה. דגירה הפתרונות למשך 30 דקות בטמפרטורת החדר.
הערה: היחס בין נוגדנים לחלקיקים יהיה ספציפי AuNPs לצבוע משומשים צריך להיות מותאם עבור כל מקרה ומקרה. המטרה פה היא לקבל את היחס הגבוה ביותר של נוגדנים עבור בדיקות AuNP להיקשר תוך מניעת אגרגציה של החלקיקים. השתמש המשוואה הבאה כדי לקבוע את הכמויות המתאימות להוסיף יחד:
כאשר V הוא נפח, C הוא ריכוז לידי ביטוי חלקיקים או נוגדנים לכל מיליליטר. הסנפירנפח אל צריך להיות כ 1.5 מ"ל.
- בלוק הנותרים אתרים על פני השטח AuNP עם MPEG-SH.
- כן MPEG-SH ידי המסת תיאול פוליאתילן גליקול methoxy המוצקה לריכוז 200 מיקרומטר באמצעות מים. הפתרון וורטקס עד-SH MPEG נמס לגמרי.
- להוסיף MPEG-SH בכל 40,000: 1 יחס לפתרון AuNP-PEG-Ab עשה צעד 2.3. דגירה הפתרון בטמפרטורת החדר למשך 10 דקות על מנת להבטיח את האתרים הנותרים על ננו-חלקיקים מזהב חסומות. השתמש המשוואה הבאה כדי לקבוע את הכמויות המתאימות להוסיף יחד:
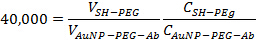
כאשר V הוא נפח, C הוא ריכוז לידי ביטוי חלקיקים או נוגדנים לכל מיליליטר. ההיקף הסופי צריך להיות כ 1.5 מיליליטר.
- שחזור בדיקות ראמאן פונקציונליות.
- חלקיקים צנטריפוגה ב 5000 XG במשך 20 דקות ב ג לאגד נמוךצינורות entrifuge או עד supernatant ברור. הסר את supernatant ידי pipetting נזהר שלא להפריע את AuNPs.
- Resuspend חלקיקים עם 1 מ"ל של תמיסת 1x PBS שנעשה בעבר. להעריך את ריכוז AuNP ידי לקיחת מדידת UV-Vis של נפח קטן של הפתרון (3 μl) ולהשוות את התוצאות על מדידות של ריכוז AuNP ידוע. כוון את עוצמת הקול כך הפתרון הסופי הוא לפחות 1 x 10 11 חלקיקים לכל מיליליטר.
- פתרונות חנות ב 4 מעלות צלזיוס עד שהוא משמש functionalizing של הצלחת immunoassay. השתמש פתרונות בתוך שבוע.
| כרכים להוסיף של כל רכיב (מ"ל) | |||
| לריכוז סופי DTTC (מ"מ) | הפתרון עובד DTTC (200 מ"מ) | AuNP | מַיִם |
| 0.2 | 0.1 | 20 | 79.9 |
| 0.6 | 0.3 | 20 | 79.7 |
| 1 | 0.5 | 20 | 79.5 |
| 2 | 1.0 | 20 | 79 |
| 5 | 2.5 | 20 | 77.5 |
| 7 | 3.5 | 20 | 76.5 |
| 10 | 5.0 | 20 | 75 |
טבלה 1. דוגמה דילול DTTC. דילולים שונים של DTTC והיקפי כלולות של המניה DTTC, פתרון ננו-חלקיקים מזהב, ומים.
3. פלייט Immunoassay כן
- לאגד אנטיגן הרצוי לצלחת immunoassay.
- הכינו מספיק אנטיגן מדולל (50 מיקרוגרם / מ"ל) כדי למלא את בארות קלקר. הפתרון וורטקס,ומייד להוסיף פתרון בארות הצלחת. אפשר האנטיגן להיקשר הצלחות במשך שעה 1 בטמפרטורת החדר.
- לשטוף אנטיגנים מאוגדים.
- הסר את פתרון אנטיגן העודף ידי השלכת פתרון לתוך מיכל אטום לסילוק ולהכות על הצלחת כנגד שולחן נייר מגבת מכוסית.
- להוסיף TBST אל הבארות לשטוף את המשטח ואז להסיר בכביסה באותו אופן כאמור. חזור על פעולה זו עוד פעמיים.
- בלוק נותר אתרי קישור על הצלחת כדי למנוע הלא ספציפי מחייב.
- להוסיף 70 μl של פתרון חסימת HSA היטב כל הצלחת דגירה בטמפרטורת החדר למשך 30 דקות.
- הסר ולשטוף את הצלחת באמצעות אותו נוהל כמו שצוין בשלב 3.2. מכסה את הצלחת ויבשה ולאחסן ב 4 מעלות צלזיוס עד מוכן לשימוש נוסף.
- Functionalize צלחת immunoassay.
- להוסיף 70 μl של tהוא לחקור חלקיקים מוכנים בסעיף 2 לעמודה הראשונה של צלחת 96-היטב לדלל עמודות עוקבות באמצעות 1: דילול סדרה 2. אפשר הצלחת כדי לדגור במשך לפחות שעה 1. דוגמה כיצד להכין את צלחת immunoassay ניתנת באיור 3.
- לשטוף את הצלחת עם TBST חמש פעמים כמפורטות צעדים 3.2, מוודא להיפטר AuNPs כראוי. לאחר שטיפה של דבר, להוסיף 70 μl של 1x PBS היטב כל ומכסים חותם צלחת.
הערה: דגימות הבקרה צריכות להיות ברורות. אם הלא ספציפי מחייב התרחש, דגימות השליטה תהיינה בצבע דומה כמו דגימות הבדיקה.
- רגישות assay בדיקה על-ידי UV-Vis ו ספקטרוסקופיית ראמאן.
- עבור כל טוב, למדוד את UV-Vis הספקטרום החל 400 כדי 700 ננומטר באמצעות UV-Vis קריאת-צלחת ספקטרופוטומטר.
- באמצעות מיקרוסקופ ראמאן הפוכה, למקד את המטרה על פני השטח של הבאר כי יש חלליות AuNP. אובטיין ספקטרום ראמאן של הבאר. אסוף ספקטרום החל 1,800 -1 ס"מ עד 400 ס"מ -1. חזור על שלב זה עבור כל הבארות.
- באמצעות תוכנת ספקטרלי מתאימה, לבצע תיקון בסיס פולינום -11 על מנת ספקטרום רמן פולינום כדי 3 rd עבור ספקטרום UV-Vis.
- באמצעות תוכנת ספקטרלי מתאימה, לנרמל את רמן UV-Vis ספקטרום. הגדר את הערך המקסימאלי ל 1 ו לדרג את כל הערכים האחרים בהתאם. כדי לנרמל את ספקטרום ראמאן, בחר לשיא קלקר ייחודי ולהגדיר אותו שווה ל 1 ו לדרג את כל הערכים האחרים בהתאם.
- באמצעות תוכנת ספקטרלי מתאימה, לבצע אינטגרצית שיא עבור כל ספקטרום. עבור ספקטרום ראמאן, השיא המייצג את כתב ראמאן חייב להיות נעדר באזור של פסגות קלקר. כדי לבצע אינטגרצית שיא, לציין את הגבולות הנפרדים עבור השיא הרצוי ולהקליט את אזור השיא הרצוי עבור כל הדגימות כולל הבקרות.
- Plהכבושים על אזור השיא הממוצע של ריבית כפונקציה של היומן של ריכוז AuNP עם סרגלי שגיאות עבור כל נקודה המציינת סטיית ההתקן הקשורה אליו. התאם נקודות כיול אלה עקומים לוגיסטיים 4-פרמטר.
- לקבוע את הערך הממוצע של ריק על ידי ממוצעים באזור השיא של ריבית מדגם ריק. קבע את סטיית התקן של התחומים הללו, זה הוא סטיית התקן של ריק.
- מאותה השיא ניתח בשלב הקודם, למצוא את סטיית התקן של אזור השיא של הריכוז הנמוך ביותר.
- חשב את הגבול של הגבול ריק והתחתון של זיהוי כמפורט בסעיף נציג התוצאות. השתמש בערכים אלה עם עקומות כיול 4PL לקבוע את LLOD מבחינת ריכוז AuNP.
תוצאות
במחקר זה, 60 חלקיקי זהב ננומטר שימשו ספקטרוסקופיה UV-Vis. UV-Vis ספקטרום קליטה מן 400 כדי 700 ננומטר נאספו אזורי השיא עבור כל ריכוז AuNP נקבע באמצעות תוכנת ניתוח ספקטרלי קוד פתוח 8. לפני לשיא אינטגרציה, ספקטרה שנאספה עברה תיקון בסיס באמצעות התאמה פולינום שלוש נקודות. באזורי ...
Discussion
בפרוטוקול המפורט, ישנם מספר נקודות קריטיות לכתובת. נושא אחד הוא הבחירה של כתב רמן ננו-חלקיקים מזהב. אף על פי הפרוטוקול נכתב כדי להיות מותאם לשימוש אישי, כתב ראמאן DTTC שמש כדוגמא. DTTC הוא כתב מטען חשמלי חיובי ונקשר טיעונים שליליים משטחים כגון AuNPs כתרי ציטראט. פרוטוקול זה י...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This work was supported by a Research Catalyst Award from Utah State University. The authors would like to thank Annelise Dykes, Cameron Zabriskie, and Donald Wooley for their contributions.
Materials
| Name | Company | Catalog Number | Comments |
| 60 nm Gold Nanoparticle | Ted Pella, Inc. | 15708-6 | These are citrate capped gold nanoparticles. Please see Discussion for relationship between Raman reporter and AuNP surface charge and its imporance to proper selection of AuNP and/or Raman reporter. |
| Sodium Bicarbonate | Fisher Scientific | S233-500 | |
| Methanol | Pharmco-Aaper | 339000000 | |
| Tris Buffered Saline (10x) pH 7.5 | Scy Tek | TBD999 | |
| Bottle Top Filtration Unit | VWR | 97066-202 | |
| Tween 20 (polysorbate 20) | Scy Tek | TWN500 | Used as an emulsifying agent for washing steps. |
| Phosphate Buffered Saline 10x Concentrate, pH 7.4 | Scy Tek | PBD999 | |
| Protein LoBind Tube 2.0 ml | Eppendorf Tubes | 22431102 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Protein LoBind Tube 0.5 ml | Eppendorf Tubes | 22431064 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Microplate Devices UniSeal | GE Healthcare | 7704-0001 | Used for sealing and storing functionalized plates. |
| Assay Plate, With Low Evaporation Lid, 96 Well Flat Bottom | Costar | 3370 | |
| HPLC grade water | Sigma Aldrich | 270733-4L | |
| 3,3′-Diethylthiatricarbocyanine iodide (DTTC) | Sigma Aldrich | 381306-250MG | Raman reporter |
| mPEG-Thiol, MW 5,000 - 1 gram | Laysan Bio, Inc. | MPEG-SH-5000-1g | |
| OPSS-PEG-SVA, MW 5,000 - 1 gram | Laysan Bio, Inc. | OPSS-PEG-SVA-5000-1g | OPSS-PEG-SVA has an NHS end. |
| Mouse IgG, Whole Molecule Control | Thermo Fisher Scientific | 31903 | Antigen |
| Goat anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody | Thermo Fisher Scientific | 31164 | Antibody |
| Human Serum Albumin Blocking Solution | Sigma Aldrich | A1887-1G | Bovine serum albumin can be used instead. |
| Mini Centrifuge | Fisher Schientific | 12-006-900 | |
| UV-Vis Spectrophotometer | Thermo Scientific | Nanodrop 2000c | |
| UV-Vis Spectrophotometer | BioTek | Synergy 2 | |
| Desalting Columns | Thermor Scientific | 87766 | |
| In-house built 785 nm inverted Raman microscope unit | N/A | N/A | An inverted Raman microscope is best for proper focusing onto surface of the well plate. Otherwise a very low magnification will be used due to height of the 96-well plate. An in-house built system was used as it was cheaper than buying from a vendor. However, any commercially available inverted Raman microscope system can be used. |
References
- Israelsen, N. D., Hanson, C., Vargis, E. Nanoparticle properties and synthesis effects on surface-enhanced Raman scattering enhancement factor: an introduction. Sci. World J. , e124582 (2015).
- Wang, Y., Schlücker, S. Rational design and synthesis of SERS labels. Analyst. 138 (8), 2224-2238 (2013).
- Wang, Y., Yan, B., Chen, L. SERS tags: novel optical nanoprobes for bioanalysis. Chem. Rev. 113 (3), 1391-1428 (2013).
- . . The Immunoassay Handbook: Theory and applications of ligand binding, ELISA and related techniques. , (2013).
- Cox, K. L., Devanarayan, V., Kriauciunas, A., Manetta, J., Montrose, C., Sittampalam, S. Immunoassay Methods. Assay Guid. Man. , (2004).
- . . ELISA development guide. , (2016).
- Israelsen, N. D., Wooley, D., Hanson, C., Vargis, E. Rational design of Raman-labeled nanoparticles for a dual-modality, light scattering immunoassay on a polystyrene substrate. J. Biol. Eng. 10, (2016).
- Menges, F. . Spekwin32 - optical spectroscopy software. Version 1.72.1. , (2016).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Yu, X. Quantifying the Antibody Binding on Protein Microarrays using Microarray Nonlinear Calibration. BioTechniques. 54, 257-264 (2013).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin. Biochem. Rev. 29 (Suppl 1), S49-S52 (2008).
- . . EP17-A2: Evaluation of Detection Capability for Clinical Laboratory Measurement Procedures; Approved Guideline. 32. No 8, (2012).
- Leigh, S. Y., Som, M., Liu, J. T. C. Method for assessing the reliability of molecular diagnostics based on multiplexed SERS-coded nanoparticles. Plos One. 8 (4), e62084 (2013).
- Sinha, L. Quantification of the binding potential of cell-surface receptors in fresh excised specimens via dual-probe modeling of SERS nanoparticles. Sci. Rep. 5, 8582 (2015).
- Shi, W., Paproski, R. J., Moore, R., Zemp, R. Detection of circulating tumor cells using targeted surface-enhanced Raman scattering nanoparticles and magnetic enrichment. J. Biomed. Opt. 19, 056014 (2014).
- Xia, X., Li, W., Zhang, Y., Xia, Y. Silica-coated dimers of silver nanospheres as surface-enhanced Raman scattering tags for imaging cancer cells. Interface Focus. 3 (3), 20120092 (2013).
- McLintock, A., Cunha-Matos, C. A., Zagnoni, M., Millington, O. R., Wark, A. W. Universal surface-enhanced Raman tags: individual nanorods for measurements from the visible to the infrared (514-1064 nm). Acs Nano. 8 (8), 8600-8609 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved