A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ותרופות טיפול
In This Article
Summary
Small laboratory fish have become popular models for bone research on the mechanisms underlying human bone disorders and for the screening of bone-modulating drugs. In this report, we describe a protocol to assess the effect of alendronate on bone cells in medaka larvae with osteoporotic lesions.
Abstract
עצם יוצרי אוסטאובלסטים אינטראקציה עם osteoclasts-resorbing עצם לתאם את המחזור של מטריקס העצם לשלוט הומאוסטזיס שלד. Medaka וזחלי דג זברה נמצאים בשימוש נרחב כדי לנתח את ההתנהגות של תאי עצם במהלך היווצרות, ניוון עצם, ותיקון. הבהירות האופטית שלהם מאפשרת ההדמיה של תאי עצם צבעי ניאון שכותרתו fluorescently כבול מטריצת שלד mineralized. המעבדה שלנו יצרה דגי medaka המהונדס המבטאים את הגורם וישכנע osteoclast קולטן Activator של גרעיני-גורם κB ליגנד (RANKL) תחת השליטה של מקדם הלם-מושרה חום. ביטוי אקטופי של תוצאות RANKL להיווצרות העודפת של osteoclasts מופעל, אשר ניתן דמיין בקווים הכתב עם ביטוי nlGFP תחת השליטה של אמרגן cathepsin K (ctsk). אינדוקצית RANKL והיווצרות osteoclast אקטופי מובילה פנוטיפים אוסטאופורוזיס דמוי חמורים. li medaka מהונדס מתחםנס מבטאי ctsk: nlGFP ב osteoclasts, כמו גם mCherry תחת השליטה של אמרגן osterix (OSX) ב אוסטאובלסטים מוקדמת, יכול לשמש כדי לחקור את האינטראקציה של שני סוגי התאים. זה מקל על התצפית in vivo של התנהגות הסלולר בתנאים של ניוון העצם ואת החלמתה. כאן אנו מתארים את השימוש במערכת זו כדי לבדוק תרופה המשמשת בדרך כלל בטיפול באוסטיאופורוזיס אדם מתאר פרוטוקול הדמיה לחיות. מודל medaka מוסיף למחקרים בתרבות תא ועכברים, ומציע מערכת חדשה לניתוח vivo של פעולת תרופה במערכת השלד.
Introduction
שלד החוליות מספק תמיכה מבנית והגנה על איברים, מאפשר ניידות, ומשמש מקור לסידן. לכל אורך חייו, מטריצת העצם התאית מופעלת מעל רף כדי לשמור על יציבות עצם ונוקש. תהליך זה דורש פעילות מתואמת בחוזקה הגומלין של אוסטאובלסטים יוצרי העצם osteoclasts-resorbing העצם. Osteoblasts נגזרות אבות mesenchymal מולטיפוטנטיים ולייצר קולגן ליצירת דמוי עצם, החלק חלבוניים של מטריקס העצם 10. Osteoblasts אינטראקציה עם osteoclasts להשיג פעילות מאוזנת של שני סוגי התאים, אשר נדרש שליטת עצם הומאוסטזיס 7. בגלל אינטראקציות רגולציה המורכבות האלו, תגובות טיפול תרופתי הומאוסטזיס עצם לא ניתן לבדוק באופן מלא באמצעות במבחנה. לפיכך, קיימת דרישה חזקה במודלים של בעלי חיים. בהשוואה להגדרות תרבית תאים, במודלים vivo יכול לספקתובנה חשובה רשתות רבות-תאי בתוך סביבת העצם.
במודלים של עכברים רבים קיימים עבור מגוון רחב של הפרעות עצמות אדם כוללים אוסטאופורוזיס 16. עם זאת, הגודל והנגישות של עוברי עכברים מייצגים מגבלות משמעותיות עבור הדמית חיה של תהליכי שלד. דגים teleost קטנים, ומצד שני, לשמש חלופה אטרקטיבית הדמיה in vivo. דג זברה (Danio rerio) ו medaka (Oryzias latipes) הפכו במודלים של בעלי חיים פופולריים למחקר שלד במהלך שני העשורים האחרונים 17, 19, 22, 24. עצם חוליות דגים ביונקים דומה מאוד, הוא על מבני ברמה פיזיולוגית, ורבי גני רגולטוריים מפתח מסלולי איתות שמורים 3. כמו יונקים, דגים teleost בזהירות להסדיר את הפעילות של אוסטאובלסטים ו osteoclasts לאזן היווצרות העצם ספיגת 26. והחשוב מכל, הבהירות האופטית של fish זחלים מאפשרים שימוש כתבי ניאון לתייג תאי עצם ומטריצת השלד המסוידת 8, 9, 12, 21, 23, המאפשרת התצפית של תהליכים תאיים בתוך החי. בנוסף, שורה של כלים גנטיים נוצרה כדי להקל על מחקר biomedically רלוונטי בדגים. לקבלת medaka בפרט, שיטות מוטצית גן ממוקדת על ידי CrispR / Cas9 2, תא שושלת התחקות 6, ואתר ספציפי transgenesis 14 הוקם לאחרונה וכעת הם נרחב בשימוש 15.
זחלי חוליות קטנים שמשו בהצלחה עבור מסכים כימי, אשר הוביל לגילוי של מספר תרופות רלוונטיות פרמקולוגית 1, 18.
הזחלים דג סובלניים לריכוזים נמוכים של DMSO והם מסוגלים לספוג תרכובות מן הסביבה המימית שלהם, או דרך העור או דרך מערכת העיכול 1, 5. נציג המעבדה שלנו בעברקווי medaka מהונדסים orted מבטאי כתבי ניאון בתאי עצם בשליטת osteoblast- השונה ומקדמים ספציפיים osteoclast. אלה כוללים אוסטאובלסטים מוקדמים (קולגן 10a1, col10a1; osterix, OSX) 20, 21, אוסטאובלסטים בוגר (osteocalcin, OSC) 27, ו osteoclasts (cathepsin K, ctsk) 24. כמו כן, אנו שנוצרנו קו מהונדס המבטא את הגורם וישכנע osteoclast קולטן Activator של גרעיני-גורם κB ליגנד (RANKL) תחת השליטה של מקדם הלם-מושרה חום 24.
אינדוקציה של RANKL במערכת זו התוצאה היא ההיווצרות אקטופי של osteoclasts הפעיל. זה מוביל ספיגת עצם מוגברת פנוטיפ אוסטאופורוזיס דמוי חמור, עם מינרליזציה באופן דרסטי בגופים בחוליות. הראינו לאחרונה כי פעילות האוסטאוקלסטים במודל זה יכול להיחסם על ידי etidronate ביספוספונטים ו alendronate, TWתרופות o נפוצות בטיפול באוסטיאופורוזיס אדם, ובכך אימות medaka כמערכת מודל מתאימה אוסטאופורוזיס 27.
בשל גדליו הגוזלים הגדולים שלהם, התפתחות מהירה, וגודל קטן של עוברים, זחלי medaka מהונדסים מתאימים בצורה ייחודית להקרנה בקנה המידה הגדולה של תרופות לאוסטאופורוזיס לניתוח vivo של התנהגות תא עצם. עיוני medaka ובכך יכולים להשלים ניסויים ביעילות בתרביות תאים והן בעכברים ומיועדים לגלות מטרות טיפוליות חדשות טיפולים חדשניים להפרעות עצמות אדם.
במחקר הנוכחי, אנו מתארים פרוטוקול לטיפול זחלי medaka עצם כתב עם התרופה לאוסטאופורוזיס המשותפת, alendronate. כמו כן, אנו מתארים בפירוט כיצד מטופלים הזחלים הם רכובים והוכנו הדמיה חיה של מטריקס העצם תאי עצם. ניתן פרוטוקולים אלה להתאים בקלות תרכובות כימיות קטנות אחרות כי גם לעבוד אנבוליים עצם או תרופות תרופתיות.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הניסויים בוצעו בהתאם טיפול בבעלי חיים מוסדיים אישרה ועדת שימוש (IACUC) פרוטוקולים של האוניברסיטה הלאומית של סינגפור (R14-293).
1. בעלי דגים ואת האוסף של עובר
- תרי WT, ctsk: 24 nlGFP, RANKL: HSE: CFP 24, ו OSX: mCherry 21 דגים יחידים או תרכובת מהונדסת medaka ב 26 מעלות צלזיוס מתחת מחזור אור מבוקר (14 שעות אור, 10 שעות חושכות) כדי לגרום השרצה.
- השרצה יומית מתקיימת במהלך 30 הדקות הראשונות אחרי האור דולק. הביצים נדבקות זה לזה באמצעות חוטים לצרף את הבטן של הנקבה במשך כמה שעות. השתמש נטו בסדר-מרושת לתפוס מבוגר נקבה נושאת אשכול ביצה. תנו דגים למנוחה קצרה ברשת ולאחר מכן לעסות בעדינות את הבטן של הדג להתפשט באשכול הביצית המופרית בזהירות מהבטן של הנקבה.
הערה: נקבת medaka בריאהיכול לייצר 10 - 20 ביצים כל יום במשך כ 5 חודשים. - מניחים את הביצים לתוך צלחת פטרי פלסטיק 60 מ"מ. השתמש פיפטה פלסטיק לשטוף את העוברים עם 5 - 10 הפתרון של מ"ל של 0.3x Danieau (בינוני דגים; 19.3 מ"מ NaCl, 0.23 KCl מ"מ, 0.13 מ"מ MgSO 4, 0.2 מ"מ Ca (NO 3) 2, ו -1.7 מ"מ HEPES, pH 7.0). הוסף 1 מ"ל של% 0.25 (w / v) פתרון המניות מתילן כחול ל -2.5 ליטר של המדיום דגים כדי למנוע את צמיחת הפטריות.
- בעדינות לגלגל אשכול ביצה כדי ליצור קשר של חוטים מצורפים. שימוש במלקחיים כדי להסיר החוטים המצורפים בקפידה מתוך אשכולות ביצית המופרים להשיג עובר בודד (איור 1 א).
- לביים את העוברים על פי Iwamatsu 2004 13.
- תרבות 20 - 30 עובר לכל 60 מ"מ פלסטיק צלחת פטרי C חממת 28 °. שינוי המדיום יומי על מנת להבטיח התפתחות תקינה של העוברים.
הערה: בפעם סביב הבמה הבקיעה (8 - 9 D postfertilization,DPF) הוא קריטי במיוחד עבור הישרדות. הסר chorions "פנויות" לשמור המדיום נקי כדי להבטיח שיעורי הישרדות זחל טובים.
2. הקרנת עובר טרנסגניים
- השתמש סטראו מצויד מנורה כספית עבור דימות פלואורסצנטי ו- GFP, RFP, ומסנני CFP להקרין עוברים מהונדסים לביטוי כתב ניאון באמצעות גדלת 40X.
- ראייה לזהות OSX: עוברים mCherry על ידי ביטוי הכתב mCherry בתחילת שנות יוצרי עצמות הגולגולת, כגון cleithrum, משני צידי הראש האחורי (איור 1 ב ', חץ), ואת parasphenoid, במיקום מרכזי הגולגולת הגחון ( איור 1 ב ', ראש חץ).
הערה: הביטוי Reporter מתחיל מ 5 DPF ואילך 21. - זהה ctsk: עוברים nlGFP ידי ביטוי nlGFP חזק בראש (איור 1 ג, חץ) וזנב (איור 1 ג, ראש חץ), החל6 DPF.
הערה: osteoclasts אנדוגני מהווה רק לאחר 21 DPF. nlGFP להביע תאים בשלב מוקדם זה (6 DPF) אינם osteoclasts אבל אחרים, עד כה uncharacterized, ctsk תאים -positive 24. - זהה RANKL: HSE: עוברים מהונדס CFP ידי ביטוי CFP בכל מקום אחרי טיפול הלם חום קצר במשך 20 דקות ב 39 מעלות צלזיוס, שנערך ב -2 DPF או במאוחר למטרות ההקרנה.
הערה: transgenes RANKL ו CFP נמצא בשליטתו של אותו יסוד הלם החום דו-כיוונית (HSE). ביטוי CFP מציין 24 אינדוקציה RANKL מוצלח. - בצע 1.5 - טיפול בהלם חום 2 שעות ב 9 DPF או במאוחר לגרום למספר גדול של osteoclasts חוץ רחמי באזור תא המטען, אשר כתוצאה מכך גורמת פנוטיפ אוסטאופורוזיס דמוי 24.
הערה: הביטוי RANKL טרנסגניים מושרה 9 תוצאות DPF ב מהפעלה אקטופי של ובתאים osteoclast רדומים, אשר באופן אנדוגני אינה מופעלתלפני 21 DPF. השתמש באמבט מים כדי להשיג תנאי 39 ° C יציבים. תנו עוברים Medaka צלחת פטרי המכילה לצוף על פני המים. ודאו המכסה של צלחת פטרי יבש כדי למנוע טביעתה של המנה. - עוברים מסך מקווי המתחם, כגון RANKL: HSE: CFP / ctsk: nlGFP פעמיים מהונדס ו OSX: mCherry / RANKL: HSE: CFP / ctsk: nlGFP משולשת מהונדס, על פי דפוס הביטוי של כל transgene הפרט.
הערה: Hemizygous ו הומוזיגוטים עובר מהונדס התאפיינו רמות קרינה שונות של transgene הכתב. עובר הומוזיגוטים הייתה עוצמת קרינה כי הייתה כ הוכפלה בהשוואה לזו של transgenics hemizygous. קווי מתחם שהיו הומוזיגוטים הן RANKL: HSE: CFP ו ctsk: nlGFP התקבלו על ידי incrossing חזר במשך כמה דורות. עבור OSX משולשת מהונדס: mCherry / RANKL: HSE: CFP / ctsk: דגים nlGFP, RANKL הומוזיגוטים: HSE: CFP / ctsk: דגי nlGFP היו שלובים עם OSX הומוזיגוטים: ספקי mCherry. הצאצאים הטרוזיגוטיים משולש המהונדס וכתוצאה מכך הועלו incrossed להשיג עוברי הומוזיגוטים RANKL: HSE: CFP. RANKL: HSE: transgene CFP חייב להיות הומוזיגוטים על מנת לקבל האינדוקציה היעילה של osteoclasts חוץ הרחמים.
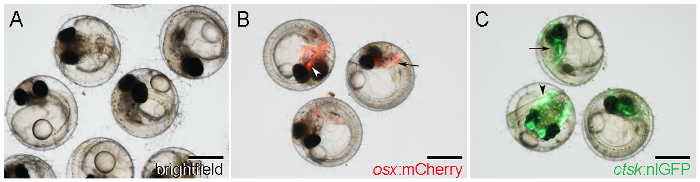
איור 1: WT ו מהונדס Medaka עוברים ב -7 D Postfertilization (DPF). א. עובר WT ציין עם תאורת brightfield. B. עוברים מהונדס מראה OSX: ביטוי mCherry ברחבי cleithrum (חץ) parasphenoid (ראש חץ). ג. עוברים מהונדס מראה ctsk: ביטוי nlGFP בראש (חץ) והזנב (ראש חץ). ברי סולם: 500 מיקרומטר.025 / 55025fig1large.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
3. טיפול Bisphosphonate של Medaka הזחלים
- הכן פתרונות המכילים ריכוזים שונים של ביספוספונטים (BPS) ללימודי מנה-תגובה.
הערה: BP למופת להשתמש בפרוטוקול זה הוא alendronate.- ממיסים alendronate במדיום דגים בריכוז של 100 מיקרוגרם / מ"ל להכין פתרון המניות.
- במיקסר מערבולת כדי להבטיח פירוק מוחלט. אחסן את הפתרון המניה ב 4 מעלות צלזיוס.
- הכן פתרונות עבודה שונים על ידי דילול פתרון המניות עם מדיום דגים לסדרה של ריכוזים (כלומר, 25, 37.5, 50, 62.5, ו -75 מיקרוגרם / מיליליטר).
הערה: סמים שונים עשויים להיות קליטים שונים, הפצה, מטבוליזם, והפרשה (ADME) פרמטרים, אשר יש לקחת בחשבון בעת בדיקת שימוש זה medaka זחלי מערכת. כמו כן, מסיסות ויציבות תרופה עשויות להשתנות כאשרמיושם כמו בתמיסה מימית. פחות תרכובות מסיסים במים ייתכן שיהיה צורך מומס הראשון בממסים אורגניים, כגון DMSO. במקרה זה, פתרון המניות מוכן ב DMSO, אשר לאחר מכן הוא מדולל יותר במדיום דגים. ראוי לציין, כי פתרונות קידוח במים (בינוני דגים) ניתן לאחסן במקרר למשך כמה wk. עם זאת, פתרונות המכיל DMSO חייב להיות מאוחסן על RT כדי למנוע התגבשות.
- העברת זחלים medaka לתוך צלחות שש היטב (שישה הזחלים / טוב) עבור עוקבות BP (alendronate) טיפול.
- הסר בינוני הדג בזהירות בעזרת פיפטה פלסטיק נקי להוסיף נפח קטן (כ. 0.5 מ"ל) של פתרון alendronate היטב כל אחד.
- הימנע בינוני דגים שאריות, כפתרון הוסיף BP יכול להיות מדולל, אשר היא קריטית במיוחד עבור פתרונות alendronate פחות מרוכז.
- הסר נפח קטן של פתרון alendronate (עד 0.5 מ"ל) מבאר כל עם טפטפת פלסטיק נקי ולהחליפה volu גדוללי (4 מ"ל) של פתרון alendronate.
- שנה בינונית מדי יום כדי להבטיח התפתחות עוברים נורמלית.
4. מכתים חיה של מטריקס עצם Mineralized
- ממיסים 0.5 גרם של Alizarin complexone (ALC; Alizarin-3-methyliminodiacetic חומצה) או 0.05 גרם של calcein ב 50 מ"ל של מדיום דגים להכין 1% ו -0.1% פתרונות המניות, בהתאמה. במיקסר מערבולת כדי להבטיח פירוק מוחלט.
הערה: בינוני דגים ללא תוספת של מתילן כחול משמשת זה ואת הצעדים הבאים כדי להפחית autofluorescence ב הזחלים. - שימוש במסנן מזרק לשימוש חד-פעמי (0.2 מיקרומטר) כדי לסנן את הפתרון מכתים. אחסן את הפתרון המסונן בחושך ב RT.
הערה: הצבע של מסונן, ברור הפתרון מכתים ALC הוא צהוב כהה לכתום. הצבע של פתרון calcein המסונן, הברור הוא צהוב בהיר. פתרונות ניתן להשתמש במשך מספר חודשים. - לדלל את מניות ALC או calcein מסונן פתרון 1:10 ב בינוני דגיםדגירת זחלי medaka עבור 1.5 - 2 h (0.1% פתרון ALC) או 2 - 2.5 שעות (פתרון 0.01% calcein) באינקובטור 28 ° C אם זחלים בין 9 ו -17 DPF משמשים. שמור את הדגימות בחושך.
- מעבירים את הזחלים עד בינוני דגים טריים בעזרת פיפטה פלסטיק נקי.
- הסר בינוני דגים עם טפטפת פלסטיק נקי ולהוסיף בינוני דגים טריים. חזור על פעולה זו במשך 3 - 4 פעמים עד אין פתרון אדום או צהוב מוכתם (ALC או calcein, בהתאמה) שנשאר. השאירו את הזחלים במדיום דגים עבור 30 - 60 דקות לפני מקבע אותם הדמיה להימנע epifluorescence מהמדיום.
הערה: 0.1% פתרון מכתים ALC מזיק הזחלים medaka לזמנים בחשיפה ממושכת. פעמים הדגירה של יותר מ -2 h להשפיע על ההישרדות של הזחלים. ריכוז וזמן מכתים ולכן צריכים להיות מותאם במיוחד בשלבים שונים על מנת להשיג תוצאות הישרדות מכתים עובר אופטימליות.
5. דימות פלואורסצנטי חי p>
- להרדים את הזחלים medaka עם 0.01% Tricaine (אתיל methanesulfonate 3-aminobenzoate) במדיום דגים.
הערה: מורדמים הזחלים להיות משותק לאחר 5 - 10 דקות בתמיסה Tricaine ובדרך כלל משקרים או על צדם או גבם. - השתמש microloader פלסטיק להתמצא הזחלים בהתאם לאזור של עניין. האוריינטציה של הזחלים להשתמש בפרוטוקול זה הוא לרוחב.
- השתמש stereomicroscope עם תאורה פלואורסצנטי הדמיה. השתמש בהגדלה גדולה כאשר לוקח תמונות, התמקדות בחלקים שונים של הזחלים (הראש, גזע קדמי, מטען אחורי, וזנב). וסטיץ 'תמונות בודדות יחד אזורים חופפים באמצעות תוכנת עיבוד תמונה מתאימה (ריבועים באיור 3G).
הערה: פעולה זו מסייעת לשפר את איכות התמונה של כל חלקי הגוף הרלוונטיים במישור הנכון המוקדים. - החזר את הזחלים למדיום הדגים להתאוששות לאחר ההדמיה.
- להרדים את הזחלים עם 0.01% Tricaine במדיום דגים עבור 5 - 10 דקות עד שהם נעשים משותקים.
- ממיסים נמוכה ההיתוך agarose 1.5% בטווח הבינוני דגים על ידי חימום במיקרוגל. מגניב פתרון זה כ -30 מעלות צלזיוס.
- הוסף 0.5 - 1 מ"ל של-התכה נמוכה נוזלי 1.5% agarose במדיום דגים בצלחת פטרי עם רצפת זכוכית. מעביר את הזחלים הרדימו לתוך התמיסה בעזרת פיפטה פלסטיק נקיה.
הערה: קח זהירות מיוחדת כי הטמפרטורה של agarose ההתכה נמוכה הנוזלי היא נמוכה מספיק כדי לא לפגוע הזחלים. - לפני agarose מתמצק, להשתמש microloader פלסטיק לדחוף את הזחלים אל החלק התחתון של צלחת פטרי להתמצא הזחלים בהתאם לאזור של עניין. האוריינטציה של הזחלים להשתמש בפרוטוקול זה הוא לרוחב.
הערה: הדגימות מוכנות הדמית confocal לחיות לאחר agarose לחלוטין מבצרת. - שימוש במיקרוסקופ confocal כדי ACQתמונות uire.
- השתמש בקו לייזר 543 ננומטר עבור מכתים mCherry ו ALC מנתח. השתמש בקו לייזר 488 ננומטר עבור nlGFP והכתים calcein מנתח.
- לאחר הדמיה, להוסיף בינוני דגים כדי בצלחת פטרי ולהשתמש זוג מחטים מזרק בסדר (27 x G ½ 1 ") כדי להסיר את הזחלים בזהירות מן agarose. מעבירים את הזחלים עם המצורפת residually agarose בצלחת פטרי עם המדיום דגים להתאושש .
- לעבד את התמונות באמצעות תוכנת ניתוח תמונה 27.
Access restricted. Please log in or start a trial to view this content.
תוצאות
מספרי ביצה שופעים, כמו גם את הגודל הקטן של הזחלים, להפוך medaka מודל מצוין הקרנת סמים. צלחת אחת שש גם שמשה לתרבות עד 36 זחלים, אשר היו מספיק כדי לספק נתונים בעלי משמעות סטטיסטית. יתרון גדול נוסף של שימוש דג לניתוח שלד הוא האפשרות לעשות הדמיה לחיות. השקיפות של זחלים דגים מאפש...
Access restricted. Please log in or start a trial to view this content.
Discussion
צעדים קריטיים בתוך הפרוטוקול
זה חיוני כי התנאים לטיפול הלם חום הם עקביים ויציבים כאשר משווים מדגמים שונים. בתנאי טמפרטורה יציבים להבטיח רמות דומות של אינדוקצית RANKL ב הזחלים המהונדסים, וכתוצאה מכך, היווצרות osteoclast דומה, אשר יכול להי?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים מתחרים או פיננסיים.
Acknowledgements
פרויקט זה מומן על ידי תרומות של סינגפור משרד החינוך (משרד החינוך, מספר מענק 2013-T2-2-126) והמכון הלאומי לבריאות, ארה"ב (NIH, להעניק מספר 1R21AT008452-01A1). TY קיבל מלגה לתואר שני מהמחלקה NUS של מדעי הביולוגיה. אנו מודים יחידת confocal של מרכז NUS למדעי bioimaging (CBIS) בתמיכה המתמשכת שלהם.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Alendronate | Sigma | A4978 | |
| alizarin-3-methyliminodiacetic acid, Alizarin Complexone | Sigma | A3882 | |
| Calcein | Sigma | C0875 | |
| ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma | A5040 | |
| ImageJ (1.4.3.67) | National Institute of Health (NIH) | https://imagej.nih.gov/ij/ | |
| LSM 510 Meta confocal | Zeiss | ||
| LSM Image Browser (4.2.0.121) | Zeiss | http://www.zeiss.com/microscopy/en_de/downloads/lsm-5-series.html | |
| Micro-loader | Eppendorf | 5242956003 | Eppendorf ep T.I.P.S 20 μL |
| NIS-Elements BR 3.0 software | Nikon | ||
| Photoshop CS6 (13.0.0.0) | Adobe | ||
| SMZ1000 stereomicroscope | Nikon |
References
- Ablain, J., Zon, L. I. Of fish and men: using zebrafish to fight human diseases. Trends Cell Biol. 23 (12), 584-586 (2013).
- Ansai, S., Kinoshita, M. Targeted mutagenesis using CRISPR/Cas system in medaka. Biol Open. 3 (5), 362-371 (2014).
- Apschner, A., Schulte-Merker, S., Witten, P. E. Not all bones are created equal-using zebrafish and other teleost species in osteogenesis research. Methods Cell Biol. 105, 239-255 (2011).
- Bajoghli, B., Aghaallaei, N., Heimbucher, T., Czerny, T. An artificial promoter construct for heat-inducible misexpression during fish embryogenesis. Dev Biol. 271 (2), 416-430 (2004).
- Barrett, R., Chappell, C., Quick, M., Fleming, A. A rapid, high content, in vivo model of glucocorticoid-induced osteoporosis. Biotechnol J. 1 (6), 651-655 (2006).
- Centanin, L., Ander, J. J., Hoeckendorf, B., Lust, K., Kellner, T., Kraemer, I., Urbany, C., Hasel, E., Harris, W. A., Simons, B. D., et al. Exclusive multipotency and preferential asymmetric divisions in post-embryonic neural stem cells of the fish retina. Development. 141 (18), 3472-3482 (2014).
- Charles, J. F., Aliprantis, A. O. Osteoclasts: more than 'bone eaters. Trends Mol Med. 20 (8), 449-459 (2014).
- DeLaurier, A., Eames, B. F., Blanco-Sanchez, B., Peng, G., He, X., Swartz, M. E., Ullmann, B., Westerfield, M., Kimmel, C. B. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505-511 (2010).
- Du, S. J., Frenkel, V., Kindschi, G., Zohar, Y. Visualizing normal and defective bone development in zebrafish embryos using the fluorescent chromophore calcein. Dev Biol. 238 (2), 239-246 (2001).
- Eriksen, E. F. Cellular mechanisms of bone remodeling. Rev Endocr Metab Disord. 11 (4), 219-227 (2010).
- Hockendorf, B., Thumberger, T., Wittbrodt, J. Quantitative analysis of embryogenesis: a perspective for light sheet microscopy. Dev Cell. 23 (6), 1111-1120 (2012).
- Inohaya, K., Takano, Y., Kudo, A. The teleost intervertebral region acts as a growth center of the centrum: in vivo visualization of osteoblasts and their progenitors in transgenic fish. Dev Dyn. 236 (11), 3031-3046 (2007).
- Iwamatsu, T. Stages of normal development in the medaka Oryzias latipes. Mech Dev. 121 (7), 605-618 (2004).
- Kirchmaier, S., Hockendorf, B., Moller, E. K., Bornhorst, D., Spitz, F., Wittbrodt, J. Efficient site-specific transgenesis and enhancer activity tests in medaka using PhiC31 integrase. Development. 140 (20), 4287-4295 (2013).
- Kirchmaier, S., Naruse, K., Wittbrodt, J., Loosli, F. The genomic and genetic toolbox of the teleost medaka (Oryzias latipes). Genetics. 199 (4), 905-918 (2015).
- Komori, T. Animal models for osteoporosis. Eur J Pharmacol. 759, 287-294 (2015).
- Mackay, E. W., Apschner, A., Schulte-Merker, S. A bone to pick with zebrafish. Bonekey Rep. 2, 445(2013).
- MacRae, C. A., Peterson, R. T. Zebrafish as tools for drug discovery. Nat Rev Drug Discov. 14 (10), 721-731 (2015).
- Mitchell, R. E., Huitema, L. F., Skinner, R. E., Brunt, L. H., Severn, C., Schulte-Merker, S., Hammond, C. L. New tools for studying osteoarthritis genetics in zebrafish. Osteoarthritis Cartilage. 21 (2), 269-278 (2013).
- Renn, J., Buttner, A., To, T. T., Chan, S. J., Winkler, C. A col10a1:nlGFP transgenic line displays putative osteoblast precursors at the medaka notochordal sheath prior to mineralization. Dev Biol. 381 (1), 134-143 (2013).
- Renn, J., Winkler, C. Osterix-mCherry transgenic medaka for in vivo imaging of bone formation. Dev Dyn. 238 (1), 241-248 (2009).
- Schilling, T. F., Kimmel, C. B. Segment and cell type lineage restrictions during pharyngeal arch development in the zebrafish embryo. Development. 120 (3), 483-494 (1994).
- Spoorendonk, K. M., Peterson-Maduro, J., Renn, J., Trowe, T., Kranenbarg, S., Winkler, C., Schulte-Merker, S. Retinoic acid and Cyp26b1 are critical regulators of osteogenesis in the axial skeleton. Development. 135 (22), 3765-3774 (2008).
- To, T. T., Witten, P. E., Renn, J., Bhattacharya, D., Huysseune, A., Winkler, C. Rankl-induced osteoclastogenesis leads to loss of mineralization in a medaka osteoporosis model. Development. 139 (1), 141-150 (2012).
- Wakamatsu, Y., Pristyazhnyuk, S., Kinoshita, M., Tanaka, M., Ozato, K. The see-through medaka: a fish model that is transparent throughout life. Proc Natl Acad Sci USA. 98 (18), 10046-10050 (2001).
- Witten, P. E., Huysseune, A. A comparative view on mechanisms and functions of skeletal remodelling in teleost fish, with special emphasis on osteoclasts and their function. Biol Rev Camb Philos Soc. 84 (2), 315-346 (2009).
- Yu, T., Witten, P. E., Huysseune, A., Buettner, A., To, T. T., Winkler, C. Live imaging of osteoclast inhibition by bisphosphonates in a medaka osteoporosis model. Dis Model Mech. 9 (2), 155-163 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved