Method Article
טעינת צבע סידן לתוך צפרדע עצב צפרדע דרך גדם עצב: סידן חולף הרשמה צפרדע Neuromuscular צפרדע
In This Article
Summary
כאן, אנו מתארים שיטה לטעינת צבע סידן רגיש דרך גדם העצב הצפרדע לתוך קצות העצבים. כמו כן, אנו מציגים פרוטוקול להקלטת וניתוח של טרמינטים סידן מהיר בקצות העצבים ההיקפיים.
Abstract
אחת השיטות האפשריות ביותר למדידת רמות סידן presynaptic מסופי עצב presynaptic הוא הקלטה אופטי. הוא מבוסס על שימוש בסידן צבעי ניאון רגישים שמשנים את עוצמת הפליטה שלהם או את אורך הגל בהתאם לריכוז הסידן החופשי בתא. ישנן מספר שיטות המשמשות כתם תאים עם צבע סידן. הנפוצים ביותר הם תהליכים של טעינת צבעים באמצעות micropipette או מראש incubating עם צורות acetoxymethyl אסתר של צבעים. עם זאת, שיטות אלה אינם ישימים לחלוטין צמתים neuromuscular (NMJs) בשל בעיות מתודולוגיות המתעוררות. במאמר זה, אנו מציגים שיטה להעמסת צבע סידן רגיש דרך גדם העצב הצפרדע של עצב הצפרדע לתוך קצות העצבים. מאז הכניסה של סידן חיצוני לתוך מסופי העצבים ואת המחייב הבאים לצבוע סידן להתרחש בתוך זמן מיליקונד בקנה מידה, יש צורך להשתמש במערכת הדמיה מהירה לרשום אלה אינטראקטיביותNs. כאן, אנו מתארים פרוטוקול להקלטת סידן חולפת עם מצלמת CCD מהירה.
Introduction
סידן יונים (Ca 2 + ) להשתתף בתהליכי איתות עצביים רבים, כולל ייזום, תחזוקה, ופלסטיות של שחרור המתווך 1 , 2 , 3 , 4 , 5 . עם הגעתו של פוטנציאל הפעולה, תאיים Ca 2 + נכנס מסוף העצבים ויזם שחרור נוירוטרנסמיטר. בסינפסות מסוימות, זרם הסידן ניתן למדוד ישירות בשיטות אלקטרופיזיולוגיות 6 , 7 , 8 . במקרה של צומת neuromuscular (NMJ), לא ניתן להשתמש מהדק תיקון ישיר שתי אלקטרודות מתח טכניקות מלחציים בשל גודל הדקות של קצות העצבים.
הקלטות של פנים Ca 2 + זרמים מן קצות העצבים של NMJ יכול להיעשות על ידי electrophys עקיפהשיטות יולוגיות 9 , 10 . עם זאת, שיטות אלה דורשות טיפול מוקדם של סינפסה על ידי נתרן אשלגן יון חוסמי ערוץ. שיטות אופטיות אינן דורשות הפרדה פרמקולוגית של יונים זרמים במסוף העצבים ולאפשר הקלטות של Ca 2 + זרם, מופעלות על ידי פוטנציאל פעולה, ואת העלאה הבאים של יונים Ca 2 + ב axoplasm 11 , 12 , 13 , 14 . שיטות אלה מבוססים על הקלטות של שינויים הקרינה של Ca ספציפי 2 + צבעים רגישים על הכריכה של חינם Ca 2 + יונים 15 , 16 , 17 , 18 , 19 .
Ca 2 + מחוונים ניתן לטעון לתוך cElls באמצעות מגוון של שיטות, בהתאם למטרה של הניסוי. החוקרים להשתמש ביישום אמבטיה של צורות לצבוע חדיר קרום 20 , 21 , טוען דרך פיפטה תיקון 22 , או microinjection 23 , 24 , 25 . עם זאת, כל השיטות הללו יש מגבלות מסוימות במקרה של NMJ בשל הייחודיות שלה ארכיטקטורה סינפטי. עבור NMJ, השיטה הנוחה והמצליחה ביותר היא לטעון את הצבע דרך גדם העצב, שיטת מילוי קדימה 26 , 27 , 28 , 29 . טכניקה זו יכולה לשמש לטעינת צבעים שונים הקרינה לתוך קצות העצבים ההיקפיים. שיטה זו שימשה בהצלחה עבור מסופי עצב תסיסנית 28 , עצב המנוע לטאה28 , ו צפרדע מוטורי מסופי העצבים 17 , 26 , 27 , 30 . בהתאם לאובייקט הנחקר, פרטים שיטתיים עשויים להשתנות. זכוכית מיקרו פיפטה ניתן להשתמש עבור עצבים קטנים מן הזחלים 28 . כמה חוקרים תיארו שיטה 27 , 28 שבה סוף לחתוך טרי של עצב innervating שריר שקוע לתוך היטב מראש מלא צבע. ההכנה נשארת לכמה שעות כדי לספוג את הצבע. הצבע נספג על ידי האקסונים ומועבר אל מסופי העצבים. במאמר זה, אנו מתארים שיטה של טעינת אינדיקטור פלואורסצנטי לתוך צפרדעים עצב מוטורי המנוע דרך גזע עצב. הפרוטוקול שלנו משתמש קצה פיפטה פלסטיק עבור הדגירה של הרקמה עם צבע. כמו כן, אנו מתארים כיצד לרכוש ולנתח Ca 2 + פלואורסצנטי traמטופלים.
Protocol
ניסויים בוצעו על ההכנות שריר עצב מבודדים של פקטורוס עורית של שריר מן הצפרדע רדיבונדה רנא . גודל בעלי החיים של שני המינים היה כ 5-9 ס"מ. ההליכים הניסיוניים בוצעו בהתאם להנחיות לשימוש בחיות מעבדה של אוניברסיטת קאזאן הפדרלית והאוניברסיטה הרפואית קאזאן, בהתאם למדריך NIH לטיפול ולשימוש בחיות מעבדה. פרוטוקול הניסוי עמד בדרישות של מועצת הקהילה האירופית הנחיה 86/609 / EEC ו אושרה על ידי ועדת האתיקה של אוניברסיטת קאזאן רפואי.
1. הכנת הפתרונות
- הכנת הפתרון של רינגר.
- הכן פתרון של רינגר: 113.0 mM NaCl, 2.5 מ"מ KCl, 3.0 מ"מ NaHCO 3 , ו 1.8 מ"מ CaCl 2 . התאם את pH 7.2-7.4.
- הכן את הפתרון של רינגר עם Ca 2 + נמוך גבוה Mg 2 + תוכן: 113.0 mM NaCl, 2.5 מ"מ KCl, 3.0 מ"מ NaHCO 3 , 6.0 מ"מ MgCl 2 , 0.9 מ"מ CaCl 2 . התאם את pH 7.2-7.4.
- הכנת פתרון טעינת הצבע.
- הכן את הפתרון מבוסס מים המכיל HEPES-Na ב 10 מ"מ (pH 7.2-7.4).
- הוסף 14 μL של הפתרון HEPES בקבוקון עם צבע 30 .
הערה: צבע Ca 2 + אינדיקטור מגיע בקבוקון 500 μL עם 500 מיקרוגרם של אבקה. - וורטקס ספין למטה כדי לערבב ביסודיות.
- לדלל את הפתרון להביא את הריכוז הסופי של מחוון Ca 2 + עד 30 מ"מ. הימנע חשיפה לאור החנות ב -20 מעלות צלזיוס.
2. נוהל טעינת צבע
- לנתח את שריר pectoris עורית עם חתיכת עצב pectoralis proprius .
הערה: הליך הניתוח זמיןב להורדה חינם של העיתון על ידי Blioch et al. , 1968 31 .- עבור הליך לנתיחה, להשתמש בשני מלקחיים בסדר ומספריים הקרנית (ראה טבלה של חומרים ). מעבירים את הרקמה גזור לתוך סיליקון elastomer מצופה פטרי צלחת מראש מלא פתרון של רינגר לתקן את הרקמה עם סיכות נירוסטה בסדר כך שהוא נמתח מעט בצלחת.
- למלא מחדש את צלחת פטרי עם aliquot טרי של הפתרון של רינגר. הסר את רקמות החיבור. אין לפגוע בעצב.
- הכן את פיפטה מילוי: באמצעות סכין גילוח, לחתוך חתיכה ~ 2 מ"מ ארוכה של החלק הקוני של פלסטיק רגיל 10 פיפטה μL קצה.
- הכינו חתיכת חימר דוגמנות לעלות על פיפטה מילוי על צלחת פטרי.
- חבר את החלק האחורי של פיפטה מילוי מזרק פלסטיק באמצעות צינורות סיליקון ומתאמי חיבור פלסטיק עשוי טיפים פיפטה.
- לפני דאתם טעינת ההליך, להסיר את הפתרון של רינגר מהצלחת פטרי באמצעות פיפטה פלסטיק. יבש את הכנת עצב השריר באמצעות מזרק בסדר; זה ימנע את הדילול של Ca 2 + צבע על העמסה הבאים של פיפטה מילוי.
- הסר את Ca 2 + בקבוקון מחוון מהמקפיא ולאפשר לה להפשיר בטמפרטורת החדר במקום חשוך.
- תחת שליטה stereomicroscope עם הגדלה נמוכה (10 ×), לזהות את הצומת בין השריר לבין העצב. עם פינצטה בסדר ומספריים, לחתוך את העצב פקטורליס proprius קרוב למשטח השרירים (ראה שלב 2.1). השאירו גדם עצב על אורך 2 מ"מ.
- תקן את פיפטה מילוי המצורפת צינורות המזרק על צלחת פטרי באמצעות חימר דוגמנות.
- להזיז את קצה פיפטה קרוב לגדם עצב.
- ללא צובט אותו, בעדינות לשאוב את גדם העצב לתוך קצה פיפטה מילוי.
- הסר את צינור היניקה מן blunT סוף של פיפטה מילוי.
- בזהירות להסיר את הפתרון עודף מן פיפטה מילוי באמצעות מזרק עם מחט ארוכה (ראה טבלה של חומרים ). אין לצבוט את גדם העצב.
- אנכית לרומם את קצה פיפטה מילוי מעט, שמירה על גדם עצב aspirated בקצה.
- לבודד את החלק aspirated של גדם עצב מבחוץ של קצה פיפטה מילוי באמצעות ג'לי נפט.
- יבש את גדם העצב מבודדים פיפטה מילוי במידת הצורך: בעדינות לשאוב את עודף הפתרון של פיפטה מילוי באמצעות מזרק עם מחט ארוכה.
- צייר 0.5 μL של פתרון טעינה צבע (ראה שלב 1) באמצעות פיפטה עם קצה פיפטה ארוכה.
- בעדינות להכניס את קצה פיפטה עם פתרון טעינה לתוך פיפטה מילוי. מוציאים את התערובת ישירות על גדם העצב.
- חותם את הקצה הפתוח של פיפטה מילוי עם ג'לי נפט.
- הוסף aliquot קטן של רינגר של sOlution על צלחת פטרי לשמור על ההכנות רטוב.
- דגירה ההכנה בטמפרטורת החדר בתנאים כהים ורטובים במשך 5 שעות.
- הסר את פיפטה מילוי עם פתרון טעינה, לשטוף את ההכנה עם הפתרון של רינגר, ולשמור אותו לילה במקרר ב 8 ° C.
הכנת הרקמה למיקרוסקופיה
- הר ההכנה לתוך תא מצופה elastomer סיליקון לתקן אותו עם מחטים מיקרו פלדה כגון זה מתוח מעט.
- שוטפים את הרקמה עם aliquot של פתרון טרינגר טרי.
- השתמש אלקטרודה יניקה כדי לעורר את העצבים; בניית האלקטרודה זמין להורדה חינם של העיתון על ידי Kazakov et al. ,. מקם את קצה האלקטרודה קרוב לקצה לחתוך את העצבים לשאוב את גדם העצב לתוך פתח האלקטרודה.
- הר חדר הכנה על הבמה מיקרוסקופ. פלאקE בדיקה את הטמפרטורה ואת כניסת ו מוצא מוצא בחדר.
- חבר את כבל החשמל למרכיב Peltier.
- כדי superfuse הכנה, להשתמש במערכת פשוטה מונחה כוח הכבידה. כדי להסיר את הפתרון עודף, להפעיל את משאבת יניקה זלוף.
- הפעל את יחידת הבקר התרמי.
- הגדר את בקרת הטמפרטורה ל 20 ° C.
- הר מגן הגנה אולטרה סגול.
- חבר את האלקטרודה חוט מגרה כדי ממריץ חשמלי לבחון את התכווצויות השרירים מתחת למיקרוסקופ עם עדשה אובייקטיבי 4x.
- ממלאים את מערכת זלוף עם הפתרון של רינגר עם נמוך Ca 2 + ו גבוה Mg 2 + תוכן.
הערה: פתרון זה משמש למניעת התכווצויות שרירים. ירידה בריכוז של סידן חיצוני עלייה של התוצאה מגנזיום חיצוני הפחתת משרעת Ca 2 + transients.However, בהתבסס על ניסיון קודם, 0.9 mM CaCl 2 ו 6 מ"מ MgCl 2 עדיין מספיק כדי לפתור באופן אמין את משרעת Ca 2 + הארעיים. ראוי להזכיר כי קיימות דרכים אחרות כדי להפחית התכווצויות שרירים מבלי להקטין את Ca 2 + ריכוז.לדוגמה, השימוש d-tubocurarine או alpha-bungarotoxin, חוסמי ספציפי של קולטני אצטילכולין ניקוטיני, היה לגמרי או חלקית לחסום שרירים פרצופים 17 , 27 , 28 , 30. עם זאת, תוספת של רעלים אלה יכולים גם להשפיע על כניסת סידן presynaptic 33 . כדי למנוע זאת, μ-conotoxin GIIIA ניתן להשתמש 27 . - הפעל את המשאבה ולהתחיל את superfusion של ההכנה עם הפתרון של רינגר עם Ca נמוך 2 + ו Mg 2 + גבוה.
- עבור עדשה 40 × אובייקטיבי על המיקרוסקופ.
- הפעל את t הוא מונוכרומטור (ראה טבלה של חומרים ).
- בחר אורך גל פליטה של 488 ננומטר ומצב מתמשך של תאורה בתוכנה שליטה monochromator.
- תחת הגדלה גבוהה במצב הקרינה, להבטיח מסופי העצבים היו טעון עם צבע.
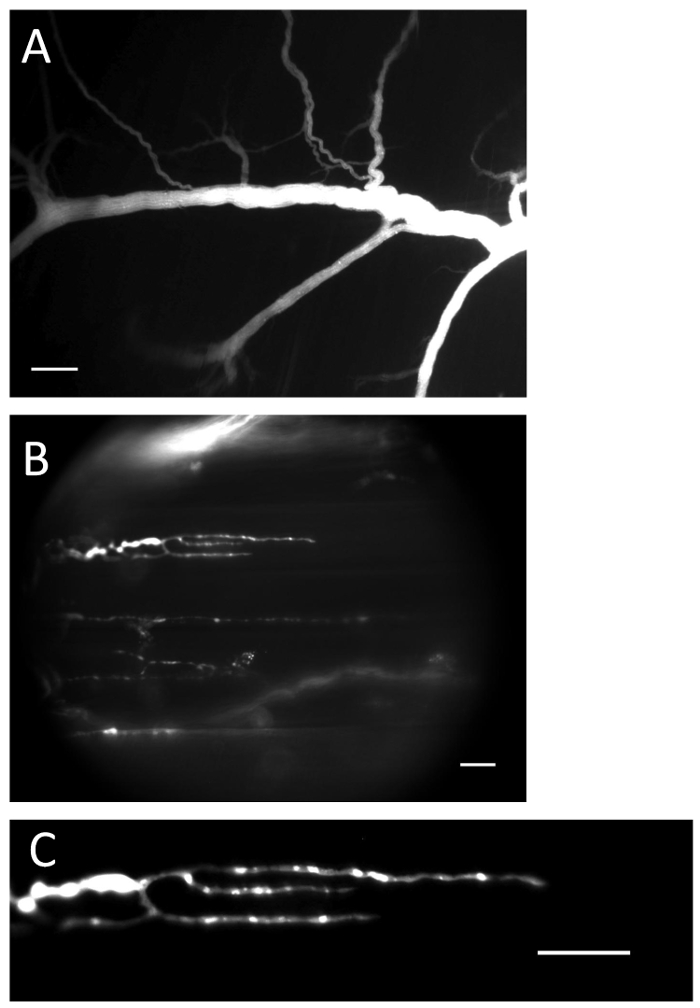
איור 1 : עצבים ומסופים עם מחוון Ca 2 + טעון. ( A ) עצב מלא עם מחוון Ca 2 + לאחר הליך הטעינה. סולם בר = 200 מיקרומטר. ( ב ) קצות העצבים מלאים מחוון Ca 2 + . סולם בר = 20 מיקרומטר. ( ג ) Ca 2 + - אינדיקטור פלואורסצנטי נראה בבירור בסוף העצבים. סולם בר = 20 מיקרומטר._blank "> אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
- אפשר את ההכנה לאזן עבור לפחות 30 דקות ב נמוך Ca 2 + ו גבוה Mg 2 + פתרון.
4. לכידת וידאו עם מצלמה דיגיטלית CCD
הערה: הפרטים של לכידת אותות הקרינה הם ספציפיים עבור כל מיקרוסקופ וסוג המצלמה, אבל שיקול המפתח הוא לכידת תמונה במהירות.
- השתמש 1 kHz כמו תדר ללכוד מינימום הקלטות של יחיד Ca 2 + transients ב NMJ.
הערה: מצלמות דיגיטליות מהירות CCD נחוצים עבור הדמיה פלואורסצנטי (ראה טבלה של חומרים ). מערכת רכישת נתונים ותוכנות (ראה טבלה של חומרים ) שימשו כאן לסינכרון של המצלמה, monochromator, וממריץ. בקצרה, פרוטוקול זה מאפשר את הדור של סינכרון פולסים על פלטי דיגיטלי של הנתוניםרכישת מערכת כדי לפתוח את התריס, ללכוד את אות הווידאו, ולהפעיל גירוי. ניתן להגדיר את כל הפרמטרים הזמניים בפרוטוקולים ו / או במנגנונים. פרוטוקול טיפוסי הוא סדרה של 500 מסגרות שנרכשו ב 1 קילוהרץ (80 x 80 פיקסלים). תאורה עם אור עירור יכול להלבין את מחוון Ca 2 + ו photodamage רקמת התא. לכן, למנוע חשיפה ארוכה לאור עירור. בפרוטוקול זה, הצמצם פתוח רק עבור הזמן הדרוש כדי ללכוד את הווידאו. רכש 20 סדרות לכל מסוף עצבי מסוים. המטרה כאן היא לפקח על אותם אתרים בקבוצת הביקורת ולאחר משלוח סמים. - תחת עדשה אובייקטיבית 4X של מיקרוסקופ, להשתמש במשטר שדה בהיר לדמיין את השרירים ואת העצב ענפים.
- לעבור העדשה 40X אובייקטיבי, באמצעות משטר epifluorescence ואורך גל עירור של 488 ננומטר, לחפש קצות העצב טעון צבע. זהה אזור בעל עניין עצבי.
- על צינור trinocular oF המיקרוסקופ, לבחור את רמות האור נתיב החליפין: 100% אור למצלמה.
- התחל את רכישת התוכנה עבור המצלמה CCD.
- תחת מצב "Live", מצא את ההחזר על ההשקעה והתאם את המיקוד.
- בחר את התפריט "שנה" הגדרות.
- השתמש "בסיסי תצורה" ב 1,000 מסגרות לשנייה (fps), עם רזולוציה של 80 x 80.
- הגדר את מספר מסגרות הקלט ל -500.
- הזן את שם הניסוי.
- בחר "טריגר חיצוני".
- הגדר את הזמן לפני ההדק ל -10 ms.
- הגדר את מספר החזרות ל -20.
- בתוכנה שליטה monochromator, בחר אורך גל פליטה של 488 ננומטר "חיצוני מופעלת תאורה" מצב.
- הפעל את תוכנת רכישת הנתונים.
- טען את פרוטוקול גירוי.
- לפני הקלטת וידאו, ללכוד את מסגרת כהה באמצעות תוכנת רכישת וידאו.
- הפעל את פרוטוקול גירוי.
- בחר את ההחזר על ההשקעה ואת checK האות המוקלט.
5. ניתוח נתונים
NoOTE: לניתוח נתונים, השתמש בתוכנת המצלמה CCD ו ImageJ; הנתונים מיוצגים כעקומה בתכנית גיליון אלקטרוני. בתוכנת המצלמה CCD, ממוצע 20 חוזר ולייצא את התוצאות לקובץ תמיכה ImageJ. ב- ImageJ, בחר את ההחזר על ההשקעה ואת הרקע. הפחת את הרקע מהחזר ההשקעה. מייצג את הנתונים כיחס: (ΔF / F 0 -1) x 100%, כאשר הוא ΔF הוא עוצמת הקרינה במהלך גירוי ו F 0 היא עוצמת הקרינה במנוחה.
- ברכישת תוכנה עבור המצלמה CCD, לחץ על קובץ> קבצים ממוצעים. בחר את הקבצים וממוצע אותם.
- שמור את הקובץ הממוצע כקובץ .fit על-ידי לחיצה על "שמור כקובץ Fit".
- הפעל את תוכנת ImageJ. בצע את השלבים הבאים:
- לחץ על תמונה> כוונון> בהירות / ניגודיות.
- לחץ על תמונה> ערימות> כלים>; מחסנית סדרן.
- לחץ על ניתוח> כלים> מנהל החזר ROI.
- גרור ושחרר את קובץ ה- .fit הממוצע לתוך חלון ImageJ.
- התקרב לחלון לקבלת תצוגה טובה יותר.
- על ידי הזזת הסמן, בחר את המסגרת האחרונה ומחק אותה (זוהי מסגרת כהה)
- בחר ROI מלבני על פני השטח האמין להיות הרקע. הוסף אותו למנהל החזר ROI
- מדוד את הרקע על ידי לחיצה על עוד> מדידה מרובה. שים לב ל- MAN. להעתיק את הנתונים, לייצא אותו לתוכנית גיליון אלקטרוני, ולחשב את הערך הממוצע של הסף עבור יחס.
- הפחת את הסף מהערימות על-ידי לחיצה על תהליך> ראשי> הפחתה. הזן את הערך הממוצע של הסף.
- בחר ROI מלבני סביב מסוף העצבים. הוסף אותו למנהל החזר ROI.
- בצע מדידה על ידי לחיצה על עוד> מדידה מרובה. שים לב ל- MAN. העתק וייצא אותו לתוכנית גיליון אלקטרוני.
- ממוצע היסט של האותות.
הערה: השתמש בהראשון כמה עשרות נקודות הוכחת בסיס צבע פלואורסצנטי ללא גירוי; זה הקרינה במנוחה. - מחלקים את האותות על ידי הקרינה במנוחה.
- הפחת "1" ו להכפיל ב -100%.
- מגרש את האות ולחשב את משרעת של Ca 2 + חולף.
תוצאות
לאחר טעינת צבע ועל גירוי עצב המנוע, עלייה משרעת של האות ניאון (Ca 2 + חולף) ניתן לאתר מסופי העצבים (ראה איור 2 ). פרמטרים של Ca 2 + הארעיים מוצגים בטבלה 1 . כמותית, הפרמטרים של Ca 2 + transients נמדדים במחקר שלנו קרובים לנתונים המתקבלים על ידי מדענים אחרים בסינפסות של חיות קר דם 15 , 34 . הפרמטרים של Ca 2 + הארעיים תלויים בשיעור של מחייב של Ca 2 + עם צבע הדיסוציאציה לאחר מכן. שיעור הכניסה של Ca 2 + לתוך עצב הסיום, אינטראקציה עם צבע, ואת דיפוזיה בציטופלזמה להשפיע על כל עלייה של Ca 2 + חולף. זמן ריקבון של האות ניאון תלוי הזיקה של צבע,את המהירות של אינטראקציה Ca 2 + עם מאגרים תאיים, והסרה על ידי משאבות יון 35 . ניתוח משרעת של Ca 2 + ארעיים ניתן להשתמש כדי ללמוד את ההשפעה של חומרים שונים על כניסת סידן המשתתף שחרור נוירוטרנסמיטר 33 .

איור 2 : ממוצע Ca 2 + חולף נמדד צפרדע NMJ. Ca 2 + חולף חושבה בהתבסס על הממוצע של אותות מ 13 NMJ צפרדע. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
| שִׂיאΔF / F (%) | עלייה של 20% -80% (ms) | Τ (אלפיות השנייה) |
| 12,6 ± 1,1 (n = 13) | 4.6 ± 0.5 (n = 13) | 115.3 ± 8.3 (n = 13) |
טבלה 1: הפרמטרים הממוצעים של Ca 2 + חולף. הנתונים מוצגים כממוצע ± SE; N הוא מספר המדידות ב- NMJs. השיא ΔF / F הוא המשרעת הממוצעת של ΔF / F.
Discussion
במאמר זה, הצגנו את השיטה של ביצוע Ca 2 + רגיש טעינת צבע לתוך קצות העצבים צפרדע דרך גדם עצב. בסוף הליך הטעינה, כל המסופים בחלק הפרוקסימלי של העצב יש רמות משמעותיות של הקרינה. ההערכה היא כי הריכוז בתוך המסוף של החללית נע בין 40 ל 150 מיקרומטר 17 .
הליך הדגירה מתבצע בשני שלבים: בטמפרטורת החדר ולאחר מכן בטמפרטורה נמוכה יותר במקרר. חשוב לשלוט על זמן הדגירה רקמה עם צבע בטמפרטורת החדר. בהתאם אורך בפועל של גדם עצב, צבע ספציפי, ואת הטמפרטורה, זמן הדגירה עשוי להשתנות. אם overexposed, מסופים בחלקים הפרוקסימלי קרוב לגדם עצב ניתן לעומס יתר על המידה. עם זאת, בחלק האמצעי של העצב, עדיין ניתן למצוא מסופים כי הם טעונים בצורה משביעת רצון. במהלך הE הדגירה ארוכה במקרר, צבע מופץ באופן שווה מעל קצות העצבים.
התצפיות שלנו 33 , 35 , כמו גם את הנתונים של חוקרים אחרים 30 , להוכיח את חוסר כל השפעה ניכרת של הליך הטעינה על משרעת התגובה postsynaptic או על תדירות של פוטנציאל צלחת מיניאטורה. אריכות ימים טובה תועדה בהכנות הטעונות. יש כמה נקודות חשובות ברצוננו למשוך תשומת לב. זה מאוד חיוני כדי למקם את גדם העצב לתוך פתרון טעינת צבע בתוך דקות ספורות לאחר כריתה כדי לאפשר לצבוע להיכנס לתוך האקסונים של עצב לחתוך; עיכובים יכולים לגרום לטעינה לא יעילה, ככל הנראה בשל resealing של אקסונים העצבים 27 , 36 . כמה חוקרים לטבול את גדם העצב ב 100 מ"מ EDTA (a Ca 2 + - ו Mg 2 + -chelator) מיד לאחר כריתה של העצב כדי למנוע את האקסונים לחתוך מ resealing. המאגר מוסר לאחר 1-2 דקות והוחלף עם פתרון טעינה צבע 37 . השימוש של ג 'ל נפט היטב במקום צינורות פלסטיק עבור הליך הטעינה מאפשר שימוש בגדם עצב קצר יותר. תוך שימוש בגישה זו, עצב הוא נחתך לאחר שהוא שקוע הפתרון HEPES עם צבע, ואת האקסונים לא reseal בגלל חוסר יונים divalent בפתרון צבע 27 , 28 .
במחקר שלנו, השתמשנו בצורת מלח מסיס במים של מחוון Ca 2 + במקום dextran. הצמד דקסטרן מפוזר באקסון לאט יותר מאשר צורות מלח. עם זאת, השימוש מצומד dextran מפחית compartmentalization צבע וטיפול על ידי עצב NMJs. סידן ירוק 1-3,000 MW dextran מצומד יש קצב דיפוזיה טוב מדגים ממודרים מופחת Up class = "xref"> 38.
חשוב מאוד למנוע תקופה ארוכה של תאורה פלואורסצנטי של הרקמה, כי זה משפיע על בריאותו והישרדותו. אנו משתמשים באופטי נומרסקי בערוץ האור הנראה כדי לחפש מסופי עצבים. במהלך ההקלטה, אנו מגבילים את השדה המואר באמצעות דיאפרגמה.
ראוי לציין כי שיטת הטעינה הזו מתאימה רק להכנות שעשויות לעמוד בדגירות ארוכות. כדי להקטין את זמן הטעינה כאשר מחקרים נערכים על רקמות שבריריות יותר ( למשל, סינפסות של בעלי חיים חם דם), יש צורך downscale את אורך עצב העצבים להשתמש micropipettes לטעינת 29 , 39 .
טכניקת הטעינה הזו מתאימה היטב לשינויים הדמיה cytosolic Ca 2 + , עם אינדיקטורים ניאון תחת שני גירוי עצב יחיד ופעילות סינפטי קצביEf "> 17 , 27 , 35. ניתוח של משרעת Ca 2 + -Transient ניתן להשתמש כדי לחקור את ההשפעה של חומרים שונים על כניסת סידן המשתתף שחרור נוירוטרנסמיטר 33 .
Disclosures
למחברים אין מה לגלות.
Acknowledgements
מחקר זה בוצע במסגרת תוכנית הממשלה הרוסית לצמיחה תחרותית של אוניברסיטת קאזאן הפדרלית ומענק מהקרן הרוסית למחקר בסיסי (16-04-01051, 16-34-00817, 15-04-02983). אנו מודים ארבעה בודקים אנונימיים על מתן הערות מועילות על טיוטות קודמות של כתב היד. אנו מביעים את הכרת התודה שלנו ל- Yuliya Aratskaya על ההקלטה הקולית. אנו מודים לד"ר ויקטור אילין על הערות מועילות רבות ועזרה עם עריכת finale של כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| Ca2+ indicator | Molecular Probes, USA | Oregon Green 488 BAPTA-1 hexapotassium salt, O6806 | 500 μg |
| Silicone Elastomer | Dow Corning, USA | Sylgard 184 elastomer | |
| Pipette | Biohit, Russia | 720210 | 0.5-10µL |
| Pipette tip | Fisher Scientific, USA | 02-707-175 | 10µL |
| Pipette tip | Biohit, Russia | 781349 | 10µL |
| Razor Blade | Fisher Scientific, USA | 12-640 | |
| Minutien Pins | Fine scince tools, Canada | 26002-20 | |
| Corneal Mini-Scissors | MT MEDI CORP, Canada | S-1111 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9610 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9611 | |
| Modelling clay | local producer | can be replaced by any local producer | |
| Petroleum jelly | local producer | can be replaced by any local producer | |
| Microspin FV 2400 | Biosan, Latva | BS-010201-AAA | |
| Multi-spin MSC 3000 | Biosan, Latva | BS-010205-AAN | |
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40mm |
| Syrynge | local producer | 0.5 ml | |
| HEPES | Sigma-Aldrich, USA | H0887 | 100ml |
| Microscope, BX51 | Olympus, Japan | ||
| Data acquisition system | Molecular Devices, USA | Digitdata 1550 | |
| software | Molecular Devices, USA | pClamp software, Version 10 | protocol can be download from : http://kpfu.ru/portal/docs/F_230007060/Video.capture.with. RedShirt.Neuro.CCD.camera.pro |
| Bath and bath temperature controler | Experimental Builder | can be replaced by any chamber with temperature control. For example from https://www.warneronline.com/ | |
| Monochromator | Till Photonics, Germany | Polychrome V | no longer available, can be replaced by other sutable stable light source 488 nm |
| monochromator control software | Till Photonics, Germany | Polycon | |
| Digital CCD camera | Redshirt imaging, USA | Neuro CCD SMQ | |
| Model 2100 Isolated Pulse Stimulator | A-M Systems, USA | ||
| Acquisition software for CCD camera | Redshirt imaging, USA | Turbo SM software | |
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel |
References
- Llinás, R., Sugimori, M., Silver, R. B. Microdomains of high calcium concentration in a presynaptic terminal. Science. 256, 677-679 (1992).
- Augustine, G. J. How does calcium trigger neurotransmitter release?. Curr Opin Neurobiol. 11, 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37, 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Curr Opin Neurobiol. 15, 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Curr Opin Cell Biol. 22, 496-505 (2010).
- Borst, J. G., Sakmann, B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383, 431-434 (1996).
- Borst, J. G., Sakmann, B. Calcium current during a single action potential in a large presynaptic terminal of the rat brainstem. J Physiol. 506, 143-157 (1998).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J Neurosci. 17, 2990-3001 (1997).
- Molgó, J., Mallart, A. Effects of Anemonia sulcatatoxin II on presynaptic currents and evoked transmitter release at neuromuscular junctions of the mouse. Pflugers Arch. 405 (4), 349-353 (1985).
- Slutsky, I., Rashkovan, G., Parnas, H., Parnas, I. Ca2+-independent feedback inhibition of acetylcholine release in frog neuromuscular junction. J Neurosci. 22 (9), 3426-3433 (2002).
- Haugland, R. P., Gregory, J. Indicators for Ca2+, Mg2+, Zn2+ and other metal ions. Handbook of fluorescent probes and research products. , 771-826 (2002).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods Cell Biol. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harb Protoc. 2010 (3), (2010).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. J Physiol. 505, 585-592 (1997).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophys J. 74, 1549-1563 (1998).
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal. Pflug Arch Eur J Phisiol. 440, 351-365 (2000).
- Sabatini, B. L., Oertner, T. G., Svoboda, K. The life cycle of Ca2+ ions in dendritic spines. Neuron. 33, 439-452 (2002).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. Single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. J Neurosci. 31, 11268-11281 (2011).
- Regehr, W. G., Yuste, R., Konnerth, A. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in neuroscience and development: a laboratory manual. , 307-314 (2005).
- Macleod, G. T. Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 786-790 (2012).
- Eilers, J., Konnerth, A. Dye loading with Patch Pipettes. Cold Spring Harb Protoc. 2009 (4), 277-281 (2009).
- Coleman, W. L., Bill, C. A., Simsek-Duran, F., Lonart, G., Samigullin, D., Bykhovskaia, M. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. J Physiol. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 797-801 (2012).
- Talbot, J. D., David, G., Barrett, E. F., Barrett, J. N. Calcium dependence of damage to mouse motor nerve terminals following oxygen/glucose deprivation. Exp Neurol. 234 (1), 95-104 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10, 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. alpha-Latrotoxin releases calcium in frog motor nerve terminals. J Neurosci. 20 (23), 8685-8692 (2000).
- Newman, Z., Malik, P., Wu, T. Y., Ochoa, C., Watsa, N., Lindgren, C. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harb Protoc. 2012 (7), 3440-3450 (2012).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Blioch, Z. L., Glagoleva, I. M., Liberman, E. A., Nenashev, V. A. A study of the mechanism of quantal transmitter release at a chemical synapse. J Physiol. (1), 11-35 (1968).
- Kazakov, A., Aleksandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. 40 (9), 13-16 (2015).
- Khaziev, E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Front Physiol. 7 (621), 1-10 (2016).
- Bélair, E. L., Vallée, J., Robitaille, R. Long-term in vivo modulation of synaptic efficacy at the neuromuscular junction of Rana pipiens frogs. J Physiol. 569 (1), 163-178 (2005).
- Samigullin, D., Fatikhov, N., Khaziev, E., Skorinkin, A., Nikolsky, E., Bukharaeva, E. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Front Synaptic Neurosci. 6 (29), 1-10 (2015).
- Angleson, J. K., Betz, W. J. Intraterminal Ca2+ and spontaneous transmitter release at the frog neuromuscular junction. J Neurophysiol. 85 (1), 287-294 (2001).
- Shahrezaei, V., Cao, A., Delaney, K. R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J Neurosci. 26 (51), 13240-132499 (2006).
- Troncone, L. R., et al. Promiscuous and reversible blocker of presynaptic calcium channels in frog and crayfish neuromuscular junctions from Phoneutria nigriventer spider venom. J Neurophysiol. 90 (5), 3529-3537 (2003).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Sudakov, I. A., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoSci. 7 (1), 162-166 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved