Method Article
הקרנת איכות הסביבה של Aeromonas hydrophila, Mycobacterium spp. Pseudocapillaria tomentosa במערכות דג זברה
In This Article
Summary
פרוטוקול זה מתאר את השימוש sump מטליות וניתוח בוצה של דג זברה מערכות, מה שמוביל גילוי מוגברת בהשוואה לשימוש הבלעדי של זקיפים לזהות פתוגנים כגון Aeromonas hydrophila, Mycobacterium spp. Pseudocapillaria tomentosa. מערכת לפקח tomentosa פ ביצים בהסגר גם מוצע.
Abstract
מערכות ניטור הבריאות הם שפותחו ונמצאות בשימוש במתקנים מחקר דג זברה מפני פתוגנים של רזבורה rerio כגון Aeromonas hydrophila, Mycobacterium spp. Pseudocapillaria tomentosa יש פוטנציאל לפגום רווחת ומחקר. הדגים הם בדרך כלל שנותחה אחרי המוות כדי לזהות חיידקים. השימוש של זקיפים היא דרך המוצע כדי לשפר את רמת הרגישות של המעקב וכדי להפחית את מספר בעלי חיים כדי לטעום. ההגדרה של מיכל סינון מקדים סנטינל מהמערכת recirculating מתואר. הטכניקה מפותחת כדי למנוע זיהום מים וכדי לייצג את אוכלוסיית הדגים על-ידי בחירה זהירה של גיל, מגדר, זנים. על מנת להשתמש המספר המינימלי של חיות, מפורטים גם טכניקות למסך את הסביבה. תגובת שרשרת פולימראז (PCR) על משטח sump מטליות משמש לשפר באופן משמעותי את הגילוי של כמה מינים mycobacterial שכיחה פתוגניים כגון Mycobacterium fortuitum, Mycobacterium haemophilumו- Mycobacterium chelonae. בשיטה סביבתית אחרת כוללת עיבוד של בוצה בחלק התחתון של מיכל או בור קיבול לחפש ביצים tomentosa פ . זוהי טכניקה זול ומהיר שניתן להחיל בהסגר איפה מכשיר הרבייה שקוע לתוך המיכל של בעלי חיים מיובאים. לבסוף, PCR מוחל על המדגם בוצה, hydrophila א ומתגלה של הניקוז התחתון ועל פני השטח. באופן כללי, טכניקות ההקרנה סביבתיים אלה שהוחל פתוגנים ספציפיים אלה הובילו רגישות מוגברת בהשוואה בדיקה של זקיפים סינון מקדים.
Introduction
על מנת להגן על מחקר, רווחת בעלי חיים1,2, הנוכחות של פתוגנים מנוטר בתוך מתקנים בעלי חיים. במקרה של דג זברה, לבריאות ניטור3,4,5,6,7,8,9,10,11 מסתמך על חיות ניתוח לאחר המוות histopathology, בקטריולוגיה תרבות או שיטות מולקולריות לעתים קרובות. בדיקות רק המושבה חיות אינה השיטה המומלצת בגלל המספר של דגים והוצאות נלוות הנדרשים כדי לזהות פתוגנים של שכיחות נמוכה. לכן, השיטה המועדפת היא לחשוף קבוצה קטנה של בעלי חיים כדי עומס גבוה יותר של מזהמים. דגים אלה נקראים סינון מקדים זקיפים. חשיפה זו נמשך כבר חודשים, זה כרוכה בהגברת עומס העבודה של המטפלים בבעלי חיים ו/או פתרון הנדסי בנוי למטרה. אתגר נוסף הוא ההקרנה של קווי מיובאים בהסגר שהחיות פורייה להשאירו בחיים ואיפה זה אינה תואמת מבחני שגרתית על הגוויות.
נתאר כאן כמה שיטות לזהות פתוגנים דג זברה מסוימת (hydrophila א, Mycobacterium spp., ו פ tomentosa) על-ידי הקרנת הסביבה הימית של המערכת. המטרה היא להפחית את מספר הדגים המשמש לניטור תקינות וכדי לייעל את מחזור, עלות, ורגישות של הזיהוי. שיטות כאלה הם אלטרנטיבה השימוש בבעלי חיים, ניתן ליישם כמה טכניקות ההקרנה יבוא בבידוד. לדוגמה, Mocho9 הצליח לזהות יותר מינים mycobacterial פתוגניים על-ידי ביצוע PCR sump מטליות ולא על דג זברה (כולל זקיפים), זה היה מתקבל עם דוגמאות פחות. כי אותו ללמוד, ביצים tomentosa פ זוהו עם רגישות רבה יותר על-ידי הקרנת הבוצה את הטנק באמצעות הנפקה ומיקרוסקופיה במקום בדיקות דגים על ידי ה-PCR ו- histopathology.
טבלה 1 מסכמת את המאפיינים השונים של הפלאג תוכניות3,4,5,6,7,8,9,10 בשימוש על ידי מספר מתקנים דג זברה. לאחר סינון זקיפים מקבלות מים באותו אופן כמו דגים המושבה ואילו זקיפים סינון מקדים לקבל מים ברגע זה יש שהופץ דרך מיכלי דגים המושבה הראשונה. לדוגמה, סינון מקדים זקיפים ניתן להגדיר במערכת recirculating על-ידי ללא הרף קבלת בור קיבול מים. לא ייתכן אופציה כאשר ישנן מערכות עצמאיות רבות בחדר אחד. במקרה זה, טנק אחד של זקיפים סינון מקדים יכול לשמש כדי לסנן את כל החדר. שהזקיפים במיכל סטטי, מחוץ למערכת recirculating, המים שלהם משתנה באופן קבוע, באמצעות סינון מים, רק קרי, בור קיבול המים של כל המערכות בחדר. טכניקה זו היא כמפורט להלן כקו להשוואה עם היעילות של ההקרנה סביבתיים. הסידור המוצע נועד לשלוט בבעיות איכות מים כמו ירידה של pH או זיהום חנקן.
הרעיון של ההקרנה סביבתיים חיידקי מסתמך על ההנחה כי חיידקים הם לזיהוי biofilm כגון אלה שנמצאו על הקיר sump על פני המים או את כל הטינופת בתחתית מיכל. הניקוז נראה נקודת דגימה אידיאלי במערכת חקלאות ימית recirculating מאז שהיא אוספת פסולת (מים, צואה, הזנה, וחומר אורגני אחר) מתוך כל מיכלי סינון. השטח של הניקוז לעיתים קרובות נגיש בקלות, מקימה זה מהר, זה יכול להתבצע גילוח ורחיצה כירורגית למניעת זיהום צולב של המדגם (מתוך כפפות לדוגמה). המושג משמש לזיהוי ונפוצים פתוגניים Mycobacterium spp. דג זברה מערכות9,12. הטכניקה המתוארת להלן, אנחנו מדווחים גם על זיהוי של hydrophila א דג זברה sump משטח מטליות, בוצה.
ההקרנה סביבתי עבור טפיל ביצים המבוסס על הזיהוי על ידי מורי. et al. 13 ו הטכניקה הנפקה משמש באופן שגרתי עבור פרזיטולוגיה והקרנת מיקרוסקופיים טפיל ביצים צואה14. Mocho9 הציע אלטרנטיבה תהליך הדגימה, הראה כי הטכניקה יכול לשמש כדי לזהות מינים אחרים של ביוטופ דגים. נגוע rerio ד לעבור tomentosa פ ביצים עם הצואה שלהם ולהישאר ביצי הטפיל בתחתית המיכל, ב כל הטינופת. הם יכולים להיות שנאספו לשם עקב צפיפות שלהם יותר מים. הצפיפות של הביצים משמש לעיבוד המדגם סביבתיים מדי. הנפקה ראשונה עם צנטריפוגה מפריד מים ופסולת אור מחומר כבד יותר. צנטריפוגה השני מסתמך על פתרון סוכר רוויה (עם צפיפות גדול יותר צפיפות של ביצים פ tomentosa ) כדי לאפשר טפיל ביצים לצוץ על פני השטח של הצינור.
ניתן לשלב ההקרנה לחיידקים biofilm ועבור tomentosa פ מתחתית המיכל על ידי ביצוע PCR עבור כל הפתוגנים אלה על המשקע מדגם בוצה שהושג לאחר צנטריפוגה הראשון. הדבר מייעל את זמן הדגימה. השיטה המתוארת להלן. אנו גם מציעים להשתמש טכניקות אלה בהקשר הסגר. למסך מיובאים דג זברה למבוגרים צריך להשאר בחיים, מוכנס מכשיר הרבייה למיכל בידוד. אחרי שבוע אחד, צואה וחומרי פסולת אחרים במכשיר הרבייה נאספים וכוח הוקרן על ידי מיקרוסקופ או ה-PCR. הטכניקה המתוארת להלן, כמה ביצים tomentosa פ אותרו על ידי מיקרוסקופ בהקשר זה.
Protocol
1. חשיפה של סינון מקדים Sentinels מתוך מערכת Recirculating
-
הגדר טנק 8 L נקי מחוץ מערכת recirculating. תמלא מים מגיע sumps. להוסיף 2 חרוזי קרמיקה או ספוג קוביות של ביו-מדיה ממערכות למסך (איור 1). להוסיף 1-2 rerio ד/L (קרי, 12 דגים). השתמש פראי סוג דגים של רקע גנטי דומיננטי במתקן, לדוגמה השתמשנו
- בחר לפחות 6 דגים כדלקמן: נקבה אחת לפחות, זכר אחד מתחת 6 חודשים של גיל, נקבה אחת זכר אחד בין 6 עד 18 חודשים, נקבה אחת ואת זכר אחד מעל גיל 18 חודשים.
-
להאכיל פעם ביום. משתנים של דיאטות (למשל, דיאטה יבש, ארטמיה) כדי לוודא שהזקיפים נחשפים כל הדיאטות אשר בשימוש במתקן דג זברה. לשנות מים על שני, רביעי, ושישי, קרי, שלוש פעמים בשבוע במשך 4 חודשים.
- לנהל את השינוי במים, להעביר זקיפים, ביו-מדיה לתוך טנק זמניים. רוקן לחלוטין למיכל סנטינל ולנקות אותו. מילוי מחדש הטנק סנטינל עם בור קיבול מים בלבד. להחזיר את זקיפים ואת ביו-מדיה.
- לחשוף את הזקיפים 4 חודשים בור קיבול למים. המתת חסד את הדג על ידי שיטה שאושרו כגון טבילת בפתרון יתר 2-פנוקסיאתנול (3 מ ל/L).
-
כדי לוודא מוות, לחכות 10 דקות לאחר הפסקת תנועת opercula.
- קח את הגופה עם מלקחיים ומקפיאים לחלוטין ב-80 מעלות צלזיוס במיכל מזוהה. זה ישמש עבור ה-PCR12,15.
- לחלופין, לחתוך tailat את עוקץ סימטרית, ניק לקיר הבטן והגדר בפורמלין 4%.
התראה: שימוש בכפפות, מנדפים הקבינט עבור histopathology. תווית הדגימה.
2. בור קיבול ספוגיות
- השתמש מקלון יבשה סטרילית עם מוט פלסטיק. ללבוש כפפות. אתר השטח כדי ספוגית (קיר sump במשטח של המים) והסר כל פריט מניעת גישה קלה אל פני השטח. בחר משטח sump עם זרם נמוך.
-
תסלפו הדגימה על-ידי הסרת האריזה החיצונית ולחשוף את הטיפ כותנה סטרילי לאוויר. למנוע זיהום צולב של הדגימה על-ידי טיפול לא לגעת משטחים שלא נבדקו.
- דגימה הקיר sump מעל 5-10 ס מ כדי לספוג את המים ואת biofilm על פני השטח של מים בור קיבול.
- Sheath הדגימה בחזרה או לפרוץ את הטיפ שפופרת צנטרפוגה סטרילי. תווית לדוגמה, לשלוח לבדיקת PCR או להקפיא ב-80 מעלות צלזיוס.
3. זיהוי של ביצים tomentosa פ בתחתית מיכל
-
בוצה ניתוח על ידי מיקרוסקופ
- השתמש במזרק 60 מ ל9 לרוקן את כל הטינופת בתחתית של בור קיבול או כל טנק החזקת דגים כולל זקיפים. לחלק את הדגימה צינורות 15 מ"ל. סגור את הצינורות עם צמרות בורג שלהם, תווית הצינורות.
- להכין את הפתרון סוכר רוויה (משקל סגולי = 1.27) על ידי ערבוב 227 גר' סוכר ב- 177 מ של מים חמים עם פגים14.
- Centrifuge צינורות 15 מ"ל ב 175-250 g x 10 דקות ומפרידה עם הנדנדה דליים. Decant הצינורות ולשמור המשקע בצינור שלהם.
- למלא הצינורות באמצע הדרך עם הפתרון סוכר רוויה. לסגור את הצינורות עם פקק מתברג שלהם ומערבבים היטב המשקע עם הפתרון.
- למקם את הצינורות הדליים הנדנדה צנטריפוגה, למלא אותם עם סוכר רווי פתרון לחלק העליון. הגדרת זכוכית מכסה אחד בעדינות על גבי כל שפופרת, ליצור קשר עם הסוכר רווי פתרון.
- צנטריפוגה ב 175-250 x g עבור 10 דקות הערה כי קצת זכוכית הכיסוי עלול ליפול ולשבור במהלך צנטריפוגה ומכאן שם הם צינורות 4 עבור כל דגימה 60 מ. הרם את מכסה הזכוכית והנח אותו על משטח זכוכית. תווית השקופית עם עט עיפרון או סמן.
- במקרה שבר מכסה זכוכית רבים מדי להתרחש, למלא את רוב ברכבת התחתית עם הפתרון סוכר רוויה, צנטריפוגה ב 175-250 g x 10 דקות, למלא את הדף עם הפתרון סוכר רוויה, ואז בעדינות להגדיר את מכסה הזכוכית. המתן 30 דקות.
- חפשו את הביצים tomentosa פ עם מיקרוסקופ13 (איור 2 ו- Video 1). לזהות השתלים דו-קוטבי ההגדלה 400 X6.
הערה: גודל הביצים הוא 57-78 מיקרומטר ארוך ו- 27-39 מיקרומטר בקוטר16,17. הערה שאת שקופית חיובית אחת מספיקה לכל המדגם 60 מ ל תוכרז חיובי.
-
ההקרנה המיובאים בעלי חיים בבידוד לביצים tomentosa פ
- הגדר זכר ונקבה rerio ד במיכל. להוסיף למיכל התקן משמש בדרך כלל כדי לקצור, לשמר את מכירותיו ביצים אבל להשתמש בו כאן כדי לאסוף את הצואה (איור 3).
הערה: לדוגמה, 1 ליטר רבייה מיכל מלא (המיכל החיצוני וגם הפנימי טנק עם התחתון מגוררת) לגמרי שקוע בתוך מיכל 13 L, המאפשר גישה חופשית שהדגים להכנס ולצאת המכשיר הרבייה. - להסיר את ההתקן הרבייה אחרי שבוע אחד ולקצור את כל הטינופת שנאספו במכשיר הרבייה כפי שמתואר בשלב 3.1 "בוצה ניתוח על ידי מיקרוסקופ."
- הגדר זכר ונקבה rerio ד במיכל. להוסיף למיכל התקן משמש בדרך כלל כדי לקצור, לשמר את מכירותיו ביצים אבל להשתמש בו כאן כדי לאסוף את הצואה (איור 3).
4. PCR על המשקע בוצה
- האחות את כל הטינופת בתחתית מיכל או בור קיבול עם מזרק 60 מ ל9 , להעביר את הדגימה אל צינור 60 מ. סגור את הצינור עם פקק מתברג שלה, לתייג את הצינור. השלך המזרק.
- לנער את הצינור 60 מ ל ולהעביר 15 מ"ל ל צינור 15 מ"ל. סגור את הצינור עם פקק מתברג שלה, לתייג את הצינור.
- Centrifuge הצינור 15 מ"ל ב 175-250 g x 10 דקות ומפרידה עם הנדנדה דליים. Decant הצינורות ולשמור המשקע בצינור.
-
תסלפו מקלון על-ידי הסרת האריזה החיצונית ולחשוף את הטיפ כותנה סטרילי לאוויר. למנוע זיהום צולב של הדגימה על-ידי טיפול לא לגעת משטחים שלא נבדקו.
- דגימה המשקע בצינור 15 s.
- Sheath הדגימה בחזרה או לפרוץ את הטיפ שפופרת צנטרפוגה סטרילי. תווית לדוגמה, להקפיא ב-80 מעלות צלזיוס ושלח לבדיקת PCR.
הערה: 45 מ ל יישארו בצינור 60 מ. זה יכול להישמר לצורך זיהוי של ביצים tomentosa פ מאת בוצה ניתוח על ידי מיקרוסקופ כפי שמתואר בשלב 3.1, לדוגמה, כדי לאשר את התוצאה ה-PCR. ניתן לנסות את ה-PCR ב כל הטינופת לסינון בעלי חיים מיובאים, בעקבות צעד 3.2.
תוצאות
היתרונות של הושארו sump לזהות ונפוצים Mycobacterium spp. לעומת דגימות הדגים נתמכים על ידי התוצאות באיור4. של דגים 115 נבדק, chelonae מ , haemophilum מ אותרו ב-5% ל-3% מכלל הדגימות, בהתאמה. אין מינים אחרים mycobacterial פתוגניים זוהה. של אותן מערכות, מטליות sump 49 חשף את הנוכחות של 5 מינים mycobacterial. יחס הסיכויים מחושבים עם ההשערה כי chelonae מ ו מ fortuitum מזוהים בתדירות גבוהה יותר על ידי ה-PCR ב הושארו sump משטח יותר במדגם דגים. . זה משמעותי סטטיסטית עם יחס הסיכויים בהתאמה של 11 (95% CI: 4-29; p < 0.0001) ו 306 (95% CI: 18 כדי 5208; p = 0.0001). התוצאות מציגות כי הטכניקה ספוגית sump משטח הוא חלופה ערך השימוש הבלעדי של זקיפים למסך המתקן דג זברה Mycobacterium spp. הדגימות סביבתיים שימשו גם עבור hydrophila אמסך. חיידקים אלו אותרו דגים, בוצה, ודוגמאות פני השטח (איור 4). זה תומך גם את היכולת של טכניקות המוצע למסך את ביוטופ דגים.
לגבי הניתוח של בוצה לזהות tomentosa פ ביצים, Mocho9 זיהה את הטפיל 27% של הדגימות דגים ע י PCR histopathology ואילו הביצים התגלו אצל 93% בוצה שנותחה מ באותה המערכת. כאן, הטכניקה היתה תיגר לשחזר את הסגר ההקרנה. בהקשר זה, לא ניתן לטעום בעלי חיים מיובאים, הערכת מצב הבריאות שלהם מבעוד עוזר עם הנהלת biosecurity. דג של מצב בריאות לא ידוע במתקן חיובי tomentosa פ נקבעו ב 8 טנקים עם גידול התקנים: מקסימום של הטנק דגים/13 L 16, 7 הטרנסגניים וקו פראי-סוג 1, מעורבות מגדרית, בגילאי 4-24 חודשים. כל הטינופת שנקטפו ההתקנים לאחר שבוע אחד, נותחו על ידי מיקרוסקופ. ביצים tomentosa פ נראו בדגימות (88%) 7. לבסוף, זיהוי ה-PCR של הטפיל היה trialed על בור קיבול מטליות, בוצה משקעים. 4 מתוך 6 בוצה הדגימות היו PCR חיובית, כל התוצאות היו שליליות עבור הושארו משטח. זה לא מפתיע מאחר ההקרנה בוצה מסתמך על היכולת של הביצים ליפול לתחתית המיכל. זה מראה כי טכניקות ניתוח בוצה יכול לשמש כדי מסך rerio ד aquaria עבור התפשטות tomentosa פ ו כי השיטות ניתן להתאים להקרנה של בעלי חיים מיובאים.

איור 1: מיכל סינון מקדים סנטינל מחוץ למערכת recirculating. מיכל 8 L הוא התמלא מים, ביו-מדיה מ- sumps של המערכות למסך. החרוזים לבן קרמי bio-מדיה שני לשבת בחלק התחתון של הטנק (במרכז התמונה). 12 דגים נבחרו בהתאם לגיל שלהם, זן, מגדר, הוספתם למיכל בלוטת הזקיף. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
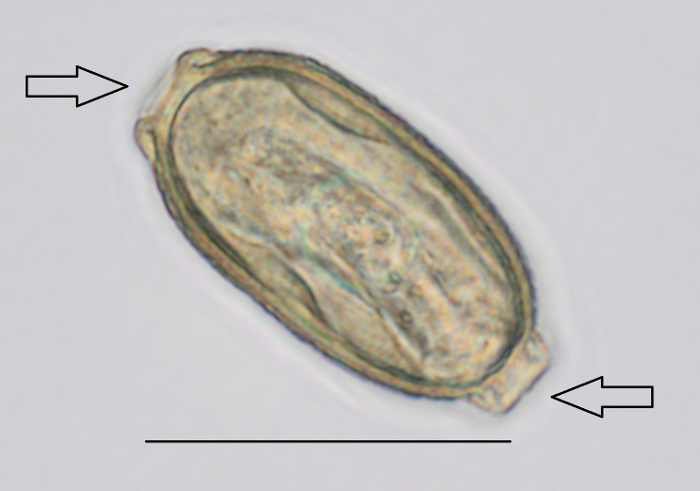
איור 2: ביצה פ tomentosa זוהה במהלך ניתוח בוצה על ידי מיקרוסקופ. ההגדלה בשימוש היה 400 X. חיצים מציינים השתלים הפרעה דו קוטבית. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: רבייה התקן שקוע בתוך טנק החזקת דגים לאיסוף בוצה לניתוח. המיכל הזה מוגדר על ספסל לצורך לתמונה; שוכן אחרת במערכת recirculating. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
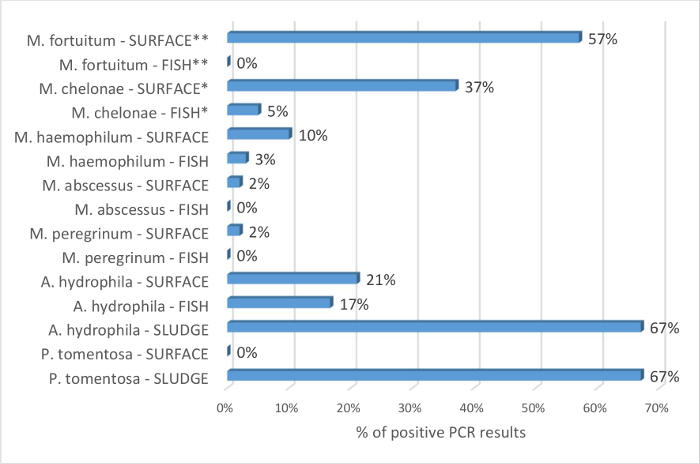
איור 4: אחוז זיהוי של spp. Mycobacterium , hydrophila או פ tomentosa על ידי ה-PCR של דגים, פני השטח sump מטליות, בוצה sump. אחוז מתקבל על-ידי חלוקת מספר תוצאות חיוביות עבור כל המינים הפתוגן לפי מספר הדגימות שנבדקו. האחוז של תוצאות חיוביות שניתנו על ידי דגימת סוג דגים, משטח או בוצה, ציין שם של החיידקים. מטליות sump משטח 49 ודגים 115 נבדקו על ידי ה-PCR לזיהוי Mycobacterium spp. הנתונים נאספים עם תוצאות9 של Mocho שכן הוא הרחבה של מחקר זה. הדג זקיפים בעיקר סינון לפי פרוטוקול בסעיף 1. לעיתים רחוקות, כאשר זקיפים לא היו זמינים, הנמלטים והמושבה בת דגים (> 18 חודשים) היו שנדגמו. כל המערכות שנבדקו עבור Mycobacterium spp. נבדקו על דגימות דגים, בור קיבול. יחס הסיכויים מחושבים עם ההשערה כי chelonae מ ו מ fortuitum מזוהים בתדירות גבוהה יותר על ידי ה-PCR ב הושארו sump משטח יותר במדגם דגים. . זה משמעותי סטטיסטית עם יחס הסיכויים בהתאמה של 11 (95% CI: 4-29; p < 0.0001) ו 306 (95% CI: 18 כדי 5208; p = 0.0001). התחממות עולמית PCR היה שלילי על כל הדגימות וזה הוא לפיכך ייחשב נעדר מתקנים אלה אינם כלולים בניתוח. 12 דגים, מטליות sump משטח 14 ו- 6 sump בוצה נבדקו על ידי ה-PCR לנוכחות של hydrophila א. 6 sumps נבדקו לנוכחות של tomentosa פ על פני השטח, את כל הטינופת. PCR = תגובת שרשרת של פולימראז. CI = הסמך. * ו * * לציין מובהקות סטטיסטית; השוואות אחרות לא היו משמעותיים מבחינה סטטיסטית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
וידאו 1: סריקת ביצה של Tomentosa פ עם המיקרוסקופ. השקופית מתקבל מניתוח בוצה כפי שמתואר בשלב 3.1. השדה נסרק לגילוי ביצה של tomentosa פ. ברגע מבנה מזוהה, זה הוא התקרבות כדי לאשר את הזיהוי ברזולוציה גבוהה יותר. אנא לחץ כאן כדי לצפות בסרטון. (לחיצה ימנית כדי להוריד.)
| מחברים | גיל תחילת החשיפה | משך חשיפה | גיל הדגימה | פוסט לפני או אחרי המוות סינון | מגדר | Strain(s) |
| ברטון. et al. 3 | 4 חודשים | 6 חודשים | 10 חודשים | סינון מקדים | N/A | N/A |
| בורחס. et al. 4 | 6 חודשים | 6 חודשים | 12 חודשים | סינון מקדים | N/A | אלב פראי סוג |
| . Collymore et al. 5 | צעיר ככל האפשר | 3 חודשים | < 6 חודשים | סינון מקדים | N/A | N/A |
| פרינהוטל. et al. 6 | 4 חודשים | 4 חודשים | 8 חודשים | קדם ופוסט סינון | N/A | אלב פראי סוג |
| ליו. et al. 7 | 3 חודשים | 1-6 חודשים | 4-9 חודשים | קדם ופוסט סינון | N/A | פראי סוג |
| מרטינס. et al. 8 | 3 חודשים | 3 חודשים | 6 חודשים | סינון מקדים | N/A | פראי סוג |
| Mocho9 | < 6 חודשים, 6 - 12 חודשים, > 18 חודשים | 4 חודשים | 7 - 24 חודשים | סינון מקדים | 1 נקבה, 1 זכר של כל קבוצת גיל | אלב פראי סוג |
| מוריי. et al. 10 | 3-4 חודשים | 3 חודשים, 6 חודשים, 1 שנה | 7, 10 ו- 16 חודשים | קדם ופוסט סינון | N/A | אלב פראי סוג |
טבלה 1: השוואה בין הגדרות הפלאג במתקני דג זברה. הדג סנטינל ייתכן שנבחר על פי גיל, מין או זן שלהם. הם נחשפים לתקופה שיקבע, הם מקבלים מערכת קדם או שלאחר סינון מים. המידע נאסף ממקור הנושא 2016 מיוחד על בריאות של דג זברה יומן3,4,5,6,7,8,9, 10.
Discussion
מגבלות של הטכניקות, שלבים קריטיים, לפתרון בעיות:
גיל, מגדר, זן, ואורך חשיפת שהזקיפים לא מתוקננים. זו מוצגת בטבלה 1. יש מעט מאוד הקרנת דגים מתחת 6 חודשים של גיל, או של דג בגילאי. ייתכנו כמה פתוגנים להשפיע על הדגים הצעירים כמו ישנם כמה גורמי מחלה נפוצים יותר מבוגר באוכלוסייה10,18,19,20. באופן דומה, המגדר אינו נחשב בבחירה של כמה קבוצות סנטינל למרות מסוימים מדווחים שישנה דעה קדומה מגדר עבור חלק פתוגנים21. הטכניקה המוצע מנסה לטפל בבעיות אלה, אף על פי הבחירה של המתח יכול להיעשות על פי. חיידק מסוים כדי לפקח. לדוגמה, TU יכול לעזור. עם זיהוי Mycobacterium spp.12,22, אך קיים סיכון שהזקיפים ואז לשמש מאגר או הצג סימנים קליניים. לגבי האורך של חשיפה, הגישה של מרכז המשאבים הבינלאומי דג זברה10 מגדיל את הסיכויים לגילוי פתוגנים שלא יכול להיות בעלי תקופת זיהום לקוי. הצורך של חשיפה ממושכת מרמז כי זקיפים אינם זמינים. התוספת של הדגימות סביבתיים מאפשר גמישות הכפלה של האירועים ההקרנה. לדוגמה, הדגימה יכול להתרחש אחת לחודש עם מרווח 4 חודש בין כל שיטת הקרנה. זה עשוי להפחית את לשגות של זמן לפני חיידק הציג לאחרונה מזוהה.
טכניקות ההקרנה סביבתיים להסתמך על הגילוי של פתוגנים בסביבה. פתוגנים לשפוך על ידי הדג, לכן מדולל במים המערכת. לא היה בחנו את האפשרות של לכידת פתוגנים על-ידי סינון מים23 . השיטות שאנו מתארים הם יעילה רק אם פתוגנים מקבלים מספיק זמן כדי להכפיל ב biofilm כדי להגיע לסף מסוים של זיהום המאפשר זיהוי ודגים. מגבלה זו של הטכניקות למינימלי בעקבות מבחר האתרים דגימה קריטית: כל הטינופת במיכל נדגמים במקום כל הטינופת בור קיבול, המים ואת biofilm שנדגמו בפני השטח של הניקוז במקום מיכל או שלאחר סינון. למרות זאת, כל דגימות מן באותה המערכת סביר לתת את אותן תוצאות. תוצאות חיוביות עבור tomentosa פ יכול להיות מאושרות על-ידי שימוש assay אחר (histopathology, PCR או ניתוח בוצה). יכול להיות אישרו mycobacterial PCR תוצאות חיוביות על ידי תרבות או מעבדות אבחון נוסף. עם זאת, בעת יצירת מצב בריאות, עוד יותר דגימות מומלץ לאשר תוצאות שליליות בכל טכניקה הקרנה סביבתיים.
המשמעות של הטכניקה לגבי שיטות קיימות/חלופית:
Mycobacterium spp. נפוצים בסביבה, נוכחותם הניקוז אינה מנבאת שלהם פתוגניות12. Mocho9 הראה כי פיקוח על שיעורי התמותה הוא מפתח סקר את ההתפתחויות של בעיות בריאות. השימוש בבעלי חיים דגימות נשאר חיוני כל חקירה וטרינרי. לניטור תקינות מרמז על גילוי של כל גורמי מחלה שכיחה במתקן, זה אינה יכולה להיות מושגת עם השימוש הבלעדי של טכניקות ההקרנה סביבתיים. עם זאת, חוסר הרגישות של כלי אבחון יכול לעכב או למנוע תיאור מדויק של מצב בריאותו. בזמן השימוש של זקיפים מפחיתה את מספר הדגים הדרוש לאיתור חיידק נפוץ בקרב האוכלוסייה, חוסר רגישות מוסיף משקל באמצעות שילוב של שיטות, כולל הקרנה סביבתי5,23. אכן מצב ספציפי פתוגן חינם בדרך כלל מוגדר העדר של זן במתקן כזה כי דגימות בעלי חיים ואיכות הסביבה חייב לבדוק שלילי24,25.
התוצאות ספוגית sump לזהות Mycobacterium spp. מראים כי הסתמכות על דגים דגימות עלול להוביל מצב בריאותיות שליליות כוזבות. המין mycobacterial נבדק 6 מתוארים כתוצאה פתוגניים או פוטנציאל החולני של דג זברה15 וכמה לא להיות חוסל על ידי חיטוי משטח ביצה עם כלור26 כמו שגרתי שבוצעה בבידוד. לכן, השלילית עשויות להיות כמה השלכות על משתפי לייבא שורות. לדוגמה, מ fortuitum היה פספס את ה-PCR על מדגם דגים אבל יותר ממחצית הדגימה sump PCR מגלים אותו. בהתחשב בכך כי mycobacteria אלה הם עמידים יותר בפני הכלור מאשר אחרים, היכולת שלהם לגדל מערכות המים27, זה סיכון עבור מתקן ייבוא שאינו נגוע. כדי לאפשר הייבוא של קווים, מנהלי צריכים לבטוח ולהשוות את הדוחות הבריאות המתקן ייצוא עם שלהם. תוכנית הערכת ביצועים ICLAS28 היא המפתח לתהליך הזה בחולדות. הרשת RESAMA דיווח על הגילוי של gordonae מ ו מ mucogenicum הצרפתית rerio ד11. Mycobacteria אלה מוצעים לא הפאנלים של המעבדות מסחריים בהם אנו משתמשים. זה יהיה שימושי כדי להרחיב את התוכנית ICLAS, הרמוניה מבחני אבחון, כמו גם את רשימת זנים פתוגניים29.
Hydrophila א הוא גם. חיידק בעל פוטנציאל להיות מוצג בעת ייבוא בעלי חיים, למרות הרגישות שלה כלור30 עושה לחיסולה סביר יותר במהלך חיטוי משטח ביצה שגרתית. בור קיבול, ספוגית ותוצאות בוצה מראים כי ההקרנה סביבתי יכול לשמש כדי לזהות את הפתוגן. חיידקים אחרים כמו Mycobacterium spp. זוהו ב כל הטינופת על ידי ה-PCR23. סוג זה של מדגם רלוונטי במיוחד שכן הוא מאפשר הזיהוי של המחסן פתוגנים. לדוגמה, יישום חדש נוסף הוא ניתוח בוצה על המסך דגים המיובאים בהסגר עבור tomentosa פ. הטפיל מהווה איום של חיה בריאות13 ו neoplasia מודלים16. יתר על כן, ריכוז כלור בשימוש שגרתי דג זברה ביצה חיטוי משטח אינם יעילים31. לכן, היכולת מסך החיות מיובאים עם מחזור שבוע וללא המתת חסד כל דג נראה מאוד אטרקטיבי. טכניקה זו יכול להשפיע את כללי ההסגר, biosecurity בכך שהוא מאפשר מיון ראשוני. אם היבוא. תהליך קבלת ההחלטות מיועדת מכן פתוגנים ונפוצים במתקן ייצוא, פתוגנים שאותרו בדגימות של הדג המיובא, ואת הסכנה של התפשרות על מצב בריאותו של מתקן ייבוא10.
יישומים עתידיים או כיוונים אחרי מאסטרינג טכניקות אלה:
גם אם טיפול שגרתי הסגר היא האפשרות שבחרת, היעילות של כזה תרופה32,33,34,35,36 יכול להידרש בניתוח בוצה התקן הרבייה. באופן כללי יותר, ההקרנה סביבתי יכול לשמש לבדיקת תרכובות נגד חיידקים, טפילים חיסול, כולל ביוטופ דגים. יישום אחר נישה של ההקרנה סביבתי היא לנטר האוכלוסייה הפתוגן חיה הזנה37,38. למרות היישום העיקרי של טכניקות אלה כמו תוספת רבת ערך הכלים אבחון לבריאות ניטור במתקני דג זברה. תודה עלות וזמן מדויק יותר, יעיל ההגדרה של מצב תקינות, מטליות sump וניתוח בוצה הם משלימים המעקב סנטינל ואת התרגול הסגר שגרתית. אכן, העתיד של טכניקות אלה הוא להיות חלק שגרתי של כל דוח המעבדה הימית בריאות.
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצה להודות לצוות BRF בשחייה במכון פרנסיס קריק שלהם לעזרה טכנית, הקלט הקריטי. עבודה זו נתמכה על ידי פרנסיס קריק המכון אשר מקבל את הליבה המימון מ לחקר הסרטן בבריטניה (FC001999), בבריטניה המועצה למחקר רפואי (FC001999) וטרסט (FC001999).
Materials
| Name | Company | Catalog Number | Comments |
| Aqua-Sed 250 mL | Vetark | 2-phenoxyethanol | |
| Tubed Sterile Dryswab Tip | mwe | MW100 | Sump surface |
| BD Plastipak Disposable Syringe 50mL Eccentric | Becton Dickinson | 300866 | They are actually graduated to 60 ml |
| Centrifuge tube 15 mL Corning | Corning | 430766 | |
| Centaur 2 benchtop centrifuge with 4 x 200 mL Swing–Out Rotor (unsealed) | Sanyo | MSB020.CX1.5 | |
| Cover Glass 22 mm x22 mm | Menzel-Glaser | MNJ-350-020H | |
| Plain Swab Sterile Plastic Applicator Rayon Tipped White Cap | Sterilin Ltd Thermo Fisher Scientific | F155CA | Swab sediment from sludge |
| 50 mL Self-Standing Centrifuge Tube CentriStar Cap | Corning | 430921 | |
| In-Tank Spawning Tray Set | MBK Installations Ltd |
References
- Schroeder, P., Mocho, J. P. A veterinary perspective on laboratory zebrafish welfare. Fish Veterinary Journal. 14, 37-46 (2014).
- Mason, T., et al. Strategies to Mitigate a Mycobacterium marinum Outbreak in a Zebrafish Research Facility. Zebrafish. 13, 77-87 (2016).
- Barton, C. L., Johnson, E. W., Tanguay, R. L. Facility Design and Health Management Program at the Sinnhuber Aquatic Research Laboratory. Zebrafish. 13, 39-43 (2016).
- Borges, A. C., et al. Implementation of a Zebrafish Health Program in a Research Facility: A 4-Year Retrospective Study. Zebrafish. 13, 115-126 (2016).
- Collymore, C., Crim, M. J., Lieggi, C. Recommendations for Health Monitoring and Reporting for Zebrafish Research Facilities. Zebrafish. 13, 138-148 (2016).
- Geisler, R., Borel, N., Ferg, M., Maier, J. V., Strähle, U. Maintenance of Zebrafish Lines at the European Zebrafish Resource Center. Zebrafish. 13, 19-23 (2016).
- Liu, L., Pan, L., Li, K., Zhang, Y., Zhu, Z., Sun, Y. Zebrafish Health Conditions in the China Zebrafish Resource Center and 20 Major Chinese Zebrafish Laboratories. Zebrafish. 13, 8-18 (2016).
- Martins, S., Monteiro, J. F., Vito, M., Weintraub, D., Almeida, J., Certal, A. C. Toward an Integrated Zebrafish Health Management Program Supporting Cancer and Neuroscience Research. Zebrafish. 13, 47-55 (2016).
- Mocho, J. -. P. Three-Dimensional Screen: A Comprehensive Approach to the Health Monitoring of Zebrafish. Zebrafish. 13, 132-137 (2016).
- Murray, K. N., Varga, Z. M., Kent, M. L. Biosecurity and Health Monitoring at the Zebrafish International Resource Center. Zebrafish. 13, 30-38 (2016).
- Legendre, L., et al. RESAMA: A Network for Monitoring Health and Husbandry Practices in Aquatic Research Facilities. Zebrafish. 13, 56-65 (2016).
- Whipps, C. M., Matthews, J. L., Kent, M. L. Distribution and genetic characterization of Mycobacterium chelonae in laboratory zebrafish Danio rerio. Dis Aquat Organ. 82 (1), 45-54 (2008).
- Murray, K. N., Peterson, T. S. Pathology in practice. P. tomentosa infection in zebrafish. J Am Vet Med Assoc. 246 (2), 201-203 (2015).
- Foreyt, W. J. . Veterinary Parasitology Reference Manual. , (2001).
- Whipps, C. M., Lieggi, C., Wagner, R. Mycobacteriosis in zebrafish colonies. ILAR J. 53 (2), 95-105 (2012).
- Kent, M. L., Bishop-Stewart, J. K., Matthews, J. L., Spitsbergen, J. M. Pseudocapillaria tomentosa, a nematode pathogen, and associated neoplasms of zebrafish (Danio rerio) kept in research colonies. Comp Med. 52 (4), 354-358 (2002).
- Moravec, F. Observations on the bionomy of the nematode Pseudocapillaria brevispicula (Linstow, 1873). Folia Parasitol. 30, 229-241 (1983).
- Ramsay, J. M., Watral, V., Schreck, C. B., Kent, M. L. Pseudoloma neurophilia infections in zebrafish Danio rerio: effects of stress on survival, growth, and reproduction. Dis Aquat Organ. 88 (1), 69-84 (2009).
- Watral, V., Kent, M. L. Pathogenesis of Mycobacterium spp. in zebrafish (Danio rerio) from research facilities. Comp Biochem Physiol C Toxicol Pharmacol. 145, 55-60 (2007).
- Whipps, C. M., Dougan, S. T., Kent, M. L. Mycobacterium haemophilum infections of zebrafish (Danio rerio) in research facilities. FEMS Microbiol Lett. 270, 21-26 (2007).
- Chow, F. W., Xue, L., Kent, M. L. Retrospective study of the prevalence of Pseudoloma neurophilia shows male sex bias in zebrafish Danio rerio (Hamilton-Buchanan). J Fish Dis. 39 (3), 367-370 (2016).
- Murray, K. N., Bauer, J., Tallen, A., Matthews, J. L., Westerfield, M., Varga, Z. M. Characterization and management of asymptomatic Mycobacterium infections at the Zebrafish International Resource Center. J Am Assoc Lab Anim Sci. 50 (5), 675-679 (2011).
- Crim, M. J., Lawrence, C., Livingston, R. S., Rakitin, A., Hurley, S. J., Riley, L. K. Comparison of Antemortem and Environmental Samples for Zebrafish Health Monitoring and Quarantine. J Am Assoc Lab Anim Sci. , (2017).
- Jensen, E. S., Allen, K. P., Henderson, K. S., Szabo, A., Thulin, J. D. PCR testing of a ventilated caging system to detect murine fur mites. J Am Assoc Lab Anim Sci. 52 (1), 28-33 (2013).
- . Commission Regulation (EC) No 1168/2006 of 31 July 2006 implementing Regulation (EC) No 2160/2003 as regards a Community target for the reduction of the prevalence of certain salmonella serotypes in laying hens of Gallus gallus and amending Regulation (EC) No 1003/2005 (Text with EEA relevance). OJ. L. 211, 4-8 (2006).
- Chang, C. T., Colicino, E. G., DiPaola, E. J., Al-Hasnawi, H. J., Whipps, C. M. Evaluating the effectiveness of common disinfectants at preventing the propagation of Mycobacterium spp. isolated from zebrafish. Comp Biochem Physiol C Toxicol Pharmacol. 178, 45-50 (2015).
- Le Dantec, C., Duguet, J. P., Montiel, A., Dumoutier, N., Dubrou, S., Vincent, V. Chlorine disinfection of atypical mycobacteria isolated from a water distribution system. Appl Environ Microbiol. 68 (3), 1025-1032 (2002).
- Goto, K., Hayashimoto, N., Ishida, T., Takakura, A., Kagiyama, N. First trial in the developmental phase of the "performance evaluation program" based on the ICLAS animal quality network program: self-assessment of microbiological monitoring methods using test samples supplied by ICLAS. Exp Anim. 58 (1), 47-52 (2009).
- Nogueira, C. L., et al. Mycobacterium saopaulense sp. nov., a rapidly growing mycobacterium closely related to members of the Mycobacterium chelonae--Mycobacterium abscessus group. Int J Syst Evol Microbiol. 65 (12), 4403-4409 (2015).
- Massa, S., Armuzzi, R., Tosques, M., Canganella, F., Trovatelli, L. D. Note: susceptibility to chlorine of Aeromonas hydrophila strains. J Appl Microbiol. 86 (1), 168-173 (1999).
- Martins, M. L., Watral, V., Rodrigues-Soares, J. P., Kent, M. L. A method for collecting eggs of Pseudocapillaria tomentosa (Nematoda: Capillariidae) from zebrafish Danio rerio and efficacy of heat and chlorine for killing the nematode's eggs. J Fish Dis. 40 (2), 169-182 (2017).
- Maley, D., Laird, A. S., Rinkwitz, S., Becker, T. S. A simple and efficient protocol for the treatment of zebrafish colonies infected with parasitic nematodes. Zebrafish. 10 (3), 447-450 (2013).
- Samaee, S. M. Experimental Assessment of the Efficacy of Five Veterinary Broad-Spectrum Anthelmintics to Control the Intestinal Capillariasis in Zebrafish (Danio rerio). Zebrafish. 12 (3), 255-267 (2015).
- Collymore, C., et al. Tolerance and Efficacy of Emamectin Benzoate and Ivermectin for the Treatment of Pseudocapillaria tomentosa in Laboratory Zebrafish (Danio rerio). Zebrafish. 11 (5), 490-497 (2014).
- Chang, C. T., Whipps, C. M. Activity of Antibiotics against Mycobacterium Species Commonly Found in Laboratory Zebrafish. Journal of Aquatic Animal Health. 27 (2), 88-95 (2015).
- Chang, C. T., Doerr, K. M., Whipps, C. M. Antibiotic treatment of zebrafish mycobacteriosis: tolerance and efficacy of treatments with tigecycline and clarithromycin. J Fish Dis. , (2017).
- Peterson, T. S., Ferguson, J. A., Watral, V. G., Mutoji, K. N., Ennis, D. G., Kent, M. L. Paramecium caudatum enhances transmission and infectivity of Mycobacterium marinum and M. chelonae in zebrafish Danio rerio. Dis Aquat Organ. 106 (3), 229-239 (2013).
- Watts, S. A., Lawrence, C., Powell, M., D'Abramo, L. R. The Vital Relationship Between Nutrition and Health in Zebrafish. Zebrafish. 13, 72-76 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved