A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מכשיר לביצוע נדידת תאים / ריפוי פצעים צלחת 96-ובכן
In This Article
Summary
כאן, אנו מציגים פרוטוקול לבצע assay נדידת תאי תפוקה למחצה גבוהה על צלחת תרבית תאי 96-היטב. פרוטוקול זה הוא שיטה מהירה, פשוטה וחסכונית ליצור פצעי שריטה עקביים על monolayer תא.
Abstract
הגירת התא / ופצע assay היא שיטה נפוצה ללמוד נדידת תאים ותהליכים ביולוגיים אחרים, כגון אנגיוגנזה גרורה של גידולים. ב assay זה, תאים גדלים להקים monolayer ומחובר פצע מכנים נוצר על ידי גירוד עם התקן. ואז שיעור ההגירה של התאים לעבר אזור הערומים ניתן לנטר באמצעות הדמיה. wounder המכאני 8 הערוצים שלנו נועד להתמודד עם רוב הבעיות קשורות assay נדידת תאים. ראשית, wounder שלנו ניתן לעקר בקלות על ידי מעוקר או בחומרי חיטוי נפוץ. שנית, הפינים מתכווננת הבודדים אפילו לאפשר מגע עם צלחת תרבית תאים כך פצעים חדים לשחזור ניתן ליצור. שלישית, הברים המנחים משני צידי wounder ולהבטיח את מעמדה ופציעתם עקבית בכל טוב. שימוש טיפי פיפטה פלסטיק חד פעמיים עבור ופצע עוד יכול לספק טיפול טוב יותר של wounder וכן למזער צולבות contaminatיוֹן. לסיכום, wounder התא שלנו יכול לספק לחוקרים עם מכשיר ידידותי למשתמש לשחזור עבור ביצוע assay נדידת תאים באמצעות צלחת תרבות 96-היטב הסטנדרטית.
Introduction
נדידת תאים ממלאת תפקיד חשוב בתהליכים תאיים, כגון עובר, נוירוגנזה, אנגיוגנזה, ריפוי פצעים, תיקון רירי, אפיתל mesenchymal-מעבר בפיתוח נורמלי למחלת מצב 1. זהו תהליך מסובך שכרוך התיאום של רבי אירועים בין-תוך תאי כולל אינטראקציות מולקולת איתות, קיטוב תא, ארגון מחדש cytoskeletal, שיפוץ מטריקס, בליטת הממברנה אפנון הידבקות תאי תאים דינמיים 2. על ידי לימוד נדידת תאים, הגילוי והאימות של כימיקלים או ביומולקולות מובילה תנועת תא הביוכימיים הקשורים אליה ניתן לקבוע. תהליך בסיסי זה יכול לשמש לטובה כמו פרוקסי עבור יישומים שונים, כגון טיפול במחלות התרופה מיקוד.
את assay והפצע הוא אחת מבחני נדידת תאים 3. הנה,מדגם בודד של תאים יוסר באופן חלקי על ידי אמצעים מכאניים לייצר אזור ערומים שבו תאים יעברו כדי לכסות את האזור. אחוז ההחלמה בנקודת זמן מסוימת יהיה פיקוח. בעת טיפול מספר גדול של דגימות, בעיות כגון עלות הניסיונית בין זיהום בתוך דגימות יכולות להיות בעייתיות. למרות כלי מבחנים מסחריים רבים זמינים לחקר תא גירה 4, 5, 6, רבים מהם נדרשים ציוד יקר ומתוחכם ושיפורים נדרשים עדיין. מסיבות אלו, wounder תא מכאני 8 ערוצים (איור 1) מפותח.
8 ערוצי wounder התא המכאני שלנו מאגד כמה תכונות ייחודיות בפתרון הבעיות הנ"ל. הוא מספק את הגמישות לבצע נדידת תאים / ופצע מבחנים בפורמט צלחת תרבות 96-היטב. ג.א. מתכווננתעיצוב בר iding מבטיח שאזור השריטה נמצא במצב המרכזי של כל טוב. כמו כן, בעיצומה של הברים המנחים יכול להיות מותאם כך wounder ישימה עבור מותגים שונים של צלחות תרבית. לבסוף, עיצוב הסיכה ופציעתם מתכווננת מאפשר גם איש קשר של הטיפים פיפטה עם פני צלחת התרבות להשיג ופציעתם סימולטני לשחזור 7, 8.
Protocol
1. מבוא החלק Wounder (איור 1)
- הכן את בעל פינים ידי תיקון סיכות ופציעתם במרחקים שווים. החזק את הטיפים פיפטה ולהתאים את גובה הטיפ על ידי הזזת הסיכות ופציעתם מתכווננת מעלה ומטה.
- התאימו את המנחה-בר מתכווננת על מותגים שונים של צלחות תרבות 96-היטב להבטיח שהאזור ופציעתם נמצא בעמדה קבועה.
- תקן את הסיכה ופציעתם מתכווננת על ידי הידוק בורג hex. תקן את הבר המנחה בעמדה ידי הידוק כמוס ראשי קץ hex בשני הקצוות.
2. הגדרת הרוחב של מחזיק הפין (איור 2)
- שחרר את כמוסות ראשי קץ hex עם מפתח ברגים hex M5.
- הכנס מספר מתאים של התאמת טבעות לשני הצדדים של בעל פינים כך הסורגים המנחים להתאים באופן מושלם עם הרוחב של הצלחת התרבות 96-היטב.
הערה: קורנינג Iwaki צלחות דורשים 1 זוג טבעות גדולות 1 זוג טבעות קטנות. פלקון pl Nuncאטס צריך 1 זוג טבעות גדולות. - הדקו את ראשי קץ hex caps לתקן הבר המנחה.
3. התאמת ברי המנחים (איור 3)
- התאם את הסיכות ופוצעים עם טיפי פיפטה פלסטיק 10 μL סטרילי.
- שחרר את כמוסות ראשי קץ hex עם מפתח ברגים hex M5.
- החזק את wounder וטובל את הסיכות ופציעתם לתוך עמודה אחת של צלחת תרבות 96-היטב.
- התאם את הגובה של הסורגים המנחים עד כל הטיפים בקושי לגעת בתחתית הבארות.
- הדק את הכמוסות ראש קץ hex. ודא כי wounder עכשיו מתאים באופן מושלם על הצלחת התרבות כי הפינים-ממוצבים היטב באמצע הבארות.
4. כיול של פיני
- החזק את wounder בניצב משטח שטוח סטרילית (צלחת פטרי כלומר) לשחרר את כל הברגים hex עם מפתח ברגים hex M3.
- הקש על wounder עד כל הטיפים שווה לגעת משטח סטרילי שטוח.
- חזק את ברגי hex שוב לנעול את הסיכות בעמדה.
- בדוק את השוויון של כל קצה על ידי קשה על wounder בעדינות על המשטח סטרילי השטוח.
5. וגרד תא חד שכבתי (איור 4)
- זרע אנושי לתאי אנדותל כלי הדם הטבורי על צלחת תרבית תאים 0.1% ג'לטין מצופה 96-היטב. תאי תרבות בינונית 199 בתוספת 20% בסרום שור עובר מומת חום, 1% פניצילין / סטרפטומיצין ו הפרין 0.09 g / L. שמור על תאים בתוך חממה humidified עם פחמן דו חמצני 5% ב 37 ºC לילה לפני בשימוש. תאים צריכים להגיע ל -100% confluency לפני ופצע.
- מניח את הטיפים ופציעתם על השמאלי ביותר (או הימני ביותר) הצד של כל טוב בתוך באותו הטור של הצלחת התרבות. חלק את wounder פני לצד השני של הבאר; לוודא את הטיפים ופציעתם נוגעות בתחתית הבאר.
- חזור על מגרד (שלב 5.2) עבור כל העמודות.
- לאחר פציעה, שנזרק tהוא בינוני בכל טוב ולהחליף עם תרכובות בדיקות המכיל בינוני טרי.
6. קליטת נתונים וניתוח תמונה
- תמונה כולה גם עם הפצע מכני על monolayer התא באמצעות מיקרוסקופ צריכת חשמל נמוכה עם מצלמה דיגיטלית (אובייקטיבי למשל 10X) מיד לאחר ופצעו (t = 0 ח).
- להוסיף תרכובות בדיקה אם רוצה דגירה במשך האורך הרצוי של זמן. תמונה כולה היטב עם אזור הפצע שוב לאחר זמן דגירה הרצוי (t = Δh).
- באמצעות תוכנת ניתוח תמונה כגון ImageJ ( https://imagej.nih.gov/ij/ ), למדוד את השטח הפצוע על התמונה באמצעות כלי ביד החופשי.
- חישוב אחוזי סגירת הפצע:
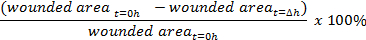
תוצאות
8 ערוצים זה wounder המכאני בנוי לגרד בשכבת תא על מנת לבצע את assay נדידת תאים. זהו מכשיר ידידותי למשתמש, כי יכול לבצע מבחני מגרד תא 96-גם צלחות בפחות מדקה ללא הכשרה מיוחדת. Wounder זה יכול להציג אזורי פצע על משטחי תא ברוחב אחיד של כ -600 מיקרומטר עם קצוות חדים (א...
Discussion
יש wounder התא שלנו כמה תכונות ייחודיות בפתרון הבעיות של מבחני נדידת תאים מסורתיים. Wounder התא מכני 8 ערוצים עשוי נירוסטה ציון גבוה (פלדה 304) עם אורך חיים ארוך כי ניתן לעקר על ידי מעוקר. כמעט כל המותגים המסחריים של תרבות צלחות 96-היטב הקיימים בשוק ניתן להשתמש עם wounder התא מכני זה...
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
המחברים מבקשים להודות למר תם Po ליונג, מר וונג צ'י Kin ואת הצוות הטכני של סדנת הפקולטה למדעי הטבע, אוניברסיטת המטביל הונג קונג עבור כישורים טכניים שלהם וייעוץ בקבלת האבטיפוס של wounder זה.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plate | Nunc | 167008 | Other brands of 96-well cell culture plate can also be used |
| P10 pipette tips | Axygen | 301-03-051 | Short P10 pipette tip is more easy to create a clear wound |
| Wounder | R&P Technology Limited | ||
| Medium 199 | Sigma | M2520-1L | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Fetal bovine serum | Gibco | 26140079 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Penicillin/Streptomycin | Gibco | 15140122 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H3393 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Gelatin from bovine skin | Sigma | G9391 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
References
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3 (5), 362-374 (2003).
- Friedl, P. Prespecification and plasticity: shifting mechanisms of cell migration. Curr Opin Cell Biol. 16 (1), 14-23 (2004).
- Lampugnani, M. G. Cell migration into a wounded area in vitro. Methods Mol Biol. 96, 177-182 (1999).
- Sholley, M. M., Gimbrone, M. A., Cotran, R. S. Cellular migration and replication in endothelial regeneration: a study using irradiated endothelial cultures. Lab Invest. 36 (1), 18-25 (1977).
- Gotlieb, A. I., Spector, W. Migration into an in vitro experimental wound: a comparison of porcine aortic endothelial and smooth muscle cells and the effect of culture irradiation. Am J Pathol. 103 (2), 271-282 (1981).
- Chen, Y. C., et al. Single-cell migration chip for chemotaxis-based microfluidic selection of heterogeneous cell populations. Sci Rep. 18 (5), 9980 (2015).
- Yarrow, J. C., Periman, Z. E., Westwood, N. J., Mitchison, T. J. A high-throughput cell migration assay using scratch wound healing, a comparsion of image-based readout methods. BMC Biotechnol. 4, 21 (2004).
- Lauder, H., Frost, E. E., Hiley, C. R., Fan, T. P. Quantification of the repair process involved in the repair of a cell monolayer using an in vitro model of mechanical injury. Angiogenesis. 2 (1), 67-80 (1998).
- Yue, P. Y. K., Leung, E. P. Y., Mak, N. K., Wong, R. N. S. A simplified method for quantifying cell migration/ wound healing in 96-well plates. J. Biomol Screen. 15 (4), 427-433 (2010).
- Yue, P. Y., et al. Elucidation of the mechanisms underlying the angiogenic effects of ginsenoside Rg(1) in vivo and in vitro. Angiogenesis. 8 (3), 205-216 (2005).
- Kwok, H. H., Chan, L. S., Poon, P. Y., Yue, P. Y., Wong, R. N. Ginsenoside-Rg1 induces angiogenesis by the inverse regulation of MET tyrosine kinase receptor expression through miR-23a. Toxicol Appl Pharmacol. 287 (3), 276-283 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved